结合图像的叶绿素荧光动力学植物水分胁迫探测方法
周春艳 华灯鑫 乐 静 闫 庆 毛建东 景 敏
(1.西安理工大学机械与精密仪器工程学院, 西安 710048; 2.北方民族大学电气信息工程学院, 银川 750021)
结合图像的叶绿素荧光动力学植物水分胁迫探测方法
周春艳1,2华灯鑫1乐 静1闫 庆1毛建东2景 敏1
(1.西安理工大学机械与精密仪器工程学院, 西安 710048; 2.北方民族大学电气信息工程学院, 银川 750021)
为了准确、直观探测植物水分胁迫及生长状态信息,融合了叶绿素荧光动力学参数及荧光图像对不同干旱胁迫条件下的植物进行了实验观测。以460 nm蓝色LED作为激发光源,EMCCD加装690 nm带通滤光片进行荧光图像采集,对4种不同采样周期下的各1 000幅图像求每幅图的像素平均值,按时间序列绘制荧光强度,可得到信息更全面的叶绿素荧光动力学曲线,并计算得出各个动力学参数。同时,对不同时间产生的荧光图像进行降噪、乘除等运算,并用伪彩色显示,可直观分析各类因素导致的荧光分布不均匀性。对易失水叶片和非易失水叶片分别进行快速水分胁迫和缓慢水分胁迫实验,结果表明,荧光比Rfd及动力学曲线上次峰值出现的时间随着胁迫的加剧均发生相应变化,且与叶片含水率之间具有较高的拟合决定系数。因此,将叶绿素荧光动力学特征和图像信息相结合,可提高植物干旱胁迫早期预测的准确度和直观性,为现场连续无损地监测植物生长状态、各类胁迫信息、病虫害检测等提供了一种快速的遥测手段。
水分胁迫; 叶绿素荧光成像; 荧光动力学
引言
适量的水分供给是作物产能的重要因素,传统的作物水分含量监测方法大多受响应速度慢、精度低、直接接触破坏植株生长等不利因素影响[1]。近年来,随着光学技术的发展,可通过分析叶片的光谱特性,利用反射光谱、透射光谱和叶绿素荧光光谱等指数对植物的干旱胁迫进行无损检测[2]。其中叶绿素荧光作为植物光合作用的指示器,可反映植物的光合状态,可在肉眼看到症状出现前就显现出胁迫特征,因此广泛应用于植物各类胁迫状态的监测和预警[3-4]。
近年来,许多科学家分别从荧光光谱和荧光动力学[5]等方面对植物叶绿素荧光进行了研究,其相关指数可反映出植物的生存状态、胁迫、病理等多种信息[6-7]。其中,叶绿素荧光动力学技术已发展成为一项成熟的热门技术,在鉴定和评价作物的耐逆境能力方面应用广泛[8-10]。叶绿素荧光成像法以其速度快、非接触、能直观反映整个叶片上所有点的光合状态等优势,得到了越来越广泛的应用,其中,较多利用不同光谱荧光图像比值分析植物叶片的光合特性。LANG等[10]发现多光谱荧光图像比值F440/F690和F440/F740随着含水率的降低呈线性增长趋势。
以成像的方式获取荧光动力学参数结合了动力学和成像法的优点,既可以获得整个叶片表面的光合作用不均匀性,也可以获得各个动力学参数。LICHTENTHALER等[11]发现受干旱胁迫的叶片的叶绿素荧光比Rfd和最大荧光与稳态荧光之比Fm/Fs降低,但该实验中仅采集了2幅图像来求图像荧光比。BLUMENTHAL等[12]对荧光动力学曲线上的150个数据点,利用隐马尔科夫模型建模,可以区分出不同胁迫种类和胁迫等级。TAKAYAMA等[13]利用蓝色LED照射番茄植株,激发其产生荧光,用帧率为15帧/s的CCD采集30 s并绘制叶绿素荧光动力学曲线图,建立了参数PFI,即最大点P点的值除以S点到M点的平均值(S点和M点分别定义为在23 s和30 s时采集的荧光值)。HSIAO等[14]利用蓝色LED照射白菜植株,激发其产生荧光,用帧率为1.7帧/s的CCD采集300 s并绘制叶绿素荧光动力学曲线图,建立了参数DFI,即荧光最大值P点到170 s处连线到荧光动力学曲线上最长的线段值。
以上研究,均采用荧光成像法获取荧光动力学曲线,建立不同的参数,可以对植物胁迫进行早期监测和胁迫等级的判定。然而仅对慢速荧光部分进行了少数点的采集,不能得到完整的荧光动力学曲线。本文设计一种基于LED诱导叶绿素荧光成像的装置,利用LED作为光源,EMCCD作为采集设备,通过设定不同的采集速率,可以测量叶绿素荧光动力学曲线上快速部分和慢速部分的特征值,获得完整的荧光动力学曲线,并可以采集不同时间点上的荧光图像。因此,可利用荧光图像分析叶片光合作用的空间不均匀性,也可通过分析荧光动力学参数得出相应的胁迫信息,以期在肉眼发现胁迫症状之前采取相应的补救措施,保证植物处于最佳生长状态。
1 原理、材料与方法
1.1 叶绿素荧光动力学原理
植物叶片吸收外界光能用于光合作用,然而并不是所有吸收的光能都参与光化学反应,而是通过3种形式分配,如图1所示,在弱光照射下,植物吸收的光能有95%以上被用于光化学反应,大约3%的吸收光能转化成热的形式耗散掉,仅有不到1%的光能转化为红色的荧光发射出来,在强光下,植物为避免灼伤会自行减弱光合作用,吸收的光能有95%~97%转变成热辐射,而2.5%~5.0%转变成荧光发射[15]。由于植物的营养状况和受胁迫程度等与光合作用有密切关系,因此,精细探测植物荧光信息可以间接作为研究植物营养状况、生理状况、病害状况和受胁迫程度的方法。

图2 叶绿素荧光动力学曲线Fig.2 Typical chlorophyll fluorescence induction curves
叶绿素荧光和光化学反应、热耗散之间存在竞争机制,用光照射经过暗适应的叶片时,随着光合作用的强弱变化,会产生随时间发生动态变化的荧光,该现象称为“荧光动力学曲线”,如图2所示,国际上统一将诱导动力学曲线划分为原点O、偏转I、小坑D、最高峰P、半稳态S、次峰M和终点T这几个节点。O-P称为“快相”,大约用几秒钟时间,主要反映了PSⅡ的原初光化学反应及光合机构的结构和状态等的变化。P-T称为“慢相”,大约用几分钟时间,主要反映了光合碳代谢的变化,随着光合碳代谢速率的上升,荧光强度逐渐下降。叶绿素荧光动力学技术能更本质地反映出叶片在进行光合作用时对光能的吸收与传递过程。
1.2 实验装置及测量步骤
如图3所示为本文设计的叶绿素荧光成像系统装置,光源为10个1 W的蓝色LED灯(460 nm),激发植物叶片产生荧光,荧光通过滤光片(690FS10-50型,Andover Co.,Ltd.,USA)后由EMCCD(iXon Ultra 897型,Andor)接收,然后通过USB口传输给计算机,在计算机中进行数据处理。

图4 叶绿素荧光动力学变化曲线Fig.4 Chlorophyll fluorescence transient variation curves

图3 叶绿素荧光成像系统装置图Fig.3 Diagram of chlorophyll fluorescence imaging system
由于荧光动力学曲线分为快相和慢相部分,快相的变化在微秒级别,而慢相的变化在分钟级别,因此,实验中可对每个暗适应20 min后的叶片分别进行快速和慢速测量,以得到整个荧光动力学曲线上的特征点。将EMCCD的拍摄模式设为fast kinetics 和kinetics 2种模式,在fast kinetics 中,设置拍摄周期为20 μs,在kinetics模式下拍摄3次,采样周期分别为5 ms、50 ms和0.5 s,每次拍摄均采集1 000幅图像,对每幅图像的荧光强度求平均值,并按时序排列,得到时间和相对荧光强度之间的坐标图,如图4所示,分别为拍摄周期为20 μs、5 ms、50 ms和0.5 s时采集到的1 000幅荧光图像连续平均强度。从图中可以得出荧光动力学曲线的拐点特征信息,快速上升阶段的J点和I点,达到最大值的P点,下降阶段的2个峰值M′和M点,以及半稳态值S点和稳态值T点。由于这些特征值和植物的叶绿素含量、生理状态、胁迫等信息都有一定的量化关系,因此,可通过这些特征点建立参数为定量研究植物的光合特性、胁迫种类与等级、模型建立等提供依据。
1.3 实验材料
分别进行快速水分胁迫和缓慢水分胁迫实验。快速水分胁迫是指将叶片从植株上摘下,进行自然失水,间隔几小时或连续每天测量其荧光动力学图像。缓慢水分胁迫是选取2盆培养环境和长势一致的植株(以绿萝为样本),其中1株每天浇水100 mL,保证充分的水分供给,另1盆不浇水,每隔1 d从2盆植株上选取生长位置和状态相近的叶片,分别测量其荧光动力学曲线。根据多次实验结果分析,将快速水分胁迫实验分为2组,即易失水叶片和非易失水叶片,例如,苹果树叶、梨树叶、杏树叶、槐树叶等属于易失水叶片,一旦摘下脱离树干,则在1 d内就会失水严重,荧光变化明显。而花卉类植物,如常见的绿萝、碧玉、鸭掌等叶片,在摘离植株后连续数天内依然保持有较高的含水率,荧光变化现象与前者不同。
1.4 实验数据处理方法
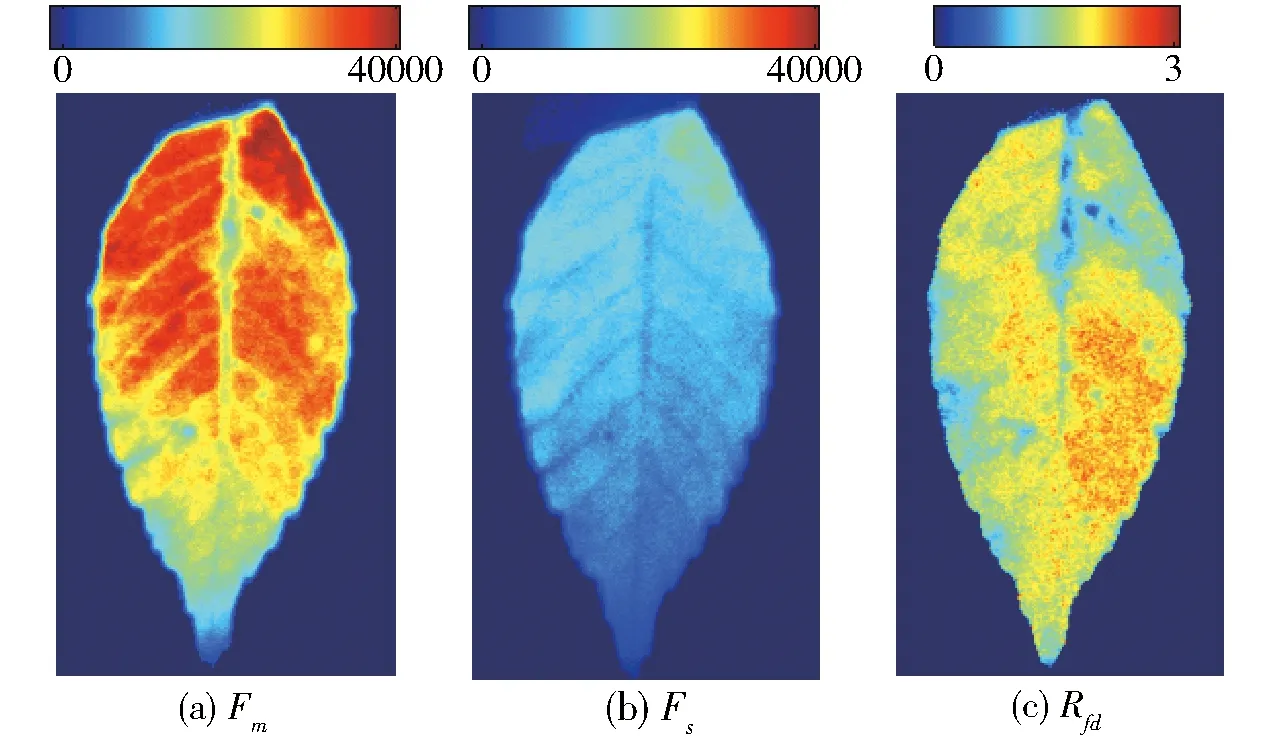
图5 槐树叶最大荧光、稳态荧光和荧光比图像的伪彩色显示Fig.5 Images of red chlorophyll fluorescence F690 of a locust tree leaf measured at maximum fluorescence level (Fm), steady state level (Fs) and image Rfd
因本文方法可连续采集荧光动力学曲线上不同时刻的荧光图像,因此,可通过求平均像素的方法得出如图4所示荧光动力学曲线。同时,也可对每个时刻的荧光图像进行降噪、乘法、除法等运算,并进行伪彩色显示,即可从图像上直观分析叶绿素荧光的空间分布不均匀性、各类胁迫的区域局部性影响、农药通过叶脉缓慢渗透等现象。如图5所示为槐树叶荧光最大时的荧光图像Fm和稳态荧光图像Fs的伪彩色图像,以及求得的叶绿素荧光比Rfd图像,Rfd是反映叶片光合作用能力的一个重要参数。从图中可以看出,最大荧光Fm和稳态荧光Fs均呈现不均匀性,叶片上端的荧光强,下面叶尖部分的荧光弱,这一方面和叶片不同位置的叶绿素含量不同导致荧光强弱不同有关,另一方面,也和光源的不均匀性有关,但是荧光比Rfd的图像强度分布却并未呈现以上特性,这说明通过荧光图像的比值可以消除光源不均匀性的影响,且能更真实地反映植物的光合特性。
另外,还可以对叶片进行剖面分析,如图6所示,从叶片的左边到右边同一直线上,荧光的强弱也有所不同,根据以上现象,可分析当叶片受到不同种类及不同等级胁迫时,其生理状态的2维变化。
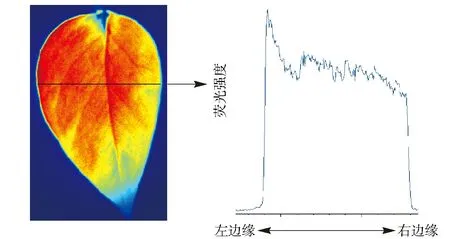
图6 叶绿素荧光强度2维分布图Fig.6 Profile analysis of chlorophyll fluorescence measured across leaf area from left to right side
2 结果与讨论
2.1 快速水分胁迫实验
2.1.1 易失水叶片
通过多次实验发现,田间果树、绿化树等叶片属于易失水叶片,抗旱能力较差,一旦脱离树干,则很快会失水,荧光变化较为明显,图7所示为以苹果叶为代表的易失水叶片的荧光动力学曲线变化。总共测量了4次,分别为刚摘下时和过了6 h、24 h、30 h的测量结果。结果显示,刚摘下时,荧光迅速达到最大值,然后衰减到稳态值,Rfd值大约为2.47;当过了6 h后,最大荧光和稳态荧光都有所增强,但Rfd值为2.77,说明在失水6 h内,叶片的光合能力并未减弱;当过了24 h再测量时,荧光最大值和稳态值都有明显上升,且Rfd降低到0.53;到30 h后,荧光基本没有衰减,这是由于叶片严重失水,几乎失去了光化学反应能力所造成的。
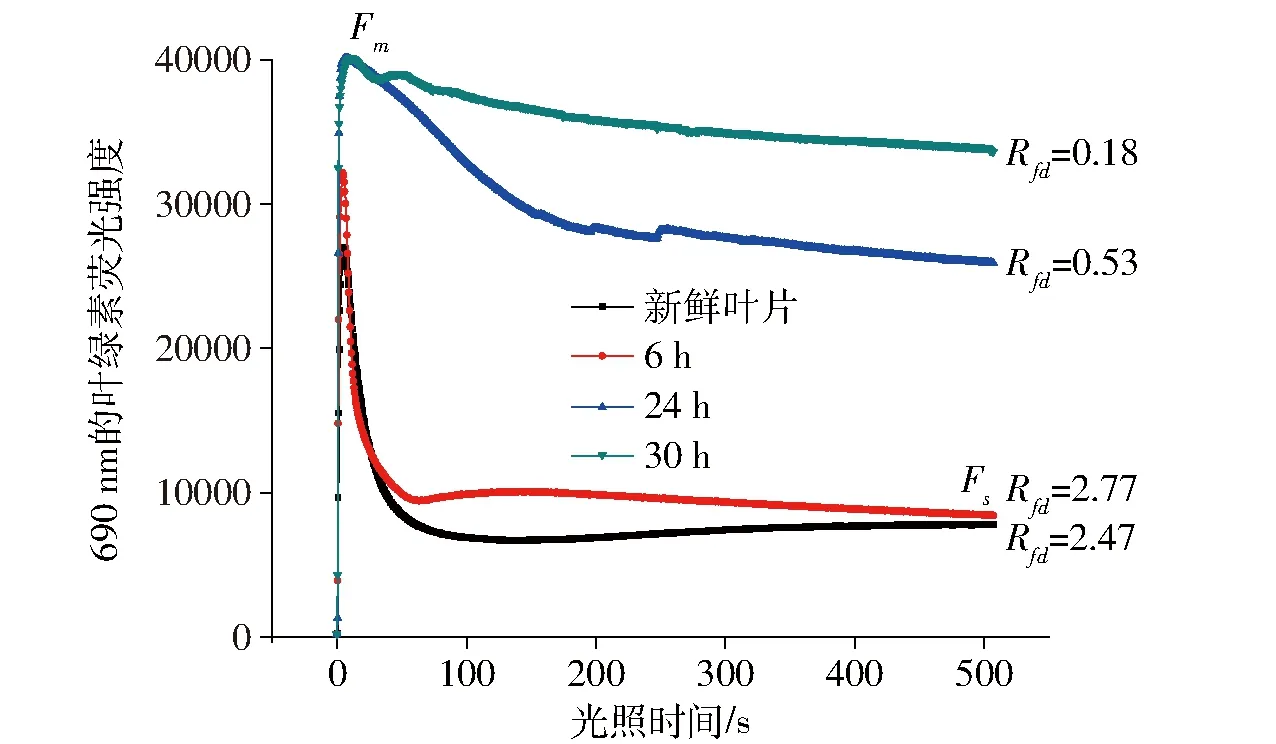
图7 不同水分胁迫下苹果叶片的叶绿素荧光动力学曲线Fig.7 Curves in chlorophyll fluorescence kinetics of apple tree leaf with different water stress
同时,也对苹果叶片进行了荧光图像分析,如图8所示,分别为失水6 h、24 h和30 h后的叶绿素荧光比Rfd图像,从图8可看出,随着水分胁迫状态的加剧,Rfd呈减小趋势。
因此,由荧光动力学曲线计算得出的Rfd参数或通过荧光比Rfd图像均可反映植物的缺水状态,可根据物种的不同,设定一个合适的Rfd参数,做到在线监测,适量适时灌溉,达到节约水资源,避免植物过度缺水或过度浇灌。
2.1.2 非易失水叶片
对绿萝、碧玉、鸭掌等花卉类非易失水叶片,也进行了干旱胁迫的荧光测定,表1和图9以绿萝为例。每次测量前先测量叶片的质量,以计算每次相对失水量,表1所示为其连续失水5 d所对应的质量。将叶片暗适应20 min后,利用EMCCD连续拍摄1 000幅图像,计算每幅图像的荧光强度平均值,按时间顺序做出其荧光衰减曲线,即得出荧光诱导动力学曲线。如图9所示为摘下第1天和连续失水5 d的荧光动力学曲线。
表1 不同胁迫天数下绿萝叶片的质量
Tab.1 Leaf mass ofScindapsusaureusunder different water-stress days
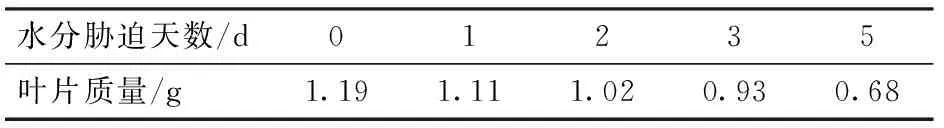
水分胁迫天数/d01235叶片质量/g1.191.111.020.930.68
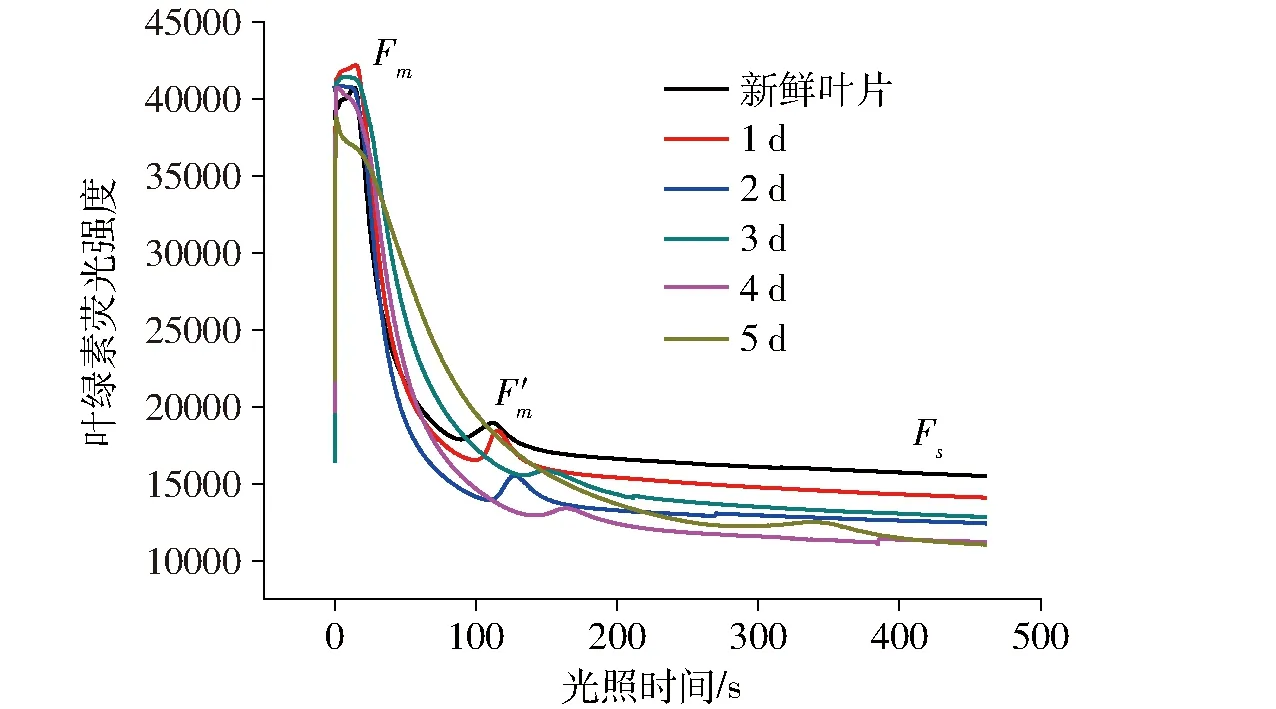
图9 绿萝叶片在不同时间水分胁迫下的荧光动力学曲线Fig.9 Fluorescence induction curves under different levels of water stress of Scindapsus aureus leaves
从表1和图9中可以看出,随着失水天数的增加,叶片的质量逐渐下降(含水率逐渐减小),荧光从最大值Fm衰减的速率降低,达到次峰值F′m的时间逐渐延迟,且稳态值Fs逐渐减小,并没有出现前面分析的易失水叶片和文献中常见的稳态荧光Fs增大的现象,反而Rfd呈现了增大的趋势。这说明当叶片摘离植株较长时间后,不只受到水分胁迫的影响,还会受到衰老等其他因素的影响。分析上图并提取几个重要参数,即Rfd((Fm-Fs)/Fs)、Fm/Fs、次峰值F′m出现时间与水分胁迫天数,对其与叶片含水率之间作相关分析,如图10所示,发现都呈正相关,且参数F′m出现的时间与含水量之间的拟合决定系数最高,达到0.98。因此,该参数可作为研究植物遭受水分胁迫程度的参量。
2.2 缓慢水分胁迫实验

图10 水分胁迫天数与参数Fm/Fs、Rfd以及F′m之间的相关性分析Fig.10 Variations of parameters Fm/Fs , Rfd and appearance time of F′m with increase of water stress days

图11 不同水分胁迫和正常绿萝叶片的叶绿素荧光动力学曲线Fig.11 Fluorescence induction curves under different days of water stress and control of Scindapsus aureus leaves
缓慢水分胁迫实验,是对2盆长势良好的绿萝植株进行对照性实验,其中1盆每天浇水100 mL,保证充分的水分供应,另1盆连续干旱7 d,在这7 d内肉眼并看不出2盆植株长势明显的区别。每隔1 d选取2盆植株的中间叶片进行测量,测量结果如图11所示,图11a、11b、11c、11d分别为未浇水1 d、3 d、5 d和7 d时的绿萝叶片叶绿素荧光动力学曲线和每天浇水(未受胁迫)的绿萝叶片的动力学曲线比较图。从图中可以看出,受胁迫叶片的荧光值均有一定幅度上升,且随着胁迫天数的增加,胁迫叶片动力学曲线的次峰值F′m与浇水叶片的次峰值F′m出现的时间差依次增大。分别提取参数Rfd和次峰值出现的时间差如表2所示,在胁迫第1天2个F′m的时间差为12.8 s,第2天相差为41.5 s,第3天和第4天的时间差迅速增大,分别为152 s和153 s。同时比较了受胁迫叶片的Rfd(control)和胁迫叶片的Rfd(stress),发现受胁迫后,Rfd参数有所减小,且随着胁迫的加剧,Rfd(control)-Rfd(stress)值也依次增大。这说明,当受到缓慢水分胁迫时,虽然肉眼看不出胁迫症状,但是参数Rfd和次峰值出现的时间均出现减小和延迟的现象。因此,可选取合适的参数值,实施现场在线监测,优化灌溉管理系统,保证植物处于最佳生长状态。
表2 正常叶片和受胁迫叶片的荧光次峰值出现时间及
荧光比Rfd的差值
Tab.2 Time difference ofF′m(control)-F′m(stress)and difference ofRfd(control)-Rfd(stress)

水分胁迫天数/d1357F'm(control)-F'm(stress)12.841.5152153Rfd(control)-Rfd(stress)0.090.040.731.99
3 结论
(1)对于果树、绿化树等易失水叶片,当摘离树枝时,其水分很快流失,且随着胁迫的加剧,其荧光变化明显,稳态荧光Fs迅速上升,荧光比Rfd迅速减小,大约30 h后,荧光基本没有衰减,叶片几乎失去光合反映能力。对于花卉类非易失水叶片,当受到快速水分胁迫(摘离植株)时,由于多种因素的影响,Rfd参数呈现增大趋势,但其动力学曲线上次峰值出现的时间随着水分胁迫的加剧出现延迟现象,该时间与胁迫天数的决定系数可达0.98。
(2)当非易失水叶片受到缓慢水分胁迫时,受胁迫叶片相比正常叶片的荧光有所增强,这是由于光合作用减小的缘故。且受胁迫后,荧光比Rfd减小,同样,次峰值出现的时间后延。
(3)由此可以看出当叶片仅受到水分胁迫时,例如缓慢水分胁迫和易失水叶片的快速水分胁迫,荧光比Rfd和次峰值出现时间的延迟都可作为水胁迫程度的判定参数。然而,当非易失水叶片受到快速水分胁迫时,由于摘离枝体,不仅受到水分胁迫,还受到衰老、营养胁迫等因素影响,Rfd值反而增大,因此不宜作为水分胁迫判别依据。但是,次峰值出现的时间依然与水分胁迫程度有很高的相关性,可以作为水分胁迫程度的判别参数。
(4)融合了叶绿素荧光图像及动力学特征,该方法对于植物水分胁迫的监测和预警是有效的,在不同实验下,建立不同参数,亦可用于植物的营养胁迫、高温胁迫、病虫害检测等领域,为后续进一步定量分析植物生理生长状态和建模提供依据。
1 张石锐, 董大明, 郑文刚,等. 农田土壤水分含量的激光诱导荧光光谱表征[J]. 光谱学与光谱分析, 2012, 32(10):2623-2627.
2 张佳华, 许云, 姚凤梅,等. 植被含水量光学遥感估算方法研究进展[J].中国科学:技术科学, 2010(10):1121-1129.
3 HARTMUT K L, FATBARDHA Babani. Detection of photosynthetic activity and water stressby imaging the red chlorophyll fluorescence[J]. Plant Physiology and Biochemistry, 2000, 38(11):889-895.
4 GAMEIRO C, UTKIN A B, CARTAXANA P, et al. The use of laser induced chlorophyll fluorescence (LIF) as a fast and non destructive method to investigate water deficit inArabidopsis[J]. Agricultural Water Management, 2016,164,part1:127-136.
5 KAUTSKY H, HIRSCH A. Neue versuche zur kohlensäureassimilation[J]. Naturwissenschaften, 1931, 19(48):964.
6 PANIGADA C, ROSSINI M, MERONI M, et al. Fluorescence, PRI and canopy temperature for water stress detection in cereal crops[J]. International Journal of Applied Earth Observation & Geoinformation, 2014, 30(1):167-178.
7 HSIAO S C, CHEN S, YANG I C, et al. Evaluation of plant seedling water stress using dynamic fluorescence index with blue LED-based fluorescence imaging[J]. Computers & Electronics in Agriculture, 2010, 72(2):127-133.
8 陈建明, 俞晓平, 程家安. 叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J]. 浙江农业学报, 2006, 18(1):51-55.
9 李钦夫, 李征明, 纪建伟,等. 叶绿素荧光动力学及在植物抗逆生理研究中的应用[J]. 湖北农业科学, 2013, 52(22):5399-5402.
10 LANG M, LICHTENTHALER H K, SOWINSKA M, et al. Fluorescence imaging of water and temperature stress in plant leaves[J]. Journal of Plant Physiology, 1996, 148(5):613-621.
11 LICHTENTHALER H K, FATBARDHA Babani. Detection of photosynthetic activity and water stressby imaging the red chlorophyll fluorescence[J]. Plant Physiology and Biochemistry, 2000, 38(11):889-895.
12 BLUMENTHAL J, MEGHERBI D B, LUSSIER R. Unsupervised machine learning via Hidden Markov Models for accurate clustering of plant stress levels based on imaged chlorophyll fluorescence profiles & their rate of change in time[C]∥2014 IEEE International Conference on Computational Intelligence and Virtual Environments for Measurement Systems and Applications (CIVEMSA), 2014:76-81.
13 TAKAYAMA K, NISHINA H, IYOKI S, et al. Early detection of drought stress in tomato plants with chlorophyll fluorescence imaging—practical application of the speaking plant approach in a greenhouse[J]. IFAC Proceedings Volumes, 2011,44(1):1785-1790.
14 HSIAO S C, CHEN S, YANG I C, et al. Evaluation of plant seedling water stress using dynamic fluorescence index with blue LED-based fluorescence imaging[J]. Computers & Electronics in Agriculture, 2010, 72(2):127-133.
15 卢劲竹, 蒋焕煜, 崔笛. 荧光成像技术在植物病害检测的应用研究进展[J/OL]. 农业机械学报, 2014, 45(4):244-252. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20140439&flag=1.DOI:10.6041/j.issn.1000-1298.2014.04.039. LU Jingzhu, JIANG Huanyu,CUI Di. Progress of fluorescence imaging technology in detection of plant diseases[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2014,45(4):244-252.(in Chinese)
Detecting Method for Plant Water Stress with Chlorophyll Fluorescence Kinetics Based on Imaging
ZHOU Chunyan1,2HUA Dengxin1LE Jing1YAN Qing1MAO Jiandong2JING Min1
(1.SchoolofMechanicalandPrecisionInstrumentEngineering,Xi’anUniversityofTechnology,Xi’an710048,China2.SchoolofElectricalandInformationEngineering,NorthUniversityofNationalities,Yinchuan750021,China)
Chlorophyll fluorescence is a useful indicator as it gives important information about the stress and health state of plant. In order to detect plant water stress and growth state accurately and intuitively, plants under different drought stress conditions were experimented by using chlorophyll fluorescence imaging method combined with the chlorophyll fluorescence kinetics parameters. The chlorophyll fluorescence was excited by 460 nm LEDs, and acquired by EMCCD equipped with 690 nm band pass filter. The average pixel value was calculated for each image of 4 000 pictures which were acquired in four different sampling periods individually. The intensity of each image was plotted according to the time sequence, thus the chlorophyll fluorescence kinetics curve could be concluded, and chlorophyll fluorescence kinetics parameters could be calculated. Meanwhile, images were processed for noise reduction, calculation of multiplication and division and so on. And then they were displayed by pseudo color, thus various factors led to uneven distribution of fluorescence could be intuitively analyzed. Fast water stress and slow water stress experiments were conducted for easy to dehydrate and not easy to water loss leaves, respectively. The results showed that the fluorescence ratioRfdand the time of second peak of kinetics curve were changed with the increase of stress, and both had high fitting determination coefficient with leaf water content (0.86 and 0.98). Therefore, the method combined the chlorophyll fluorescence imaging with chlorophyll fluorescence kinetics parameters could improve the accuracy and intuition of plant drought stress earlier prediction, and it could be a rapid means of remote sensing for site continuous monitoring the growth status of plants, all kinds of stress, pest and disease and so on.
water stress; chlorophyll fluorescence imaging; fluorescence kinetics
10.6041/j.issn.1000-1298.2017.01.019
2016-09-27
2016-11-17
国家自然科学基金项目(61605157、61275185、61565001)和国家民委科研项目(14BFZ011)
周春艳(1983—),女,博士生,北方民族大学讲师,主要从事荧光激光雷达研究,E-mail: zchunyan@126.com
华灯鑫(1964—),男,教授,主要从事激光雷达遥测技术研究,E-mail: xauthdx@163.com
S123; S127
A
1000-1298(2017)01-0148-07

