组蛋白乙酰化调控异常与大鼠抑郁行为的关系研究
李海燕,伏箫燕,崔 婷,蒋青松,邱红梅
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室, 重庆 400016)
组蛋白乙酰化调控异常与大鼠抑郁行为的关系研究
李海燕,伏箫燕,崔 婷,蒋青松,邱红梅
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室, 重庆 400016)
目的 研究组蛋白乙酰化与慢性不可预见刺激(chronic unpredictable stress,CUS)致大鼠抑郁行为的关系。方法 30只♂ Sprague Dawley(SD)大鼠随机分为对照组和模型组,采用孤养结合CUS方式连续刺激28 d建立大鼠抑郁症模型;以开场实验和强迫游泳实验评价大鼠抑郁行为;采用实时荧光定量PCR法检测大鼠前脑皮层和海马组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)mRNA表达;采用Western blot法检测大鼠前脑皮层和海马组蛋白H3(histone 3,H3)、组蛋白H4(histone 4,H4)、乙酰化组蛋白H3(actylation-histone 3,acH3)及乙酰化组蛋白H4(actylation-histone 4,acH4)蛋白表达水平。结果 与对照组大鼠相比,模型组大鼠开场实验得分明显降低(P<0.01)、强迫游泳实验不动时间明显延长(P<0.01)、前脑皮层和海马HDAC2 mRNA和蛋白表达明显增加(P<0.01)、组蛋白H3和组蛋白H4蛋白表达均无明显差异、acH3及acH4蛋白水平均明显降低(P<0.01)。结论 CUS诱导大鼠产生抑郁样行为改变,其机制可能与脑内HDAC表达增高致组蛋白乙酰化修饰水平降低有关。
抑郁症;组蛋白乙酰化;慢性不可预见刺激; 乙酰化组蛋白H3; 乙酰化组蛋白H4; HDAC2
抑郁症是一种常见的精神障碍类疾病,以高致残率、致死率及反复阶段性发作等为特点[1],已跻身全球疾病负担源的第11位[2]。抑郁症发病机制纷繁复杂,可能涉及遗传、心理、社会环境等多种因素,迄今仍未得到明确阐明。近年来研究显示,基因修饰功能的表观遗传学改变也可能参与了抑郁症的发生[3]。表观遗传学是指在遗传物质的DNA序列不变的情况下,通过组蛋白翻译后修饰、非编码的RNA调控作用、DNA启动子甲基化修饰等调节下游目的基因表达和功能,最终影响细胞分裂、增殖并可致遗传的一门新兴学科[4]。组蛋白乙酰化修饰是表观遗传学研究的重要组成部分之一,与基因活化密切相关。组蛋白乙酰化水平增高有利于降低组蛋白与DNA 之间的亲和作用,使染色质核小体结构松散,利于转录因子与DNA结合继而促进相应基因的转录和表达,而乙酰化水平降低则发挥相反的作用[5]。其中,组蛋白H3(histone 3,H3)和组蛋白H4(histone 4,H4)氨基末端的赖氨酸残基乙酰化修饰对转录尤为重要。组蛋白乙酰化修饰由组蛋白乙酰化酶和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调控。HDAC是调控机体组蛋白乙酰化修饰水平的重要酶类,研究发现血清HDAC水平增高与临床抑郁症的发生呈正相关[6],海马HDAC水平增高与小鼠抑郁症的发生密切相关[7]。
目前研究表明,组蛋白乙酰化与去乙酰化功能的失衡,组蛋白乙酰化水平降低可能参与了抑郁症的发生[8],但尚缺乏系统研究。因此,本研究以孤养结合慢性不可预见刺激(chronic unpredictable stress,CUS)构建大鼠抑郁症模型,通过对HDAC2、组蛋白H3、组蛋白H4、乙酰化组蛋白H3(actylation-histone 3,acH3)及乙酰化组蛋白H4(actylation-histone 4,acH4)等指标的测定,研究组蛋白乙酰化水平与大鼠抑郁行为之间的关系,探讨抑郁症发病的可能机制。
1 材料与方法
1.1 实验动物 清洁级♂ Sprague Dawley(SD)大鼠30只,体质量180 g~220 g,由重庆医科大学动物中心提供,医学动物许可证号:SYXK(渝)2012-0001。本研究符合作者所在单位实验动物伦理委员会所制定的伦理学标准。
1.2 主要试剂与仪器 NE-PER核蛋白胞质蛋白抽提试剂盒(美国Thermo公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术公司);Anti-acetyl-Histone H3 Antibody、Anti-acetyl-Histone H4 Antibody、Anti-Histone H3 Antibody、Anti-Histone H4 Antibody、Anti-HDAC2 Antibody(德国Merck Millipore公司);ECL化学发光试剂盒(美国Bio-Rad公司);凝胶成像系统(美国Bio-Rad公司);PCR引物、总RNA提取试剂盒、cDNA第一链合成试剂盒、染料法实时荧光定量试剂盒(宝生物工程大连有限公司);实时定量PCR仪(美国Bio-Rad公司);Thermo低温高速离心机Fresco 21(美国);台式离心机(上海市安亭科学仪器厂,TGL-16C);超低温冰箱(日本Sanyo公司)。
1.3 方法
1.3.1 动物分组和模型建立 ♂ SD大鼠30只,在安静通风、室温(17~23) ℃、给予自由摄食和饮水的环境下适应性喂养1周后随机分为对照组和模型组,每组各15只。对照组大鼠每笼5只,正常饲养,不予刺激。模型组大鼠每笼1只,参照本实验室前期建模方法[9],采用孤养结合CUS方式连续给予刺激28 d建立抑郁症大鼠模型。给予的刺激方式包括倾斜24 h,噪音3 h,夹尾1 min,昼夜颠倒,潮湿垫料24 h,禁食+空笼24 h,电击5 min,45℃热水浴5 min,闪频3 h,禁饮禁食24 h,通宵照明,水平振荡10 min。建模过程中每天随机给予一种刺激,同种刺激方式4 d内不重复出现,使动物不可预知。
1.3.2 开场实验(open-field test,OFT) 参照文献[10],使用黑色内壁100 cm× 100 cm× 40 cm的木质敞箱进行测定,木箱底部均分为5×5个方格。实验在安静昏暗的环境下进行,测试开始时将大鼠置于木箱底部中央格,观察并记录其5 min内运动情况,以水平运动得分(大鼠四爪均进入底部小方格的穿越格子数)、垂直运动得分(大鼠后肢直立次数)、理毛次数及大小便4项得分总和作为开场实验得分。每只大鼠测试完成后清理粪便并用酒精清洁敞箱,避免其遗留气味对下次测试造成影响。
1.3.3 强迫游泳实验(forced swim test, FST) 参考文献[11]并稍加改进,强迫游泳实验仪器为高60 cm、直径20 cm、水深30 cm的透明圆柱形玻璃缸,测试时间7 min。实验开始时将大鼠放入玻璃缸内,使其适应2 min后记录后5 min内累计不动时间,整个实验过程中维持水温在25 ℃左右。
1.3.4 实时荧光定量PCR法检测皮层及海马HDAC2 mRNA的表达 末次刺激24 h后,每组随机选取大鼠4只,以质量分数为4%的水合氯醛麻醉后,断头并于冰浴上分离大鼠皮层和海马,-80 ℃保存备用。参照GeneBank 大鼠基因序列设计并合成HDAC2 和内参β-actin 引物(由宝生物工程大连有限公司合成)。HDAC2上游:5′-GAGGTCGTAGGAATGTCGCT-3′,下游:5′-CAAGGGTTGTTGAGTTGTTCTG-3′,扩增片段 178 bp;β-actin 上游:5′-ACGGTCAGGTCATCACTATCG-3′,下游:5′-GGCATAGAGGTCTTTACGGATG-3′,扩增片段 155 bp。采用TRIzol法根据试剂盒说明书提取大鼠前脑皮层和海马总RNA,测定RNA浓度,按照1 μg/20 μL反应体系进行逆转录合成cDNA,利用SYBR Green 荧光技术,在定量PCR仪器上按如下条件进行扩增:95 ℃ 30 s,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环后72 ℃再延伸5 min。反应结果以Ct值表示,通过2-△△Ct计算目的基因的相对表达量。
1.3.5 Western blot 法检测皮层及海马HDAC2、acH3、acH4、H3及H4蛋白表达 末次刺激24 h后,每组随机取大鼠4只,以质量分数为4%的水合氯醛麻醉后,断头、分离大鼠皮层和海马并于冰上匀浆,采用NE-PER核蛋白胞质蛋白抽提试剂盒、BCA试剂盒分别进行胞质、胞核蛋白的提取及蛋白浓度的测定。每孔上样量30 μg,依次进行SDS-PAGE凝胶电泳、转膜、室温5%脱脂牛奶封闭2 h、一抗4℃摇床孵育过夜、洗膜3次、二抗室温下孵育1h、洗膜3次、 ECL显色,凝胶成像仪成像后用Image Lab软件(Bio-Rad)分析结果。以β-actin 、Lamin B为内参分别校正HDAC2、H3、H4、acH3及acH4蛋白水平。

2 结果
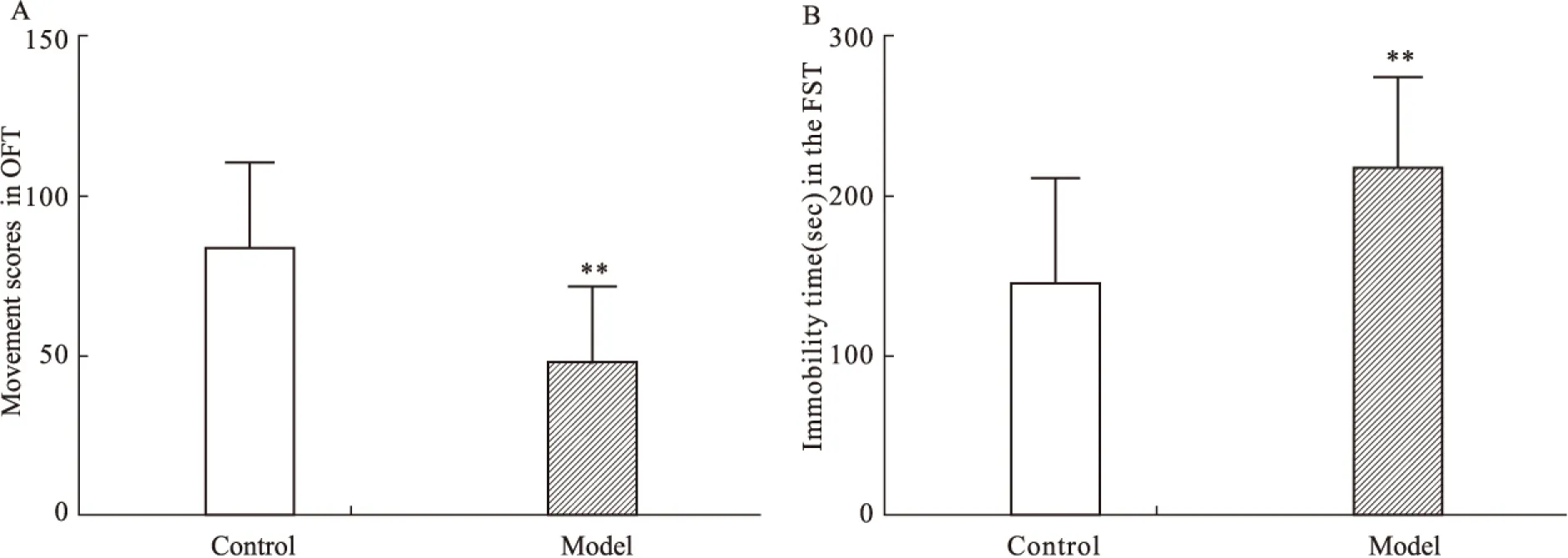
2.1 CUS对大鼠行为的影响 开场实验结果显示,模型组大鼠开场实验得分较对照组大鼠明显降低(P<0.01),提示模型组大鼠出现明显焦虑样抑郁行为;强迫游泳实验结果显示,模型组大鼠强迫游泳不动时间较对照组大鼠明显延长(P<0.01)(Fig 1),提示模型组大鼠出现明显绝望样抑郁行为。
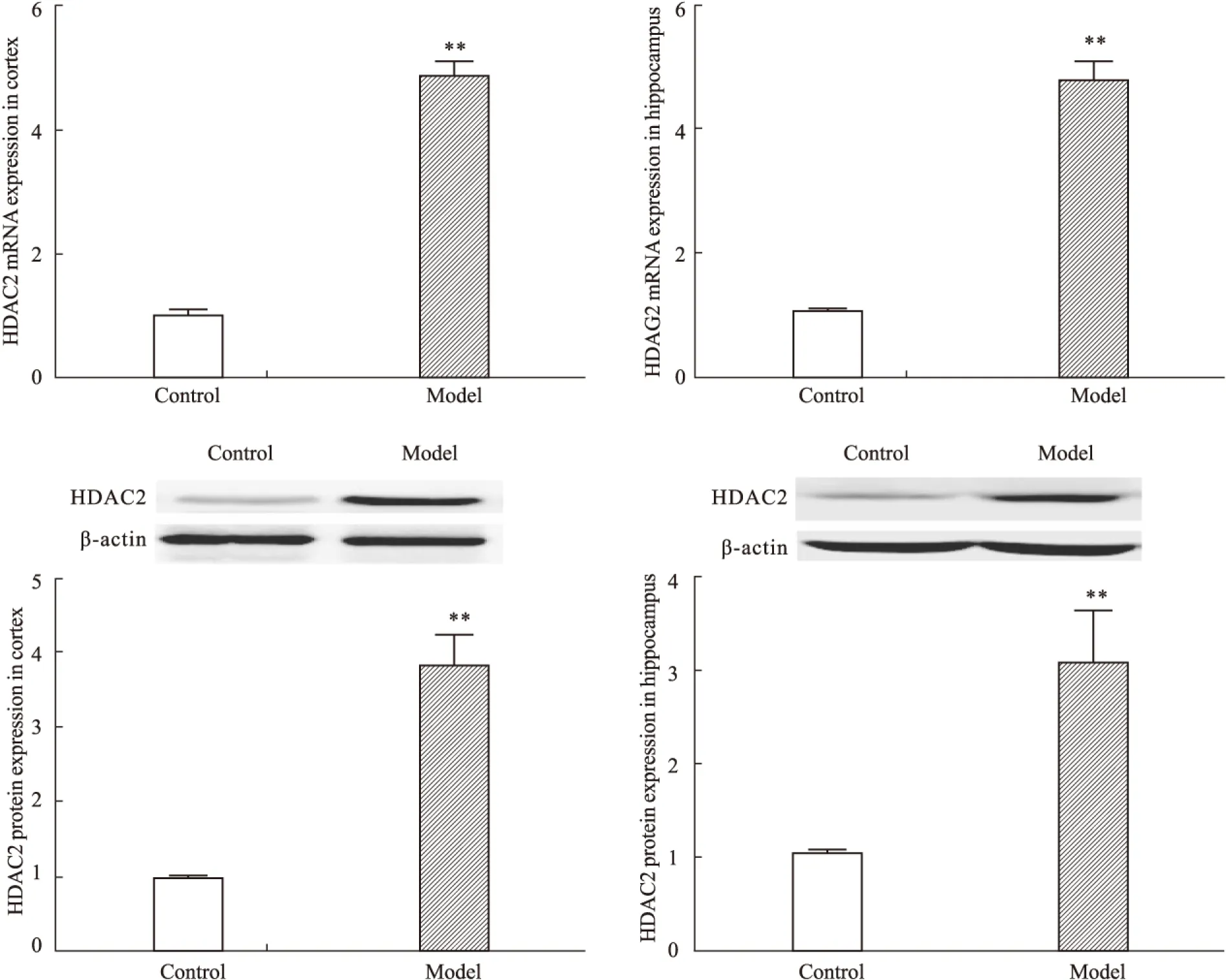
2.2 CUS对大鼠前脑皮层和海马HDAC2 mRNA及蛋白表达的影响 与对照组大鼠相比,模型组大鼠前脑皮层和海马HDAC2 mRNA(皮层P<0.01,海马P<0.01)及蛋白(皮层P<0.01,海马P<0.01)表达均明显增加(Fig 2)。提示模型组大鼠脑内出现明显HDAC2表达增高。
2.3 CUS对大鼠前脑皮层和海马H3及acH3蛋白表达的影响 与对照组大鼠相比,模型组大鼠前脑皮层和海马H3蛋白表达差异无显著性, acH3蛋白水平均明显降低(皮层P<0.01,海马P<0.01)(Fig 3)。提示模型组大鼠脑内H3水平无明显变化而H3乙酰化修饰水平明显降低。
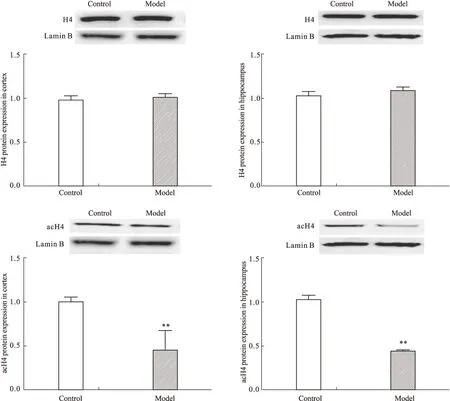
2.4 CUS对大鼠前脑皮层和海马acH4及H4蛋白表达的影响 与对照组大鼠相比,模型组大鼠前脑皮层和海马H4蛋白表达差异均无显著性,acH4蛋白水平均明显降低(皮层P<0.01,海马P<0.01)(Fig 4)。提示模型组大鼠脑内H4表达无明显变化而H4乙酰化修饰水平明显降低。

**P<0.01 vs control
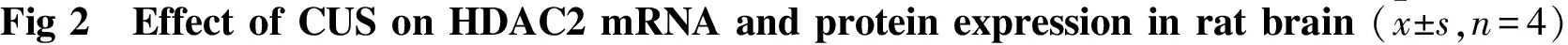
**P<0.01 vs control

**P<0.01 vs control
3 讨论
抑郁症是一种以绝望、快感丧失、兴趣缺失为主要特征的情绪障碍类疾病[12]。随着抑郁症发病率和死亡率的逐年升高,对抑郁症发病机制和治疗研究已成为当前社会关注的热点。目前,抑郁症的基础研究通常通过抑郁症动物模型进行,而CUS是实验鼠抑郁模型建立的经典方法之一[13]。OFT和FST是评价大鼠抑郁行为的有效指标,OFT通过检测大鼠在新异环境中的探究行为反映大鼠的焦虑抑郁状态[10],FST 中的不动时间与大鼠绝望行为密切相关[11]。为此,本课题组以CUS 诱导建立大鼠抑郁模型,观察大鼠抑郁行为与脑内组蛋白乙酰化水平之间的关系,探索抑郁症发病的表观遗传学机制。研究结果显示,CUS大鼠开场实验运动得分较对照组明显降低,提示CUS成功诱导大鼠出现焦虑样抑郁行为;强迫游泳实验不动时间较对照组明显延长提示CUS成功诱导大鼠出现绝望样抑郁行为。
表观遗传学是一门研究不涉及基因序列改变的、具有可遗传性和可逆性的基因表达调控的新兴的遗传学分支学科,其调控方式主要有组蛋白翻译后修饰、基因组印迹、DNA甲基化以及RNA编码等。近年来研究发现,表观遗传学调控异常参与多种精神障碍性疾病的发生,如双相情感障碍、精神分裂症等[14-15]。组蛋白翻译后修饰是表观遗传学研究的重要组成部分,包括乙酰化、磷酸化、甲基化、糖基化、泛素化等多种形式。在真核生物细胞中, DNA链缠绕由组蛋白H2A、H2B、H3、H4各两分子组成的八聚体构成核小体,是染色质的基本单位。组蛋白乙酰化修饰是研究最早的组蛋白转录后修饰,是基因转录调控和染色质重塑的关键因素之一。乙酰化修饰的位点主要为H3、H4的N端尾部赖氨酸残基,组蛋白乙酰化后可减弱组蛋白与DNA链之间的相互作用,增大空间位阻,利于DNA解螺旋并与转录因子结合,激活基因转录,反之则抑制转录。

**P<0.01 vs control
HDAC是调控组蛋白乙酰化修饰的关键酶类,可通过去乙酰化反应降低组蛋白乙酰化水平进而干扰下游目的基因表达。根据氨基酸序列的不同HDAC可分为4类:第1类包含HDAC1-3及HDAC8,第2类包含HDAC4-7、HDAC9-10,第3类是sirtuins即沉默信息调节因子及相关蛋白,第4类为HDAC11,其中 第1类和第2类在多种神经精神系统疾病的表观遗传学调控中发挥着重要的作用。近年来研究发现,外周血细胞HDAC2表达增高与临床重度抑郁症发生密切相关[6];慢性社交障碍可导致大鼠海马区乙酰化H3、H4水平降低[16];甲基汞诱导的小鼠抑郁行为与海马乙酰化H3水平降低密切相关[17];多种抗抑郁药物可通过上调HDAC表达改善C57BL/6 小鼠抑郁样行为[18],均提示HDAC表达异常与临床及动物抑郁症发生具有相关性,但尚缺乏系统研究。本研究结果显示CUS 致大鼠前脑皮层和海马HDAC2 mRNA及蛋白表达均明显升高,总H3和H4水平无明显改变,而acH3及acH4蛋白水平明显降低,提示CUS诱导大鼠抑郁样行为改变可能与脑内HDAC2表达增高致组蛋白H3、H4乙酰化修饰水平降低,继而导致下游抑郁症相关基因表达异常密切相关。
(致谢:本实验在重庆市生物化学与分子药理学重点实验室完成,感谢实验室各位老师和同学在实验中提供的帮助)。
[1] Kessler R C,Adler L,Barkley R,et al.The prevalence and correlates of adult ADHD in the United States: results from the Na-tional Comorbidity Survey Replication[J].Am J Psychiatry,2006,163(4) : 716-23.
[2] Murray C J,Vos T,Lozano R,et al.Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions,1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380: 2197-223.
[3] Lockwood L E,Su S,Youssef N A.The role of epigenetics in depression and suicide: A platform for gene - environment interactions [J].Psychiatry Res,2015,228(3) : 235-42.
[4] Vialou V,Feng J,Robison A J,et al.Epigenetic mechanisms of depression and antidepressants action[J].Annu Rev Pharmacol Toxicol,2013,53: 59-87.
[5] Chen X,Guan X J,Peng X H,et al.Acetylation of lysine 9 on histone H3 is associated with increased pro-inflammatory cytokine release in a cigarette smoke-induced rat model through HDAC1 depression [J].Inflamm Res,2015,64(7) : 513-26.
[6] Hobara T,Uchida S,Otsuki K,et al.Altered gene expression of histone deacetylases in mood disorder patients[J].J Psychiatr Res,2010,44(5) : 263-70.
[7] Di Nuzzo L,Orlando R,Toqnoli C,et al.Antidepressant activity of fingolimod in mice[J].Pharmacol Res Perspect,2015,3(3) :e00135.
[8] Eren Koak E,Ertuˇgrul A.Psychiatric disorders and epigenetics [J].Turk Psikiyatri Derg,2012,23(2) : 130-40.
[9] Qiu H M,Yang J X,Jiang X H,et al.Enhancing tyrosine hydroxylase and tryptophan hydroxylase expression and improving oxidative stress involved in the antidepressant effect of sodium valproate on rats undergoing chronic unpredicted stress[J].Neuroreport,2015,26(18) : 1145-50.
[10] 伏箫燕,李海燕,崔婷,等.CUS 致大鼠抑郁行为涉及TNF-a 及IDO-HAAO 通路激活[J].中国药理学通报,2016,32(5) : 620-5.
[10] Fu X Y,Li H Y,Cui T,et al.TNF-α mediated the activation of IDO pathway involved in the mechanism of depression in rats induced by CUS[J].Chin Pharmacol Bull,2016,32(5) : 620-5.
[11] Chen L,Chen M,Wang F,et al.Antidepressant-Like effects of Shuyusan in rats exposed to chronic stress: effects on hypothalamic-pituitary-adrenal function[J].Evid Based Complement Alternat Med,2012,2012: 940846.
[12] Farrell C,O’Keane V.Epigenetics and the glucocorticoid receptor: A review of the implications in depression[J].Psychiatry Res,2016,242: 349-56.
[13] 汪丽佳,邱红梅,蒋心惠,等.CUS 致大鼠抑郁行为涉及单胺递质合成酶表达下调[J].中国药理学通报,2015,31 (4) :527-31.
[13] Wang L J,Qiu H M,Jiang X H,et al.Down-regulation of monoamine neurotransmitter synthetase expression involved in CUS-induced depression of rats[J].Chin Pharmacol Bull,2015,31 (4) : 527-31.
[14] Moos W H,Maneta E,Pinkert C A,et al.Epigenetic treatment of neuropsychiatric disorders: autism and schizophrenia[J].Drug Dev Res,2016,77(2) : 53-72.
[15] Peedicayil J.Epigenetic approaches for bipolar disorder drug discovery [J].Expert Opin Drug Discov,2014,9(8) : 917-30.
[16] Hollis F,Duclot F,Gunjan A,et al.Individual differences in the effect of social defeat on anhedonia and histone acetylation in the rat hippocampus[J].Horm Behav,2011,59(3) : 331-7.
[17] Onishchenko N,Karpova N,Sabri F,et al.Long-lasting depression-like behavior and epigenetic changes of BDNF gene expression induced by perinatal exposure to methylmercury[J].J Neurochem,2008,106(3) : 1378-87.
[18] Ookubo M,Kanai H,Aoki H,et al.Antidepressants and mood stabilizer effects on histone deacetylase expression in c57bl/6 mice: Brain region specific changes[J].J Psychiatr Res,2013,47(9) : 1204-14.
Research on relationship between abnormal regulation of histone acetylation and depression in rats
LI Hai-yan, FU Xiao-yan, CUI Ting, JIANG Qing-song, QIU Hong-mei
(DeptofPharmacology,ChongqingKeyLaboratoryofBiochemistryandMolecularPharmacology,ChongqingMedicalUniversity,Chongqing400016,China)
Aim To study the role of histone acetylation and its involvement in the depression-like behaviors of rats induced by chronic unpredictable stress (CUS). Methods Thirty male Sprague Dawley (SD) rats were randomly divided into control group and model group. The method of solitary condition with CUS for consecutive 28 days was used to establish the rat depression model. The open-field test (OFT) and the forced swimming test (FST) were used to evaluate the depressive behaviors of rats; the real time PCR was used to detect the change of HDAC2 mRNA, and Western blot was used to determine the protein expressions of H3, H4, acH3 and acH4 in the prefrontal cortex and hippocampus of rats. Results Model group showed obvious depression-like behaviors with decreasing locomotive activity in OFT (P<0.01) and increasing immobility time in FST (P<0.01), up-regulating the mRNA and protein expression of HDAC2 (P<0.01), and down-regulating the protein expression of acH3 and acH4 (P<0.01) in the prefrontal cortex and hippocampus significantly, compared with control group. Conclusion The mechanism of depressive behaviors of rats induced by CUS may be associated with down-regulating the level of histone acetylation modification.
depression; histone acetylation; CUS; acH3; acH4; HDAC2
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.020.html
2016-08-11,
2016-11-27
国家自然科学基金资助项目(No 31400881);重庆市教委科学技术项目(No KJ1400208)
李海燕(1990-),女,硕士生,研究方向:神经精神药理学,E-mail:710120446@qq.com; 邱红梅(1978-),女,博士,副教授,研究方向:神经精神药理学,通讯作者,Tel:023-68485161;E-mail:qiuhongmei@cqmu.edu.cn
10.3969/j.issn.1001-1978.2017.01.010
A
1001-1978(2017)01-0052-07
R-332;R322.81;R341.27;R741.02;R749.42;R977.6

