Wnt信号通路在肿瘤调控方面的研究进展
张世蘋,张 旭
(南京中医药大学, 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
Wnt信号通路在肿瘤调控方面的研究进展
张世蘋,张 旭
(南京中医药大学, 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
Wnt信号通路是一条进化上十分保守的信号通路,控制着细胞的生长、分化、凋亡和自我更新。在肿瘤的发生发展中,该通路常常异常激活,并能够和其他信号通路协同或拮抗调节肿瘤的增殖、迁移和侵袭。该文主要对Wnt信号通路的研究进展及其在各类肿瘤生长调控中的作用进行简要综述。
Wnt信号通路;β-catenin; APC蛋白; 信号通路的调节; 机制; 肿瘤
1982年,研究者在小鼠乳腺瘤病毒整合部位发现一种命名为int1的原癌基因,与后来Sharma报道的果蝇无翅基因 wingless具有同源性[1],两者合称为 Wnt。Wnt信号通路在胚胎发育和某些正常的生理过程中发挥作用,同时也可对多种肿瘤发挥诱导和调节作用[2]。本文将对Wnt信号通路转导的研究进展,尤其是对肿瘤调控方面的研究作一简要介绍。
1 Wnt信号通路的组成和途径
Wnt信号网包括:19种Wnt配体(分泌性糖蛋白),跨膜受体和3个途径(Wnt /β-catenin、 Wnt /Ca2+、 Wnt/pcp)[3](见Fig 1)。Wnt蛋白可分为两类: Wnt1类和 Wnt 5a类。Wnt1类蛋白有:Wnt1、Wnt3、Wnt3a、Wnt7a、Wnt8a 和 Wnt8b;Wnt5a类包括Wnt2、Wnt4、Wnt5a、Wnt5b、Wnt6、Wnt7b和 Wnt11。Wnt蛋白跨膜受体有:卷曲蛋白 (frizzled, Frz)和低密度脂蛋白受体相关蛋白 (low density lipoprotein receptor-related protein, LRP5/6)。
Wnt/β-catenin途径是Wnt信号通路的经典途径。该通路的标志是β-catenin的积累,并向核内转移。Wnt蛋白与细胞表面的Frz、LRP5/6结合形成三聚体,将信号传递并活化胞质内蓬乱蛋白(dishevelled, Dsh或Dvl),减弱由β-catenin与轴蛋白(axin)、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、结直肠腺瘤性息肉基因(adenomatous polyposis, APC)组成的降解复合物稳定性,阻止β-catenin磷酸化降解,使β-catenin在细胞质内浓度升高,继而转入核内与T细胞转录因子/ 淋巴样增强因子(T-cell factor/lymphoid enhancing factor, TCF/LEF)相互作用,激活Wnt/β-catenin信号通路,最终活化下游靶基因的表达。Wnt/Ca2+通路由 Wnt5a 和 Wnt11激活结合于 Frz受体,通过三聚体G蛋白介导,对钙调蛋白依赖的激酶Ⅱ(calmodulin-dependent protein kinaseⅡ,CamkⅡ)、蛋白激酶 C (protein kinase C, PKC)起作用,诱导细胞内Ca2+浓度增加,活化T细胞核因子(nuclear factor of activated T cells, NFAT),核内 NFAT的积聚导致靶基因的最终激活,调节肿瘤细胞之间的黏附,该通路能拮抗经典的Wnt通路。细胞平面极性通路(Wnt/polarity通路) ,又称 Wnt/PCP 途径或 Wnt/Jun激酶途径,涉及 RhoA(ras homolog gene family, member A)和Jun激酶(jun-terminal kinase, JNK) ,Wnt蛋白质直接作用于 Frz受体,活化Dvl进而激活小三磷酸鸟苷酸酶 RhoA和 Rac及下游的相关激酶,此通路在胚胎发育阶段可调控细胞骨架的重排,参与原肠胚形成[4]。
2 Wnt信号通路的调节
2.1 Dvl蛋白 Dvl蛋白可直接与Axin相互作用实现对Axin功能的抑制,进而上调经典Wnt信号通路活性[5]。Frz与Dvl蛋白的PDZ结构域作用招募Dvl,形成Dvl/Frz/LRP6受体聚合物。Wnt蛋白促进Dvl依赖的LRP6磷酸化,调节下游基因的表达。另外,Dvl在细胞质和细胞核之间的穿梭可转导Wnt信号,导致β-catenin的聚集[6]。
2.2 Axin蛋白 Axin蛋白是一种构架蛋白,是正常体轴形成的抑制物,其高表达可抑制Wnt信号传导。Axin与APC、GSK-3β形成β-catenin的降解复合体;同时Axin也是 Dishevelled的竞争性抑制因子,负向调节 Wnt 信号通路。有研究发现[7],Axin通过下调 TCF-4的表达从而抑制肺癌细胞的增殖和侵袭能力。
2.3 APC蛋白 APC基因高甲基化导致APC 基因失活, APC 蛋白表达减少,促进肿瘤的发生。在针对非小细胞肺癌的研究中发现有71%的 NSCLC 患者可检出APC基因的甲基化[8]。结肠癌的研究中显示[9],恢复APC的功能可抑制结肠癌细胞的增殖转移,说明APC是肿瘤的抑制基因。
2.4 β-catenin蛋白 β-catenin蛋白是 Wnt 信号通路的核心成员。目前,造成β-catenin蛋白降解的原因有3个:一是Wnt信号的增强。Wnt蛋白与受体结合,通过GSK-3β等抑制APC的活性,从而减少对β-catenin蛋白的降解,使β-catenin在胞内累积;二是 APC的突变。APC突变后其对β-catenin蛋白的降解作用受到抑制。其三是β-catenin的逃逸性突变造成β-catenin的降解受阻。
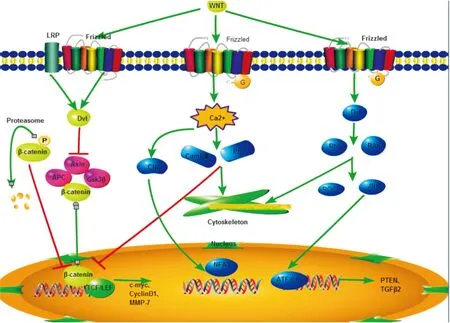
Fig 1 Wnt signaling pathway
2.5 Wnt抑制因子-1(wnt inhibitory factor-1,WIF-1) WIF-1的N端信号序列为其独特的WIF结构域,有5个表皮生长因子样重复序列,基因启动子区富CpG岛,G/C含量高达 63.5%。WIF-1与Wnt蛋白直接结合后可阻断Wnt信号的传递,Wnt信号也可通过反馈机制对WIF-1的表达和分布进行调节。研究发现,在Wnt通路激活的多种类型肿瘤中均出现WIF-1基因表达下调或缺失。
2.6 分泌型卷曲相关蛋白(secreted frizzled related proteins, SFRPs) SFRPs是分泌型蛋白,类似于frizzled的半胱氨酸区域和保守亲水性羧基末端区域,能结合Wnt,干涉Wnt信号通路传导。其或与受体竞争结合Wnt蛋白,或直接与Wnt蛋白结合,阻断Wnt信号通路的转导。因而SFRPs被认为是肿瘤的抑制基因[10]。
2.7 Dickkopf 蛋白(Dkk) Dkk蛋白是一种分泌蛋白,也是Wnt信号系统的抑制剂。在细胞外Dkk1与配体Wnt竞争结合受体 LRP5/6,抑制Wnt信号;另外Dkk可诱导形成Dkk1-LRP5/6-Kremen复合物,通过诱导复合物的内吞作用抑制Wnt经典通路活性。Dkk1也可以通过非经典Wnt/ JNK通路诱导细胞凋亡。
2.8 R-spondins 蛋白(Rspo) R-Spondin是新发现的分泌性蛋白家族,包括4个成员(Rspo1~4)。近年来该家族蛋白被证实是经典Wnt/β-catenin通路的激活剂[11]。Rspo蛋白中furin-like结构域是Rspo激活Wnt/β-catenin通路的关键部位。删除任何1个furin-like结构域都会导致Rspo蛋白对Wnt/β-catenin通路的激活作用减弱甚至丧失。有研究发现[12],Rspo依赖G蛋白偶联受体,又名富含亮氨酸重复序列的G蛋白偶联受体(leucine-rich repeat-containing G protein-coupled receptors,LGR)保持Frz受体的稳定,进而增强Wnt信号。
3 Wnt信号通路与其他信号通路之间相互关系
3.1 Wnt信号通路与Notch信号通路 Notch信号通路是一组高度保守的细胞间通信机制。Wnt和Notch信号通路在胚胎发育、组织再生和肿瘤形成等方面相互作用并协调发展。Notch可以联合β-catenin抑制Wnt信号通路,诱发在人舌癌细胞周期阻滞和凋亡[13];Wnt可活化Dvl对抗Notch信号通路。Wnt信号通路中的GSK-3β也可与Notch通路相互作用而影响Notch通路活性。但也有研究发现Wnt和Notch通路在某些细胞中可发挥协同作用,例如:APC变异的小鼠中Notch信号通路的活化可以激活Wnt信号通路促进腺癌的发展[14]。3.2 Wnt信号通路与TGF-β/BMP信号通路 转化生长因子β(transforming growth factor-β,TGF-β)超家族由TGF-β、活化素(activin)、骨形态发生蛋白(bone morphogenetic protein, BMP)等组成。TGF-β超家族与其受体(TGF-βRI和TGF-βII),胞内信号转导分子(主要是Smad 蛋白家族)组成了一个影响肿瘤发生和发展信号通路,即TGF/BMP信号通路。Wnt信号通路和TGF-β/BMP信号通路之间可以相互调节对方通路的活性。在结肠癌细胞中BMP4的表达依赖于β-catenin的表达。TGF-β/BMP通路的BMP2/4也可以调节Wnt通路的Wnt8表达。Smad7联合β-catenin作用或直接连结Axin,均可导致细胞中β-catenin累积[15-16]。
3.3 Wnt信号通路与Hippo通路 Hippo通路是一种可以调节细胞增殖和分化以及细胞死亡的一个高度保守的生长控制信号通路。YAP(yes-associated protein)和TAZ(transcription co-activator PDZ-binding motif)是其关键下游效应分子,也是该通路主要的调节因子。非磷酸化状态的YAP可以转移入核,与转录增强因子(transcriptional enhancer factor ,TEAD/TEF) 家族和其他转录因子相互作用来调节靶基因的转录表达,发挥促进细胞增殖、抑制细胞凋亡及肿瘤形成的作用。Hippo通路通过TAZ与Dvl的相互作用增强,限制Wnt/β-catenin信号通路活性。在细胞核内,两通路可发挥协同作用,YAP和β-catenin相互作用后诱导经典Wnt通路靶基因表达[17]。有Wnt信号时,YAP/TAZ可以从β-catenin降解复合物脱落,引起核内聚集和WNT/YAP/TAZ依赖的生物学效应活化;没有Wnt时,YAP/TAZ在降解复合物招募β-Trcp(β-transductin repeat containing protein)过程中发挥作用,导致β-catenin的非活化[18]
3.4 Wnt信号通路与Hedgehog信号通路 Hedgehog(Hh)信号通路在控制细胞增殖、调节不同类型细胞分化及保持成体干细胞的自稳态中起着重要作用,异常激活可导致许多癌症的发生。该通路的核心组成部分包括分泌型糖蛋白配体(Hh)、两种主要的膜蛋白受体, Patched(Ptc)和Smoothed(Smo)、核转录因子(GLi)及下游目的基因。Hh配体与受体Patched结合后,抑制转膜蛋白Smoothed,继而诱导信号转导,激活转录因子Gli,随后Gli进入细胞核并启动下游目标基因的表达。子宫内膜癌细胞核中增强Gli1的表达可以引起核内β-catenin的聚集[19]。反之,Wnt/β-catenin信号通路可诱导RNA结合蛋白,CBD-BP的表达,继而引起Gli1 mRNA的表达,增强Hedgehog通路信号[20]。
4 Wnt信号通路在各类肿瘤中的作用
4.1 结直肠癌 结直肠癌中广泛存在 Wnt经典信号通路的异常激活和β-catenin蛋白的核内积聚现象,通过抑制Wnt信号通路活性可以抑制结肠癌增殖[21-22]。85%以上的结直肠癌中均存在APC的突变,突变后的APC阻断β-catenin磷酸化降解,诱导结直肠癌的发生[9]。此外,Axin突变、β-catenin自身突变也可引起β-catenin的胞内聚集,活化Wnt/β-catenin通路。
4.2 肝癌 经典Wnt/β-catenin信号通路可通过激活下游靶基因c-myc、c-jun、CyclinD1、VEGF(vascular endothelial growth factor)等而诱导肝癌 。78%肝癌细胞中β-catenin高表达,53%在细胞膜上表达,22%在细胞质中表达,19%在细胞膜和细胞核中均表达。细胞膜和细胞质中β-catenin的高表达多见于高、中分化肝癌组织中;细胞核中β-catenin高表达多见于中、低分化肝癌组织[23]。肝癌组织中β-catenin的高表达与其突变有关,其突变在肝癌中是频发事件,可高达44.1%。4.3 肺癌 Wnt通路在肺癌发生发展中也起着重要作用。Dsh蛋白作为Wnt途径上游分子,同时是Wnt信号通路的正调节因子。Dsh家族蛋白在NSCLC中普遍存在,在肺腺癌中表达水平高于鳞癌,且与 NSCLC的发生发展密切相关。71%的非小细胞肺癌和38%的小细胞肺癌均发现抑癌基因APC的DNA甲基化。Wnt通路的核心蛋白β-catenin的表达与肺癌组织的分化及淋巴结转移有关。但也有研究发现[24],支气管上皮细胞中Wnt信号激活并不能导致肺癌发生,但合并 KRAS突变基因的表达就能促进肺肿瘤侵袭力更强。4.4 乳腺癌 乳腺癌中,Wnt通路的异常激活常常是由β-catenin 和 APC- Axin-Gsk-3β多蛋白复合体引起的。β-catenin降解障碍致使胞质内游离的β-catenin 聚集并入核与 TCF/LEF 结合,激活下游靶基因CyclinD1。CyclinD1是原癌基因,调节细胞进入细胞增生期,其过度表达和失调控均可导致细胞周期调控异常促进肿瘤发生[25]。
4.5 膀胱癌 Malgor等[26]发现 Wnt5a与膀胱癌的病理分级、TNM 分期及预后呈正相关性,Wnt5a可在膀胱癌和浸润性膀胱癌中高表达,正常组织低表达,提示其与膀胱癌的发生发展呈正相关。跨膜受体卷曲蛋白 Frz1 可通过 Wnt/β-catenin 信号通路影响膀胱癌的发生。APC 启动子甲基化程度与膀胱癌的复发及进展程度呈正相关,是膀胱癌形成的早期事件。Axin的遗传变异可激活 Wnt 信号通路,从而促进膀胱癌的发生。膀胱癌细胞核内的 β-catenin 表达明显增加; 敲除 β-catenin 后,膀胱癌细胞的侵袭和迁移能力下降。此外经典 Wnt/β-catenin信号通路各组成成分均可能与膀胱癌的浸润和转移密切相关,主要机制为通过促进癌细胞的迁移黏附和肿瘤血管生成,以及诱导细胞增殖等方式参与膀胱癌的浸润及转移[27]。
4.6 鼻咽癌 研究发现 Wnt/β-catenin 信号通路可以导致鼻咽癌的发生和发展,β-catenin一方面参与正常的干细胞增殖与分化,另一方面对肿瘤干细胞获得自我更新的能力方面具有关键性作用[28]。Wnt/β -catenin 信号通路可调节自我更新网络,并对于多能性基因、肿瘤抑制通路以及肿瘤干细胞标志物的表达具有核心作用。研究发现表皮生长因子受体(epidermal growth factor receptor, EGF-R) 在鼻咽癌肿瘤干细胞中具有重要调节作用,此作用需要通过AKT信号介导[28],而AKT 的作用则需要β-catenin介导。有50%~80% 鼻咽癌表达EGF-R,且均预后较差。近些年逐渐有更多的研究证实 EGF-R与 Wnt/β-catenin 信号通路之间有重要的多重介导作用[29]。
4.7 恶性黑色素瘤 Wnt2在人的恶黑细胞株及肿瘤中呈现过表达。Wnt5a在50%的恶性黑素瘤细胞株中起着正调节作用,增加细胞活力和侵袭力。表达Wnt5a载体转染的黑素瘤细胞侵袭性增加,而阻断这条通路,其侵袭性受到明显抑制[30]。β-catenin与恶性黑素瘤的关系可能更为密切,β-catenin膜表达的丢失与皮肤黑素瘤的肿瘤进展相联系。原位和转移性黑素瘤以及黑素瘤的不同生长阶段,均出现膜β-catenin 着色有缺失。
Tab 1 Regulation of Wnt signaling pathwaycomponents in tumor growth
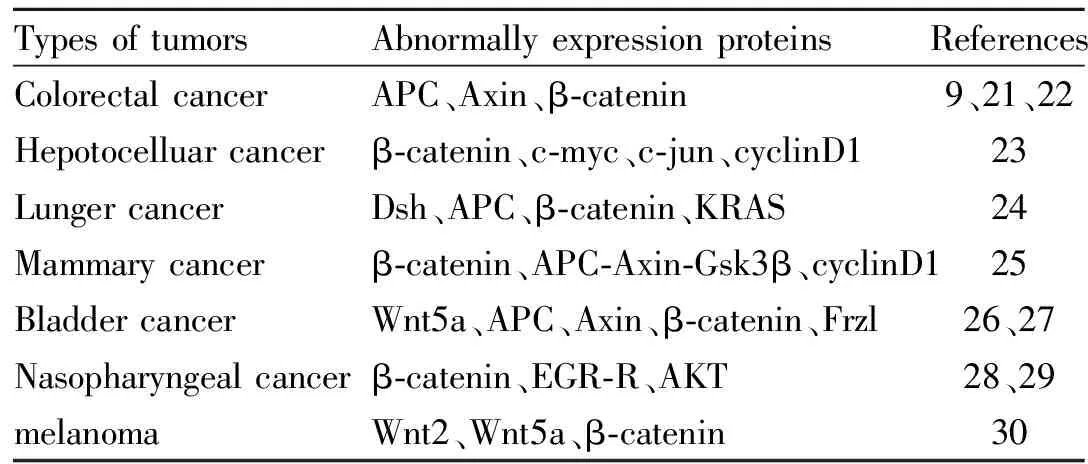
TypesoftumorsAbnormallyexpressionproteinsReferencesColorectalcancerAPC、Axin、β⁃catenin9、21、22Hepotocelluarcancerβ⁃catenin、c⁃myc、c⁃jun、cyclinD123LungercancerDsh、APC、β⁃catenin、KRAS24Mammarycancerβ⁃catenin、APC⁃Axin⁃Gsk3β、cyclinD125BladdercancerWnt5a、APC、Axin、β⁃catenin、Frzl26、27Nasopharyngealcancerβ⁃catenin、EGR⁃R、AKT28、29melanomaWnt2、Wnt5a、β⁃catenin30
5 结语
由此可见,Wnt信号传导通路在细胞正常发育过程和肿瘤发生发展具有重要作用,尤其对于肿瘤的诊断和靶向治疗具有明显意义。但由于Wnt通路是一个错综复杂的网络系统,又与各类信号通路互相关联互相作用,故仍有许多问题尚不清楚,有待进一步研究。如何利用该通路机制研制有效的抗癌药物,是未来的研究方向。
[1] Nusse R, Brown A, Papkoff J, et al. A new nomenclature for int-1 and related genes: the Wnt gene family[J].Cell, 1991, 64(2): 231.
[2] Berndt J D,Moon R T. Cell biology. Making a point with Wnt signals[J].Science, 2013, 339(6126):1388-9.
[3] Nusse R. Wnt signaling in disease and in development[J].CellRes, 2005,15(1):28-32.
[4] Tao Q,Yokota C,Puck H, et al.Matemal Wnt 1 activates the canonical Wnt signaling pathway required for axis formation in Xenopus embryos[J].Cell, 2005, 120(6):857-71.
[5] Kikuchi A, Yamamoto H, Sato A, et al. New insights into the mechanism of Wnt signaling pathway activation[J].IntRevCellMolBiol,2011,291:21-71.
[6] Gan X Q, Wang J Y, Xi Y , et al. Nuclear Dvl, c-Jun, beta-catenin, and TCF form a complex leading to stabilization of beta-catenin-TCF interaction[J].JCellBiol,2008,180:1087-100.
[7] Xu H T,Wei Q,Liu Y, et al.Overexpression of axin downregulates TCF-4 and inhibits the development of lung cancer[J].AnnSurgOncol, 2007,14(11):3251-9.
[8] Grote H J,Schmiemann V,Kiel S,et al.Aberrant methylation of the adenomatous polyposis coli promoter IA in bronchial aspirates from patients with suspected lung cancer[J].IntJCancer,2004,110(5):751-5.
[9] Kim J C, Koo K H, Roh S A, et al. Genetic and epigenetic changes in the APC gene in sporadic colorectal carcinoma with synchronous adenoma[J].IntJColorectalDis, 2003, 18(3):203-9.
[10] Niu C C,Zhao C,Yang Z D,et al. Down -regulation of γ-catenin inhibits CML cell growth and potentiates the response of CM L cells to imatinib through β-catenin inhibition[J].IntJMolMed,2013,31(2):453-8.
[11] Kim K A, Zhao J, Andarmani S, et al. R-Spondin proteins: a novel link to beta-catenin activation[J].CellCycle,2006,5:23-6.
[12] Hao H X, Xie Y, Zhang Y, et al. ZNRF3 promotes Wnt receptor turnover in an R-spondin-sensitive manner[J].Nature,2012,485:195-200.
[13] Duan L,Yao J,Wu X,et al. Growth suppression induced by Notch1 activation involves Wnt-beta-catenin down-regulation in human tongue carcinoma cells[J].BiolCell,2006, 98(8):479-90.[14] Fre S, Pallavi S K, Huyghe M, et al. Notch and Wnt signals cooperatively control cell proliferation and tumorigenesis in the intestine[J].ProcNatlAcadSciUSA, 2009, 106(15):6309-14.
[15] Edlund S, Lee S Y, Grimsby S, et al. Interaction between Smad7 and beta-catenin: importance for transforming growth factor beta induced apoptosis[J].MolCellBiol, 2005,25:1475-88.
[16] Tang Y, Liu Z, Zhao L, et al. Smad7 stabilizes beta-catenin binding to E-cadherin complex and promotes cell-cell adhesion[J].JBiolChem, 2008,283:23956-63.
[17] Heallen T, Zhang M, Wang J, et al. Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size[J].Science, 2011, 332(6028):458-61.
[18] Azzolin L, Panciera T, Soligo S, et al. YAP/TAZ incorporation in the beta-catenin destruction complex orchestrates the Wnt response[J].Cell, 2014, 158(1):157-70.
[19] Liao X, Siu M K, Au C W, et al. Aberrant activation of hedgehog signaling pathway contributes to endometrial carcinogenesis through beta-catenin[J].ModPathol, 2009,22:839-47.
[20] Noubissi F K, Goswami S, Sanek N A, et al. Wnt signaling stimulates transcriptional outcome of the Hedgehog pathway by stabilizing GLI1 mRNA[J].CancerRes, 2009,69:8572-8.
[21] 郭颖,田芝瑜,符航,等. 青篙琥酯诱导人结肠癌细胞凋亡与Wnt/β-catenin信号通路的关系研究[J].中国药理学通报,2016,32(5):707-11.
[21] Guo Y, Tian Z Y, Fu H, et al. Study on the relationship between promoting apoptosis effect of artesunate and Wnt/β-catenin pathway in colon cancer cells[J].ChinPharmacolBull, 2016,32(5):707-11.
[22] 袁霜雪,王东旭,伍秋香,等. 白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J]. 中国药理学通报,2015,31(4):537-41.
[22] Yuan S X, Wang D X, Wu Q X, et al. Study on the relationship between anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J].ChinPharmacolBull,2015,31(4):537-41.
[23] Tien L T,Ito M,Nakao M,et al.Expression of beta-catenin in hepatocellular carcinoma[J].WorldJGastmenteml, 2005, 11(16):2398-401.
[24] Pacheco-Pinedo E C,Durham A C, Stewart K M,et al. Wnt /β-catenin signaling accelerates mouse lung tumorigenesis by imposing an embryonic distal progenitor phenotype on lung epithelium[J].JClinInvest,2011,121(5):1935-45.
[25] Farago M,Dominguez I,Landesman-Bollag E,et al. Kinase inactive glycogen synthase kinase 3beta promotes Wnt signaling and mammary tumorigenesis[J].CancerRes,2005,65(13):5792-801.
[26] Malgor R,Crouser S,Greco D,et al.Correlation of Wnt5a expression with histopathological grade/stage in urothelial carcinoma of the bladder[J].DiagnPathol,2013,8:139.
[27] Du Y,Wang Y,Zhang F,et al. Regulation of metastasis of bladder cancer cells through the Wnt signaling pathway[J].TumourBiol,2015,36(11):8839-44.
[28] Ma L,Zhang G,Miao X B,et al. Cancer stem -like cell properties are regulated by EGFR/AKT/beta-catenin signaling and preferentially inhibited by gefitinib in nasopharyngeal carcinoma[J].FEBSJ,2013,280(9): 2027-41.
[29] Zhang P,Wu S K,Wang Y,et al.p53,MDM2,eIF4E and EGFR expression in nasopharyngeal carcinoma and their correlation with clinicopathological characteristics and prognosis: a retrospective study[J].OncolLett,2015,9(1): 113-8.
[30] Weeraratna A T,Jiang Y,Hostetter G,et al.Wnt5a signaling directly affects cell motility and invasion of metastatic melanoma[J].CancerCell, 2002,1(3):279-88.
Research progress on role of Wnt signaling pathway in regulation of tumors
ZHANG Shi-ping, ZHANG Xu
(JiangsuCollaborativeInnovationCenterofTraditionalChineseMedicine(TCM)PreventionandTreatmentofTumor,NanjingUniversityofChineseMedicine,Nanjing210023)
Wnt signaling pathway is a highly conservative signal pathway controlling cell growth, differentiation, apoptosis and self-renewal. This signal pathway is often abnormally activated in tumor development and progression, which can cooperate or antagonize with other signal pathways to regulate tumor proliferation, migration and invasion. This paper makes a review of the recent research of Wnt signaling pathway progression and its function in tumor growth regulation.
Wnt signaling pathway; β-catenin; Adenomatous polyposis coli protein; regulation of signaling pathway; mechanism; tumor
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.006.html
2016-08-08,
2016-11-12
江苏省2015年度普通高校研究生科研创新计划项目(No KYZZ15-0274); The People Programme (Marie Curie Actions) of the European Union’s Seventh Framework Programme FP7/2007-2013/ under REA grant agreement n° PIR SES-GA -2013-612589);江苏省优势学科和江苏省自然科学基金项目(No BK20131415);国家自然科学基金资助项目(No 81503374)
张世蘋(1982-),女,博士生,研究方向:中药复方抗肿瘤,Tel:025-85811813, E-mail:apple17_guoguo@126.com; 张 旭(1968-),女,博士,教授,研究方向:中药复方抗肿瘤,通讯作者,E-mail:zhangxu@njutcm.edu.cn
10.3969/j.issn.1001-1978.2017.01.003
A
1001-1978(2017)01-0014-05
R-05;R329.2;R341;R73;R977.6

