右美托咪定预处理对食道癌根治术中血流动力学及术后镇痛的临床研究
周民涛,邢群智
目前,食管癌最主要且有效的治疗方法是食管癌根治术,然而,术后易伴随剧烈且持久的疼痛[1],术后易发生肺不张和肺部感染等严重并发症[2~4]。因此,开胸术后充分有效的镇痛是非常重要的[5]。右美托咪定(dexmedetomidine,Dex)是一种新型高选择性的α2-肾上腺受体激动药,主要作用于中枢和外周神经系统,产生镇静和抗焦虑以及抑制交感神经兴奋的作用[6]。同时它还起到镇痛的作用,可减少阿片类药物的用量以及不良反应。本研究通过麻醉诱导前静脉注射Dex 1μg·kg-1,来探讨Dex对血流动力学的影响及术后镇痛效果,为临床提供一定的理论依据,现报道如下。
1 资料与方法
1.1一般资料选取南阳市第一人民医院2016年4月至2017年4月择期行食管癌根治术全麻男性病人60例。采用数字表随机分为观察组(右美托咪定组)和对照组,每组30例。纳入标准:年龄(63.42±7.36)岁,体质量61.76~72.29 kg,美国麻醉医生协会(American society of anesthesiologists,ASA)Ⅱ~Ⅲ级;癌症无转移;手术时间3~4 h。排除标准:有精神疾病、严重的慢性肺、心脏和肝性等疾病患者;凝血功能障碍者;有慢性疼痛、吸毒史者。两组病人的年龄、体质量、手术时间以及手术剔除人数比较,差异无统计学意义(P>0.05),具有可比性,见表1。
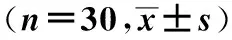
表1 两组一般情况比较
1.2麻醉方法患者入手术室后除一般监测外,需监测中心静脉压和有创动脉压。两组均采用静脉全身麻醉。观察组患者诱导前静脉注射右美托咪定1 μg·kg-1,10 min注射完毕。麻醉诱导:咪唑安定(江苏恩华药业股份有限公司,批号:1603021)0.05 mg·kg-1静脉注射,瑞芬太尼(宜昌人福药业有限公司,批号:6160405)和丙泊酚(西安力邦制药有限公司,批号:21608081)靶控输注(target controlled infusion,TCI)(CP600TCI,Slgo科技有限公司,中国)预期血浆浓度分别是4.5 ng·mL-1和2.5 μg·mL-1,病人熟睡后罗库溴铵(浙江仙琚制药股份有限公司,批号160504)1 mg·kg-1静脉注射,TOF值为0时,行双腔支气管插管。麻醉维持:术中行脑电双频谱指数(bispectral index,BIS)监测,调整丙泊酚和瑞芬太尼的TCI血浆浓度,维持BIS值在45~55之间;顺阿曲库铵2 μg·kg-1·min-1恒速泵注。两组术后均采用舒芬太尼静脉自控镇痛(patient-controlled intravenous analgesia, PCIA):药物配方:枸橼酸舒芬太尼注射液(宜昌人福药业,批号:1161004)2 μg·kg-1加生理盐水稀释至100 mL注入镇痛泵。镇痛泵参数设置为:负荷剂量0.1 mL·kg-1,维持量2 mL·h-1,自控剂量0.5 mL,锁定时间15 min。手术结束前约30 min静注负荷剂量0.1 mL·kg-1后接镇痛泵,治疗2 d。恶心呕吐者昂丹司琼8 mg静脉点滴。若出现严重不良反应,呼吸频率小于11次·min-1以及不能唤醒者停用PCIA,并将该患者排除。
1.3观察指标记录两组入室后(TA0)、麻醉诱导后3 min(TA1)、插管时(TA2)、切皮时(TA3)、拔管时(TA4)、出手术室(TA5)的有创平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR),并记录术中麻醉药物的用量;记录两组入室后(TB0)、手术后2 h(TB1)、术后12 h(TB2)、术后24 h(TB3)和术后48 h(TB4)的视觉模拟评分(visual analogue scales,VAS)评分、疗效等级评定、安全等级评定和不良反应。
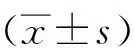
2 结果
与对照组比较,观察组TA2~TA4时点MAP和HR明显降低(P<0.05),差异有统计学意义。与同组TA0时点比较,两组TA1点MAP和HR明显降低(P<0.05),但对照组更明显;对照组TA2~TA4点MAP和HR明显增高(P<0.05),差异有统计学意义,见表2。
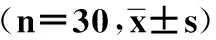
表2 两组术中血流动力学指标变化
注:①同组TA0时间点相比,P<0.05;②与对照组同时间点相比,P<0.05。MAP:有创平均动脉压;HR:心率。
与对照组比较,观察组术中丙泊酚和瑞芬太尼用量明显降低(P<0.05),差异有统计学意义,见表3。与对照组比较,观察组TB1~TB3时VAS评分明显降低(P<0.05),见表4;观察组镇痛疗效在TB1、TB2、TB3优于对照组(P<0.05),见表5;安全性等级比较观察组高于对照组(P<0.05),差异有统计学意义,见表6。

表3 两组术中用药量比较 mg
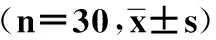
表4 两组VAS评分比较
注:①与对照组比较,P<0.05。
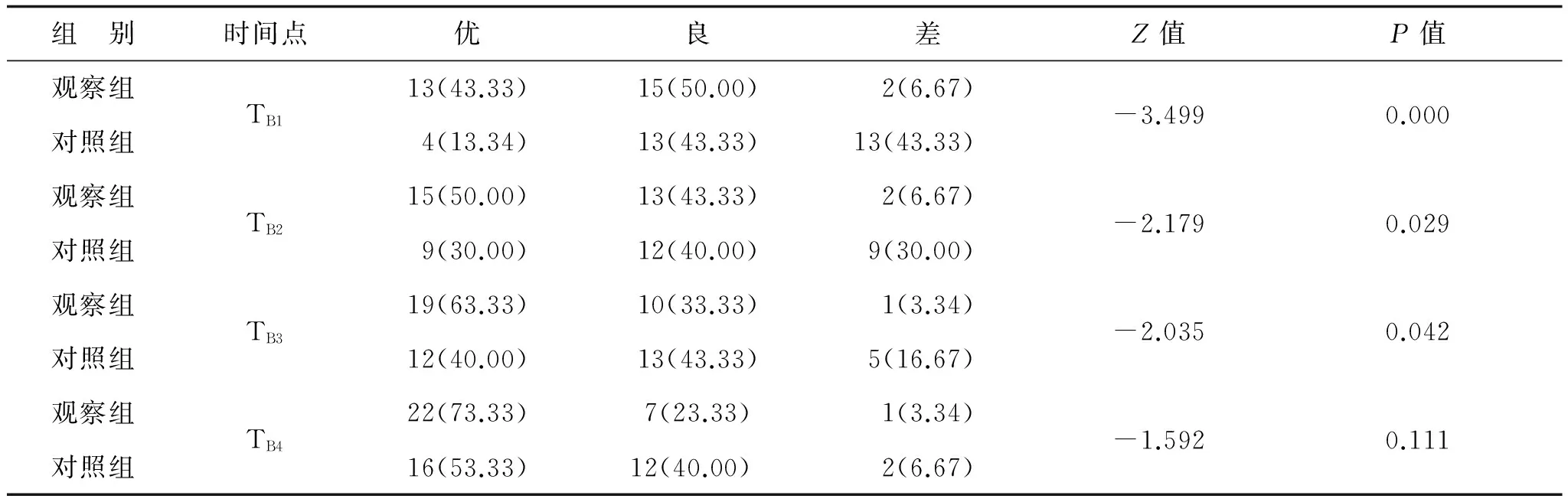
表5 两组治疗后镇痛疗效比较(n=30) 例(%)
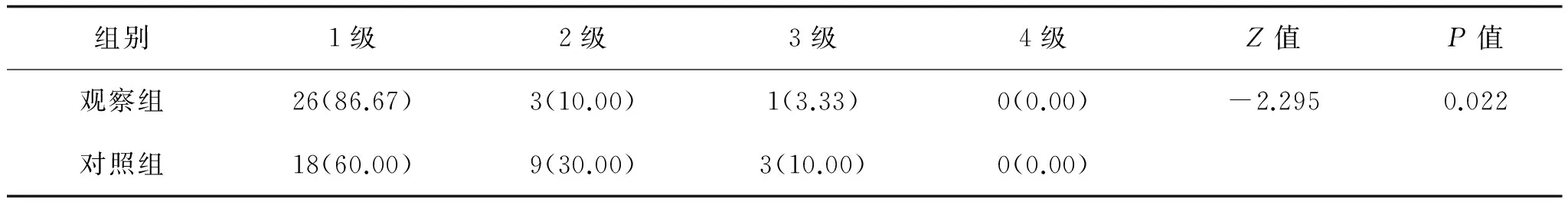
表6 两组安全性等级比较 例(%)
3 讨论
Dex是一种具有高度选择性的α2-肾上腺素受体激动剂,具有镇静和镇痛以及抗焦虑的作用,几乎不抑制呼吸[7]。Dex能明显降低麻醉药物和镇痛药物的用量,在临床上的应用也越来越受到重视。
Dex能激活分布在突触前膜神经节的肾上腺素受体,发挥其对抗交感神经的兴奋作用,通过负反馈调节,降低节后交感神经的兴奋性,抑制节前神经细胞的释放。并能激活分部在突触后膜上的β2-肾上腺素受体,导致交感神经节后纤维细胞膜产生超极化[8],抑制其释放去甲肾上腺素,使交感神经活性降低[9],引起心率和心血压的降低。本研究表明,观察组比对照组血流动力学平稳。与对照组比较,观察组气管插管时、切皮时、拔管时MAP和HR均明显低于对照组;观察组表现血压降低的原因可能是Dex能兴奋脑干延髓头端腹外侧核[10]。与给药前比较,诱导后3 min对照组和观察组MAP和HR均显著下降,但对照组更明显。可能的原因是静脉注射1 μg·kg-1的Dex可导致暂时性的血压升高和心率轻微减慢,尤其在体壮的成年人更易出现。导致血压升高的主要是Dex激动血管平滑肌上的α2β受体[11-12],导致血管收缩、血压升高反射引起心率下降的结果[13]。本研究血压升高的现象没有呈现,可能是与麻醉诱导扩张血管作用相互叠加的结果。TA2~TA4各时点观察组的心率均低于对照组,其原因可能为Dex使交感神经的兴奋性降低,迷走神经的兴奋性相对增强,并且Dex具有咪唑啉结构,也能激活咪唑啉受体[14],引起心率减慢和血压下降。本研究中各时间点患者未出现显著的心动过缓,这与徐美英等[15]的研究相符。
舒芬太尼具有镇痛强度大、易透过细胞膜和血脑屏障和心血管功能稳定等优点,是目前外科手术不可缺少的麻醉和镇痛药物[16],张瑞芹等[17]发现术后采用舒芬太尼PCIA,不良反应与舒芬太尼的用量存在着明显的量效关系,当舒芬太尼用量超过2.0 μg·kg-1时,不良反应的发生显著增加。本研究发现观察组在术后2、12和24 h VAS评分显著低于对照组,且镇痛效果优于对照组,观察组安全等级高于对照组。其原因可能是Dex作用于突触前膜α2受体,疼痛信号的传导受到阻止,抑制其释放去甲肾上腺素[18],并能使交感神经的活性受到抑制。Dex作用于脊髓内α2受体,产生镇痛和降低焦虑作用。有研究发现右美托咪定能减少丙泊酚以及镇痛药物的用量[19],本研究与这结果相符,观察组术中丙泊酚和瑞芬太尼用量明显减少。Dex能对抗交感神经起兴奋作用,保护心肌细胞,降低机体组织的缺血再灌注损伤,提高术后苏醒的质量,还能减少术后患者烦躁、恶心、呕吐以及寒战的发生率。
综上所述,右美托咪定预处理可较好维持胸科手术患者术中血流动力学的稳定,并能减少术中麻醉药物的用量。美托咪定在胸科手术中具有较好的辅助镇痛作用,术前使用右美托咪定,可获得较好的术后镇痛效果。
[1] 钱慧华,袁光华,宗林.肋间神经阻滞联合静脉自控镇痛对食管癌术后疼痛及早期呼吸功能影响[J].临床军医杂志,2017,45(7):739-741.
[2] Hwang EG,Lee Y.Effectiveness of intercostal nerve block for management of pain in rib fracture patients[J].J Exerc Rehabil,2014,10(4):241-244.
[3] Sthan AS,Esther M,Pogatzki Z.Chronic pain after surgery or injury[J].Pain,2011,19(1):1-5.
[4] Wilkinson JN,Pennefather SH,Mc Cahon RA.Thoracic anaesthesia[M].Oxford:Oxford University Press,2011:576-578.
[5] 王春晓.现代术后镇痛学[M].广州:广东科学技术出版社,2008:226.
[6] Nazari an A,Christianson CA,Hua XY,et al.Dexmedetomidine and ST-91 analgesia in the formalin model is mediated by alpha2A-adrenoceptors:a mechanism of action distinct from morphine[J].Br J Pharmacol,2008,155(7):1117-1126.
[7] 周汾,李肇端,余剑波.右美托咪啶临床应用研究进展[J].中国中西医结合外科杂志,2013,19(2):215-217.
[8] Hall JE,Uhrich TD,Barney JA,et a1.Sedative,amnestic,and analgesic properties of small-dose dexmedetomidine infusions[J].Anesth Analg,2000,90(3):699-705.
[9] 吕艳,韩春莹,麻海春,等.右美托咪啶在老年冠心病患者行非心脏手术期间心肌保护的研究[J].中国实验诊断学,2013,17(2):368-369.
[10]Madden CJ,Stocker SD,Sved AF.Attenuation of homeostatic responses to hypotension and glucoprivation after destruction of catecholaminergic rostral ventrolateral medulla neurons[J].Am J Physiol Regul Integr Comp Physiol,2006,291(3):751-759.
[11]Ebert TJ,Hall JE,Barney JA,et al.The effects of increasing plasma concentrations of dexmedetomidine in humans[J].Anesthesiology,2000,93(2):382-394.
[12]佘守章,许学兵,李慧玲,等.右旋美托咪啶的镇静效应及其对国人颈内动脉血流量的影响[J].广东医学,2005,26(6):729-732.
[14]Stone LS,Fairbanks CA,Wilcox GL.Moxonidine,a mixed alpha (2)-adrenergic and imidazoline receptor agonist, identifies a novel adrenergic target for spinal analgesia[J].Ann N Y Acad Sci,2003,1009(1):378-385.
[15]徐美英,吴德华,张晓峰.右美托咪定在胸外科手术患者中的应用[J].临床麻醉学杂志,2011,27(11):1059-1061.
[16]庄心良,曾因明, 陈伯銮.现代麻醉学[M].3版.北京:人民卫生出版社,2003:524.
[17]张瑞芹,方先海,崔晓光.舒芬太尼术后静脉自控镇痛的量效关系[J].哈尔滨医科大学学报,2006,40(5):409-411.
[18]付兰君,周细明,余克方.右美托咪定复合盐酸麻黄碱用于无痛肠镜疗效观察[J].吉林医学,2012,10(2):2106-2107.
[19]高建瓴,詹英,杨建平,等.右美托咪啶辅助全身麻醉患者的镇静及全身麻醉药物的节俭作用[J].上海医学,2010,33(6):525-527.

