SPINK1在结直肠癌中的表达及其与预后的关系
钱婀娜,徐正顺,于 泳,肖燕景
结直肠癌发病率在男性癌症患者中居第3位,女性癌症患者中居第2位[1]。这种疾病具有侵袭性,即使在目前的治疗方式下仍有大量患者死亡。丝氨酸蛋白酶抑制剂Kazal 1型(serine protease inhibitor Kazal Ⅰ,SPINK1)是一种胰蛋白酶激酶抑制剂[2],目前已知它与炎症、细胞增殖和癌症的发生有关,基因突变会导致慢性或遗传性胰腺炎。而且,SPINK1表达水平改变与许多癌症的预后有关[3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种酪氨酸蛋白激酶受体,与其相应配体结合,激活后参与调节细胞内的信号传导,EGFR的过度表达与肿瘤的进展和预后有关[4]。因此,酪氨酸激酶抑制剂被用来抑制肿瘤生长,提高肿瘤细胞对化疗敏感性[5]。本研究利用免疫组织化学技术检测SPINKl和EGFR蛋白在结直肠癌中的表达及探讨与预后的关系,现报道如下。
1 资料与方法
1.1一般资料收集郑州市第十人民医院和郑州市中心医院病理科2012年至2013年手术切除并经病理证实为结直肠癌和结直肠腺瘤的石蜡组织标本98例。其中,结直肠癌55例;所有患者术前均未接受化疗、放疗或免疫治疗,手术后进行常规化疗,随访时间2~36个月,疾病进展定义为因结直肠癌死亡或在随访过程中出现新发的转移;本组中有12例出现了新发的转移及疾病相关性死亡。本组中结直肠腺瘤43例,选取40例病理证实癌旁正常组织作为正常对照。结直肠癌中男性35例,女性20例;年龄28~81岁,中位数年龄69.6岁;根据美国癌症联合会(American Joint Committee on Cancer,AJCC)[6]公布的肿瘤分期标准,将结直肠癌分为Ⅰ+Ⅱ期24例,Ⅲ+Ⅳ期31例;临床病理资料,见表1。所有标本均经40 g·L-1福尔马林固定,石蜡包埋,4 μm厚连续切片,HE染色观察细胞形态和组织学结构。鼠抗人SPINK1单克隆抗体(1∶800,Abnova公司,台湾),兔抗人EGFR多克隆抗体(即用型)及DAB显色试剂盒(北京中杉金桥生物公司)。
1.2方法免疫组织化学染色,采用柠檬酸钠缓冲液高压修复,按试剂盒说明书操作,一抗4 ℃孵育过夜,以PBS代替一抗作为阴性对照,并分别设立阳性对照,新鲜DAB显色。由两位病理学家独立阅片,如有异议,病理学家一起分析最后得出一致结论。SPINKl免疫组化阳性信号定位于细胞质,EGFR阳性信号为细胞膜和/或胞质着色。结果判定[7-8]:①无着色为0分,淡黄色记1分,棕黄色记2分,棕褐色记3分;②阳性范围记分:每张切片在光镜下随机观察10个高倍视野,各计数100个细胞,计算出阳性细胞百分比,阳性细胞率为0记0分,<10%记1分,10%~50%记2分,>50%记3分。上述2项结果相乘:0~1分为阴性(-),2~9分为阳性(+)。
1.3统计学处理采用SPSS 18.0软件进行统计分析。计数资料之间的比较采用χ2检验,两指标间相关性采用Spearman等级相关分析,生存分析采用Kaplan-Meier法,进行双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1SPINK1和EGFR蛋白在结直肠癌的表达及其与临床病理特征的关系结直肠癌SPINK1蛋白与性别、肿瘤大小、淋巴结有无转移、有无远处转移和肿瘤分期有关(P<0.05),而与年龄无关(P>0.05),EGFR蛋白与有无远处转移和肿瘤分期有关,而与年龄、性别、肿瘤大小和淋巴结有无转移均无关(P>0.05),见表1。
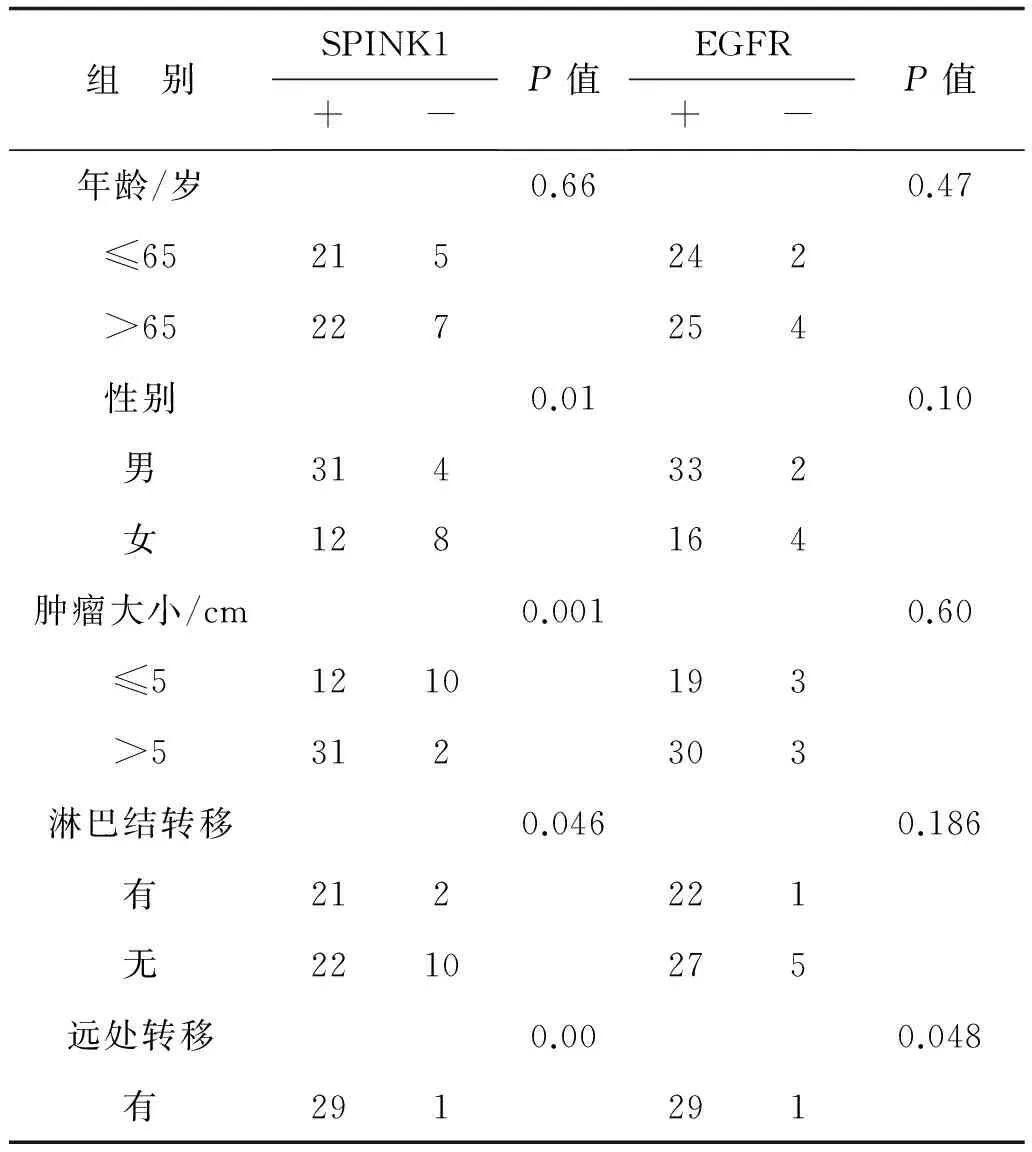
表1 SPINK1和EGFR蛋白在结直肠癌的表达及其与临床病理特征的关系 例
续表
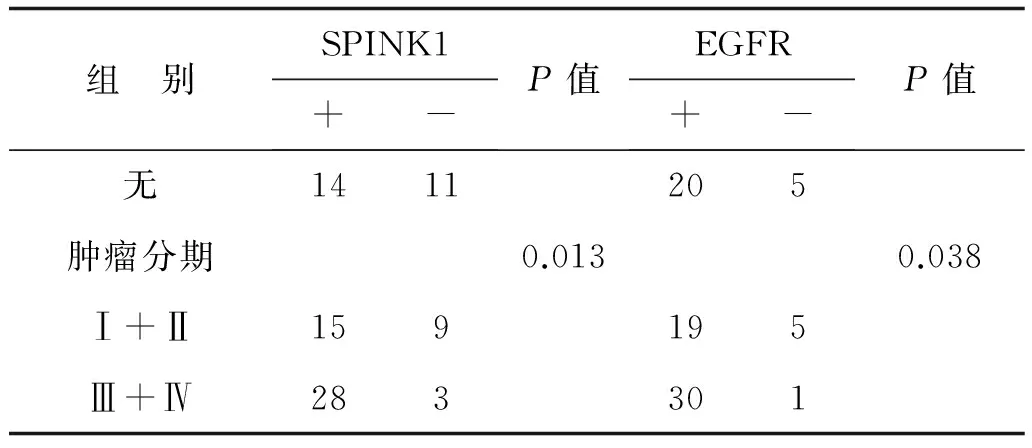
组 别SPINK1+-P值EGFR+-P值无1411205肿瘤分期0.0130.038Ⅰ+Ⅱ159195Ⅲ+Ⅳ283301
注:SPINK1:丝氨酸蛋白酶抑制剂Kazal 1型;EGFR:表皮生长因子受体。
2.2SPINK1和EGFR结直肠癌中SPINK1表达阳性信号定位于细胞质,见图1。EGFR阳性信号为细胞膜和/或胞质,见图2。SPINK1阳性率为78.18%(43/55),高于结直肠腺瘤20.93%(9/43,P<0.05)及其周围正常黏膜组2.50%(1/40,P<0.05)。结直肠腺瘤及其周围正常黏膜组SPINK1的表达差异无统计学意义(P>0.05)。结直肠癌中EGFR阳性率为89.09%(49/55),高于结直肠腺瘤18.60%(8/43,P<0.05)及其周围正常黏膜组7.50%(3/40,P<0.05)。结直肠腺瘤和及其周围正常正常黏膜EGFR的表达差异无统计学意义(P>0.05),见表2。Spearman等级相关分析显示SPINK1和EGFR在结直肠癌中表达呈正相关(rs=0.496,P<0.05)。
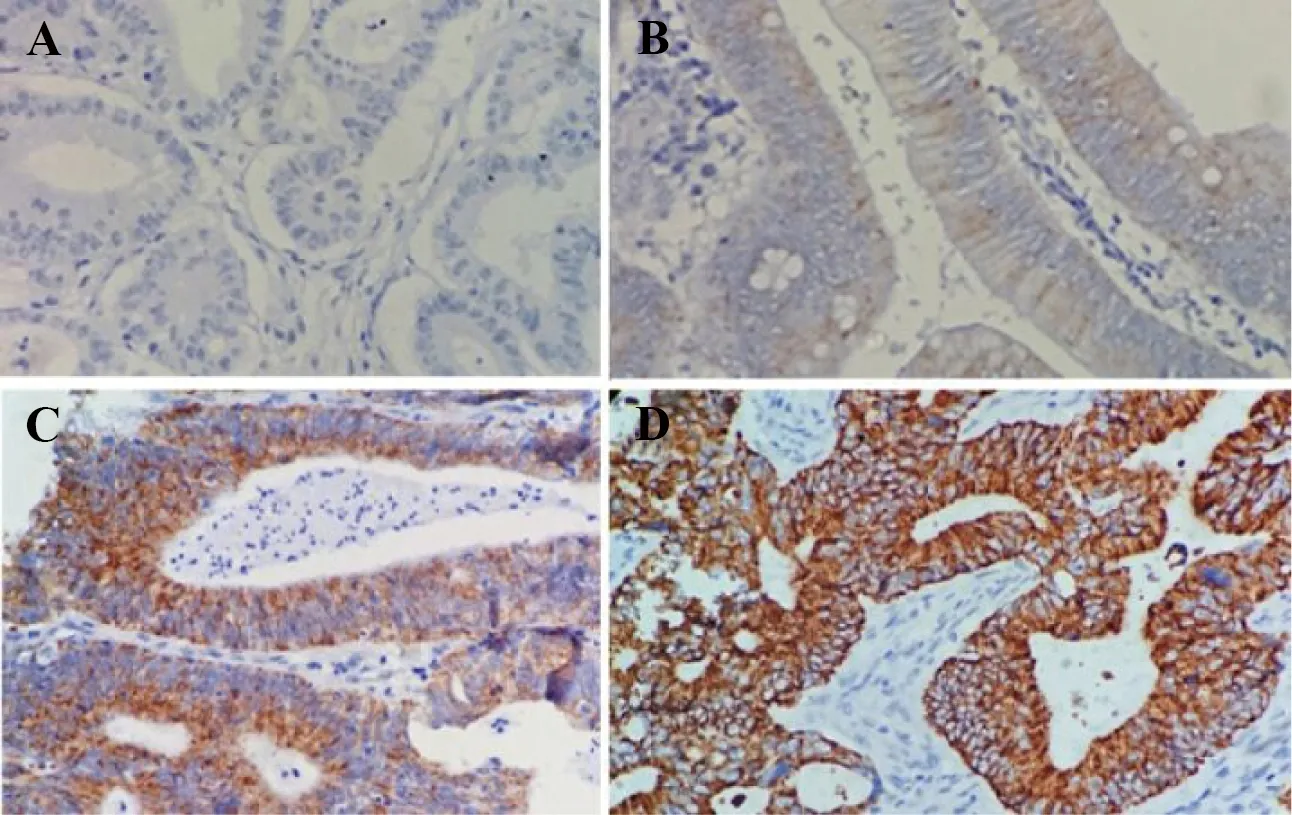
A:无染色;B:弱表达;C:中等强度表达;D:高强度表达。图1 SPINK1在结直肠癌细胞胞质中的染色强度(免疫组化,×400)
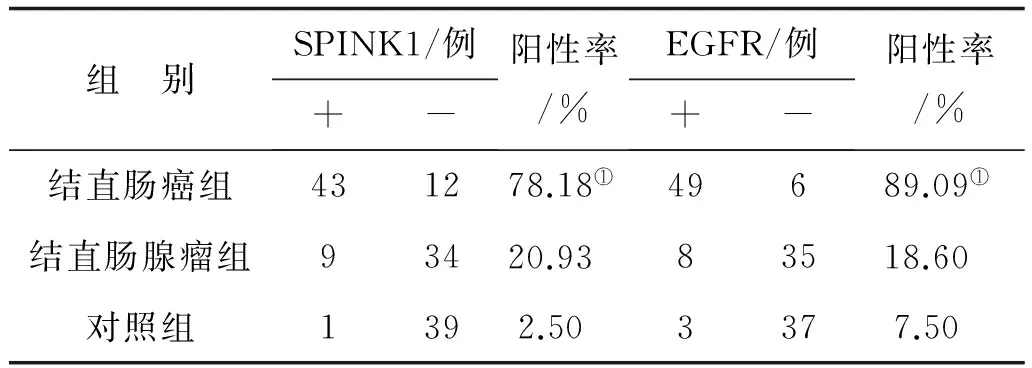
组 别SPINK1/例+-阳性率/%EGFR/例+-阳性率/%结直肠癌组431278.18①49689.09①结直肠腺瘤组93420.93 83518.60 对照组1392.50 3377.50
注:①与结直肠腺瘤组比较,P<0.05。SPINK1:丝氨酸蛋白酶抑制剂Kazal 1型;EGFR:表皮生长因子受体。
2.3SPINK1蛋白的表达与预后的相关性根据随访资料,43例SPINK1阳性的患者中有10例在治疗过程中出现了远处转移或肿瘤相关性死亡,中位生存期为23.31个月。12例SPINK1阴性的患者中有2例在治疗过程中出现远处转移或肿瘤相关性死亡,中位生存期为32.2月。Kaplan-Meie分析显示SPINKl阳性表达的病例相对于阴性者具有较短的生存期或疾病进展期,差异具有统计学意义(P<0.05),见图3。
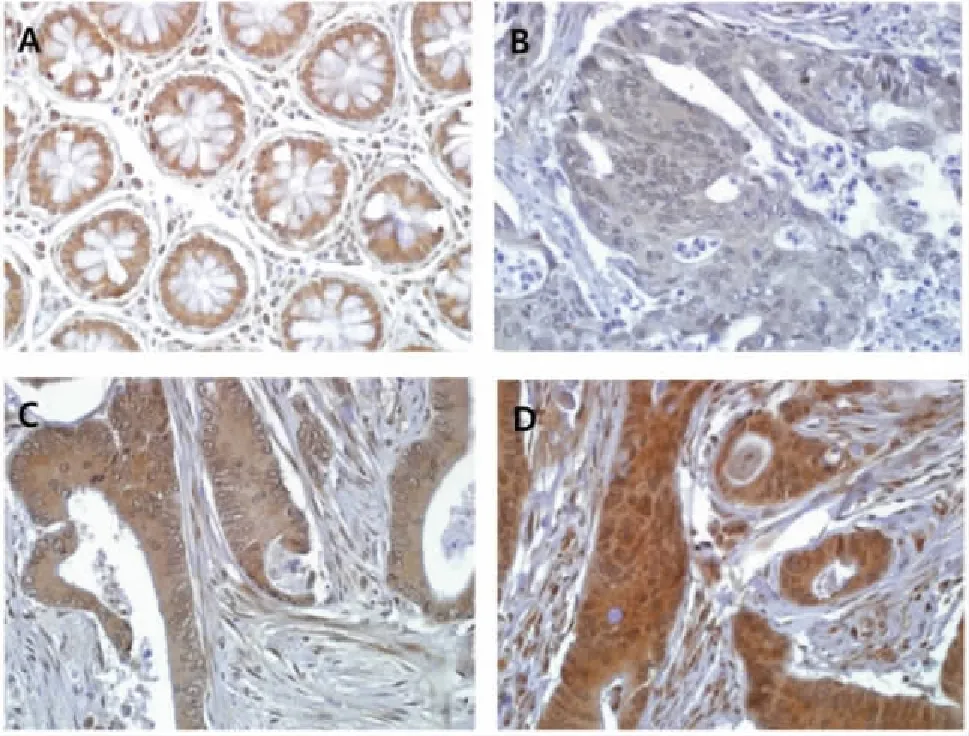
A:正常结肠黏膜;B:结直肠癌中胞质弱表达;C:结直肠癌中胞质中等强度表达;D:结直肠癌中胞质高表达。图2 EGFR在各组中的表达(免疫组化,×400)
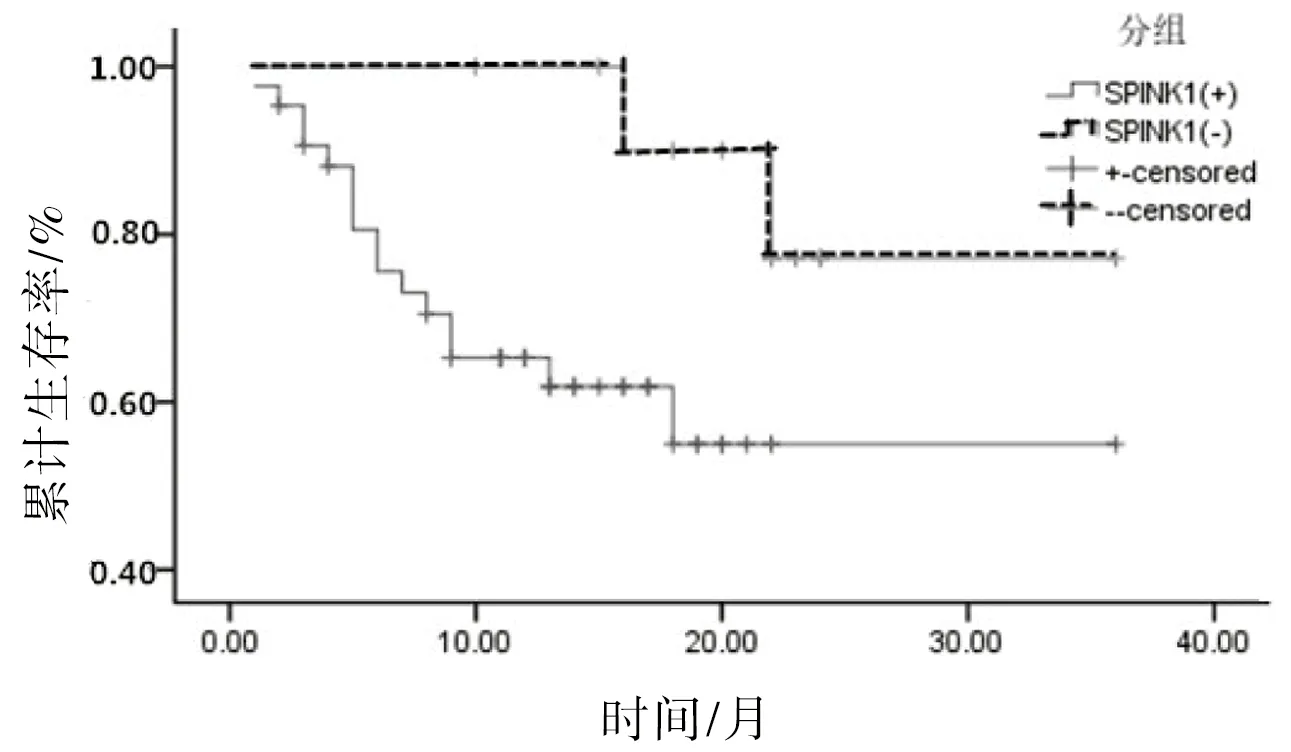
图3 SPINKI的表达与结直肠癌患者疾病进展的Kaplan-Meier曲线图
3 讨论
SPINK1是一种由SPINK基因编码的胰蛋白酶抑制剂,由胰腺腺泡细胞分泌成胰液,也被称为胰腺分泌胰蛋白酶抑制剂(tumor-associated trypsin inhibitor,TATI)或胰腺分泌性胰蛋白酶抑制剂(pancreatic secretory trypsin inhibitor,PSTI),已知在炎症、细胞增殖和癌症发病中起重要作用。有研究表明在胰腺癌、胃癌、肾癌、肝癌、乳腺癌、卵巢癌、食管癌和前列腺癌中SPINK1在组织或血清中的过表达与预后差有关[9]。本研究表明,结直肠癌中SPINK1表达阳性率高于结直肠腺瘤及其周围正常黏膜组织,结直肠癌SPINK1蛋白的表达与性别、肿瘤大小、淋巴结有无转移、远处转移和肿瘤分期有关,提示在结直肠癌进展和转移过程中SPINK1可能具有重要作用,进一步行Kaplan-Meie分析显示,SPINKl阳性表达的患者相对于阴性者具有较短的生存期或疾病进展期,差异具有统计学意义,这一结果与之前Gaber等研究相一致[10-11]。作为丝氨酸蛋白酶的弱抑制剂,SPINK1被认为由于破坏细胞外基质相互作用的平衡而在肿瘤的侵袭、转移和进展中发挥重要的介导作用[12]。有研究表明,SPINK1在肝组织中高表达与肝转移有关,在结直肠癌患者血清中SPINK1水平与结直肠癌患者总体生存率有关[13],表明SPINK1可能在结直肠癌的发生和发展中发挥作用。
EGFR是一种酪氨酸激酶受体,表达于上皮性肿瘤中[14]。EGFR表达升高参与肿瘤的发生,包括细胞增殖、凋亡、血管生成和转移,与预后不良有关。在70%~80%的结直肠癌患者中发现EGFR过度表达,被认为是靶向治疗的靶点之一[15]。本研究结果表明,结直肠癌中EGFR表达阳性率高于结直肠腺瘤及其周围正常黏膜组织,并且与有无远处转移和肿瘤分期有关,与先前Bansal等的发现相一致[16],表明EGFR的过表达随着肿瘤组织的恶性转化而逐渐增加,是一个独立的不良预后预测因子[17]。
有研究通过放射免疫法测定显示,SPINK1结合表面受体并刺激成纤维细胞中的DNA合成,在结构上SPINK1包括与表皮生长因子相似的50%的序列同源性和3个链内二硫键,表明SPINK1可作为生长因子发挥作用。SPINK1可以诱导EGFR的二聚化和磷酸化,并通过MAPK通路促进信号转导和细胞增殖[18]。
总之,本研究结果SPINK1的高表达与疾病进展和预后不良有关,Kaplan-Meie分析显示SPINKl阳性表达的病例相对于阴性者具有较短的生存期或疾病进展期SPINK1的表达与EGFR在结直肠癌中表达呈正相关,SPINK1可被视为增生性肿瘤蛋白。二者在结直肠癌中的相互作用和分子机制还需要进一步研究,为未来的临床决策和个体化靶向治疗提供充分依据。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Masamune A,Mizutamari H,Kume K,et al.Hereditary pancreatitis as the premalignant disease: a Japanese case of pancreatic cancer involving the SPINK1 gene mutation N34S[J].Pancreas,2004,28(3):305-310.
[3] Stenman UH.SPINK1:a new therapeutic target in cancer[J].Clin Chem, 2011,57(11):1474-1475.
[4] Lenz HJ.Anti-EGFR mechanism of action:antitumor effect and underlying cause of adverse events[J].Oncology,2006,20(5 Suppl2):5-13.
[5] Vokes EE,Chu E.Anti-EGFR therapies:clinical experience in colorectal, lung,and head and neck cancers[J].Oncology,2006,20(5 Suppl 2):15-25
[6] O’Connell JB,Maggard MA,Ko CY.Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging[J].J Natl Cancer Inst 2004,96(19):1420-1425.
[7] Rink M,Park K,Volkmer BG,et al.Loss of SPINK1 expression is associated with unfavorable outcomes in urothelial carcinoma of the bladder after radical cystectomy[J].Urol Oncol,2013,31(8):1716-1724.
[8] Koskensalo S,Hagstrom J,Louhimo J,et al.Tumour-associated trypsin inhibitor TATI is a prognostic marker in colorectal cancer[J].Oncology,2012,82(4):234-241.
[9]Paju A,Hotakainen K,Cao Y,et al.Increased expression of tumor-associated trypsin inhibitor,TATI,in prostate cancer and in androgen-independent 22Rv1 cells[J].Eur Urol,2007,52(6): 1670-1679.
[10]Gaber A,Johansson M,Stenman UH,et al.High expression of tumour-associated trypsin inhibitor correlates with liver metastasis and poor prognosis in colorectal cancer[J].Br J Cancer, 2009,100(10):1540-1548.
[11]Gaber A,Nodin B,Hotakainen K,et al.Increased serum levels of tumour-associated trypsin inhibitor independently predict a poor prognosis in colorectal cancer patients[J]. BMC Cancer,2010,17(10):498.
[12]Gouyer V,Fontaine D,Dumont P,et al.Autocrine induction of invasion and metastasis by tumor-associated trypsin inhibitor in human colon cancer cells[J].Oncogene,2008,27(29): 4024-4033.
[13]Gaber A,Stene C,Hotakainen K,et al.Effects of radiation therapy on tissue and serum concentrations of tumour associated trypsin inhibitor and their prognostic significance in rectal cancer patients[J].Radiat Oncol,2011,24(6):100.
[14]Nicholson RI,Gee JM,Harper ME.EGFR and cancer prognosis[J].Eur J Cancer,2001,37(Suppl 4):9-15.
[15]Rego RL,Foster NR,Smyrk TC,et al.Prognostic effect of activated EGFR expression in human colon carcinomas:comparison with EGFR status[J].Br J Cancer,2010,102(1):165-172.
[16]Bansal A,Liu X,McGregor DH,et al.Correlation of epidermal growth factor receptor with morphological features of colorectal advanced adenomas:a pilot correlative case series[J].Am J Med Sci,2010,340(4):296-300.
[17]Rokita M,Stec R,Bodnar L,et al.Overexpression of epidermal growth factor receptor as a prognostic factor in colorectal cancer on the basis of the Allred scoring system[J].Onco Targets Ther,2013,24(6):967-976.
[18]Ateeq B,Tomlins SA,Laxman B,et al.Therapeutic targeting of SPINK1-positive prostate cancer[J].Sci Transl Med,2011,3(72):1-18.

