炎症细胞因子CRP/IL-6/IL-10多态性与社区获得性肺炎易感性及严重程度的关联研究
张园 郝璐
炎症细胞因子CRP/IL-6/IL-10多态性与社区获得性肺炎易感性及严重程度的关联研究
张园 郝璐
目的 探讨炎症细胞因子IL-6/CRP/IL-10多态性与社区获得性肺炎(community-acquired pneumonia,CAP)易感性及严重程度的关联。 方法 选择2012年10月-2014年6月就诊于我院的366例CAP患者作为CAP组,另选同期405名健康体检者作为对照组。应用限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)对所有受试者的CRP 1059G/C、IL-6 -597G/A和IL-10 -592C/A进行基因型分析,收集所有受试者临床资料,并采用CURB-65和PSI评分衡量CAP患者易感性、严重程度及预后。 结果 CAP组IL-6 -597G/A的AA+AG基因型和A等位基因频率均高于对照组(均P<0.05),A等位基因可能是发生CAP的危险因子。CAP组IL-10 -592C/AAA基因型和A等位基因频率均高于对照组 (均P<0.05)。SCAP组(重症肺炎组)的死亡率、呼吸衰竭比率、脓毒性休克比率、多器官功能障碍综合症(Multiple organ dysfunction syndrome,MODS)比率、APACHEⅡ评分和住院天数均明显高于NSCAP(非重症肺炎组)组(均P<0.05)。SCAP组中IL-6 -597G/A A等位基因携带者分布频率高于NSCAP组(P<0.05)。IL-10 -592C/A在SCAP组中AA基因型及A等位基因的频率均明显高于NSCAP组(均P<0.05)。携带IL-6-597G/A 突变基因型(GA+AA)的肺炎患者白细胞数、中性粒细胞数、血沉均明显高于野生基因型携带者GG(均P<0.05)。携带IL-6 -597G/A突变基因型(GA+AA)的患者在死亡组中的比例远高于存活组(P<0.05)。携带IL-6 -597G/A 突变基因型(GA+AA)的肺炎患者CURB-65和PSI评分均明显高于野生基因型携带者GG(均P<0.05)。此外,携带IL-10 -592C/A突变基因型(CA+AA)的肺炎患者CURB-65和PSI评分也均明显高于野生基因型CC携带者,且差异均有统计学差异(均P<0.05)。结论 IL-6 -597G/A和IL-10 -592C/A与CAP的发生发展以及严重程度相关,而CRP 1059G/C则与CAP的发生发展以及严重程度无关。
炎症细胞因子;IL-6;CRP;IL-10;社区获得性肺炎;严重程度;遗传多态性
社区获得性肺炎 (Community-acquired pneumonia,CAP) 是指在院外感染的,包括具有明确潜伏期的病原体感染而在入院后平均潜伏期内发病的肺实质炎症[1]。目前已有研究表明,炎症反应通道关键分子的基因多态性与肺炎易感性相关[2]。CRP 基因位于 1 号染色体长臂,基因组长 2.5 kb,有 2 个外显子,中间由 1 个内含子隔开,编码 206 个氨基酸残基[3]。先前研究结果表明CRP +1059 的单核苷酸多态性与慢性牙周炎及克罗恩病易感性有关[3-4]。 IL-6 基因位于第 7 号染色体短臂上,含5 个外显子和4 个内含子。研究发现,IL-6 基因多态性与多种疾病存在密切相关性,包括脓毒症及慢性阻塞性肺疾病[5-6]。IL-10 作为人体内最重要的抑炎性细胞因子,其基因启动子区多态性可能是影响我国儿童哮喘严重程度的重要候选基因[7]。启动子区域的基因多态性通常被认为影响基因的表达水平,故此,我们设计本实验来研究CRP 1059G/C、IL-6 -597G/A和IL-10 -592C/A的多态性与CAP的易感性和严重程度的关系,并期望本研究能提高CAP的诊断和病情严重度的评估水平,并为寻求更好的诊治方案提供参考。
资料与方法
一、 研究对象
选择2012年10月-2014年6月就诊于我院的366例CAP患者作为CAP组,其中男208例,女158例,平均年龄64.8±8.6岁。另选同期405名健康体检者作为对照组,其中男255例,女150例,平均年龄63.5±5.8岁。患者符合2001年美国胸科医师学会制定的社区获得性诊断标准[8]:① 新近出现的咳嗽、咳痰或原有呼吸道疾病症状加重,并出现脓性痰,伴或不伴胸痛;② 发热;③ 肺实变体征和/或闻及湿性啰音;④ 白细胞计数 >10×109/L或<4×109/L,伴或不伴细胞核左移;⑤ 胸部X线检查显示片状、斑片状浸润性阴影或间质性改变,伴或不伴胸腔积液。以上①-④项中任何一项加第⑤项,并排除肺结核、肺部肿瘤、非感染性肺间质性疾病、肺水肿、肺不张、肺栓塞、肺嗜酸粒细胞浸润症及肺血管炎后,即可明确临床诊断。排除标准:① 痰涂片抗酸杆菌阳性;② 伴有代谢性疾病,如糖尿病、甲状腺功能亢进、甲状腺功能减低、原发性醛固酮增多症等;③ 既往或住院期间诊断为良性或恶性肿瘤;④ 伴自身免疫性疾病;⑤ 诊断为病毒性肺炎。本研究获得内蒙古医科大学附属医院伦理委员会批准,受试者均签署知情同意书。CAP组与对照组的性别构成、年龄比较,差异无统计学意义(均P>0.05)。
二、标本收集
所有受试者空腹10-12 h,晨起抽取肘静脉血5 mL,用于检测血清LI-6、CRP和IL-10,其余血样加EDTA抗凝剂后保存于-80℃冰箱中,待提取白细胞基因组的DNA。DNA提取采用蛋酶K消化-饱和氯化钠盐析法。每提取8组DNA样本后,用2%的琼脂糖凝胶电泳检测样本中是否含有DNA。每份外周血标本预留一个备份以便复查。
三、临床资料收集
记录CAP组所有病例的性别、年龄、合并的基础疾病、入院时症状及持续时间,入院后24小时之内的体温、呼吸频率、血压、心率、意识状态及血常规、肝功能、肾功能、血沉、C反应蛋白、痰和/或血培养、影像学资料,入院后治疗及病情改变,预后。预后判断标准根据患者28天内是否存活,分为死亡组和存活组。
四、肺炎患者病情严重量化标准和肺炎PSI评分
根据英国胸科协会改良肺炎评分(CURB-65)量化CAP严重程度[9],意识障碍、氮质血症、呼吸≥30次/分、低血压和年龄>65岁各为1分。将肺炎患者分成重症肺炎组(severe community-acquired pneumonia,SCAP)(≥3分),非重症肺炎组(non-SCAP,NSCAP)(<3分)。根据PSI评分将肺炎患者分为5级:分值0分为Ⅰ级,<70分为Ⅱ级,70-90分为Ⅲ级,90-130分为Ⅳ级,>130分为V级[10]。
五、引物设计与合成
在PCR-RFLP技术中,使用特异性限制性内切酶识别PCR产物特异性位点,然后通过凝胶电泳检测PCR产物,根据产物片断大小来判断相应位点的基因型。按照参考文献[11],并与Gene bank核对无误后,用primer 5.0设计引物序列,分别扩增CRP 1059G/C、IL-6 -597G/A和IL-10 -592C/A等位基因,,由上海生物工程公司合成。引物序列及长度见表1。

表1 PCR引物序列
六、基因多态性检测
CRP 1059G/C PCR反应体系为50μL,其中模板DNA 100 ng,10×PCR(含MgCl215 mmol/L)缓冲液5μL,Taq DNA聚合酶1.0 U,dNTPs 200 μmoL/L。PCR反应条件为:94℃预变性5min,然后94℃1 min,56℃ 1 min,72℃ 1 min,35个循环后,72℃延伸5min。取纯化后的PCR产物5μL,限制性内切酶Mae Ⅲ,55℃水浴4h,酶切片段进行2% 琼脂糖凝胶电泳分析基因型。IL-6 -597G/A PCR反应体系:10×PCR(含MgCl215 mmol/L)缓冲液2.5μL,10 μmoL/L dNTPs 4.0μL,上下游引物各1μL ,模板DNA 1μL,Taq DNA聚合酶(5 U/μL)0.2μL,加蒸馏水至25μL。PCR反应条件为:95℃预变性5min,然后95℃ 30s,50℃ 30s,72℃ 50s,35个循环后,72℃延伸7 min。取纯化后的PCR产物5μL,限制性内切酶FoKⅠ酶切,37℃消化2h,酶切片段进行2%琼脂糖凝胶电泳分析基因型。
IL-10 -592C/A PCR反应体系为25μL,含2.5μL 10× PCR 缓冲液,0.4 mmoL/L dNTPs,上、下游引物各0.6μmoL/L。PCR的反应条件为:95℃预变性2 min,94℃变性45s,58℃退火45s,72℃延伸1min,35个循环,72℃延伸5min。取纯化后的PCR产物5μL,限制性内切酶RsaⅠ酶切,37℃消化8h,酶切片段进行2% 琼脂糖凝胶电泳分析基因型。
CRP 1059G/C经PCR扩增片段为744bp,经Mae Ⅲ酶切后,有野生纯合基因型GG (310bp、233bp和201bp),突变杂合基因型GC (434bp、310bp、233bp和201bp)和突变纯合基因型CC为(434bp和310bp),(见图1A)。IL-6 -597G/A 经PCR扩增片段为321bp,经FoKⅠ酶切后,野生纯合型GG基因型为321bp,突变纯合基因型CC(193bp和128bp)和突变杂合基因型CG为(321bp、193bp和128bp),(见图1B)。IL-10 -592C/A PCR扩增产物为412bp的DNA片段,经限制性内切酶RsaI酶切后,野生纯合型AA基因型为412bp,突变纯合基因型CC(237bp和175bp)和突变杂合基因型AC为(175bp,237bp和412 bp),(见图1C)。每批PCR反应均以蒸馏水替代模板DNA作为阴性对照,随机挑取10%的DNA标本进行重复实验以证实分型方法的可靠性。
七、统计学处理
结 果
一、CRP、IL-6和IL-10 SNPs基因型及等位基因型频率在CAP组和对照组的分布
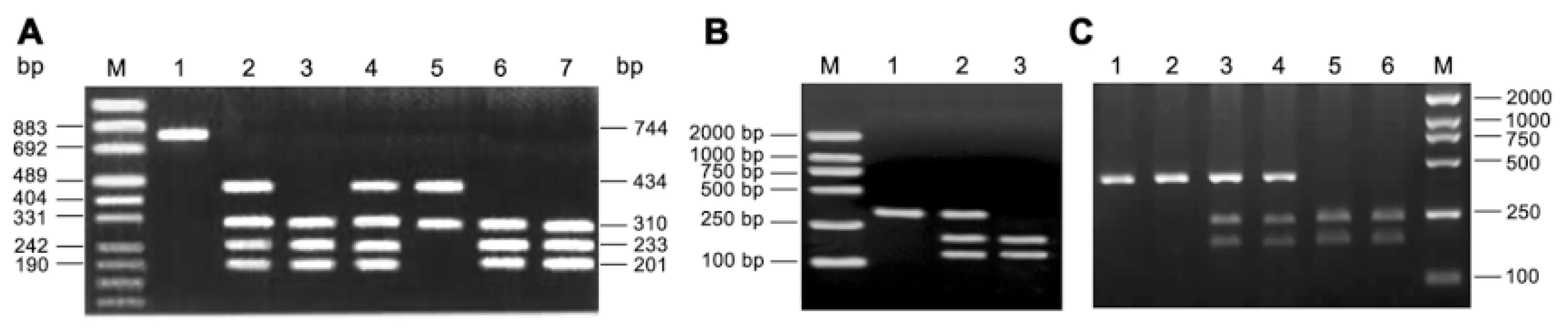
图1 CRP 1059G/C、IL-6 -597G/A和IL-10 -592C/A基因多态性检测
M:marker,1:PCR产物;2、4:GC;3、6:GG;5:CC(图1A);M:marker,1:GG;2:GA;3:AA(图1B);M:marker,1、2:CC;3、4:AC;5、6:AA(图1C)
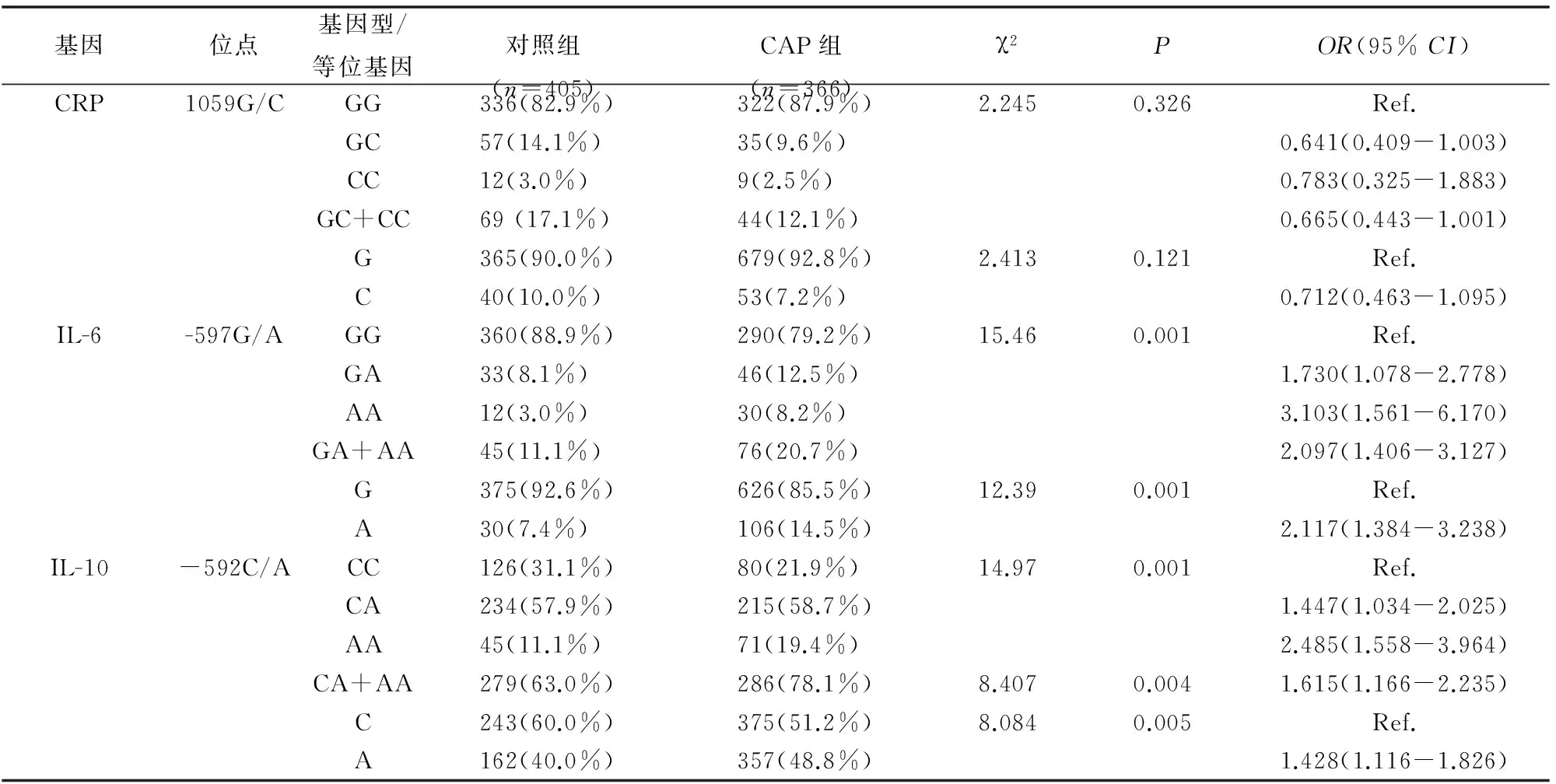
表2 CRP、IL-6和IL-10 SNPs基因型及等位基因型频率在病例组和对照组中的分布
对CAP组和对照组CRP 1059G/C、IL-6 -597G/A和IL-10 -592C/A 3个位点的基因型频数分布分别进行拟和优度χ2检验,结果表明3个位点在两组中的频数分布均符合Hardy-Weinberg平衡定律(均P>0.05)。CAP组IL-6 -597G/A的野生基因型(AA/AG)和A等位基因频率均高于对照组,且差异具有统计学意义(均P<0.05),A等位基因可能是发生CAP的危险因子(AAvs.GG:OR=3.103,95%CI=1.561-6.170;AA+GAvs. GG:OR=2.097,95% CI=1.406-3.127;Avs. G:OR=2.117,95% CI=1.384-3.238)。CAP组IL-10 -592C/A的野生基因型(AA)和A等位基因频率均高于对照组,且差异具有统计学意义(均P<0.05),A等位基因可能是CAP的危险因子(AAvs.CC:OR=2.485,95% CI=1.558-3.964;AA+CAvs. CC:OR=1.615,95% CI=1.166-2.235;Avs. C:OR=1.428,95% CI=1.116-1.826),而CRP 1059G/C各基因型和等位基因在两组间的差异无统计学差异(均P>0.05),(见表2)。
二、CAP患者的一般资料
SCAP组的死亡率、呼吸衰竭比率、脓毒性休克比率、多器官功能障碍综合症(MODS)比率、APACHEⅡ评分和住院天数均明显高于NSCAP组(均P<0.05),而SCAP组年龄、性别比例与NSCAP组无统计学差异,均P>0.05,(见表3)。
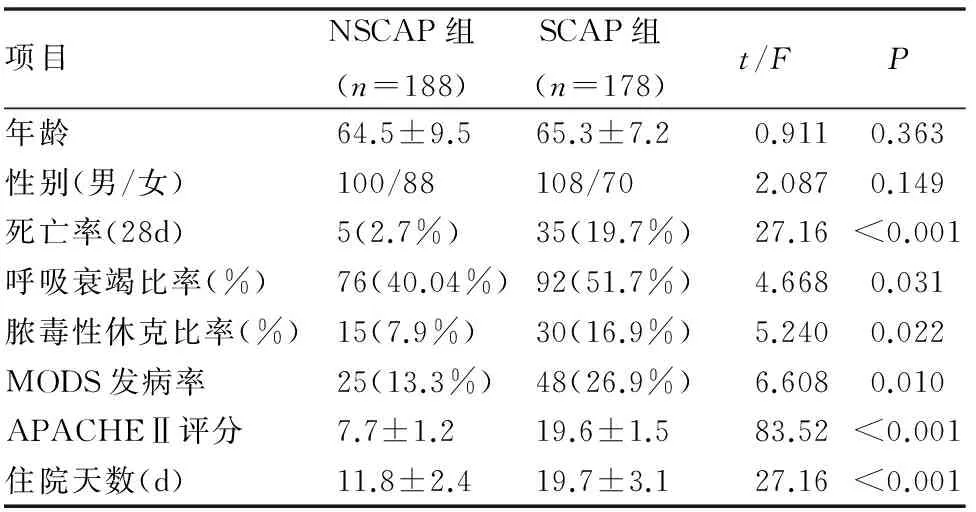
表3 非重症社区获得性肺炎与重症肺炎患者临床资料比较
三、CRP、IL-6和IL-10 SNPs与肺炎严重程度的相关性
SCAP组中IL-6 -597G/AA等位基因携带者分布频率高于NSCAP组(P<0.05),而各基因型在NSCAP组和SCAP组间无统计学差异(均P>0.05)。此外,IL-10 -592C/A各基因型和等位基因的分布频率在两组间差异均有统计学意义,且SCAP组中AA基因型及A等位基因的频率均明显高于NSCAP组(均P<0.05)。而CRP 1059G/C各基因型和等位基因的分布频率在两组间差异均无统计学意义,均P>0.05,(见表4)。
四、CRP、IL-6和IL-10 SNPs与肺炎患者病情的相关性
携带IL-6-597G/A 突变基因型(GA+AA)的肺炎患者白细胞数、中性粒细胞数、血沉均明显高于野生基因型携带者GG,且差异均有统计学差异(均P<0.05),而在住院时间方面无统计学差异(均P<0.05)。此外,CRP 1059G/C和IL-10 -592C/A携带者的住院时间、白细胞数、中性粒细胞数、血沉在各基因型间的差异也均无统计学差异,均P>0.05,(见表5)。
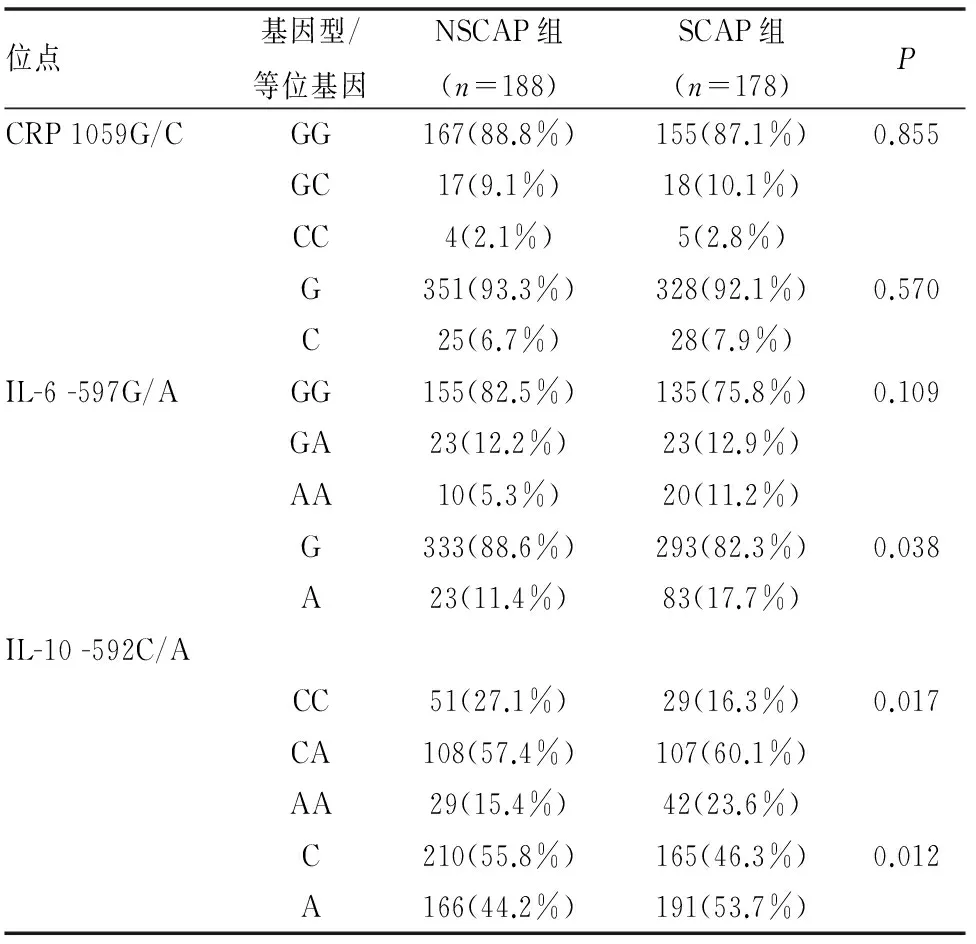
表4 CRP、IL-6和IL-10 SNPs在SCAP组与NSCAP组中的分布
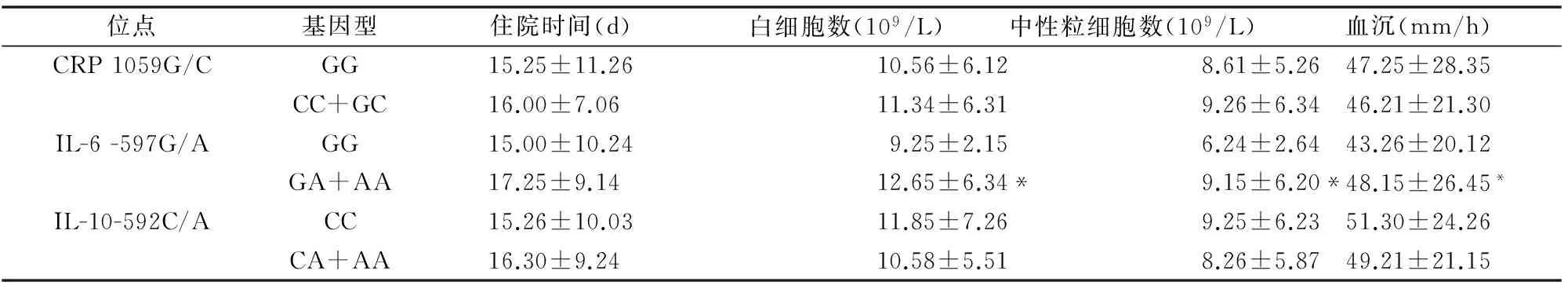
表5 CRP、IL-6和IL-10 SNPs与肺炎患者病情的相关性
与野生基因型比较,*P<0.05
五、CRP、IL-6和IL-10 SNPs与肺炎患者病死率的相关性
IL-6 -597G/A 野生基因型GG在死亡组与存活组中的分布频率分别是62.5%、81.3%,突变基因型(GA+AA)在死亡组与存活组中的分布频率分别是37.5%、18.7%,携带突变基因型(GA+AA)的患者在死亡组中的比例远高于存活组(P<0.05),而 CRP 1059G/C和IL-10-592C/A各基因型在死亡组与存活组间的差异均无统计学差异(均P>0.05),(见表6)。而在Puren等的报道中,没有发现IL-6水平和死亡率的关系[12]。
六、CRP、IL-6和IL-10 SNPs与肺炎评分标准的相关性
携带IL-6 -597G/A 突变基因型(GA+AA)的肺炎患者CURB-65和PSI评分均明显高于野生基因型携带者GG,且差异均有统计学差异(均P<0.05)。此外,携带IL-10-592C/A突变基因型(CA+AA)的肺炎患者CURB-65和PSI评分也均明显高于野生基因型CC携带者,且差异均有统计学差异(均P<0.05),而携带CRP 1059G/C肺炎患者的CURB-65和PSI评分在各基因型间的差异也均无统计学差异,均P>0.05,(见表7)。
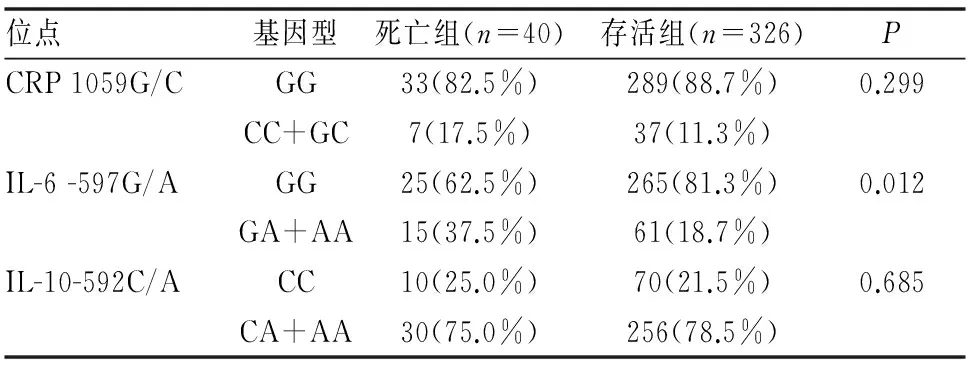
表6 CRP、IL-6和IL-10 SNPs在死亡组与存活组中的分布
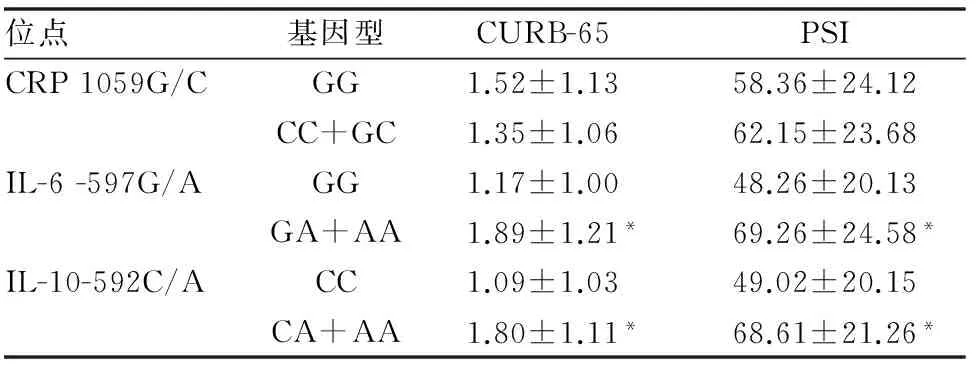
表7 CRP、IL-6和IL-10 SNPs与肺炎评分标准的相关性
与野生基因型比较,*P<0.05
讨 论
CAP是一种世界范围内的致病和致死疾病[13]。CAP相关肺损伤的确切机制是复杂的,并涉及到大量受遗传因子影响的细胞和分子过程[12]。CRP、IL-6和IL-10的表达水平与CAP的易感性和严重度关系被广泛研究并被认为是急性炎症反应中起重要作用的细胞因子。基因启动子区的位点的多态性被认为与基因的表达有密切联系,故而对以上几个基因的启动子多态性与CAP易感性的关系研究有可能为我们预测易感人群、判别疾病分级,预后等工作提供参考。我们选择IL-6 597G/A,IL-10-592C/A,和CRP-1059G/C等以报道的多态性位点,这些位点在其他疾病中多有研究,但据我们所知,本文是针对这几个位点与CAP易感度和严重程度及预后之间相关性的首次分析。
我们发现, IL-6 -597G/A的多态性的基因型频率在CAP患者组和健康对照组存在明显的差别,A等位基因的存在与CAP的易感性、病情严重程度、不良病理参数、高的病情分级指数以及病人高死亡率存在正相关性,提示A等位基因可能是危险因子。在针对埃及地区儿童的CAP回顾分析中,Zidan等人的文章表明IL-6 174GG基因型和G等位基因与CAP的易感性成显著相关,意外的是,正是GG基因型和G等位基因对重症脓毒症、急性呼吸衰竭和医院死亡率有保护作用,在CAP患儿中,血清IL-6的水平是升高的,但Zidan的数据并没有显示血清IL-6的水平与IL-6 174G等位基因存在相关性[14]。虽然研究的SNP位点不同,但这间接支持了IL-6启动子区位点多态性与CAP的敏感度和病症严重程度是相关的。这种相关性的机制还需进一步的实验来研究,可能的机制包括IL6-597G/A的多态性影响血清和肺部炎症局部IL-6的表达水平,或者此位点的作用仅仅是因为与真正具有功能的遗传位点之间具有连锁不平衡。
我们还发现IL-10-592C/A AA基因型和A等位基因频率与CAP易感性、严重程度、和PSI、CURB-65评分成正相关,显示A等位基因为可能的危险因子。而在Gallagher等人的研究中,也显示IL-10的一个启动子位点1082G/A的多态性与CAP的严重程度相关[15]。而且IL-10 592C/A被认为与肺炎脓毒症有关[16]。此位点与CAP的关系虽未见报道,我们合理的猜测IL-10 592C/A的多态性可能是通过影响IL-10的转录水平而影响机体在急性反应期的免疫调节功能。Marthe S. Paats等人的研究也指出重症CAP患者相较轻症患者和健康人血清中IL-6和IL-10的水平明显增高,且这些细胞因子的水平与肺炎严重指数成显著正相关[17],提示它们在CAP病理方面有重要作用。
虽然血清的CRP水平在肺炎和各种急性炎症的诊断中被认为有价值[18-20],并且CRP 1059G/C的多态性被认为影响CRP的表达[21]。但是我们的分析中并没有显示此位点多态性与CAP的相关具有显著性。该位点通常被认为是与心脑血管疾病相关的[22]。在Paats等人的文章中,也报道CRP的血清水平与CAP的严重程度没有相关性[17]。在Kruger.S等人的研究中,也指出血清CRP作为诊断分级依据的价值较低[23]。
为了更好的理解基因多态性与CAP的关系,其作用的机制,还需要大量的努力。我们相信对CAP在病源学的准确分型能帮助我们更好地去研究这些因子在疾病进程中的作用[24]。虽然IL-6、IL-10的各种基因多态性位点与血清中IL-6、IL-10水平关系的研究在很多种疾病中都有研究,在健康个体中,IL-6的启动子区域基因多态性与外周表达水平是相关的,但是多数疾病的研究并没有发现IL-6启动子区的基因多态性与外周血中IL-6的含量有显著相关性,故寻找能影响IL-6表达水平的基因多态位点是非常重要的,很可能这些蛋白的表达受多种基因位点的影响,故而在分析中掩盖了单一位点的作用。另一个方面说,外周血的含量对诊断是重要的,但并不一定就反映炎症局部的情况[25],故而对肺泡灌洗液的细胞因子水平的检测在可行的条件下对理解多态性位点与表达水平的关系是有帮助的。但在CAP患者中IL-6 572G/A多态性与IL-6的血清水平的关系还无人报道,因而,对血清中因子的水平进行测量也有利于我们证实或证伪这些位点的基因型与真实发生作用的因子的表达水平的关系。从我们对机理的初步推测,在感染的不同时期,相同的炎症因子可能随着疾病的进程和病人病灶内环境的改变产生不同的甚至相反的影响,我们希望有机会在动物模型上跟踪CAP组模型与对照组模型的这些因子的时序变化,以期更准确地把握这些因子影响CAP的机理。我们的分析结果显示IL-6 572G/A 和IL-10 592C/A 的遗传位点的多态性与CAP的易感性、病情严重程度、和预后具有相关性, 但需要更多的研究去揭示这种相关性的机制。
[1] 徐加红, 江桂林, 施永敏,等. 中医拔罐治疗老年社区获得性肺炎30例疗效观察[J]. 河北中医, 2014(12):1834-1835.
[2] Cai X, Fu Y, Chen Q. Association between TLR4 A299G Polymorphism and Pneumonia Risk: A Meta-Analysis[J]. Med Sc Mon Intern Med J Exper Clin Res, 2015, 21:625-629.
[3] 张帆, 邵培, 黄萍. C-反应蛋白基因多态性与相关疾病的研究进展[J]. 广东牙病防治, 2007, 15(7):330-332.
[4] 张帆, 徐国超, 黄萍,等. C-反应蛋白基因多态性与慢性牙周炎伴Ⅱ型糖尿病易感性相关研究[J]. 实用口腔医学杂志, 2009, (6):889-892.
[5] 陆晶晶, 梁永杰, 尹琦,等. 白细胞介素-6基因多态性与慢性阻塞性肺疾病及吸烟因素的相关性研究[J]. 临床内科杂志, 2013, 30(10):669-672.
[6] 孙丽蓉, 王海龙, 高扬,等. IL-1、IL-6基因多态性与慢性阻塞性肺疾病肺动脉高压相关性研究[J]. 医学研究杂志, 2013, 42(11):80-84.
[7] 张嘉琳, 陈虹, 胡良平,等. 白细胞介素4和10基因多态性与儿童哮喘的相关性及对细胞因子表达的影响[J]. 中华医学杂志, 2002, 82(2):114-118.
[8] Niederman M S, Mandell L A, Anzueto A, et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention[J]. Am J Respir Crit Care Med, 2001, 163(7):1730-1754.
[9] Marc Andre P, Timothy T, Thomas W, et al. Short-term mortality of adult inpatients with community-acquired pneumonia: external validation of a modified CURB-65 score[J]. Postgr Med J, 2015, 91(1072).
[10] Gonzalez C, Johnson T, Rolston K, et al. Predicting pneumonia mortality using CURB-65, PSI, and patient characteristics in patients presenting to the emergency department of a comprehensive cancer center[J]. Canc Med, 2014, 3(4):962-970.
[11] Cao H, Hegele R A. Human C-reactive protein (CRP) 1059G/C polymorphism.[J]. J Hum Gen, 2000, 45(2):100-101.
[12] Patwari P P, Cain P O, Goodman D M, et al. Interleukin-1 receptor antagonist intron 2 variable number of tandem repeats polymorphism and respiratory failure in children with community-acquired pneumonia[J]. Ped Crit Car Med, 2008,9(6):553-559.
[13] Mandell L A, Wunderink R G, Anzueto A, et al. Niederman. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community-Acquired Pneumonia in Adults[J]. Clin Inf Dis, 2007,44(Suppl 2):s27-s72.
[14] Zidan H E, Elbehedy R M, Azab. S F. IL6-174 G/C gene polymorphism and its relation to serum IL6 in Egyptian children with community-acquired pneumonia[J]. Cytokine, 2014,67(2):60-64.
[15] Gallagher P M, Lowe G, Fitzgerald T,et al. Association of IL-10 Polymorphism with severity of illness in community acquired pneumonia[J]. Thorax, 2003,58(2):154-156.
[16] Wattanathum A. Interleukin-10 haplotype associated with increased mortality in critically ill patients with sepsis from pneumonia but not in patients with extrapulmonary sepsis[J]. Chest, 2005,128(3):1690-1698.
[17] Paats M S,Bergen I M, Hanselaar W E,et al. Local and systemic cytokine profiles in nonsevere and severe community-acquired pneumonia[J]. Eur Respir J, 2013,41(6):1378-1385.
[18] 王艾丽, 严孝岭, 罗冰, 等. 儿童肺炎支原体感染检测MBL和CRP的意义[J]. 标记免疫分析与临床, 2009,16(1): 1-3.
[19] 王利建. CRP对流感合并急性肺炎早期诊断的临床价值[J]. 放射免疫学杂志,2010,23(2): 237-238.
[20] 简亚梅, 张少兴, 胡路华, 等. CRP动态检测在老年社区获得性肺炎的临床应用[J]. 中国冶金工业医学杂志,2010,27(6):681-682.
[21] Rizzello V, Liuzzo G, Giannuario G D,et al. 1059G/C polymorphism within the exon 2 of the C-reactive protein gene: relationship to C-reactive protein levels and prognosis in unstable angina[J]. Coronary Artery Disease, 2007,18(7):533-538.
[22] C.R. Balistreri C R, Vasto S,Listi F,et al. Association between +1059G/C CRP polymorphism and acute myocardial infarction in a cohort of patients from Sicily: a pilot study[J]. Ann N Y Acad Sc, 2006,1067(1):276-281.
[23] K. S, E. S, M. R, et al. Group, Procalcitonin predicts patients at low risk of death from community-acquired pneumonia across all CRB-65 classes[J]. Eur Respir J, 2008,31(2):349-355.
[24] Menéndez R, J.M. Sahuquillo-Arce J M, Reyes S,et al. Torres Cytokine activation patterns and biomarkers are influenced by microorganisms in community-acquired pneumonia[J]. Retour Au Numéro, 2012,141(6):1537-1545.
[25] Boutten A, Dehoux M S, Seta N,et al. Compartmentalized IL-8 and elastase release within the human lung in unilateral pneumonia[J]. Am J Respir Crit Care Med, 1996,153(1):336-342.
Correlation of IL-6/CRP/IL-10 polymorphisms with the susceptibility and severity of community-acquired pneumonia
ZHANGYuan,HAOLu
DepartmentofRespiratoryMedicine,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Huhhot,InnerMongolia010050,China
Objective To explore the correlation of IL-6/CRP/IL-10 polymorphisms with the susceptibility and severity of community-acquired pneumonia. Methods A total of 366 CAP patients were enrolled as the case group and 405 healthy individuals as control group. PCR-RFLP was performed to analyze CRP 1059G/C, IL-6-597G/A and IL-10-592C/A genotypes. CURB-65 score and PSI score were used to measure susceptibility, severity and prognosis of CAP. Results When compared with the control group, wild genotype (AA/AG) frequency of IL-6 597G/A and A allele frequency, IL-10-592C/A AA genotype and A allele were higher in the CAP group (allP<0.05). Comparing with the non-severe community-acquired pneumonia (NSCAP) group, the distribution frequency of IL-6 -597G/A A allele carrier was higher in the SCAP group (P<0.05). In terms of white blood cells count, neutrophil cells count and erythrocyte sedimentation rate (ESR), CAP patients who carried IL-6-597G/A mutant genotype were higher than wild genotype GG carriers, and all differences were statistically significant (allP<0.05). Besides, comparing with the survival group, the proportion of patients carrying IL-6 -597G/A mutant genotype (GA+AA) was far higher in the death group (P<0.05). When compared with wild genotype carriers (GG), CURB-65 score and PSI score were significantly higher in CAP patients carrying IL-6 -597G/A mutant genotype (GA+AA) (bothP<0.05). Furthermore, CURB-65 score and PSI score were significantly higher in CAP patients carrying IL-10 -592C/A mutant genotype (CA+AA) than that in wild genotype carrier (CC) (bothP<0.05). Conclusion IL-6 -597G/A and IL-10 -592C/A are associated with the occurrence and development of CAP and its severity of CAP, while there is no association of CRP 1059G/C with CAP and its severity.
inflammatory cytokines; IL-6; CRP; IL-10; severity; genetic polymorphism
10.3969/j.issn.1009-6663.2017.02.021
010050 内蒙古 呼和浩特,内蒙古医科大学附属医院呼吸内科
郝璐,E-mail: haolu1231@163.com
2016-06-08]

