DWI单指数和双指数模型在前列腺癌Gleason分级中的应用:基于三维立体直方图分析
张配配,王良,闵祥德,冯朝燕,康振,李拔森,可赞,游慧娟
前列腺癌占美国男性癌症死亡的第二位,近年来,我国前列腺癌的发病率呈逐年上升趋势[1-4]。Gleason分级是决定前列腺癌生物学活性和侵袭性的重要因素,大量文献支持Gleason分级作为预测前列腺癌结局的主要病理因素,并可指导疾病管理和治疗策略的选择[5-9]。然而,目前尚无准确可靠的非侵袭性方法评估前列腺癌的侵袭性。
磁共振成像是前列腺癌探查和定位的最佳检查方式[1-2],尤其扩散加权成像(diffusion weighted imaging,DWI)有多种弥散模型用于前列腺癌侵袭性的研究[10-12]。多项研究表明表观扩散系数(apparent diffusion coefficient,ADC)与Gleason评分(Gleason score,GS)之间呈统计学相关[8-9]。近年来,随着磁共振设备和序列的不断改进,体素内不相干运动扩散加权成像(intravoxel incoherent motion,IVIM-DWI)逐渐应用于临床[10,13]。通过采集足够的低b值(≤200 s/mm2)图像,使用双指数模型进行拟合,即可将单纯水扩散(D)与灌注相关扩散(D*)区分开来,并得到灌注分数f[1,8]。以往研究多集中于IVIM参数在前列腺癌与正常组织之间的差异[1,14],而关于其对不同病理分级前列腺癌的鉴别鲜有报道[7]。IVIM-DWI在无需注射对比剂的情况下可以无创、定量反映组织的扩散和灌注特性,为疾病的诊断提供更加丰富的信息[10]。但与临床上广泛应用的传统单指数模型定量参数ADC相比,IVIM模型能否改善对不同病理级别前列腺癌的鉴别尚有争议。以往多采用从单层面感兴趣区(region of interest,ROI)获取ADC值,只能反映前列腺癌的局部信息,且易因ROI选取不同而导致读者间差异[8-10];Gleason评分大多经直肠或会阴超声引导下穿刺获得,可能低估前列腺癌的侵袭性[6-7]。因此,本研究采用包含多个低b值的IVIM序列,以前列腺癌根治病理Gleason评分为金标准,基于全肿瘤直方图分析,以期较全面地分析单指数模型和IVIM模型定量参数ADC、D、D*和f对前列腺癌的鉴别效能。
1 材料与方法
1.1 患者资料
回顾性搜集2015年10月至2017年1月的前列腺癌根治病例,纳入标准:(1)根治术前行MRI检查,包括完整的DWI序列(共14个b值),且扫描参数统一;(2)检查前未行任何治疗,如手术、放疗、内分泌治疗等。排除标准:(1)穿刺阳性但MRI图像上癌灶不明显者即T1c期前列腺癌;(2)图像伪影重而影响诊断者。最终纳入57例患者,年龄53~79岁,中位年龄66岁;前列腺特异性抗原(prostate specific antigen,PSA)为3.389~>1000 ng/ml,中位PSA为30.188 ng/ml。
1.2 MRI检查方法
患者均采用德国西门子3.0 T MR扫描仪,以体线圈为射频发射线圈,以腹部相控阵线圈为接收线圈。扫描前适度充盈膀胱,取仰卧位,中心定位于耻骨联合上方2.0 cm。(1)前列腺常规MRI序列:行矢状面、冠状面和轴面位快速自旋回波T2WI,TR 6500 ms,TE 104 ms,层厚3 mm,无间距扫描,FOV 180 mm×180 mm,激励次数(NEX) 2,矩阵320×288,回波链长度为1。(2) IVIM-DWI序列:轴面单次激发平面回波成像(single-shot spin-echo echo-planar imaging,ss-EPI)序列,TR 3900 ms,TE 70 ms,层厚3 mm,无间距扫描,FOV 215 mm×172 mm,矩阵90×90,回波链长度1。包含14个b值,分别为b=0、10、20、30、40、50、75、100、150、200、400、800、1000、1500 s/mm2。b≤200 s/mm2时,NEX为1;b=400 s/mm2时,NEX为2;b=800 s/mm2时,NEX为3;b=1000、1500 s/mm2时,NEX为4。
1.3 图像分析
将所有DWI图像传至西门子机器专用后处理软件。由1名医师(2年前列腺磁共振诊断经验)统计阳性穿刺部位,另外2名影像科医师(从事前列腺研究时间分别为3年、4年)在不知晓Gleason评分的情况下,参照阳性穿刺部位和T2WI、ADC图低信号区,在b值为1000或1500 s/mm2的原始DWI图像上,围绕全肿瘤病灶逐层手动绘制ROI (图1),避开坏死、钙化和尿道,从而生成单指数和IVIM模型定量参数ADC、D、D*、f的直方图数据10th、25th、50th、75th、90th、mean、min、kurtosis、skewness (图2),并可获取癌灶体素数目,再乘以体素大小可得到癌灶体积size。将所有患者分为低级别组(GS≤3+4)和高级别组(GS≥4+3)。
1.4 统计学方法
采用SPSS 19.0进行统计学分析。单指数和双指数模型定量参数先行正态性和方差齐性检验,与Gleason评分的相关性采用Spearman相关分析。低级别与高级别前列腺癌组间参数比较采用独立样本t检验。采用ROC曲线分析评价各参数对低高级别前列腺癌的鉴别能力。P<0.05为差异具有统计学意义。
2 结果
共纳入57例患者,其中GS≤3+4者23例(占40.35%),GS≥4+3者34例(占59.65%;表1)。T2期占23例,T3a占17例,T3b及T4期占17例。中位年龄66岁,范围53~79岁;中位PSA值为30.188 ng/ml,范围3.389~>1000 ng/ml;MRI检查与前列腺根治术中位时间间隔为12 d,范围0~180 d。
2.1 相关性分析与差异性评价
ADC、D各直方图参数10th、25th、50th、75th、90th、mean、min中,除D的10th、25th外,均与Gleason评分呈负相关(P均<0.05;表2,图3,4),其中90th ADC的相关系数最大。低级别组的ADC、D值均大于高级别组(图5,6)。ADC、D的kurtosis与Gleason评分呈中等正相关(P<0.05),两组间kurtosis值差异有统计学意义(P<0.05)。skewness在两组间差异无统计学意义(表3)。对于所有患者,ADC值均大于相应D值,差异有统计学意义。D*、f各直方图参数与Gleason评分均无相关性(P均>0.05;表2)两组间差异均无统计学意义。肿瘤体积与Gleason评分呈中等正相关(ρ=0.419,P=0.001) (表2),大于90th ADC与Gleason评分的相关性。
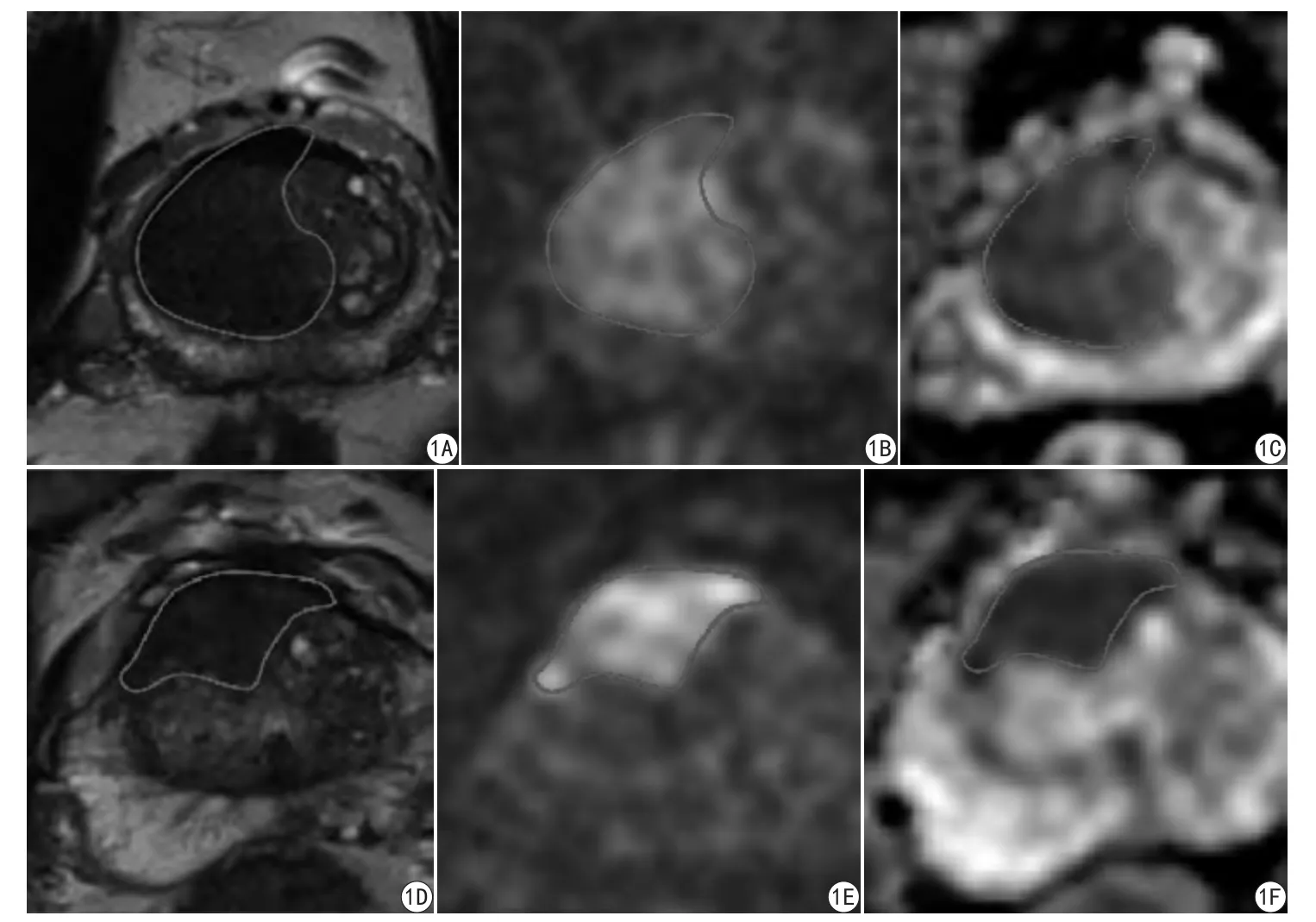
图1 A~C为同一患者,男,64岁,PSA为15.93 ng/ml,GS=3+4;图D~F为另一患者,男,69岁,PSA为24.813 ng/ml,GS=4+3。前列腺癌灶呈T2低信号,DWI (b=1000 s/mm2)高信号,ADC图示相应低信号区;且相比GS=3+4的病灶,GS=4+3病灶的ADC图信号更低Fig. 1 A—C for a patient of 64-year-old, PSA is 15.93 ng/ml, GS=3+4. D-F for another patient of 69-year-old,PSA is 24.813 ng/ml, GS=4+3. The prostate cancer lesions were encircled with freehand ROI (as shown in line). It shows a relatively low signal intensity (SI) on T2-weighted images and a high SI on corresponding DW images and ADC maps (b=1000 s/mm2) in both lesions. The ADCs of both low- and high-GS tumor foci have decreased, but high-GS tumor shows relatively lower ADCs compared to low-GS tumor.
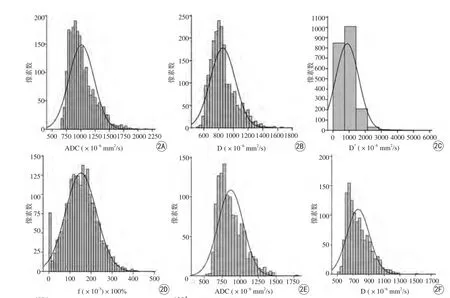
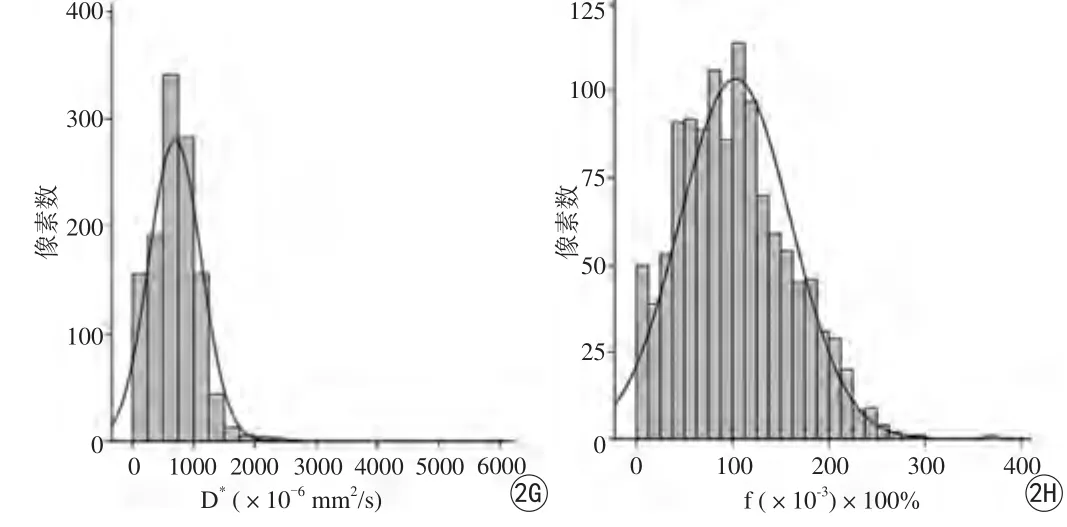
图2 A~D依次为患者的ADC、D、D*和f参数直方图,64岁,GS=3+4,总像素数为2112,均值ADC为1011.80×10-6 mm2/s,均值D为856.24×10-6 mm2/s。E~H为另一患者ADC、D、D*和f参数直方图,69岁,GS=4+3,总像素数为1197,均值ADC为868.57×10-6 mm2/s,均值D为766.24×10-6 mm2/s。与GS 3+3癌灶相比,GS 4+3癌灶的ADC、D直方图参数值整体较低,即高低级别前列腺癌的ADC和D直方图参数有统计学差异。而D*和f直方图参数差异无统计学意义Fig. 2 Histogram of whole-lesion A-D for a patient of 64-year-old, GS=3+4, the total number of pixels is 2112, mean ADC is 1011.80×10-6 mm2/s, mean D is 856.24×10-6 mm2/s . while E-H for another patient of 69-year-old, GS=4+3,the total number of pixels is 1197, mean ADC is 868.57×10-6 mm2/s, mean D is 766.24×10-6 mm2/s. The tumor with GS 4+3 moved left as a whole compared with GS 3+3 tumor foci, showing more pixels at the low ADCs and D histogram parameters, resulting in significant difference between LG- and HG-PCa. But there is no substantial divergence for D* or f histogram parameters between LG-and HG-PCa.
2.2 各参数ROC曲线分析

表1 57例纳入患者的Gleason评分情况Tab. 1 Gleason scores of 57 patients
90th ADC鉴别低高级别前列腺癌的曲线下面积(area under the curve,AUC)大于均值ADC (0.735、0.719,P>0.05);75th D、90th D的AUC大于均值D (P>0.05) (表4)。肿瘤体积(size)鉴别两组的AUC (0.783)最高。但各直方图参数的AUC两两比较,差异均无统计学意义(图7~9)。
3 讨论
近年来,随着定量影像学的发展,IVIM-DWI逐渐应用于临床研究。其计算公式为:S(b)/S0=f·exp(-b·D*)+(1-f)·exp(-b·<D>),其中D代表单纯水分子扩散,D*代表灌注相关扩散,f为灌注分数。通过采集一系列低b值(≤200 s/mm2),利用IVIM曲线拟合可将单纯水分子扩散和灌注相关扩散区分开来[14-15]。有研究称增加低b值数量,可以提高灌注参数的可信度[15]。
3.1 ADC、D、肿瘤体积与Gleason分级的相关性分析
本研究首次综合分析ADC、D各直方图参数10th、25th、50th、75th、90th、mean、min与Gleason评分的相关性及对前列腺癌侵袭性的鉴别能力。以上参数与Gleason分级呈负相关,相关系数(-0.282~-0.411)在以往研究范围内。Gleason评分越高,ADC、D值越低,这可能与恶性肿瘤分化程度不同导致的组织结构和细胞密度差异有关[16]。ADC、D的kurtosis与GS呈正相关(P<0.05),与Zhang等[8]研究结果一致。肿瘤体积与Gleason分级呈正相关,原因可能是肿瘤细胞侵袭性越强,生长速度越快,体积相对越大。skewness是一个三阶统计量,可量化ADC、D直方图相对于均值的对称性[17]。本研究中所有肿瘤的skewness值均大于0,与GS无相关性,这与Donati等[5]观点符合。skewness与Gleason评分的相关性分析受多种因素影响,如b值的选取和分布等[4,11],另外,由于Gleason评分不包含肿瘤细胞的密度、数量或体积信息,欲评价直方图偏度与肿瘤异质性的关系,须选择合适的病理指标为参照,如肿瘤细胞密度,而非GS[5]。

图3 示参数ADC各直方图指标mean、10th、25th、50th、75th、90th均随着GS的增加而减小,整体呈负相关 图4 示参数D各直方图指标mean、10th、25th、50th、75th、90th均随着GS的增加而减小,整体呈负相关 图5 示参数D各直方图指标mean、10th、25th、50th、75th、90th在GS≤3+4与GS≥4+3之间的差异,P均<0.05 图6 示参数D各直方图指标mean、10th、25th、50th、75th、90th在GS≤3+4与GS≥4+3之间的差异,P均<0.05图7 ADC各参数ROC曲线对比 图8 D各参数ROC曲线对比 图9 90th ADC、90th D、mean ADC、mean D、size的ROC曲线对比Fig. 3 Shows that the 10th, 25th, 50th, 75th , 90th of ADC show a negative correlation with GS(P<0.05). Fig. 4 Shows that the 10th, 25th, 50th, 75th , 90th of D show a negative correlation with GS (P<0.05). Fig. 5 Shows that the 10th, 25th, 50th, 75th, 90th of ADC were significantly different between GS≤3+4 and GS≥4+3 (P<0.05). Fig. 6 Shows that the 10th, 25th, 50th,75th , 90th of D were significantly different between GS≤3+4 and GS≥4+3 (P<0.05). Fig. 7 Comparisons of ROC curves of ADC histogram parameters in differentiating tumors with GS≤3+4 from those with GS≥4+3. Fig. 8 Comparisons of ROC curves of D histogram parameters in differentiating tumors with GS≤3+4 from those with GS≥4+3. Fig. 9 Comparisons of ROC curves of 90th ADC、90th D、mean ADC、mean D、size in differentiating tumors with GS≤3+4 from those with GS≥4+3.
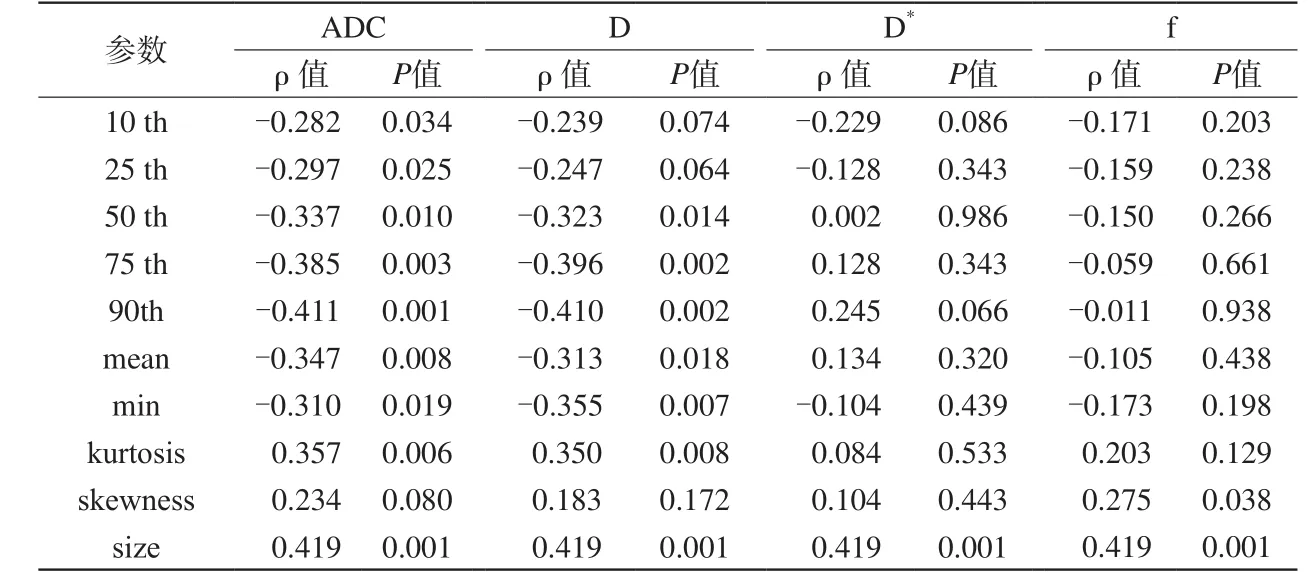
表2 ADC、D、D*、f各直方图参数与GS的Spearman相关性分析Tab. 2 Spearman correlation coefficients for correlation of ADC, D, D* and f histogram parameters with Gleason Score
表3 低级别与高级别前列腺癌组间ADC、D各直方图参数对比(x±s)Tab. 3 Comparison of ADC, D parameters between low grade and high grade prostate cancers
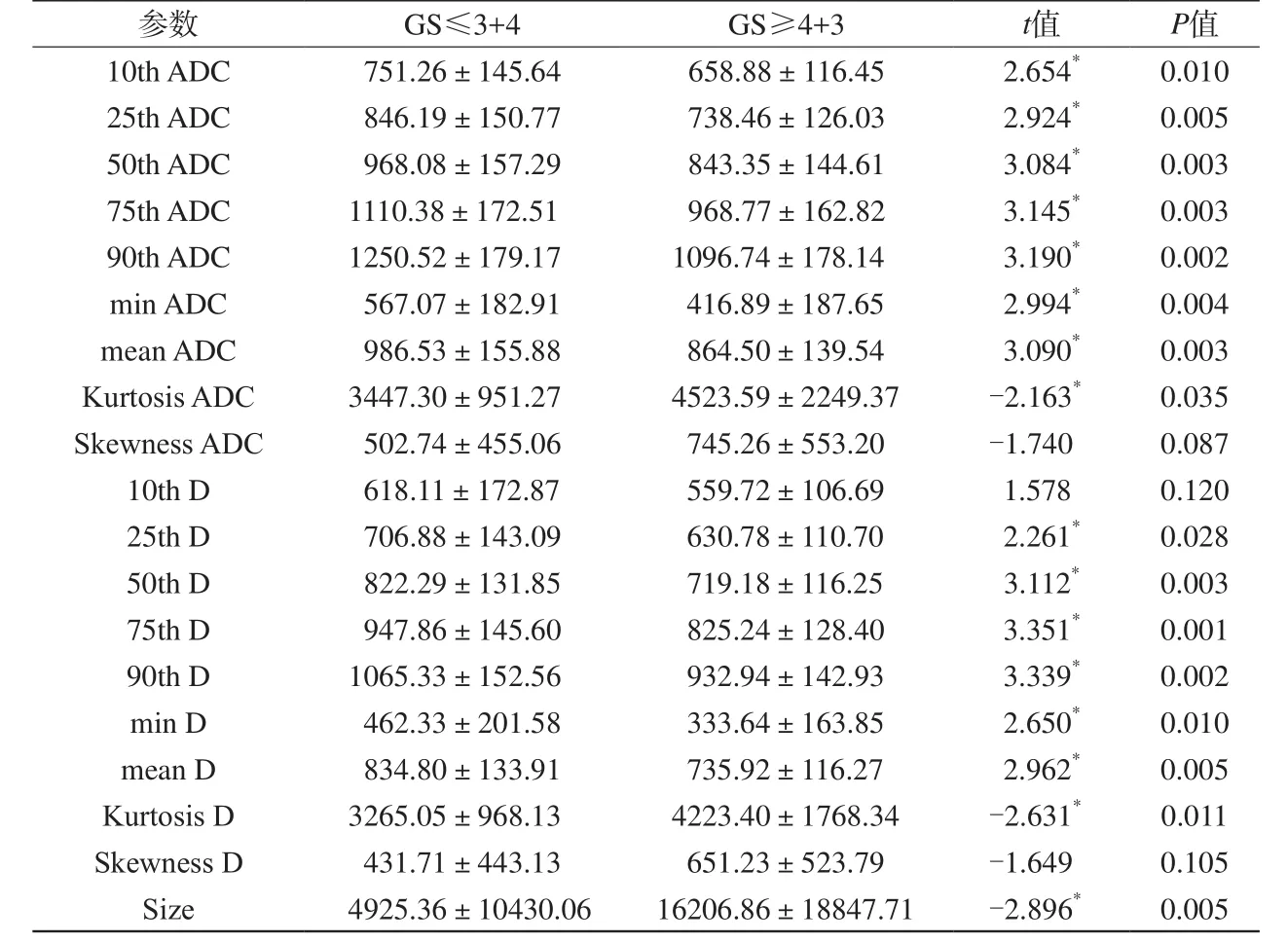
表3 低级别与高级别前列腺癌组间ADC、D各直方图参数对比(x±s)Tab. 3 Comparison of ADC, D parameters between low grade and high grade prostate cancers
注:ADC、D值的单位是×10-6 mm2/s;size指肿瘤体积大小,单位为mm3;*表示差异具有统计学意义,即P≤0.05
参数 GS≤3+4 GS≥4+3 t值 P值10th ADC 751.26±145.64 658.88±116.45 2.654* 0.010 25th ADC 846.19±150.77 738.46±126.03 2.924* 0.005 50th ADC 968.08±157.29 843.35±144.61 3.084* 0.003 75th ADC 1110.38±172.51 968.77±162.82 3.145* 0.003 90th ADC 1250.52±179.17 1096.74±178.14 3.190* 0.002 min ADC 567.07±182.91 416.89±187.65 2.994* 0.004 mean ADC 986.53±155.88 864.50±139.54 3.090* 0.003 Kurtosis ADC 3447.30±951.27 4523.59±2249.37 -2.163* 0.035 Skewness ADC 502.74±455.06 745.26±553.20 -1.740 0.087 10th D 618.11±172.87 559.72±106.69 1.578 0.120 25th D 706.88±143.09 630.78±110.70 2.261* 0.028 50th D 822.29±131.85 719.18±116.25 3.112* 0.003 75th D 947.86±145.60 825.24±128.40 3.351* 0.001 90th D 1065.33±152.56 932.94±142.93 3.339* 0.002 min D 462.33±201.58 333.64±163.85 2.650* 0.010 mean D 834.80±133.91 735.92±116.27 2.962* 0.005 Kurtosis D 3265.05±968.13 4223.40±1768.34 -2.631* 0.011 Skewness D 431.71±443.13 651.23±523.79 -1.649 0.105 Size 4925.36±10430.06 16206.86±18847.71 -2.896* 0.005

表4 ADC各直方图参数鉴别GS≤3+4与GS≥4+3组的ROC曲线对比结果Tab. 4 Comparison of AUC values of ADC, D parameters for differentiating tumor with GS≤3+4 from those with GS≥4+3
3.2 低高级别前列腺癌组间参数差异
本研究癌灶均值ADC为0.91×10-3mm2/s,略低于以往报道(0.93×10-3mm2/s~1.58×10-3mm2/s),可能与场强、b值及所用的数学模型有关[12]。低级别与高级别前列腺癌组间ADC、D值差异有统计学意义,研究结果与Peng等[2]和Hambrock等[7]的一致。ADC参数值均显著大于D值,验证了两种不同扩散的存在[1],证明IVIM模型较单指数模型能够更好地拟合信号衰减,更准确描述癌灶的扩散受限情况。
3.3 ADC、D各参数鉴别低级别与高级别组的ROC曲线分析
ADC、D的10th、25th、50th、75th、90th、mean、min的AUC任意两两比较,差异均无统计学意义,本研究结果与Peng等[2]的一致。因此,笔者认为单指数和IVIM模型DWI直方图数据并未提高对前列腺癌的诊断效能,临床工作中可沿用原来的均值ADC。一些研究认为10th ADC的诊断效能最高[5,9];Pesapane等[1]研究发现只有ADC有统计学差异,而IVIM各参数不能鉴别不同病理分级PCa。另一些研究认为D的mean、中位数和10th的鉴别效能优于ADC[8,13]。以上研究结果不同的原因可能是:(1) ROI选取方法不同,这可能导致读者间差异,且单层面ROI获取的ADC值不能充分反映肿瘤的空间变异,而全肿瘤直方图分析,充分考虑前列腺癌多灶性和异质性的特点,研究表明ADC直方图分析的诊断效能优于单层面ROI[2,8-10]。(2) b值的选取不同,以往IVIM研究中使用的低b值数量较少,如Zhang等[8]使用b值为0、50、150、300、600和900 s/mm2;Wu等[9]使用b值为0、700、1400 s/mm2;本研究所有患者的IVIM扫描参数和设置保持高度一致,共采用14个b值,其中9个b值≤200 s/mm2,希望提高D、D*、f的准确性。(3)前列腺癌异质性明显。癌灶散布于正常组织时会使均值ADC值偏高,而对10th ADC和25th ADC值影响较小,因此后两者更能反映癌灶特征。当癌细胞排列紧密时,ADC直方图很少偏斜和分散,各参数之间的差异较小[5]。(4)以往研究中Gleason评分多为经超声引导下穿刺所得,与本研究根治病理Gleason评分存在差异。
3.4 D*、f对前列腺癌侵袭性的诊断价值
本研究表明D*、f不能预测前列腺癌的侵袭性,这与以往研究结果一致[8,13-15]。本研究中f、D*的10th、25th、50th、90th、mean、min与GS无相关性,其在高低级别前列腺癌之间无统计学差异(P>0.05)。大量文献表明IVIM灌注参数(f和D*)的测量误差较大,可重复性较差[4,11],且对噪声更敏感,在肿瘤区域的变异较大,因而标准差较大;且不同解剖区带前列腺癌的参数值有差异。有研究称双指数模型中低b值的信号衰减不仅来自组织灌注,还包括其他因素如腺体分泌、液体流动[15]。
3.5 本研究的局限性
首先,本研究为单中心回顾性研究,样本较小;其次,仅选取根治病例纳入研究,本研究结果可能不适于更广泛的患者群体,因侵袭性较大的肿瘤往往失去根治时机,如本研究中≤T3a期肿瘤占70.2%,Gleason评分为10者仅有2例。另外,笔者未分别对外周带癌和移行带癌进行评价,有研究表明正常外周带和移行带因组织成分不同,其本身的ADC值存在差异[6]。
总之,单指数和IVIM模型定量参数的分布直方图能直观分析肿瘤异质性,ADC、D对低高级别前列腺癌的诊断效能相当,能够无创预测前列腺癌的侵袭性。D*、f不能鉴别前列腺癌Gleason分级。肿瘤体积有望成为前列腺癌侵袭性的良好预测因子。
[References]
[1] Pesapane F, Patella F, Fumarola EM, et al. Intravoxel incoherent motion (IVIM) diffusion weighted Imaging (DWI) in the perifericprostate cancer detection and stratification. Med Oncol,2017, 34(3): 35.
[2] Peng Y, Jiang Y, Yang C, et al. Quantitative analysis of multiparametric prostate MR images: differentiation between prostate cancer and normal tissue and correlationwith Gleason score:a computer-aided diagnosis development study. Radiology, 2013,267(3): 787-796.
[3] Cooperberg MR, Pasta DJ, Elkin EP, et al. The university of california, san francisco cancer of the prostate risk assessment score:a straightforward and reliable preoperative predictor ofdisease recurrence after radical prostatectomy. J Urol, 2005, 173(6): 1938-1942.
[4] Merisaari H, Jambor I. Optimization of b-value distribution for four mathematical models of prostate cancer diffusion-weighted imaging using b values up to 2000 s/mm (2): simulation and repeatability study. Magn Reson Med, 2015, 73(5): 1954-1969.
[5] Donati OF, Mazaheri Y, Afaq A, et al. Prostate cancer aggressiveness:assessment with whole-lesion histogramanalysis of the apparent diffusion coefficient. Radiology, 2014, 271(1): 143-152.
[6] Kobus T, Vos PC, Hambrock T, et al. Prostate cancer aggressiveness:in vivo assessment of MR spectroscopy and diffusion-weighted imaging at 3 T. Radiology, 2012, 265(2): 457-467.
[7] Hambrock T, Somford DM, Huisman HJ, et al. Relationship between apparent diffusion coefficients at 3.0-T MR imaging and Gleason grade in peripheral zone prostatecancer. Radiology, 2011, 259(2):453-461.
[8] Zhang YD, Wang Q, Wu CJ, et al. Thehistogram analysis of diffusion-weighted intravoxel incoherent motion (IVIM) imaging for differentiating the gleason grade of prostate cancer. Eur Radiol,2015, 25(4): 994-1004.
[9] Wu CJ, Wang Q, Li H, et al. DWI-associatedentire-tumor histogram analysis for the differentiation of low-grade prostatecancer fromintermediate-high-gradeprostate cancer. Abdom Imaging, 2015,40(8): 3214-3221.
[10] Zhang D, Wu T, Shi CZ, et al. The reproducibility of IVIM-DWI in normal prostate and age-related analysis. Chin J Magn Reson Imaging, 2015, 6(11): 848-854.张冬, 吴婷, 史长征, 等. 正常前列腺组织IVIM-DWI的可重现性研究及年龄相关性分析. 磁共振成像, 2015, 6(11): 848-854.
[11] Toivonen J, Merisaari H, Pesola M, et al. Mathematical models for diffusion-weighted imaging of prostatecancer using b values up to 2000 s/mm (2): correlation with Gleason score andrepeatability of region of interest analysis. Magn Reson Med, 2015, 74(4):1116-1124.
[12] Vargas HA, Akin O, Franiel T, et al. Diffusion-weighted endorectal MR imaging at 3 T for prostate cancer:tumor detection and assessment of aggressiveness. Radiology, 2011, 259(3): 775-784.
[13] Valerio M, Zini C, Fierro D, et al. 3 T multiparametric MRI of the prostate: Does intravoxel incoherent motion diffusion imaging have a role in the detection and stratification of prostate cancer in the peripheral zone? Eur J Radiol, 2016, 85(4): 790-794.
[14] Wan HY, Bi YQ, Yi Y, et al. Investigation of prostate cancer using intravoxel incoherent motion MR imaging. Chin J Magn Reson Imaging, 2015, 6(6): 445-449.万红燕, 毕芸祺, 衣岩, 等. 基于体素内不相干运动的MR扩散加权成像对前列腺癌诊断价值的初步研究. 磁共振成像, 2015, 6(6):445-449.
[15] Wu WQ, Niu JL. Applications of intravoxel incoherent motion diffusion weighted imaging in tumor diagnosis. Chin J Radiol, 2016,50(7): 553-555.武文奇,牛金亮. 基于体素内不相干运动的扩散加权成像在肿瘤诊断中的研究进展. 中华放射学杂志, 2016, 50(7): 553-555.
[16] Min XD, Wang L, Feng ZY, et al. Prostate cancer: the correlation between apparent diffusion coefficient values obtained from high resolution diffusion-weighted imaging and Gleason scores. Chin J Radiol, 2016, 49(3): 191-194.闵祥德, 王良, 冯朝燕, 等. 高分辨率扩散加权成像表观扩散系数与前列腺癌Gleason评分的相关性. 中华放射学杂志, 2015, 49(3):191-194.
[17] Turkbey B, Shah VP, Pang Y, et al. Isapparent diffusion coefficient associated with clinical risk scores for prostate cancers that are visible on 3-T MR images? Radiology, 2011, 258(2): 488-495.

