MR体素内不相干运动扩散加权成像评估慢性乙型病毒性肝炎肝纤维化程度的价值研究
李超,朱绍成,张单霞,管枢
我国是慢性乙型病毒性肝炎高发地区,国人乙型肝炎病毒携带者约占总人口的10%,且发病率还有逐年上升的趋势[1]。慢性乙型病毒性肝炎是造成肝纤维化的主要原因,如果不进行有效治疗,肝纤维化将最终进展为不可逆转的肝硬化,长期抗病毒治疗可以使慢乙肝患者的肝纤维化减轻,甚至逆转[2]。
目前,肝脏穿刺活检仍是肝纤维化程度评价的金标准,但是肝穿活检为有创性检查,存在很多弊端。Le Bihan等[3]于1986年首次提出了体素内不相干运动(intravoxel incoherent motion,IVIM)的理论,通过应用双指数模型,IVIM可区分组织中水分子布朗运动的扩散信号与毛细血管微循环形成的灌注信号,从而更好地描述生物组织、器官内复杂的信号衰减方式,因此,IVIM成像能更加准确地诊断与评价肝纤维化程度。笔者拟探讨磁共振IVIM成像技术定量评估慢性乙型病毒性肝炎肝纤维化的价值。
1 材料与方法
1.1 一般材料
肝纤维化组 :选择2016年1月至2017年3月在河南省人民医院经肝穿病理检查的慢性乙肝(包括:慢纤肝、慢活肝;隐匿性慢肝)患者55例,其中男31例,女24例,年龄21~53岁,平均年龄36.4岁,均符合2015年慢性乙型肝炎防治指南的诊断标准[4]。排除标准:(1)甲、丙、丁、戊型肝炎病毒重叠感染者;合并巨细胞病毒、人类疱疹病毒、HIV感染者;(2)药物性、免疫性及酒精性肝病患者;(3)超声或CT发现有肝内占位病变(不包括直径小于1.5 cm的囊肿或血管瘤);(4)合并门静脉栓塞或门静脉海绵样变;(5)患者难以配合,图像质量不佳而无法评估者。
正常对照组20例,其中男12例,女8例,年龄22~61岁,平均年龄38.5岁。纳入标准:(1)无长期酗酒史;(2)病毒性肝炎相关血清学标志物阴性;(3)影像学检查肝实质大致正常(可有直径小于1.5 cm的囊肿或血管瘤);(4)近期无药物治疗史;(5)无肝脏手术及脾脏切除史;(6)可配合完成磁共振检查。
所有患者及志愿者均签署知情同意书,并经过院伦理委员会批准。
1.2 病理学检查及分析
MR扫描当天行肝脏穿刺活检,肝穿方法为B超引导下从肝右后叶利用16 G Angitech穿剌针及配套穿刺枪行肝组织穿剌活检,所取肝脏组织长度为1.5~2.0 cm。将肝穿病理切片进行常规HE染色、Masson染色、网染、D-PAS染色及免疫组化分析等,由2名具有10年以上工作经验的病理科医师讨论得出病理结果。根据Scheuer[5]分期法分为S0~S4共5期,其中S0期5例、S1期16例、S2期13例、S3期10例、S4期11例;将S0期、S1期归为无和轻度肝纤维化组,S2期、S3期为中度肝纤维化组,S4期为重度肝纤维化组。
1.3 MRI检查方法
采用3.0 T超导磁共振仪(Discovery MR750,GE Healthcare,USA),8通道相控阵腹部表面线圈,腹部绑定弹性呼吸门控,进行呼吸触发。先行轴面T1WI、T2WI-FS、冠状面T2WI-FS扫描,初步观察肝脏有无形态改变及排除肝内占位,然后行IVIM-DWI扫描,扫描范围从膈顶至肝下缘,其扫描参数如下,轴面T1WI:TR 180 ms,TE 2.1 ms,矩阵320×192,FOV 360 mm×360 mm,层厚7 mm,层间距1 mm,层数24,激励次数1;轴面压脂T2WI:TR 7500 ms,TE 81.1 ms,矩阵320×320,FOV 360 mm×360 mm,层厚7 mm,层间距1 mm,层数24,激励次数2;冠状面压脂T2WI:TR 2000 ms,TE 68 ms,矩阵320×288,FOV 400 mm×360 mm,层厚5 mm,层间距1 mm,层数25;轴面IVIM-DWI:TR 3520 ms,TE 73.3 ms,矩阵128×128,FOV 360 mm×288 mm,层厚5 mm,层间距1 mm,层数21,激励次数2,b值数量13,分别为0、50、75、100、150、200、400、600、800、1000、1500、2000、2500 s/mm2。
1.4 磁共振图像分析
扫描结束后,将扫描数据传输到GE ADW 4.5后处理工作站,使用functool软件分析IVIM所得数据(图1)。对照B超引导下肝组织穿刺部位的图像,选取肝右后叶下段连续3个扫描层面,于重建图上确定感兴趣区(region of interest,ROI),避开大血管、胆管及伪影,每层面取3个ROI,面积约150 mm2,3个层面共9个ROI,测量后取平均值分别得到标准表观弥散系数(standard apparent diffusion coefficient,sADC)、快速ADC(fast ADC)、慢速ADC (slow ADC)、快速ADC/总ADC的比例(fraction ADC,fra ADC)。其中,将b值<200 s/mm2定义为低b值;b值>200 s/mm2定义为高b值。标准ADC为所有b值的平均ADC值,即sADC;快速ADC值为低b值的平均ADC值,即D*;慢速ADC值为高b值的平均ADC值,即D;fra ADC值为低b值ADC值在全部扩散效应所占比例,即f。
1.5 统计学分析
使用SPSS 19.0统计软件对相关数据进行统计学分析。所有受检者的肝脏sADC、D*、D及f值均用x±s表示。采用t检验比较正常对照组与肝纤维化组之间IVIM参数值的差别,采用单因素方差分析和Bonferroni校正检验对不同纤维化组间的IVIM参数值进行比较,不满足方差齐性的采用Brown-Forsythe分析,两两比较采用Dunnett’sT3分析。采用Spearman相关性检验分析肝纤维化分组与IVIM参数值之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 正常对照组与肝纤维化组之间各参数的比较
D、D*及f值在正常对照组与肝纤维化组之间均有统计学意义,且肝纤维化组的D、D*、f均较对照组降低,而sADC在正常对照组与肝纤维化组之间无统计学意义(表1)。
2.2 肝纤维化各组间参数值的比较
随着肝纤维化程度加重,D、D*、f值均有逐渐下降的趋势,但sADC的差异尚不具有统计学意义。D*及f值各组间均有统计学意义。D值在无和轻度肝纤维化组与中度肝纤维化组、无和轻度肝纤维化组与重度肝纤维化组之间有统计学意义,但在中度肝纤维化组与重度肝纤维化组之间无统计学意义(表2)。
2.3 肝纤维化分组与各参数之间的相关性分析
sADC值与纤维化分组无相关性,D*、f值与纤维化分组存在中等负相关,D值与纤维化分组存在较强负相关(表3)。
3 讨论
磁共振扩散加权成像是目前唯一能无创检测活体组织水分子扩散运动的技术,但单指数模型得出的表观弥散系数并不能真实反映活体组织内水分子扩散,它同时也受血流灌注的影响[6]。IVIM使用双指数模型,可以获得sADC、D、D*和f等参数,进而量化水分子扩散和血流灌注两种成分。其中,D代表体素内不相关运动水分子扩散的参数,D*代表体素内不相关运动微循环扩散的参数,f代表和微循环有关的扩散所占比例。当采用低b值(b<200 s/mm2)时,所得ADC值更多地体现了组织内血流灌注信息,而采用高b值(b>200 s/mm2)时, ADC值更多地反映了组织内水分子的扩散信息。近来,超声弹性成像FibroScan已用于肝纤维化检测,然而不适于腹腔积液、肋间隙较窄和过度肥胖的患者[7]。MRE在诊断肝纤维化方面具有优势,Kim等[8]认为以肝脏硬度值5.32 kpa为阈值时,MRE能够鉴别严重纤维化和肝硬化,但扫描时间长,且需要专用的昂贵设备。有学者研究认为DWI多b值水通道蛋白(water channel protein,WCP)分子成像三指数模型获得的ADC值在肝纤维化分期中有重要价值[9]。研究报道扩散加权成像(diffusion weighted imaging,DWI)ADC值降低提示肝纤维化的可能[10]。磁共振扩散峰度成像(diffusion kurtosis imaging,DKI)是扩散加权成像的扩展,是探测水分子扩散非高斯分布的方法,其参数Dapp和Kapp分别与肝纤维化程度呈负相关、正相关,但敏感性较低[11]。在区分肝纤维化程度效能上,多个研究认为扩散张量成像(diffusion tensor imaging,DTI)重建获得的ADC值不如DWI的ADC值[12-13]。IVIM-DWI最初应用于中枢神经系统疾病的研究[14]。近来,随着磁共振技术发展,利用IVIM研究弥漫性肝脏疾病成为一个热点。
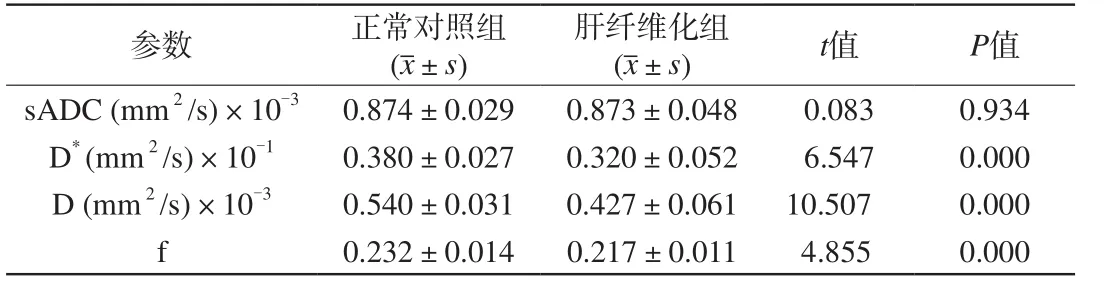
表1 正常对照组与肝纤维化组的t检验分析Tab. 1 t analysis between normal control group and liver fibrosis group
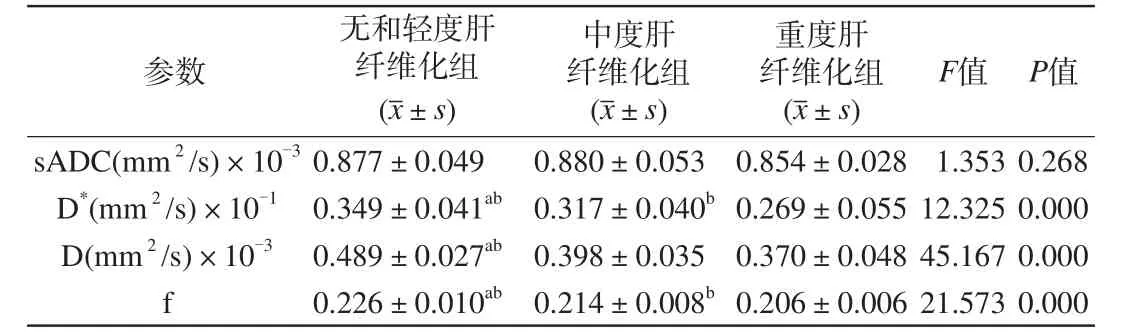
表2 肝纤维化各组间相关参数方差分析Tab. 2 The results of variance analysis of related parameters of liverfibrosis

表3 肝纤维化分组与各参数之间的相关性Tab. 3 The correlation between liver fibrosis grouping and the parameters of magnetic resonance imaging
虽然较多研究认为肝纤维化时ADC值降低,但下降原因存在争议[15-17]。有研究认为,HBV感染肝细胞后,肝细胞膜上表达的HBc Ag等成为诱发细胞免疫反应的靶抗原,从而导致机体特异性细胞毒性T淋巴细胞等攻击肝内主要靶抗原[18-20]。HBV复制产生转化生长因子-β1(TGF-β1)、血小板源性生长因子等细胞因子引起肝细胞损伤、坏死、凋亡,同时被激活分泌的多种细胞因子、脂质过氧化物等共同作用于肝星状细胞,使之激活转变为肌纤维母细胞,合成大量的胶原、蛋白多糖等细胞外基质(extracellular matrixc,ECM),ECM成分沉积和降解失衡,继续进展则成为肝硬化,甚至诱发肝癌。肝内过量的纤维结缔组织形成屏障,使肝内的扩散及灌注运动均受到影响,导致ADC值减小。同时,有学者认为ADC不能充分区分肝纤维化程度[21-24],与本研究结论接近。病理分期标准和ROI测量位置方法不同、病变在全肝分布不均匀、b值的大小数量和小b值所占比例不同及样本量有限可能是其原因,另外ADC值也受肝内脂肪、铁沉积的影响[23]。

图1 慢乙肝患者(S2期)磁共振图像。A:轴面压脂T2WI;B:IVIM图;C:sADC伪彩图;D:D*伪彩图;E:D伪彩图;F:f伪彩图Fig. 1 MR images of one patient with chronic hepatitis B (stage S2). A: AX T2WI-FS image. B: IVIM map. C: sADC map. D: D* map. E: D map. F: f map.
乙肝引起的纤维化首先发生在汇管区,这与汇管区的炎症引起淋巴细胞及浆细胞浸润有关。随着肝纤维化程度加重,炎性反应刺激组织修复,间质纤维结缔组织增生沉积,肝细胞内外屏障性结构改变,水分子自由扩散受限,从而D值趋于降低。有研究证实HBs能够直接刺激人肝星状细胞增殖,并且通过肝细胞产生TGF-β1的作用,生成I型胶原蛋白[25],这解释了乙肝相关蛋白在乙肝肝纤维化演变过程的机制。本研究结果显示D值在正常对照组与肝纤维化组间的差异有统计学意义,这与曾政等[26]的报道一致。D与肝纤维化程度具有较强相关性,也符合肝纤维化病理进展过程。
本研究结果也显示,D*、f值在不同程度肝纤维化组间差异有统计学意义,并均与肝纤维化分组呈中度负相关,与Lu等[27]和Patel等[28]的研究结果接近。在乙肝肝纤维化进程中,肝动脉增加的血流量不足以完全抵消门静脉减少的血流量,使肝脏的血液灌注减少。乙肝病毒可对肝窦内皮细胞产生影响,窦细胞膜抗原表达改变,进而细胞肿大,窦腔狭窄变形,筛孔减少,影响肝内微循环[29],动脉血流量下降,导致D*值降低,f亦下降。HBV导致肝脏不同程度的脂肪浸润变性也影响肝内血流灌注。另外,乙肝病毒DNA持续高水平复制与肝脏中重度纤维化具有一定相关性,说明乙肝病毒可以促进肝纤维化进展[30]。
肝纤维化的原因众多。慢丙肝的D和f值可以区分正常肝和纤维化肝,D*在纤维化肝中反而增高[31]。自身免疫性肝病中,原发性胆汁性胆管炎的ADC值随着肝纤维化分期进展而下降,并可以区分不同程度肝纤维化[32]。非酒精性脂肪性肝病的D、D*和f值均较正常组下降,但D*和f值不能区分中、重度病变[33]。药物性肝纤维化的ADC不能准确评估肝纤维化分期,需要结合临床检查[34]。
本研究存在一些局限性,如本研究所得数据主要通过测量肝右后叶得出,并未完全反映全肝的病理生理特征、样本量有限。今后收集更大样本,并尝试开展结合Fibroscan、MRE、肝门静脉径线测量等综合研究,以得到更客观、全面的结果。
综上所述,IVIM-DWI序列获得的定量参数D、D*以及f值,可在一定程度上反映肝脏组织病理生理状态。D、D*、f值随乙肝肝纤维化程度加重而呈现下降的趋势,IVIM-DWI序列在乙肝肝纤维化的诊断和分期中具有一定临床价值,可以作为常规MRI的补充,为临床诊疗提供更多信息。
[References]
[1] Sandrascgaran K, Tahir B, Patel A, et al. The usefulness of diffusionweighted imaging in the characterization of liver lesions in patients with cirrhosis. Clin Radiol, 2013, 68(7): 708-715.
[2] Deng QH, Ruan JY, Jiang JZ, et al. Assessment of diffusion-weighted imaging in staging liver fibrosis in rabbits. Chin J Magn Reson Imaging, 2015, 6(6): 467-470.邓乾华, 阮继银, 江锦赵, 等. 磁共振扩散加权成像在家兔肝纤维化分期的诊断价值. 磁共振成像, 2015, 6(6): 467-470.
[3] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging.Radiology, 1988, 168(2): 497-505.
[4] Hepatology association of Chinese medical association, infectious diseases association of Chinese medical association. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update. J Clin Hepatol, 2015, 31(12): 1941-1960.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版).临床肝胆病杂志, 2015, 31(12):1941-1960.
[5] Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment. J Hepatol, 1991, 13(3): 372-374.
[6] Chow AM, Gao DS, Fan SJ, et al. Liver fibrosis:an intravoxel incoherent motion (IVIM) study. J Magn Reson Imaging, 2012,36(1): 159-167.
[7] Huseyin O, Firat K, Ozan K, et al. Diffusion Weighted MRI for Hepatic Fibrosis: impact of b-Value. Iran J Radiol, 2014,11(1): e3555.
[8] Kim BH, Lee JM, Lee YJ, et al. MR elastography for noninvasive assessment of hepatic fibrosis: experience from a tertiary center in Asia. J Magn Reson Imaging, 2011, 34(5): 1110-1116.
[9] Li QJ, Li JH, Zhao ZS, et al. Assessment of aquaporins function of early-stage liver fibrosis using multi-b diffusion weighted magnetic resonance imaging. J Chin Clin Med Imaging, 2014, 25(10):719-723.李秋菊, 李加慧, 赵周社, 等. DWI多b值水通道蛋白分子成像在肝纤维化早期诊断的价值. 中国临床医学影像杂志, 2014, 25(10):719-723.
[10] Annet L, Peeters F, Abarca-Quinones J, et al. Assessment of diffusion-weighted MR imaging in liver fibrosis. J Magn Reson Imaging, 2007, 25(1): 122-128.
[11] Hu GW, Quan XY, Lin XY, et al. Application of mono-exponential ADC values and MR diffusion kurtosis imaging for liver fibrosis in rat models. Chin J Med Imaging Technol, 2015, 31(4): 493-497.胡根文, 全显跃, 林小影, 等. 磁共振单指数ADC值及扩散峰度成像在大鼠肝纤维化模型中的应用. 中国医学影像技术, 2015,31(4): 493-497.
[12] Taouli B, Chouli M, Martin AJ, et al. Chronic hepatitis: role of diffusion-weighted imaging and diffusion tensor imaging for the diagnosis of liver fibrosis and inflammation. J Magn Reson Imaging,2008, 28(1): 89-95.
[13] Tosun M, Inan N, Sarisoy HT, et al. Diagnostic performance of conventional diffusion weighted imaging and diffusion tensor imaging for the liver fibrosis and inflammation. Eur J Radiol,2013(82): 203-207.
[14] Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology, 1986,161(2): 401-407.
[15] Aubé C. Imaging modalities for the diagnosis of hepatic fibrosis and Cirrhosis. Clin Res Hepatol Gastroenterol, 2015, 39(1): 38-44.
[16] Taouli B, Koh DM. Diffusion-weighted MR imaging of the liver.Radiology, 2010, 254(1): 47-66.
[17] Vaziri-Bozorg SM, Ghasemi-Esfe AR, Khalilzadeh O, et al.Diffusion-weighted magnetic resonance imaging for diagnosis of liver fibrosis and inflammation in chronic viral hepatitis: the performance of low or high b values and small or large regions of interest. Can Assoc Radiol J, 2012, 63(4): 304-311.
[18] Yoon JH, Lee JM, Baek JH, et al. Evaluation of hepatic fibrosis using intravoxel incoherent motion in diffusion-weighted liver MRI.J Comput Assist Tomogr, 2014, 38(1): 110-116.
[19] Zhao F, Yuan J, Deng M, et al. Further exploration of MRI techniques for liver T1rho quantification. Quant Imaging Med Surg, 2013, 3(6):308-315.
[20] Ellis EL, Mann DA. Clinical evidence for the regression of liverfibrosis. J Hepatol, 2012, 56(5): 1171-1180.
[21] Koinuma M, Ohashi I, Hanafusa K, et al. Apparent diffusion coefficient measurements with diffusion-weighted magnetic resonance imaging for evaluation of hepatic fibrosis. J Magn Reson Imaging, 2005, 22(1): 80-85.
[22] Boulanger Y, Amara M, Lepanto L, et al. Diffusion-weighted MR imaging of the liver of hepatitis C patients. NMR Biomed, 2003,16(3): 132-136.
[23] Robin B, Birger M, Peter M, et al. Diffusion-weighted magnetic resonance imaging for staging liver fibrosis is less reliable in the presence of fat and iron. Eur Radiol, 2013, 23(5): 1281-1287.
[24] FrancM, Luis Martı-Bonmati L, Alberich-Bayarri A, et al. Evaluation of fibrosis and inflammation in diffuse liver diseases using intravoxel incoherent motion diffusion-weighted MR Imaging. Abdom Radiol,2017, 42(2): 468-477.
[25] Liang Z, Liu GT, Lan BZ, et al. New progress in the pathogenesis of hepatitis B related liver fibrosis. Popular Science Technol, 2015,17(194): 78-80.梁真, 刘钢涛, 蓝柏钊,等. 乙肝相关肝纤维化发病机制研究新进展. 大众科技, 2015, 17(194): 78-80.
[26] Zeng Z, Lu PX, Huang H. Intravoxel incoherent motion MR imaging in the diagnosis of liver fibrosis: a preliminary study. Radiol Practice,2015, 30(7): 775-778.曾政, 陆普选, 黄华. 磁共振体素内不相干运动成像诊断肝纤维化的初步研究. 放射学实践, 2015, 30(7): 775-778.
[27] Lu PX, Huang H, Yuan J, et al. Decreases in molecular diffusion,perfusion fraction and perfusion-related diffusion in fibrotic livers: a prospective clinical intravoxel incoherent motion MR imaging Study.Plos one, 2014, 9(12): e113846.
[28] Patel J, Sigmund EE, Rusinek H, et al. Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrastenhanced MRI alone and in combination: preliminary experience. J Magn Reson Imaging, 2010, 31(3): 589-600.
[29] Zhang SS, Lü WL, Zhang X, et al. Research advances of the pathogenesis of hepatic fibrosis. J Zhejiang University Traditional Chin Med, 2011, 35(5): 797-802.张莎莎, 吕文良, 张旭, 等. 肝纤维化的发病机制研究进展. 浙江中医药大学学报. 2011, 35(5): 797-802.
[30] Seto WK, Lai CL, Ip PP, et al. A large population histology study showing the lack of associationg between ALT elevation and significant fibrosis in chronic hepatitis B. Plos One, 2012, 7(2):e32622.
[31] Dyvorne HA, Galea N, Nevers T, et al. Diffusion-weighted imaging of the liver with multiple b values: effect of diffusion gradient polarity and breathing acquisition on image quality and intravoxel incoherent motion parameters: a pilot study. Radiology, 2013, 266(3):920-929.
[32] Kovac JD, Jesic R, Stanisavljevic D, et al. Integrative role of MRI in the evaluation of primary biliary cirrhosis. Eur Radiol, 2012, 22(3): 688-694.[33] Deng Y, Liang CH, WU XM, et al. Intravoxel incoherent motion diffusion weighted imaging in diagnosis of nonalcoholic fatty liver disease of rabbits. Chin J Med Imaging Technol, 2016, 32(7):1000-1004.邓宇, 梁长虹, 伍筱梅, 等. 体素内不相干运动磁共振扩散加权成像诊断兔非酒精性脂肪肝病. 中国医学影像技术, 2016, 32(7):1000-1004.
[34] Guan S, Zhou KR, Zhao WD, et al. Magnetic resonance diffusionweighted imaging in the diagnosis of diffuse liver diseases in rats.Chin Med J, 2005, 118(8): 639-644.

