超临界溶液浸渍法制备载药多孔微球用于肺部吸入式给药
唐 川
(大连大学 生命科学与技术学院,辽宁 大连 116622)
药物疗效的发挥,不仅依赖于药物的成分及药物的含量,同时也受到给药系统的影响[1]。传统的给药途径如口服给药,胃酸会破坏大部分蛋白质或多肽类药物的结构;而静脉注射给药则是一种侵入式给药途径,病人顺应性低。肺部由于比表面积大、毛细血管丰富等特点,成为理想的给药部位,肺部吸入式给药也成为给药途径研究领域的热点之一。已有的研究表明,蛋白质药物经肺部给药,药效发挥迅速且药代动力学可重复性好[2]。但肺部吸入式给药也有一定的局限,比如要求颗粒的空气动力学粒径在一定范围内(1~5 μm),否则不能进入肺部达到给药效果。实心药物颗粒的空气动力学粒径基本和几何粒径相同,1~5 μm的实心颗粒虽然可以到达肺部深处,但会被巨噬细胞吞噬(巨噬细胞可吞噬大约1~5 μm几何粒径的颗粒),因此只有颗粒的空气动力学粒径在 1~5 μm之间,而几何粒径不在1~5 μm之间才能满足肺部吸入式给药要求。多孔微球由于其密度较同材料实心微球小,因此其空气动力学粒径与实心微球不相同,采用多孔微球作为药物载体可实现肺部给药,并且避免被巨噬细胞吞噬。但如何在保证药物活性的同时,将药物负载到多孔微球中,制备粒径满足肺部吸入式给药要求的微粒是亟待解决的问题。
超临界溶液浸渍法(supercritical solution impregnation, SSI)是一种将小分子物质负载到聚合物中的过程技术,主要是利用超临界流体高扩散系数、低黏度及其对聚合物的溶胀作用[3]。自1986年Sand[4]使用超临界溶液浸渍(supercritical solution impregnation, SSI)制备得到含药物成分的聚合物以来,SSI被认为在药物制备领域具有广阔的应用前景。SSI过程制备药物具有如下几种显著优势:(1)操作条件温和;(2)产品有机溶剂残留量低;(3)药物在基质中均匀分布,可有效避免释药过程中的突释现象,可达到缓控释给药的目的[5,6];(4)基质制备过程与药物负载过程分开进行,载体多样,不受载药过程制约[7]。
本文以生物相容性材料聚乳酸(PLLA)为材料制成多孔微球,以地塞米松为模型药物,采用 SSI法将药物负载至多孔微球中制备载药多孔微球。考察载药多孔微球的载药量、形貌、空气动力学粒径以及释放行为等,探索载药聚乳酸多孔微球在肺部吸入式给药中的应用。
1 材料与方法
1.1 实验材料
左旋聚乳酸(PLLA),分子量 11 kDa;二氧化碳,纯度99.9%;地塞米松,纯度大于98%;泊洛沙姆F-127,纯度大于98%;聚乙烯醇,AH-26;无水乙醇、二氯甲烷,分析纯。
1.2 实验仪器
紫外可见分光光度计,型号Ultraspec 3320 pro;动力学粒径谱仪,型号 APS-3321;高速分散器,型号 XHF-D;恒温水浴槽,型号 DF-101S;真空干燥箱,型号DZF-6050;循环水式真空泵,型号SHB。
1.3 PLLA多孔微球的制备
本研究使用泊洛沙姆作为多孔微球的致孔剂,采用乳液-溶剂挥发法制备PLLA多孔微球。实验步骤如下:(1)将泊洛沙姆与PLLA溶于二氯甲烷中形成泊洛沙姆与PLLA质量比为3:7,总聚合物浓度为3%的溶液。(2)将配制好的聚合物溶液加入到浓度为1%的聚乙烯醇水溶液中,使用高速分散器在 3000 rpm下分散3 min,形成均一乳液。(3)乳液置于30℃恒温水浴槽中,200 rpm条件下搅拌5 h以挥发除去二氯甲烷。(4)待PLLA 多孔微球固化后,8000 rpm离心5 min收集得到PLLA多孔微球,并用去离子水清洗三次,以除去多孔微球表面的聚乙烯醇,干燥得到PLLA多孔微球。
1.4 载药PLLA多孔微球的制备
采用超临界流体装置,通过SSI将地塞米松负载于PLLA多孔微球,实验装置及流程如图1所示[8]。具体流程如下:在高压釜的顶部放置并固定盛放有PLLA多孔微球的滤纸,在高压釜的底部放置盛有过量地塞米松的滤纸。地塞米松与PLLA多孔微球分开放置,避免两者的直接接触和混合。启动设备,CO2经钢瓶流出,冷却成为液体,经高压泵加压后在40℃进行预热后进入高压釜,设定搅拌器转速 60 rpm,高压釜内压力15 MPa、温度40 ℃,并保持一段时间。实验结束后关闭钢瓶、高压泵,打开泄压阀卸去高压,得到载药PLLA多孔微球,保存供后续检测。
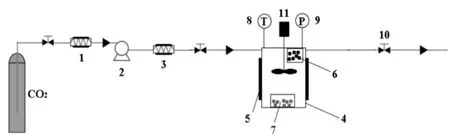
图1 超临界溶液浸渍法实验流程图
1.5 PLLA 多孔微球载药量测定
采用紫外分光光度计对载药多孔微球载药量进行测定。实验步骤如下:称取25 mg PLLA载药多孔微球样品,加入2.5 mL二氯甲烷将样品完全溶解;挥发除去二氯甲烷,再加入2.5 mL无水乙醇萃取出样品中的药物;8000 rpm离心5 min,上清液在240 nm处测定吸光值,根据地塞米松标准曲线计算得到地塞米松质量,根据式1计算得到样品的载药量(DLC),即药物质量与聚合物质量之比。

1.6 载药 PLLA 多孔微球的表征
采用扫描电子显微镜(SEM)观察载药多孔微球形貌。取少量样品使用导电胶将其固定置于铜台上,将多余的未被固定的样品除去,真空下喷金1 min,然后在SEM下对样品的形貌进行观察并拍摄图片。利用Image-pro plus软件对样品的扫描电子显微镜图片进行分析,获得微球的平均粒径。
使用空气动力学粒径谱仪测定 PLLA多孔微球的空气动力学粒径。空气动力学粒径谱仪可测定空气动力学直径为0.5~20 μm之间的颗粒。实验设定进气量5 L/min,分别测定空白多孔微球和浸渍后多孔微球空气动力学粒径,并定义可吸入比为空气动力学直径在1~5 μm之间的颗粒。
1.7 载药多孔微球的体外释放行为
载药多孔微球的释放行为通过体外释放实验进行考察。37℃条件下,称取约25 mg载药多孔微球样品置于离心管中,加入4 mL 磷酸缓冲液(0.05 M,pH7.4),在一定的时间间隔进行取样。取样时,5000 rpm离心 5 min,取上清液2 mL,同时补加磷酸缓冲液2 mL,分散后继续进行释放实验,样品在240 nm处测量吸光度。按照标准曲线可得地塞米松质量,计算得到载药PLLA多孔微球在体外的释放曲线。
2 结果与讨论
肺部吸入式给药系统不仅要求药物微粒空气动力学粒径处于1~5 μm之间,而几何粒径不处于1~5 μm之间,同时还要求多孔微粒具有一定载药量,并能够以一定速率释放药物,因此本文对载药多孔微球的载药量、形貌、空气动力学粒径、释放行为进行了研究。
2.1 浸渍时间对载药量的影响
SSI过程中浸渍时间对多孔微球载药量影响如图2所示。由图中可以看出,随着浸渍时间的增加,载药量逐渐增加,并在1 h后趋于平衡,1 h后多孔微球载药量变化不大。SSI过程主要包括三个阶段:药物在超临界CO2中的溶解;药物在聚合物中的扩散;药物在超临界CO2中和聚合物中的分配。这三个阶段中,超临界CO2环境下药物在聚合物基质中的扩散最慢,因此是SSI过程的限速步骤。在实验设定条件下(40℃,15 MPa)达到平衡载药量的时间为1 h,为保证CO2,聚合物和药物能达到分配平衡,在后续实验中浸渍时间均定为2 h。

图2 SSI过程中浸渍时间对载药多孔微球载药量的影响
2.2 载药多孔微球的载药量
通过乳液-溶剂挥发法制备的PLLA多孔微球,在用SSI法进行药物负载后(40℃,15 MPa,浸渍时间2 h),得到载药PLLA多孔微球,通过载药量测定,得出载药量为1.0 mg/g。这说明药物可以通过SSI方法负载到聚合物中,这为药物+载体形式的药物制剂提供了一种绿色化的制备方法。
2.3 载药 PLLA 多孔微球的表征
2.3.1 扫描电子显微镜(SEM)结果分析
PLLA多孔微球的SEM图片在SSI过程负载药物前后如图3所示,其中图 3(a)表示采用泊洛沙姆作为致孔剂,使用乳液-溶剂挥发法制备的空白PLLA多孔微球,可以看到大部分PLLA微粒呈球形,表面存在孔洞;图3(b)为利用SSI过程在40℃,15 MPa条件下浸渍2 h负载药物后的载药PLLA多孔微球,可以看出经过SSI过程处理之后,微球粒径变小,表面孔洞部分消失。这是因为在CO2环境中,PLLA玻璃化转变温度(Tg)大幅下降,聚合物表面出现部分软化现象,使得多孔微球表面的孔洞融合,微球由于塌缩粒径变小。这种表面孔洞消失的现象对于多孔微球在缓控释给药方面的应用是非常有利的,表面孔洞的小时可以有效避免多孔微球在药物释放过程中产生的突释现象。

图3 PLLA多孔微球的SEM图片
2.3.2 多孔微球粒径分析
药物颗粒的空气动力学性质极大的影响药物在肺部的吸入给药过程。只有空气动力学粒径在 1~5 μm之间的颗粒可以进入肺部深处,而大于5 μm的颗粒则容易进入口腔,小于1 μm的颗粒由于布朗运动停留在上呼吸道。除此以外,如果颗粒的几何粒径在1~5 μm之间则会被肺部巨噬细胞会吞噬,将其排出体外,不能达到治疗效果,因此只有空气动力学粒径处于1~5 μm之间而几何直径大于5 μm的颗粒可以进入肺部深处,完成给药[9]。
本研究采用空气动力学粒径谱仪测定多孔微球的空气动力学粒径并计算可吸入比,结果见表1。由结果可知,空白PLLA多孔微球经SSI过程负载药物后,几何粒径变小和空气动力学粒径均变小,可吸入比由24.51%提高到66.44%,这表明经SSI过程将药物负载与空白多孔微球后,有 66.44%的微粒可进入肺部深处达到给药目的。

表1 SSI浸渍前后平均粒径、空气动力学粒径及可吸入比
2.4 载药多孔微球的体外释放行为
进行体外释放实验时,选用SSI方法制备的载药PLLA 多孔微球,其制备条件为40℃,15.0 MPa,载药量为1.0 mg/g。在37℃下,载药多孔微球的释放曲线如图4所示,在释放的起始阶段,载药PLLA多孔微球在起始的24 h中共释放了20.0%的药物,在40天内累积释放了61.6%的药物。经过SSI过程处理后的PLLA多孔微球,表面孔结构闭合,微球表面为完整的球形,由于其表面封闭的结构阻止了地塞米松从微球到溶液主体的快速释放,进而使多孔微球的突释现象得到了规避。这种表面封闭的载药PLLA多孔微球对于缓释给药来说是十分有利的。
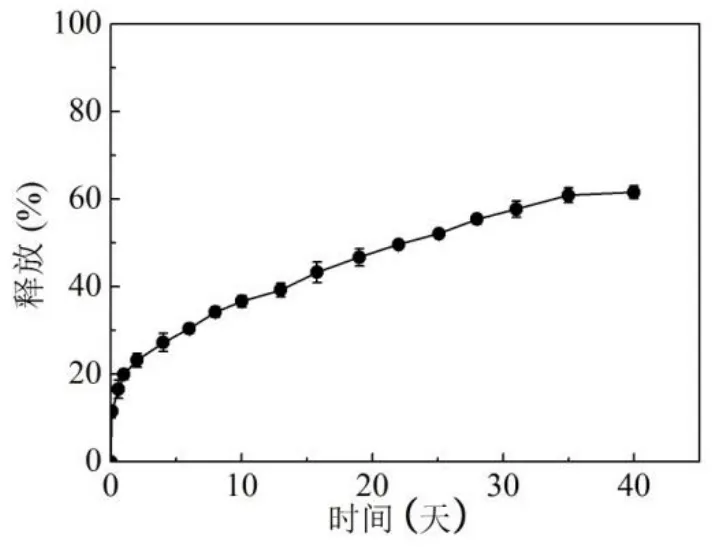
图4 在37℃下,载药PLLA多孔微球体外释放
3 结论
本文采用SSI法将地塞米松负载到PLLA多孔微球中,实验结果表明,SSI法可将地塞米松成功负载于PLLA载药多孔微球中;SEM图片显示PLLA多孔微球表面孔结构闭合,粒径减小;载药多孔微球的粒径可满足肺部吸入式给药的要求。此外,PLLA载药多孔微球的体外释放实验显示,通过SSI过程制备的PLLA载药多孔微球可降低药物的突释行为,延长释放时间。因此,利用SSI法制备载药多孔微球用于肺部吸入式给药具有良好的应用前景。
[1]中国药学会主编. 药学学科发展报告 2008-2009[R]. 中国科学技术出版社, 2009.
[2]Sharma P K, Malviya R, Singh A. Pulmonary drug delivery system: a novel approach for drug delivery [J]. Current Drug Therapy, 2011, 6:137-151.
[3]关怡新, 余金鹏, 姚善泾, 等. 超临界溶液浸渍法制备缓释药物[J]. 化工学报, 2010, 61(2): 269-274.
[4]Sand M L. Method for impregnating a thermoplastic polymer[P]. US:4598006, 1986-07-01.
[5]Duarte A R C, Simplicio A L, Vega-Gonzá lez A, et al.Supercritical fluid impregnation of a biocompatible polymer for ophthalmic drug delivery [J]. Journal of Supercritical Fluids, 2007, 42: 373-377.
[6]Diankov S, Barth D, Vega-Gonzalez A, et al. Impregnation isotherms of hydroxybenzoic acid on PMMA in supercritical carbon dioxide [J], Journal of Supercritical Fluids, 2007, 41:164-172.
[7]Yu J P, Guan Y X, Yao S J, et al. Preparation of roxithromycin-loaded poly(l-lactic acid) films with supercritical solution impregnation [J], Industrial & Engineering Chemistry Research, 2011, 50: 13813-13818.
[8]Tang C, Guan Y X, Yao S J, et al. Preparation of ibuprofenloaded chitosan ベlms for oral mucosal drug delivery using supercritical solution impregnation [J], International Journal of Pharmaceutics, 2014, 473: 434-441.
[9]朱利会, 陈爱政, 王士斌. 肺部给药用高分子多孔微球的制备及改性研究进展[J]. 化工进展, 2014, 33(7): 1832-1838.

