CO2甲烷化制替代天然气热力学计算与分析
张 旭,王子宗
(中国石化 工程建设有限公司,北京 100101)
CO2甲烷化制替代天然气热力学计算与分析
张 旭,王子宗
(中国石化 工程建设有限公司,北京 100101)
利用模拟软件ASPEN PLUS(V7.3),基于Gibbs自由能最小法,建立了CO2甲烷化制替代天然气反应体系的热力学计算模型,获得了甲烷化过程中各组分的平衡组成和主要反应的标准平衡常数。计算结果表明,CO2转化率随压力升高而增加,随温度升高先降低后逐渐升高。温度低于400 ℃、压力3.0 MPa有利于CO2甲烷化反应。CO含量较高时,CO甲烷化反应速率大于CO2甲烷化反应速率。在0.1 MPa下,温度低于625 ℃时,CO优先发生甲烷化反应。当温度高于625 ℃后,CO2转化率高于CO转化率。当体系中CO含量不高于2.00%(x)时,CO2甲烷化反应无积碳现象发生;当CO含量超过2.00%(x)、温度低于600 ℃时,反应出现明显积碳。
替代天然气;二氧化碳;甲烷化;热力学分析
CO2作为含碳物种氧化的最终产物,因温室气体效应而受到越来越多的关注。目前国内外在CO2的捕获、封存、利用以及储存等领域开展了大量的研究工作。将CO2作为能量载体进行二次利用对缓解温室气体效应将起积极促进作用。CO2甲烷化不仅可减少温室气体CO2含量,更重要的是CO2甲烷化产物CH4既是清洁能源也是化工原料[1]。利用热力学研究可辅助认识化学反应、指导工艺开发和研制催化剂[2],从热力学角度研究合成气甲烷化过程的报道较多。Gao等[2-5]研究发现,反应温度、压力及组成对甲烷化反应影响十分显著。陈宏刚等[6]通过合成气甲烷化积碳的热力学计算发现,在550~580 ℃、0.1~1.5 MPa条件下催化剂容易积碳,当温度为700 ℃、压力低于1.0 MPa时,床层积碳量达到最大。
煤制替代天然气因能实现煤炭资源的清洁高效利用,同时可作为常规天然气的战略补充而得到了快速发展。煤气化得到的合成气中主要成分是CO和H2,根据气化工艺不同,还存在一定量的CO2。CO2甲烷化作为重要的甲烷化反应之一,还鲜有关于其转化过程进行详细热力学计算与分析的报道,尤其是考察CO对CO2甲烷化的影响。本课题组前期已对CO2甲烷化[1,7-8]及CO2重整甲烷[9-10]进行了研究。
本工作在前期实验的基础上,利用模拟软件ASPEN PLUS(V7.3),基于Gibbs自由能最小法,建立了CO2甲烷化制替代天然气反应体系的热力学计算模型,分析了CO对CO2甲烷化反应的影响。
1 计算方法
复杂反应系统中的平衡组成可通过平衡常数法或Gibbs自由能最小法计算获得。平衡常数法需要获得每个反应的平衡常数,这对于甲烷化反应难以实际操作。Gibbs自由能最小法则是基于系统处于平衡状态时系统总Gibbs自由能最小原理进行计算[11],不用考虑单个反应的平衡常数,只要给出反应物和产物,即可通过数学优化获得产物分布。Gibbs自由能最小法在单相和气液固三相反应体系中均取得了满意的结果[2,6]。
反应器模块选用基于Gibbs自由能最小法的RGibbs反应器模块计算原理。状态方程选用Soave-Redlich-Kwong方程,水/烃体系定为非互溶体系,忽略气相间关联,其余参数采用软件缺省值。
2 甲烷化反应
煤经过气化、水煤气变换、酸性气体脱除后得到的合成气主要成分有:H2、CO、CO2、CH4、H2O及少量N2等。甲烷化过程中可能发生的化学反应见表1。从表1可看出,反应主要包括CO2的甲烷化和还原反应、CO的甲烷化和还原反应、CH4裂解反应、水煤气变换反应、CO2/CH4的重整与逆重整反应及歧化反应等。除CH4裂解和CO2/CH4重整反应为吸热反应外,其余均为放热反应。CO和CO2的甲烷化反应为强放热反应,所以在甲烷化生产中必须严格控制单程转化率,同时在反应器出口配套换热器。

表1 甲烷化过程中可能发生的化学反应[2-4]Table 1 Possible reactions involved in methanation[2-4]
3 结果与讨论
3.1 平衡组成与平衡常数0.1 MPa下,CO2甲烷化反应各产物含量随温度的变化见图1。从图1可看出,低温区(100~425℃)的产物主要是CH4和H2O;随温度升高,产物中CO的含量缓慢增加,这主要由逆水煤气变换反应引起[2]。未参与反应的CO2和H2的含量逐渐增大,导致产物中CH4和H2O的含量一直呈下降趋势。由于CO2甲烷化反应为强放热反应,高温不利于该反应,CO2含量在550 ℃附近达到最大值,当温度进一步升高后逐渐降低。这是因为,温度升高后主要以逆水煤气变换反应为主。同时,在反应过程中未发现积碳现象。
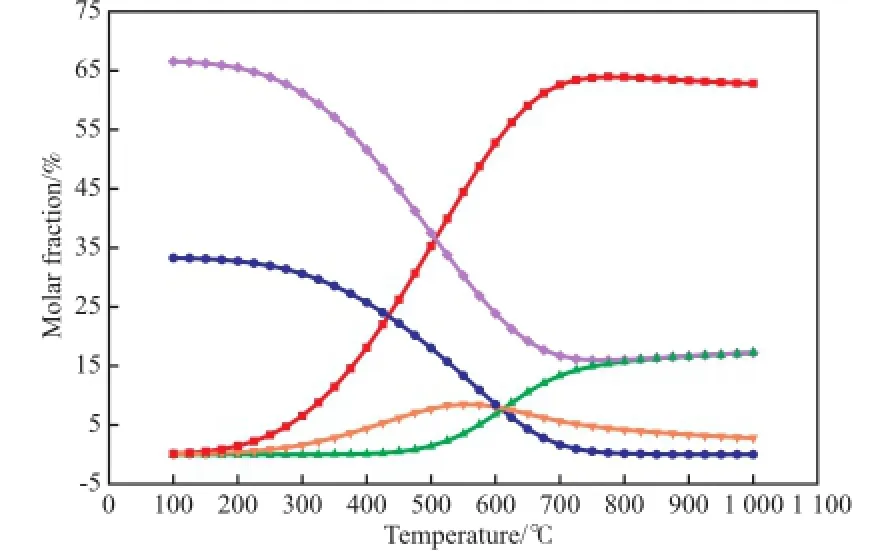
图1 CO2甲烷化反应各产物含量随温度的变化Fig.1 Product fractions in the CO2methanation vs. temperature.Reaction conditions:0.1 MPa,n(H2):n(CO2)=4.■ H2;● CH4;▲ CO;▼ CO2;◆ H2O
P a r k等[12]提出甲烷化反应过程为:CO2+H2+3H2⇌H2O+CO+3H2=H2O+CO+3H2⇌H2O+CH4+H2O。从上述过程可看出,正因为存在水煤气变换反应和逆水煤气变换反应,使甲烷化反应在不同条件下呈不同的反应结果。逆水煤气变换反应中有H2O生成,说明H2O对CO甲烷化反应有影响[2,4],这也是CO2甲烷化反应中未发现积碳的原因之一。在0.1 MPa下,如CO2甲烷化想获得高CH4收率,反应温度应低于400 ℃,但由于CO2分子结构非常稳定,通过CO2加氢获得CH4需克服较高的能垒。因此,亟需开发低温高活性的CO2甲烷化催化剂[13]。
甲烷化反应的平衡常数(K)随温度的变化见图2。
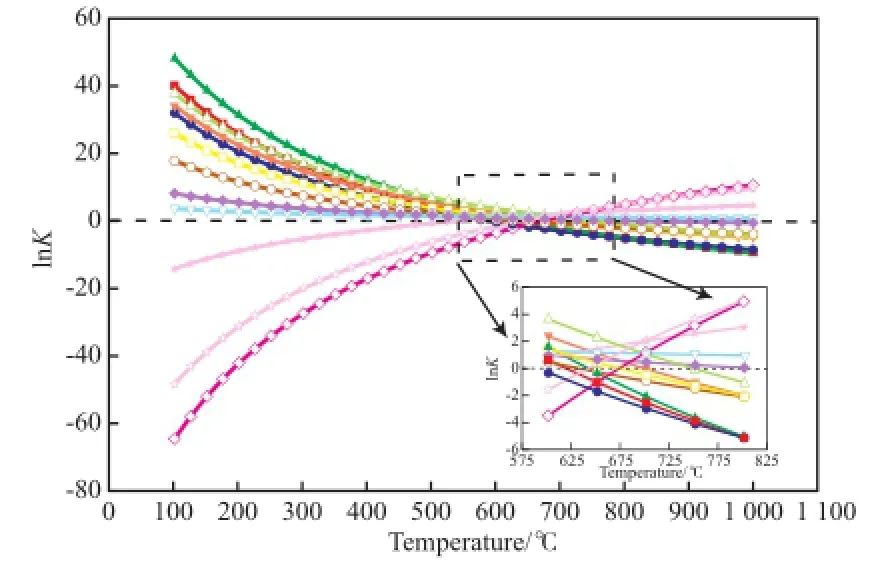
图2 甲烷化反应平衡常数随温度的变化Fig.2 Calculated reaction equilibrium constants(K) in the methanation vs. temperature.Reaction condition:0.1 MPa.Reaction No.:■ R1;● R2;▲ R3;▼ R4;◆ R5;★ R6;□ R7;○ R8;△ R9;▽ R10;◇ R11;☆ R12
从图2可看出,除R6,R11,R12反应外,其余反应的平衡常数均随温度的升高而下降,因为这些反应均为放热反应,温度升高抑制了反应向产物方向移动。当温度高于425 ℃时,CO歧化反应的平衡常数大于CO和CO2甲烷化反应的平衡常数;当温度高于575 ℃时,水煤气变换反应的平衡常数大于 CO和CO2甲烷化反应、CO2还原反应等的平衡常数;当温度高于600 ℃时,CO和CO2甲烷化反应的平衡常数小于0。因此,从热力学角度看,CO和CO2甲烷化反应的温度最好控制在600 ℃以下。
3.2 反应条件对CO2甲烷化反应的影响
选取100~1 000 ℃温度区间,每25 ℃采集一个数据,对比不同反应条件对CO2转化率的影响,结果见图3。从图3可看出,CO2转化率随压力的升高而增大,这主要是因为CO2甲烷化反应是体积缩小的放热反应。压力对CO转化率影响的规律与CO2转化率相同,当温度低于500 ℃时,CO2转化率低于CO转化率[2]。从图3还可看出,随温度的升高,CO2转化率呈先减小后增大的趋势。当压力为0.1 MPa时,CO2转化率在600 ℃时最低,当温度高于600 ℃后,由于逆水煤气变换反应成为主反应,该反应可消耗部分CO2,故CO2转化率开始增大。
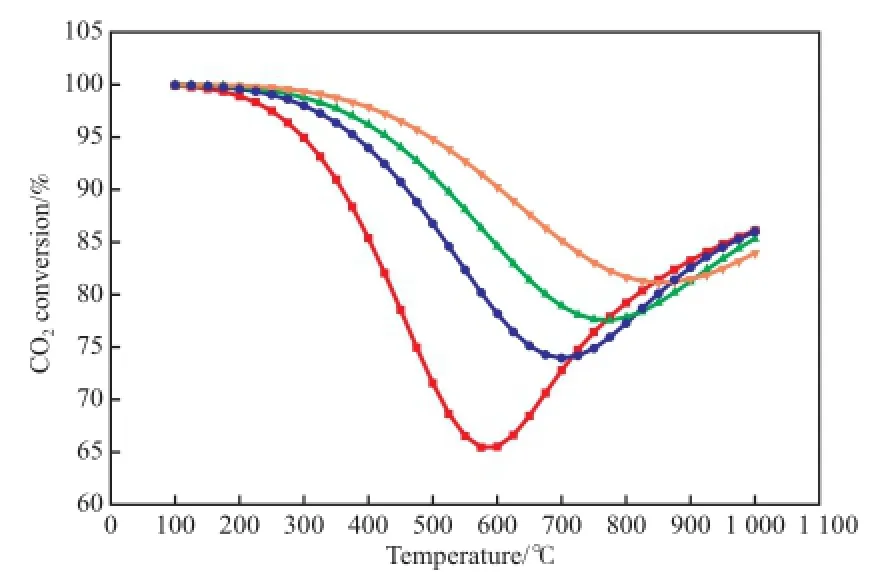
图3 反应条件对CO2转化率的影响Fig.3 Efects of reaction conditions on the CO2conversion.Reaction condition:n(H2):n(CO2)=4.p/MPa:■ 0.1;● 1.0;▲ 3.0;▼ 10.0
反应条件对CH4选择性的影响见图4。从图4可看出,CH4选择性随压力的升高而增大,随温度的升高而降低。该计算结果与Beul等[14-15]得到的结论基本一致,并且与Du等[16]以Ni/MCM-41为催化剂的CO2甲烷化实验结果吻合良好。在相同反应条件下,对比CO2和CO甲烷化反应可发现,当温度低于500 ℃时,CO2甲烷化反应的CH4选择性高于CO甲烷化反应的CH4选择性。CH4收率与其选择性的变化趋势基本相同。当压力从0.1 MPa增大到3.0 MPa时,CH4选择性的增幅较大;从3.0 MPa继续增大到10.0 MPa时,CH4选择性增幅较小。因此,已工业化的甲烷化反应装置中操作压力一般选择3.0 MPa左右。计算结果还显示,在该反应条件下不会出现积碳,这主要是因为逆水煤气变换反应生成的H2O抑制了积碳。综上所述,温度低于400 ℃、压力为3.0 MPa有利于CO2甲烷化反应。
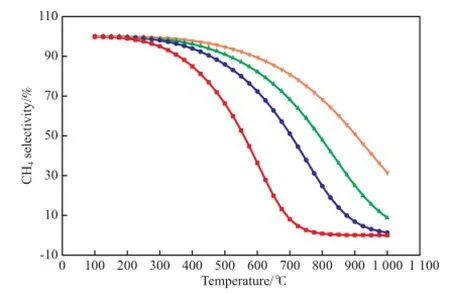
图4 反应条件对CO2甲烷化反应CH4选择性的影响Fig.4 Efects of reaction conditions on the CH4selectivity in the methanation.Reaction condition:n(H2):n(CO2)=4.p/MPa:■ 0.1;● 1.0;▲ 3.0;▼ 10.0
3.3 CO对CO2甲烷化反应的影响
在CO2甲烷化反应过程中会发生逆水煤气变换反应生成CO和H2O。另外,原料气中也有可能存在少量CO。为了更加接近CO2甲烷化反应的实际情况,研究了CO对CO2甲烷化反应的影响。
CO对CO2转化率的影响见图5。
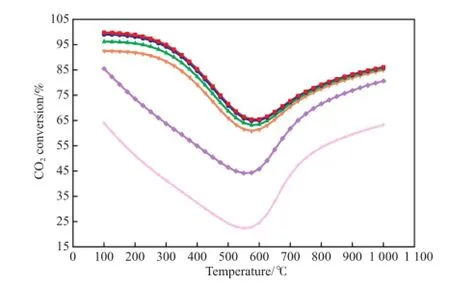
图5 CO对CO2转化率的影响Fig.5 Efects of CO on the CO2conversion.Reaction conditions referred to Fig.1.x(CO)/%:■ 0;● 0.02;▲ 0.20;▼ 2.00;◆ 9.09;★ 16.70
从图5可看出,CO2转化率随温度的升高先降低后逐渐升高,与CO2单独甲烷化反应变化规律相似。随CO含量增加,CO2转化率逐渐降低。在500℃下,当CO含量从0.20%(x)增加到16.70%(x)时,CO2转化率从67%下降到23%,可见CO对CO2甲烷化反应具有抑制作用。CO2甲烷化与CO甲烷化存在竞争反应,低于600 ℃时,CO甲烷化反应速率大于CO2甲烷化反应速率。在CO存在条件下,压力为0.1 MPa时,CO2转化率在580 ℃最低。
CO对CH4收率的影响见图6。从图6可看出,当CO含量不高于2.00%(x)时,在考察温度范围内,CH4收率基本不受CO含量变化的影响,变化趋势较一致,即随温度的升高,CH4收率逐渐降低。当CO的含量大于2.00%(x)时,随温度升高,CH4收率呈先升高后逐渐降低的趋势,在300 ℃左右达到最大值。当温度超过700 ℃后,CH4收率基本不随CO含量的改变而变化,说明此时反应体系中的CO2和CO已基本全部转化。
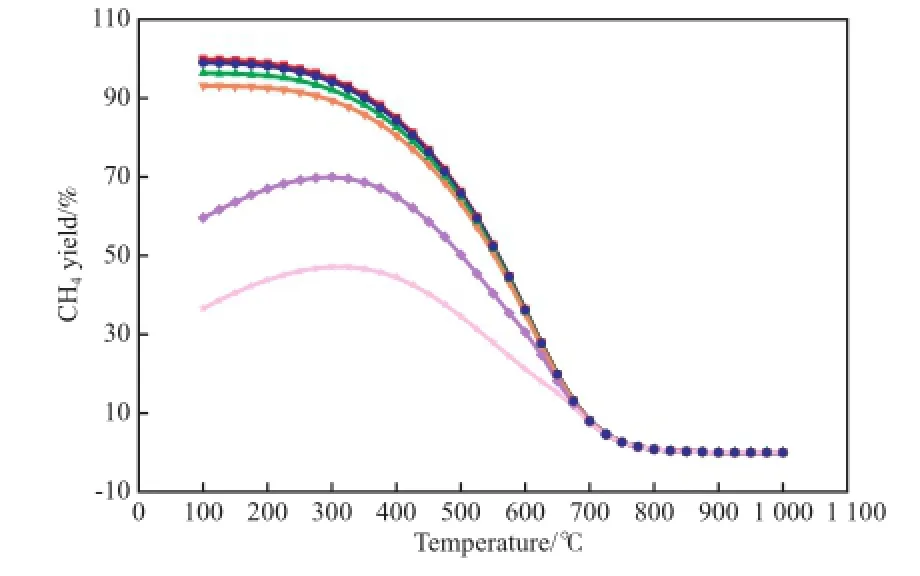
图6 CO对CH4收率的影响Fig.6 Efects of CO on the CH4yield.Reaction conditions referred to Fig.1.x(CO)/%:■ 0;● 0.02;▲ 0.20;▼ 2.00;◆ 9.09;★ 16.70
为了定量分析CO对CO2甲烷化反应的影响,考察了300 ℃下CO含量对CO2转化率和CH4收率的影响,结果见表2。从表2可看出,当CO含量从0.02%(x)增加到16.70%(x)时,CO2转化率和CH4收率较CO含量为0时,降幅分别从0.45%和0.86%增大到56.88%和49.17%。当CO含量为16.70%(x)时,CO2转化率低于CH4收率,说明CO含量较高时,CO甲烷化反应速率大于CO2甲烷化反应速率。
甲烷化反应中CO和CO2的转化率对比见图7。从图7可看出,加入CO使CO2转化率明显下降,低于500 ℃时,CO转化率高于CO2转化率,该计算结果也与实验结果吻合,即在CO和CO2共存下,CO优先发生甲烷化反应,只有当温度高于625 ℃后,CO2转化率高于CO转化率。
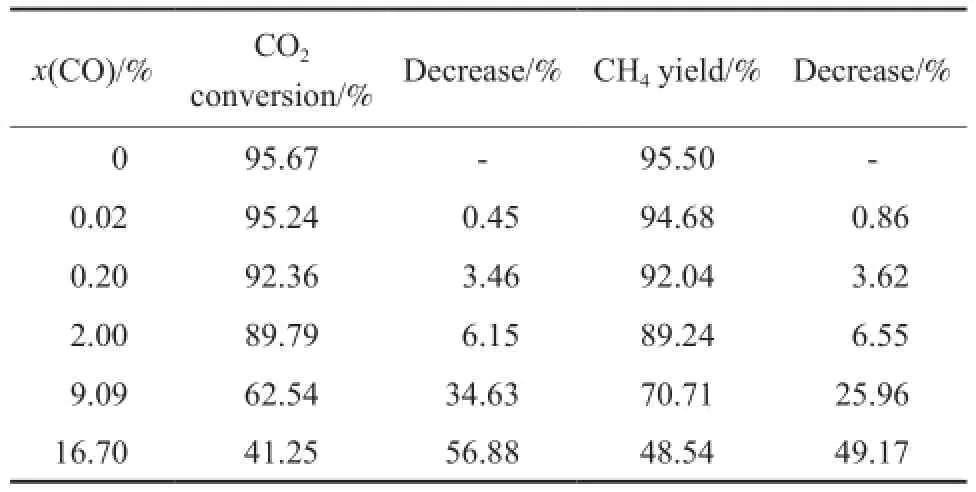
表2 CO含量对CO2转化率和CH4收率的影响Table 2 Efects of CO content on the CO2conversion and the CH4yield
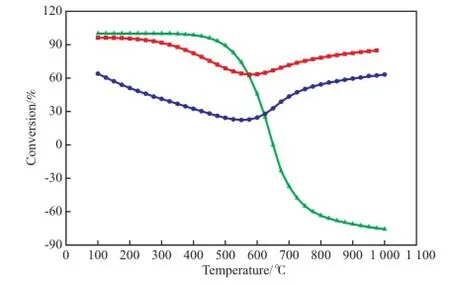
图7 甲烷化反应中CO和CO2的转化率对比Fig.7 Comparison between the conversions of CO and CO2in the methanation.Reaction condition: 0.1 MPa.■ CO2conversion,n(H2):n(CO2)=4;● CO2conversion,n(H2):n(CO2):n(CO)=4:1:1;▲ CO conversion,n(H2):n(CO2):n(CO)=4:1:1
CO对CO2甲烷化反应积碳的影响见图8。
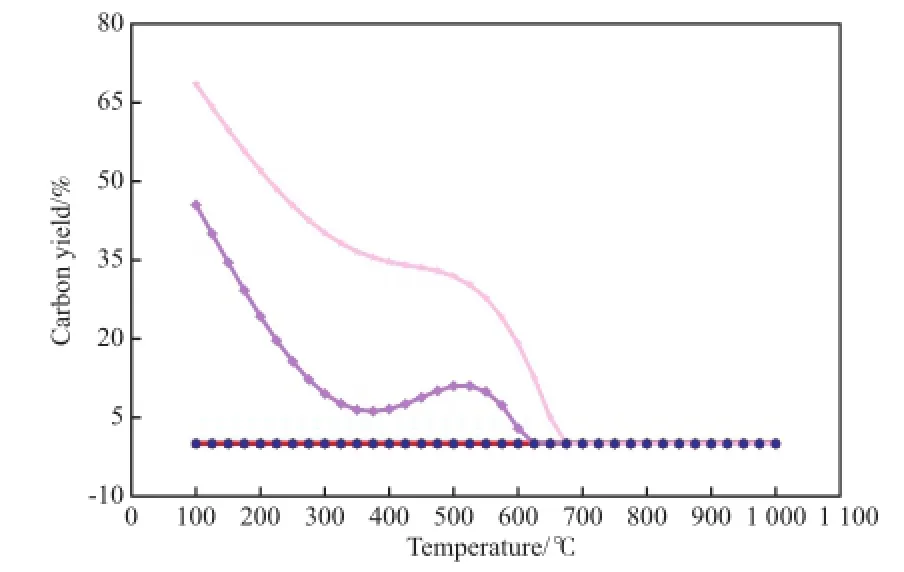
图8 CO对CO2甲烷化反应积碳的影响Fig.8 Efects of CO on the carbon deposit in the CO2methanation.Reaction conditions referred to Fig.1.x(CO)/%:■ 0;● 0.02;▲ 0.20;▼ 2.00;◆ 9.09;★ 16.70
从图8可看出,当体系中CO含量不高于2.00%(x)时,反应过程中未发现积碳;当CO含量超过2.00%(x)、温度低于600 ℃时,反应过程中出现明显积碳,但随温度的升高,积碳量总体呈下降趋势。
热力学计算结果基于反应所能达到的极限状态,但未涉及到达到平衡所需时间。从热力学角度看,当温度低于400 ℃时,CO2甲烷化反应可获得较高的CH4收率。由于CO2分子结构非常稳定,从动力学角度看,通过CO2甲烷化反应获得CH4需克服较高的能垒。因此,需要开发低温高活性CO2甲烷化催化剂。另外,为了获得高反应速率,通常需适当提高反应温度和压力。CO2甲烷化反应除温度、压力和CO的影响因素外,H/C比、CH4、水蒸气以及杂质气体乙烯、乙烷、氧气等均可能对CO2甲烷化反应带来较大影响。综上所述,Gibbs自由能最小法可应用于CO2甲烷化反应过程的热力学计算,计算结果可有效指导CO2甲烷化催化剂的研制和工艺开发。
4 结论
1)利用Gibbs自由能最小法对CO2甲烷化反应进行了计算。计算结果表明,CO2转化率随压力升高而增加,随温度升高先降低后逐渐升高。CH4选择性随压力的增大而增大,随温度的升高而降低。温度低于400 ℃、压力为3.0 MPa有利于CO2甲烷化反应。
2)CO对CO2甲烷化反应具有抑制作用,CO含量较高时,CO甲烷化反应速率大于CO2甲烷化反应速率。在0.1 MPa下,温度低于625 ℃时,CO优先发生甲烷化反应,当温度高于625 ℃后,CO2转化率高于CO转化率。
3)当体系中CO含量不高于2.00%(x)时,CO2甲烷化反应无积碳现象发生;当CO含量超过2.00%(x)、温度低于600 ℃时,反应出现明显积碳,但随温度的升高,积碳量总体呈下降趋势。
[1]张旭, 孙文晶, 储伟. 离子体技术对CO2甲烷化用Ni/SiO2催化剂的改性作用[J]. 燃料化学学报,2013,41(1):96 -101.
[2]Gao Jiajian,Wang Yingli,Ping Yuan,et al. A thermodynamic analysis of methanation reactions of carbon oxides for the production of synthetic natural gas[J]. RSC Adv,2012,2(6):2358 - 2368.
[3]左玉帮,刘永健,李江涛,等. 合成气甲烷化制替代天然气热力学分析[J]. 化学工业与工程, 2011,28(6):47 - 53.
[4]崔晓曦,曹会博,孟凡会,等. 合成气甲烷化热力学计算分析[J]. 天然气化工:C1化学与化工,2012,37(5):15 - 19.
[5]江展昌. 煤气甲烷化反应体系的热力学分析[J]. 煤气与热力,1984(6):2 - 7.
[6]陈宏刚,王腾达,张锴,等. 合成气甲烷化反应积炭过程的热力学分析[J]. 燃料化学学报, 2013,41(8):978 - 984.
[7]张旭,王子宗,陈建峰. 助剂对煤基合成气甲烷化反应用镍基催化剂的促进作用[J]. 化工进展,2015,34(2):389 -396.
[8]郭芳,储伟,徐慧远,等. 采用等离子体强化制备CO2甲烷化用镍基催化剂[J]. 催化学报,2007,28(5):429 - 434.
[9]郭芳,储伟,石新雨,等. 等离子体引入方式对强化制备二氧化碳重整甲烷反应的Ni/γ-Al2O3催化剂的影响[J]. 高等学校化学学报,2009,30(4):746 - 751.
[10]Wang Ning,Yu Xiaopeng,Shen Kui,et al. Synthesis,characterization and catalytic performance of MgO-coated Ni/SBA-15 catalysts for methane dry reforming to syngas and hydrogen[J]. Int J Hydrogen Energy,2013,38(23):9718 - 9731.
[11]朱开宏,袁渭康. 化学反应工程分析[M]. 北京:高等教育出版社,2002.
[12]Park J N,McFarland E W. A highly dispersed Pd-Mg/SiO2catalyst active for methanation of CO2[J]. J Catal,2009,266(1):92 - 97.
[13]崔凯凯,周桂林,谢红梅. 二氧化碳甲烷化催化剂的研究进展[J]. 化工进展,2015,34(3):724 - 730.
[14]Beuls A,Swalus C,Jacquemin M,et al. Methanation of CO2:Further insight into the mechanism over Rh/γ-Al2O3catalyst[J]. Appl Catal,B,2012,113/114:2 - 10.
[15]Ocampo F,Louis B,Roger A C. Methanation of carbon dioxide over nickel-based Ce0.72Zr0.28O2mixed oxide catalysts prepared by sol-gel method[J]. Appl Catal,A,2009,369(1/2):90 - 96.
[16]Du Guoan, Lim Sangyang, Yang Yanhui, et al. Methanation of carbon dioxide on Ni-incorporated MCM-41 catalysts:The infuence of catalyst pretreatment and study of steady-state reaction[J]. J Catal, 2007, 249(2): 370 - 379.
(编辑 邓晓音)
敬告读者:从2016年第1期开始,本刊“专题报道”栏目将连续刊出北京化工大学的系列专题报道。该专题主要报道化工资源有效利用国家重点实验室段雪院士课题组最近在结构可控超分子功能材料及其有序组装体方面的研究进展,包括层状无机功能材料和纳米阵列材料的制备及其在结构化催化与吸附、分离、储能器件、资源循环利用和环境保护等方面的应用基础研究以及产业化研究的最新成果。敬请广大读者给予关注。
专题报道:本期创造性地提出采用钠改性沸石吸附处理高温氨氮废水,不仅解决了氨氮问题,而且可以回收废热。见本期903-909页。
北京化工大学化工资源有效利用国家重点实验室简介:北京化工大学化工资源有效利用国家重点实验室前身为2000年8月成立的可控化学反应科学与技术教育部重点实验室,2006年6月27日由国家科技部批准筹建国家重点实验室,2009年1月4日正式通过验收。实验室学术委员会由13名专家学者组成,学术委员会主任由中科院院士周其凤教授担任,实验室主任由何静教授担任。
重点实验室密切围绕我国建设资源节约型社会的战略目标,以化工资源有效利用为主攻方向,深入研究相关领域的科学问题与技术集成原理,充分利用北京化工大学化学、化工和材料3个一级学科布局紧凑、专业方向完整的优势,通过学科间的交叉、渗透和整合,针对“化工资源有效利用”的途径,形成了3个有特色的研究方向:组装化学、可控聚合、过程强化。
实验室认真贯彻执行“开放、流动、联合、竞争”的方针,重视科学研究、人才培养、队伍建设和开放交流等各方面的工作。基于北京化工大学的基础及办学宗旨,实验室确定了基础研究与应用研究密切结合的定位,即在开展学术前沿研究的同时,以国家实际需求为切入点,直接进入国民经济建设的主战场。承担一批基础和工程化及产业化研究项目,发表一批高水平的学术论文,申报一批国家和国际发明专利,产出一批具有显示度的科研成果,形成鲜明的应用基础研究特色。
Thermodynamic analysis of CO2methanation for substitute natural gas
Zhang Xu,Wang Zizong
(SINOPEC Engineering Incorporation,Beijing 100101,China)
A thermodynamic model for CO2methanation was established based on the Gibbs free energy minimization method by means of the ASPEN PLUS(V7.3) software,and the equilibrium composition and the standard equilibrium constants were obtained. It was indicated that,the CO2conversion increased remarkably with increasing pressure,and frstly decreased and then gradually increased with temperature rise. Lower temperature than 400 ℃ and high pressure were benefcial to the CO2methanation. The reaction rate of the CO methanation was signifcantly higher than that of the CO2methanation at high CO content. The CO methanation was prior to the CO2methanation in the coexistence system under the conditions of lower temperature than 625 ℃ and pressure 0.1 MPa,while the CO2conversion was higher than the CO conversion at higher temperature than 625 ℃. No carbon deposition was found when the CO content in feed gas was less than 2.00%(x),while carbon deposition appeared signifcantly when the CO content was more than 2.00%(x) at lower temperature than 600 ℃.
substitute natural gas;carbon dioxide;methanation;thermodynamic analysis
1000 - 8144(2016)08 - 0951 - 06
TQ 514
A
10.3969/j.issn.1000-8144.2016.08.011
2016 - 01 - 27;[修改稿日期]2016 - 05 - 28。
张旭(1983—),男,四川省资阳市人,博士,工程师,电话 010 - 84875292,电邮 zx20032974@163.com。
——会偷偷侵蚀你的发动机!

