化学交换法分离锂同位素研究进展
肖江,贾永忠,石成龙,王兴权,姚颖,景燕
化学交换法分离锂同位素研究进展
肖江1,2,贾永忠1,石成龙1,王兴权1,姚颖1,景燕1
(1中国科学院青海盐湖研究所,盐湖资源综合高效利用重点实验室,青海西宁 810001;2中国科学院大学,北京 100049)
锂同位素(6Li和7Li)是核能源开发所需要的重要原料,在能源、环境和国防安全等领域具有重要应用价值。本文从已报道的化学交换分离锂同位素方法中,对锂汞齐法、溶剂萃取法、离子色层交换法和膜法进行了系统的总结、归类和评述,详细分析了各种化学交换法的分离机理和特点。结果表明,化学交换法分离锂同位素的分离效应与体系中络合剂与锂离子键合作用相关,锂汞齐法会因环境问题将被其他无汞分离体系取代。此外,溶剂萃取法、离子色层交换法和膜法都具有较大的分离效应,均是非常有前景的锂同位素分离方法。最后,对锂同位素分离研究领域的未来方向提出了一些建议,如新型螯合剂设计合成,不同分离工艺的联用和不同实验条件下分离机理中尚待解决的理论问题。
锂同位素;化学交换;分离;萃取;机理
锂,自然界存在的最轻的金属,其两种稳定的同位素6Li和7Li的天然丰度分别为7.42%和92.58%[1]。锂的两种同位素在核材料领域中都占有重要地位,但两者的核反应性能截然不同。6Li的热中子吸收截面可高达940b,极易被中子轰击后生成氚和氦,可使氚(T)不断增殖,为聚变反应提供充足的原料[2]。同时,固态化合物(6LiD)还是核武器的重要填装材料;鉴于7Li的热中子吸收截面仅为0.037b,这种极小的吸收中子的能力使其对核反应过程的调控和设备的维护中也发挥着重要的作用,如超纯7LiF可作为新一代熔融盐反应堆冷却剂的重要组分;7LiOH可以用来调节压水堆的pH,缓解容器设备的腐蚀问题[3]。因此,无论是钍熔盐堆还是核聚变反应堆,锂同位素都是不可或缺的能源和战略材料,进行锂同位素分离方法的研究意义深远。
锂同位素的分离方法有很多种,主要可分为化学法和物理法,其中化学法包括锂汞齐交换法、离子交换色层法、萃取法等;物理法包括电磁法、熔盐电解法、电子迁移、分子蒸馏和激光分离等[4]。在分离锂同位素的过程中,物理法因生产设备昂贵和生产条件苛刻、能耗高但产量小等特点,不适合应用于工业化生产;而化学交换法是分离锂同位素的一种常见且重要的方法,具有分离体系简单、操作方便、单级分离效应明显和易级联等优点。近年来,随着新型化合物(冠醚、穴醚和氮杂菲类等)对金属锂离子的特殊选择性及合成工艺的改进,极有可能在生产和工艺上突破性地推进锂同位素的分离。因此,本文旨在结合国内外已公开发表的相关文献,对各种分离锂同位素化学交换方法及机理进行归纳、总结和评价。
1 锂汞齐法
自1936年LEWIS和MACDONALD[5]首次用锂汞齐与锂盐的有机溶液进行化学交换并成功地富集6Li后,锂汞齐法成为当今唯一报道实现工业化分离同位素6Li的方法。其分离原理是在化学交换的过程中,6Li+比7Li+与汞更易结合,6Li富集在锂汞齐相中,7Li富集在另一相中,其化学交换法的反应式见式(1)。
6Li+aq/org+7Li·Hg—→7Li+aq/org+6Li ·Hg (1)
式中,下角标aq和org表示溶于水相或有机相的含锂化合物。
锂汞齐法分离锂同位素的单级分离系数的计算见式(2)。
= [6Li •Hg] × [7Li+aq/org]/[7Li •Hg] × [6Li+aq/org] (2)
最典型的锂汞齐法体系是锂汞齐-氢氧化锂水溶液体系(图1为分离流程简图),其核心交换分离流程为:来自上回流器的锂汞齐与下回流器中的氢氧化锂水溶液在交换段逆流接触,使同位素6Li在锂汞齐相中的富集程度自上而下的呈梯度分布。同时,锂汞齐从上回流器从电解槽连续产出,下回流器则进行汞的回收和6Li富端的转向,使富集6Li的氢氧化锂水溶液返回到交换段,继续与锂汞齐进行交换,直到6Li的纯度达到产品的要求后被取出。此外,为保证水相溶液的物料平衡,系统中要不断的加入自然丰度的氢氧化锂溶液。
溶剂类型、阴离子组成、温度、电流大小和溶液浓度等因素都对锂汞齐法分离体系的单级分离系数产生影响[6-10]。其中,溶剂效应主要是由于不同的溶剂具有不同的极性、介电常数和对同一萃取剂具有不同的溶解度,溶剂分子与锂离子间作用的强弱会直接影响到;阴离子对的影响主要表现在其软硬酸碱性对锂离子与汞的结合难易程度;而温度的变化会影响该化学交换过程的热力学参数,进而对锂同位素的的大小造成影响。VALFELLS等[11]报道了在同一化学交换分离锂同位素的工艺中同时获得6Li和氘的专利,利用该工艺经过315级级联后,从最后一级中可获得丰度高达99.7%的6Li,且氘也富集了100倍。该工艺流程较单一的分离锂同位素和氘更加经济,是锂汞齐交换体系分离锂同位素技术与工艺上的突破。最近,CORDOVA等[12]采用Li-Cd-Hg三组分汞齐来分离锂同位素,但其分离系数并没有得到明显提高。
锂汞齐法体系在工业上分离锂同位素的优点众多,如单级分离系数大、同位素反应交换周期短、两相转化容易和工程放大相对简单,但是其在分离过程中使用了大量汞,对生态环境与安全带来极大的威胁。因此,积极寻求其他绿色高效的锂同位素分离方法来替代锂汞齐法已势在必行。
2 溶剂萃取法
溶剂萃取分离锂同位素主要是利用6Li和7Li在两溶剂相中的分配系数的差异。该法的基本流程如图2所示,其中交换段是实现锂同位素分离与富集的工艺核心环节。
在溶剂萃取分离锂同位素的过程中,同位素的富集方向与体系中螯合剂与锂离子键合作用相关。BIGELEISEN等[14]曾报道在化学交换分离同位素中,络合物在某相中应当是具有较高的振动频率和同位素位移大的强键,而另一相则是振动频率较低和同位素位移较小的弱键,两者的差值越大则分离系数越大,且重同位素在强键相富集。从另一角度,BETTS等[15]从理论上推导了萃取过程中同位素交换反应的平衡常数,1×|Δ|,其中,为常数(不同元素具有不同的值),Δ是两相络合物中金属-配位体的键力常数之差。一般而言,分子由于热运动其中的原子会在平衡位置的附近作往复运动。从经典力学出发,这类往复运动可看成是谐振子的振动,其振动频率为式(3)。
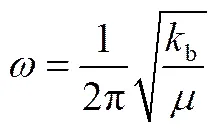
式中b为化学键的键力常数。一般来说,键长越短,键级越大,表示键越强,b就越大。为双原子的折合质量,见式(4)。
(4)
式中和分别为重和轻同位素质量。
在锂同位素液-液萃取体系中,由于Li+的离子半径很小,电荷密度高,且2s和2p均为空轨道,因此其极易与水分子络合形成稳定的四面体配位结构,以[Li(H2O)4]+结构状态存在,且利用密度泛函理论得出锂离子与水分子中的氧原子之间的键长为1.956Å(1Å=0.1nm)[16-17]。对于常见的冠醚化合物而言,Li+能与冠醚分子中的氧原子通过离子偶极作用力进行配位。BODA等[18]利用量化手段详细研究了锂离子与不同半径尺寸冠醚的主客体络合关系,研究发现锂离子与冠醚12-冠-4、15-冠-5和18-冠-6中的氧原子的键长分别为3.536Å、3.887Å和3.739Å。因此,对比易知,Li+与冠醚上氧原子的成键距离大于其与水分子中氧原子之间的距离,即前者的b值小于后者。根据上述经典力学振动模型及公式(1)和(2),则有[Li(H2O)4]+的振动频率要高于冠醚与锂离子形成的螯合物体系,即冠醚体系属于键弱相,有机相中更易富集6Li。相反的是,在另一类螯合剂(如偶氮杂菲、苯并喹啉、TBP、酮等化合物)中,其配位原子与锂离子是通过形成比水中的Li—O键更强化学键,前者的b值小于后者,即该类萃取剂体系属于键强相,有机相中更易富集7Li,几种典型的溶剂萃取法分离6Li和7Li的化学交换机理如表1所示。

表1 溶剂萃取法分离锂同位素部分体系的交换机理
2.1 萃取法分离6Li
溶剂萃取法中分离6Li的体系中,主要包括冠醚和穴醚两大体系,它们是一种包含多个醚基团的有机化合物的总称,几种典型的化合物结构见图3。自PEDERSEN等[19]合成出能与碱/碱土金属离子形成络合物的冠醚类化合物之后,JEPSON等[20]首次使用穴醚(2,2,1)作为络合剂对锂同位素进行分离,分离系数高达1.041。之后,支克正等[21]验证了穴醚(2,2,1)对锂同位素的萃取分离效应,并发现该类穴醚螯合剂都具有较高的单级分离系数,且不同结构的穴醚对锂同位素分离系数有影响。由于在穴醚化合物中含有N、O极性很强的原子,极易与水形成氢键,具有很强的水溶性,在多级萃取过程中易损失,因此,该类化合物暂不适合开发成工业化体系。
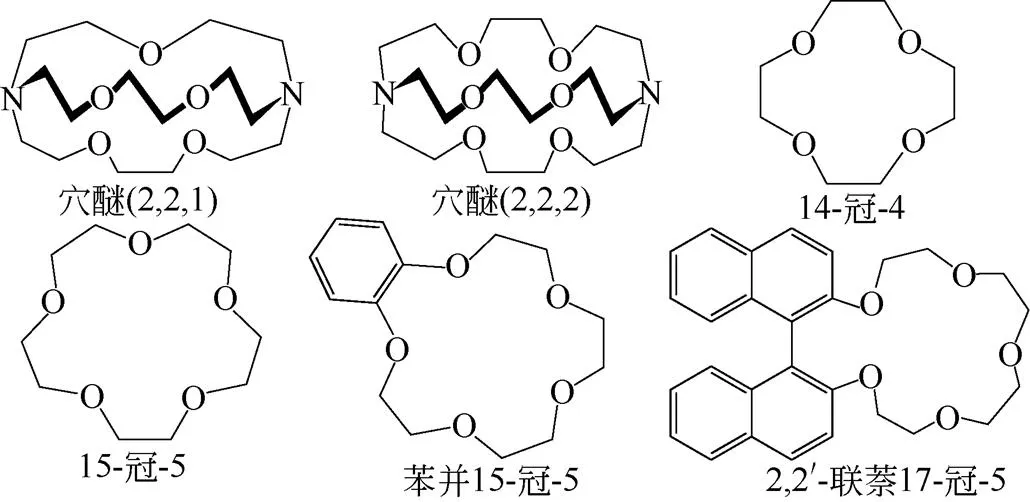
图3 几种典型冠醚类化合物结构
利用冠醚化合物来分离锂同位素已开展了大量的研究工作。1980年,NISHIZAWA等[22-23]详细考察了不同空穴尺寸冠醚和不同锂盐的对锂同位素分离效应的影响,发现锂同位素的分离系数差异显著,其中使用12-冠-4和苯并-15-冠-5得到最高的分别为1.057±0.003和1.044±0.003。同时,从热力学角度分析了冠醚尺寸的增加导致差异显著的原因是在化学交换过程中冠醚构象重排导致的焓变和熵变减小,使自由能变也降低,造成分离系数减小。之后,傅立安等[24]详细地研究了多醚溶剂萃取体系中锂同位素的分离效应,总结出当单环冠醚腔的直径约为2.6Å时锂同位素分离系数最大,锂盐阴离子对分配系数和都有影响。刘育等[25]也研究了不同尺寸冠醚对锂离子的络合能力,结果表明具有对称结构和适宜孔径尺寸的冠醚络合能力更强,过大的孔腔结构会大大降低冠醚与锂离子间的离子-偶极作用。方胜强等[26-28]对水相锂盐组成和冠醚的结构对溶剂萃取分离锂同位素进行了详细的研究,发现在一定的条件下,随锂盐浓度的增大而增大,且使用不同组成锂盐的混合可以提高萃取体系的分离系数。同时,基于对萃取剂甲苯氧基联苯桥联双苯并-15-冠-5分离锂同位素能力的考察,结果发现多冠醚甲苯氧基联苯桥联双苯并-15-冠-5的分离锂同位素的能力弱于单冠醚苯并15-冠-5,推断并证实由单冠醚组成的多冠醚(不包括穴醚)分离锂同位素的能力弱于单冠醚。此外,该团队[29]进行了以4-叔丁基-苯并-15-冠-5为萃取剂的硝基苯体系萃取水相为的2.5mol/L LiClO4研究,发现其可达1.036,单次锂萃取率为45%,并经13级萃取,萃余水相锂浓度为2.5×10–4mol/L。
进入21世纪,利用冠醚化合物分离锂同位素的研究在世界各国仍备受关注,一些新分离方法及工艺被报道。GROTE等[30]采用金属冠醚12-冠-3金属络合物来分离锂同位素,起初没有发现分离效应,但通过调整取代基上的官能团,改变空间尺寸及位阻效应,可使其具有一定的锂同位素分离效应,这为合成新型的萃取剂提供了发展方向。DAVOUDI等[31]首次将液液微萃取应用到锂同位素的分离中,研究了苯并-15-冠-5与四氯乙烯-C3H6O组成的有机相体系,发现其达1.082±0.002,是目前公开报道的最高的。尽管该方法主要针对分析工作中的微量锂同位素,但其为分离锂同位素提供新的分离体系基础。江南大学顾志国等[32]应用难挥发性离子液体代替了常规的有机试剂,并以2,2'-双萘基-17-冠-5为萃取剂,考察了不同的锂盐浓度、pH、温度、锂盐阴离子等因素对锂同位素分离的影响,在最优的条件下,锂同位素的单级可达1.046±0.002,且分配系数较无离子液体萃取体系得到一定的提高,并依据软硬酸碱理论及实验证明,三氟醋酸锂是最适的应用在工业上溶剂萃取分离锂同位素的锂盐。最近,俄罗斯科学院ZHILOV等[33]研究了以苯并-15-冠-5/氯仿为萃取剂有机相和以LiCl和LiBF4水相萃取分离锂同位素,发现其分别为1.036和1.030,并在以1H,1H,7H-十二氟-1-庚醇为有机溶剂相,利用萃取色谱进行多级锂同位素分离系数的测定,可获得富集丰度大于30%的6Li有机相。之后,该课题组[34]详细研究了苯并-15-冠-5/1H,1H,7H-十二氟-1-庚醇体系分离锂同位素,在以LiCl为萃取水相,其可达1.024,且发现水相锂盐浓度基本对无影响。
利用冠醚类萃取剂进行溶剂萃取法分离锂同位素,它们普遍具有较高的单级分离效应[35]。随着新的萃取体系的开发和技术的革新,如金属杂冠醚等新型萃取剂的合成、应用难挥发性离子液体代替了常规的有机试剂和液液微萃取应用,冠醚体系的倒相回流及水溶性等关键问题的解决,利用冠醚类溶剂萃取体系分离锂同位素是非常具有应用前景的分离方法。
2.2 萃取法分离7Li
最早用于7Li分离的螯合剂主要为一些醇、酮、单醚、酸和酯类络合剂[13],这些螯合剂包括中性溶剂萃取体系和非水萃取体系,但已报道这些萃取体系分离锂同位素分离系数均较小,原因是这些萃取剂配位氧原子能力较弱,与锂离子和水分子中氧之间的作用力相当,两相中的锂盐化合物的键强差极小,不适宜作为工业化分离锂同位素体系的主体萃取剂[36]。当前,萃取分离7Li同位素的萃取剂主要包括氮杂菲类和苯并喹啉类化合物,在碱性条件下,萃取剂的羟基上的氧原子能与Li+以很强的化学键的形式结合,远大于Li+与水分子之间的作用力,几种分离7Li的化合物的结构式如图4所示。
陈耀焕等[16,37]研究以萃取剂苏丹I为主体,发现由苏丹-I/TOPO/二甲苯与含Li+水溶液的螯合-中性配位体系其分离系数为1.009,并提出螯合-中性配位体协萃体系的锂同位素分离效应与螯合剂及中性协萃剂的螯合及配位能力有关,且结构效应也颇有影响。胡金波课题组[38]公开了一种用于分离锂同位素的偶氮类含氟萃取剂,该萃取剂具有廉价,化学稳定性优异,易于反萃、再生和对锂离子的萃取率高等优点,单级最高可达1.019。对于苯并喹啉类螯合剂,江南大学李在均课题组[39]采用双离子液体溶剂体系分离锂同位素,以4-甲基-10-羟基苯并喹啉为萃取剂,可达1.019±0.002。此外,中国科学院上海有机化学研究所[40-41]报道了一种分离锂同位素的苯并喹啉类化合物及萃取工艺,对锂离子萃取效率高,适用于单级和多级萃取工艺,分离系数在1.023左右。同时,该液液萃取体系中,有机相在上回流段加入,而在下回流段再生循环使用,采用高效液液分离设备进行的串级连接,实现7Li+的绿色、高效、多级富集。
综上所述,分离7Li的萃取剂大多合成相对容易,单级同位素分离系数和分配率较高。同时,基于螯合剂空间结构考虑,可考虑这些半环螯合剂体系中加入适当协萃剂,以期获得更大的分离系数和萃取率,更适宜的萃取体系有待深入探索。从长远角度考虑,新的萃取剂产生和工艺的开发将为锂同位素的萃取分离工业化开拓出新的道路。
3 离子交换色层法
离子交换色层法分离锂同位素主要是利用离子交换剂相和溶液相同位素平衡的的离子交换方法,反应式如式(5)。
6Li(solution)++7Li(exchanger)+—→7Li(solution)++6Li(exchanger)+(5)
离子交换色层法操作简单,在分离装置中填充离子交换剂,待离子交换剂相和溶液相接触时通过吸附和洗脱液解吸的过程来分离锂同位素,其同位素分离机理也是基于6Li+和7Li+与离子交换剂上的结合位点上振动频率的不同而引起两者键合能力的不同。离子交换色谱法的分离效应受很多因素的影响,如交换剂的结构、锂盐种类及浓度、洗脱液的种类及浓度、分离装置的结构、液相流速、操作温度和压力等。目前,用该法进行锂同位素的分离报道很多,下面从无机离子交换剂和有机离子交换剂这两种不同类型的离子交换剂来进行介绍。
无机离子交换剂是最早被用在离子交换色谱中来分离锂同位素的交换剂。自天然泡沸石(硅酸铝钠)被作为交换剂分离锂同位素以来,无机离子交换剂分离锂同位素得到了迅速发展,主要包括含HMO3(M=Sb,Nb,Ta)和层状无机结构的磷酸类金属盐[42]。日本学者[43-44]研究了以HSbO3、HNbO3和HTaO3作为交换剂,分离系数可达1.030~1.046,并得出该类吸附剂中水含量的减少对的提高有利,且理论计算最高可达1.05。此外,大量的磷酸金属盐类吸附剂也被应用到锂同位素分离的研究中,如M(HPO4)2(M=Ti、Sn)[45]、HZr2(PO4)3[46]、HTiZr2-x(PO4)3(0≤≤2)[47-49],结果表明物质的组成、合成方法、温度、pH、结晶水的含量对离子交换亲合力都有影响,得到最大为1.047。最近,SUGIYAMA等[50]提出了一种装填具有核壳结构的吸附剂的色谱柱来分离锂同位素,并对其传质过程进行模拟,结果表明具有该特殊结构的吸附剂可以有效地减小理论塔板数的数量。此外,江南大学顾志国课题组[51]制备了无机离子交换剂H0.36La0.55TiO3、H0.36La0.55Sr0.03TiO3和H0.36La0.56Ti0.97Al0.03O3并应用于锂同位素的分离,其最大单级分离系数分别为1.042、1.040和1.045,优于锰系和锆钛磷酸系的无机离子交换体系,且6Li+富集于交换剂相而7Li+富集在液相,其一般的交换机理见图5。之后,该课题组[52]又利用高温固相法合成了斜方锰矿型的Li2Ti3O7和尖晶石型的Li4Ti5O12,并对后者进行了不同含量Al3+的掺杂,得到Li3.95Al0.05Ti5O12和Li3.95Al0.1Ti5O12,这4种离子交换剂的最大分别为1.035、1.037、1.039和1.042。
有机离子交换剂用于锂同位素分离的研究当前主要集中在阳离子交换树脂和阳离子螯合树脂,几种典型的螯合树脂结构如图6所示。阳离子交换树脂是一类含有磺酸、羧酸、膦酸和铵型强酸阳离子等交换基团的树脂离子交换剂[53-55],其吸附剂的结构和淋洗液组成、交换工艺条件和温度等因素都会对锂同位素分离系数产生影响,但是整体的分离效应较小。冠醚螯合树脂是将具有水溶性的冠醚化合物嫁接到树脂上用来分离锂同位素。NISHIZAWA等[56]采用穴醚(2B,2,1)螯合树脂体系,可得到分离系数为1.034~1.047。此外,KIM等[57]合成了4'-氨基-苯并-15-冠-5螯合树脂并应用到锂同位素分离,结果表明该类树脂具有较好的锂同位素分离效应,分离系数高达1.053。之后,该团队[58-61]合成和研究了各种杂冠醚螯合树脂来进行锂同位素的分离,结果发现该类树脂都具有明显的分离效应,其中以N3O3的锂同位素分离系数最高,可达1.068。
最近,江南大学顾志国等[62]将苯并-15-冠-5和离子液体固载于多孔硅中,建立了绿色的锂同位素分离方法,分离因子高达1.046±0.002,发现该体系中萃取剂与Li+是以2∶1进行螯合配位的,其萃取机理如图7所示,且当以水为溶剂时,萃取材料表现出良好的稳定性。之后,该团队[63]以XAD-7树脂为担体分别制备了含有3种不同离子液体([C8mim][BF4]、[C8mim][PF6]、[C8mim][(CF3SO2)2N])和萃取剂(苯并-15-冠-5)的浸渍树脂并首次用于锂同位素的固-液分离,在固-液萃取体系中轻同位素6Li富集于固相,最大单级分离系数达到1.046±0.002,但该浸渍树脂当在乙醇中连续震荡36h后,苯并-15-冠-5仍然会被萃取出来。为了避免螯合剂的易流失及稳定性不强等缺陷,只有将冠醚通过化学接枝技术固载于高分子聚合物中,才能实现锂同位素的绿色高效分离。天津工业大学李建新等[64]以4-甲酰基苯并-15-冠-5和聚乙烯醇为原料,通过缩醛化反应制备苯并-15-冠-5接枝聚乙烯醇,在固-液萃取锂同位素分离LiBr过程中,其分离因子高达1.039。此外,该课题组[65-66]成功地将4-氨基-苯并-15-冠-5和4-甲酰基苯并-15-冠-5分别嫁接到高分子材料聚砜和壳聚糖上并应用到锂同位素的分离中,结果表明其单级分离系数可达1.031±0.002和1.037。
从以上研究表明,螯合树脂分离锂同位素的分离系数普遍比较大,是一种很有前景的分离方法,提高萃取剂与树脂结合的稳定性将有利于此分离方法的进一步发展。此外,利用离子交换色层法分离锂同位素也存在很多不足,如离子交换量有限、平衡耗时长、操作不连续和交换剂稳定性差、理论和工艺技术研究相对较少。然而,近年来,随着工业色谱分离技术的飞速发展,使上述难题在未来都能得到很好的解决,该技术用于工业化分离锂同位素具有巨大的潜力。
4 膜法联用
膜分离是一种利用具有选择性分离功能的材料,并根据分离物质的要求可对膜的孔径、材质和集成工艺设计的分离过程。由于膜的性能优越和可设计性,将膜与其他锂同位素分离技术相结合运用到锂同位素的分离中的研究越来越多。膜分离锂同位素,其原理与溶剂萃取和螯合树脂分离锂同位素相同,同位素的富集方向与体系中螯合剂与锂离子键合作用相关,只是同一种螯合剂以不同形态存在于各体系中。
将具有一定特异性和选择性的基团固载到膜表面和孔壁,李建新等[67]制备一种兼有膜分离和色谱两种技术的优点的新型分离方法,即膜色谱。该技术具有以下优点:①液体流速快,分离速度和处理量增大;②消除孔扩散阻力,传质效率大大提高;③动力设备投资和运行费用减少;④分离效果好,便于设计放大,其示意简图见图8(a)。该团队将冠醚嫁接到聚砜聚合物/非织造布复合膜作为膜色谱介质,利用淋洗法来分离锂同位素,结果表明膜色谱是一种很有前景的方法,其分离系数可达1.028。
2015年,何涛等[68]公布了一种简单、高效、低能耗的分离富集锂同位素的方法-膜化学交换技术(membrane chemical exchange,MCEX),单级膜萃取化学交换6Li示意简图见图8(b),其主要是采用具有离子传递功能且耐酸碱、耐有机溶剂的膜,使含天然丰度的锂盐溶液和溶有螯合剂分子有机相在膜两侧逆流接触交换,利用有机相中的螯合剂分子对6Li+和7Li+的键合力的强弱来达到分离富集的目的。此外,该团队[69]利用MCEX流程,其主要流程和萃取机理如图9,萃取剂富集7Li,在实验室用约为5个理论级的交换工艺,经248.5 h后,7Li的丰度由92.5013%富集到92.9238%。该法不仅具有溶剂萃取法的优点,同时也具有占地面积小、能耗小,运行稳定和易于规模化等优势,很有望成为工业化分离锂同位素的方法之一。
5 总结与展望
锂作为人类未来能源和国家战略的高能元素,对其同位素的分离显得尤为迫切。到目前为止,锂汞齐法是唯一利用化学分离且工业生产的锂同位素方法,但从长远角度来看,其对环境与人类的安全存在威胁,最终必然会被无汞分离体系取代。中科院青海盐湖研究所从20世纪70年代以来,积极组织开展了激光法和探讨无机材料吸附法来锂同位素的分离和机理研究,积累了一定的经验。近年来,随着该研究所建成以盐湖卤水为原料的全球首条“千吨级高纯氯化锂”生产线并成功试车投产,为锂同位素的分离提供了充足的原料保障。此外,为了盐湖锂资源的高值化利用,该研究所正积极开展锂同位素分离的前期研究工作。同时,为适应国家对能源、环境和国防安全的需求,加快和完善锂同位素分离体系的开发,还需从以下几个方面开展。
(1)采用液-液萃取和固-液萃取法来分离锂同位素,螯合剂的选择是整个工艺的核心,需根据螯合机理开展新萃取剂的设计和选择工作,并对已有的冠醚类、偶氮杂菲及苯并喹啉类等萃取剂继续进行结构优化选择(如侧基、锂的结合位点等),解决液液萃取两相中的乳化和固载化合物稳定利用等问题,并从工业化角度对生产工艺的完整性来优化参数(如单级分离系数、单级萃取率、螯合物的水溶性和多级萃取实验数据等),获得交换容量大和性能更为优越的萃取体系和固载材料。与此同时,满足工业分离锂同位素的高性能的分离设备也需要进一步开发。
(2)当前单一的传统有机溶剂很难满足多级液液萃取对工艺安全和稳定性问题的需求,可考虑选择对环境稳定的绿色溶剂——离子液体作为稀释剂,或可考虑合成具有萃取剂结构性能的功能性离子液体,为液液萃取体系和固液分离锂同位素开辟新的道路。
(3)仅采用化学交换分离锂同位素方法可能会存在一定的局限性,可考虑将其他分离方法进行有效的结合,如利用分级沉淀得到一定程度富集锂同位素产品作为其他方法的原料,或是将功能性的膜与各种分离技术如萃取、色谱交换、电迁移等方法相结合,改善单一方法的缺陷,发挥各自的优势。
(4)在分离锂同位素理论体系的构建上,很多问题都亟待解决(如6Li和7Li的富集方向不同,不同锂盐阴离子、不同的介电常数溶剂、不同溶剂或淋洗液下的分配系数和分离系数变化原因、不同条件下萃取和同位素交换机理如何等),需要进一步从理论和技术上进行完善,大量基础性的实验研究需要完成。同时,随着超级计算机等科技手段的进步与革新,在萃取剂结构设计、机理阐述和微观尺度等理论方面可以利用理论化学手段(如密度泛函理论、分子力学模拟及蒙特卡罗方法等)辅助分析和构建。
(5)为在未来的热核聚变的阵地上赢得先机,国家需要积极组织与整合国内研究机构对锂同位素分离技术和设备进行联合攻关,并加强对锂资源的战略性规划和保护,特别是锂资源集中的青海和西藏地区。
[1] XIANG Y,ZHU Z,XIANG X. Problems of lithium isotope research in salt lake study[J]. Acta Geologica Sinica(English Edition),2014,88(s1):165-166.
[2] WU J Z,SUN B Y,YANG E B,et al. Lithium isotope separation method and single-stage separation factor measurement method thereof:103736395(A)[P]. 2014-04-23.
[3] National Research council(US). Committee on separations technology, transmutation systems. Nuclear wastes:technologies for separations and transmutation[M]. US:National Academies Press, 1996.
[4] 严峰,袁威津,李建新,等. 冠醚化学交换分离锂同位素的影响因素分析及进展[J]. 化工进展,2014,33(s1):47-56.
YAN F,YUAN W J,LI J X,et al. Impact factor analysis of crown ether chemical exchange for the lithium isotopes separation[J]. Chemical Industry and Engineering Progress,2014,33(s1):47-56.
[5] LEWIS G N,MACDONALD R T. The separation of lithium isotopes [J]. J. Am. Chem. Soc.,1936,58:2519-2514.
[6] RYSKIN G Y,AGEEV R P. Separation of lithium isotopes during amalgam exchange with salt-solutions in organic-solutions. 1. Lithium salt-solutions in diethylamine[J]. Zh. Fiz. Khim.,1978,52(1):89-91.
[7] RYSKIN G Y,AGEEV R P,IVANENKO G S. Lithium isotope separation during amalgam exchange with salt-solutions in organic-solutions. 2. Lithium salt-solutions in pyridine and aniline[J]. Zh. Fiz. Khim.,1978,52(6):1447-1449.
[8] AGEEV R P,BANASEVICH A N,IVANENKO G S,et al. Separation of lithium isotopes during amalgam exchange with salt-solutions in organic-solutions. 3. Lithium salt-solutions in ammonia,methylamine,dimethylamine and propylamine[J]. Zh. Fiz. Khim.,1985,59(5): 1295-1296.
[9] PALKO A A,RY J S,BEGUN G M. Lithium isotope separation factors of some two-phase equilibrium systems[J]. Journal of Chemical Physics,1976,64(4):1828-1837.
[10] MAKOTO F,YASUHIKO F,MASAO N,et al. Isotope effects in electrolytic formation of lithium amalgam[J]. Journal of Nuclear Science and Technology,1986,23(4):330-337.
[11] VALFELLS A. Concurrent separation of lithium and hydrogen isotopes:US 4058440 A[P]. 1977-11-15.
[12] CORDOVA M H,ANDRADE C G. Lithium-6 enrichment studies using Li-Cd-Hg ternary amalgams[J]. Nucleotecnica,1993,13:15-24.
[13] 陈耀焕.溶剂萃取分离锂同位素概况[J]. 稀有金属,1983,2(4):79-87.
CHEN Y H. The research progress of lithium isotopes separation by solvent extraction[J]. Rare Metals,1983,2(4):79-87.
[14] BIGELEISEN J, MAYER M G. Calculation of equilibrium constants for isotopic exchange reactions[J]. Journal of Chemical Physics,1947,15(5):261-267.
[15] BETTS R H,BRON J. A discussion of partial isotope separation by means of solvent extraction[J]. Separation Science,1977,12(6):635-639.
[16] 陈耀焕,严金英,李永坤,等. 溶剂萃取分离锂同位素研究Ⅱ. 苏丹Ⅰ-中性配位体协萃体系萃取分离锂同位素效应探讨[J]. 原子能科学技术,1987,21(5):536-544.
CHEN Y H,YAN J Y,LI Y K,et al. Studies on separation of lithium isotopes by solvent extraction II. Study on the separation effects of lithium isotopes by SUDAN 1-neutral ligand synergetic extraction systems[J]. Atomic Energy Science and Technology,1987,21(5):536-544.
[17] 夏斐斐,曾德文,房春晖,等. Li+的水合结构和近似饱和水合层:基于密度泛函理论的研究[J]. 盐湖研究,2013(3):40-48.
XIA F F,ZENG D W,FANG C H,et al. Hydrated structure and approximated complete hydration shell of Li+:a density functional theory investigation[J]. Journal of Salt Lake Research,2013(3):40-48.
[18] BODA A,ALI S M,RAO H,et al. Ab initio and density functional theoretical design and screening of model crown ether based ligand (host) for extraction of lithium metal ion (guest): effect of donor and electronic induction[J]. Journal of Molecular Modeling,2012,18(8):3507-3522.
[19] PEDERSEN C J. Cyclic polyethers and their complexes with metal salts[J]. Journal of the American Chemical Society,1967,89(26): 7017-7036.
[20] JEPSON B E,CAIRNS G A. Lithium isotope effects in chemical exchange with (2,2,1) cryptand[R]. Miamisburg,OH(USA):Mound Facility,1979.
[21] 支克正,窦富全,朱建华,等. 冠醚分离锂同位素研究Ⅰ. 锂盐-穴醚两相交换体系的锂同位素效应[J]. 原子能科学技术,1982(6):686-690.
ZHI K Z,DU F Q,ZHU J H,et al. Study on separation of lithium isotopes by crown ethers I. The separation effects of lithium isotopes by lithium salts-cryptand synergetic extraction systems[J]. Atomic Energy Science and Technology,1982(6):686-690.
[22] NISHIZAWA K,TAKANO T,IKEDA I,et al. Extractive separation of lithium isotopes by crown ethers[J]. Separation Science and Technology, 1988,23(4-5):333-345.
[23] NISHIZAWA K,ISHINO S,WATANABE H,et al. Lithium isotope separation by liquid-liquid extraction using benzo-15-crown-5[J]. Journal of Nuclear Science and Technology,1984,21(9):694-701.
[24] 傅立安,方胜强,姚钟麒,等. 多醚液-液萃取体系中各种因素对锂的热力学同位素效应的影响[J]. 核化学与放射化学,1989,11(3):142-420.
FU L A,FANG S Q. Factors influencing the thermodynamic isotope effect of lithium in ployether-lithium liquid-liquid extraction systems[J]. Journal of Nuclear and Radiochemistry,1989,11(3)142-420.
[25] LIU Y,INOUE Y.,HAKUSHI T. Molecular design of crown ethers. VII. syntheses and cation selectivities of unsubstituted 12 -to 16-crown-4[J] Bull. Chem. Soc. Jpn,1990,63(10):3044-3046.
[26] 方胜强,傅立安. 多醚萃取体系中锂的同位素效应——盐浓效应[J]. 同位素,1991(3):166-173.
FANG S Q, FU L A. Lithium isotope effect in the extraction systems of polyethers——effect of salt concentration[J]. Journal of Isotopes, 1991(3):166-173.
[27] 方胜强,傅立安.冠醚萃取体系中锂的同位素效应——混合锂盐效应[J]. 同位素,1994(3):168-171.
FANG S Q,FU L A. Lithium isotope effect in the extraction systems of crown ethers——effect of mixed salts of lithium[J]. Journal of Isotopes,1994(3):168-171.
[28] 方胜强,傅立安,高志昌. 对甲苯氧基联苯桥联双苯并-15-冠-5分离锂同位素的能力[J]. 核化学与放射化学,1992,14(2):111-113.
FANG S Q,FU L A,GAO Z C. Separative ability of p-methylphenoxy linked biscrown ether to lithium isotopes[J]. Journal of Nuclear and Radiochemistry,1992,14(2):111-113.
[29] FANG S Q,FU L A. Extractive separation of lithium isotopes by 4--butylbenzo-15-crown-5[J]. Journal of Radioanalytical and Nuclear Chemistry,1994,187(1):25-32.
[30] GROTE Z,WIZEMANN H.D,SCOPELLITI R,et al. Lithium isotope separation by 12-metallacrown-3 complexes[J]. Z. Anorg. Allg. Chem.,2007,633(5-6):858-864.
[31] DAVOUDI M,MALLAH M H. Enrichment of6Li using dispersive liquid–liquid microextraction as a highly efficient technique[J]. Annals of Nuclear Energy,2013,62:499-503.
[32] SUN X L,ZHOU W,GU L,et al. Liquid-liquid extraction to lithium isotope separation based on room-temperature ionic liquids containing 2,2'-binaphthyldiyl-17-crown-5[J]. Journal of Nuclear Science and Technology,2015,52(3):332-341.
[33] DEMIN S V,ZHILOV V I,TSIVADZE A Y. Lithium and boron isotope effects in extraction systems[J]. Russian Journal of Inorganic Chemistry, 2015,60(5):633-637.
[34] DEMIN S V,ZHILOV V I,TSIVADZE A Y. Lithium isotope effects in extraction of lithium chloride by benzo-15-crown-5 in the 1,1,7-trihydrododecafluoroheptanol-water system[J]. Russian Journal of Inorganic Chemistry,2016,61(1):119-122.
[35] 顾志国,李在均,杨杰. 锂同位素分离[J]. 化学进展,2011,23(9):1892-1905.
GU Z G,LI Z J,YANG J. Advance in lithium isotope separation[J]. Progress in Chemistry,2011,23(9):1892 -1905.
[36] 袁群. 锂的溶剂萃取[J]. 有机化学,1979(1):90-118.
YUAN Q. The method extracting lithium by solvent extraction[J]. Chinese Journal of Organic Chemistry,1979(1):90-118.
[37] 陈耀焕,严金英,吴甫炳,等. 溶剂萃取分离锂同位素研究Ⅰ. 苏丹Ⅰ-中性配位体协萃体系萃取分离锂同位素效应[J].原子能科学技术,1987,21(4):433-440.
CHEN Y H,YAN JY,WU F B,et al. Studies on separation of lithium isotopes by solvent extraction Ⅰ. The separation effects of lithium isotopes by SUDAN 1-neutral ligand synergetic extraction systems[J]. Atomic Energy Science and Technology,1987,21(4):433-440.
[38] HU J B,ZHANG W,ZHENG W Q,et al. Fluorine- containing extractant and application thereof:104140379(A). [P].2014-11-12.
[39] XU J J,LI Z J,GU Z G,et al. Green and efficient extraction strategy to lithium isotope separation with double ionic liquids as the medium and ionic associated agent[J]. Journal of Radioanalytical and Nuclear Chemistry,2013,295(3):2103-2110.
[40] 中国科学院上海有机化学研究所. 一种用于分离锂同位素的萃取剂及其应用:103801194A[P]. 2014-05-21.
Shanghai Institute of Organic Chemistry,Chinese Academy of Sciences. A kind of separating lithium isotope extraction agent and its application:103801194A[P].2014-05-21.
[41] HU J B,ZHANG W,ZHENG W Q,et al. Backflow cascade novel process for producing lithium-7 isotope:WO2014201890 (A1)[P].2014-12-24.
[42] TAYLOR T I,UREY H C. On the electrolytic and chemical exchange methods for the separation of the lithium isotopes[J]. The Journal of Chemical Physics,1937,5(7):597-598.
[43] INOUE Y,KANZAKI Y,ABE M. Isotopic separation of lithium using inorganic ion exchangers[J]. Journal of Nuclear Science and Technology,1996,33(8):671-672.
[44] KANZAKI Y,SUZUKI N.7Li/6Li isotope separation on inorganic ion-exchangers and NMR study of the H+/Li+ion-exchange reaction[J]. The Journal of Physical Chemistry B,2002,106(5):988-995.
[45] MAKITA Y,KANOH H,HIROTSU T,et al. Fractionation of lithium isotopes by intercalation in layered inorganic ion exchangers[J]. Chemistry Letters,1998(1):77-78.
[46] OI T,UCHIYAMA Y,HOSOE M,et al. Alkali metal ion and lithium isotope selectivity of HZr2(PO4)3[J]. Journal of Nuclear Science and Technology,1999,36(11):1064-1068.
[47] TAKAHASHI H,OI T. Selectivity of alkali metal ion and lithium isotopes on ion exchangers prepared from MTi0.5Zr1.5(PO4)3(M=Li,Na)[J]. Journal of Materials Science,2001,36(7):1621-1625(5).
[48] TAKAHASHP H,MIYAJIMA T,OI T. Selectivity of alkali metal ion and lithium isotopes on ion exchangers in H form prepared from LiTiZr2-x(PO4)3(=0,1)[J]. Journal of Nuclear Science and Technology,2002,39(4):463-466.
[49] TAKAHASHI H,ZHANG Y H,MIYAJIMA T,et al. Ion exchange properties and selectivity of lithium isotopes on ion exchangers in the hydrogen form prepared from LiTiZr2−x(PO4)3(0≤≤2)[J]. Journal of Materials Chemistry,2006,16:1462-1469.
[50] SUGIYAMA T, SUQIURA K, ENOKIDE Y,et al. Separative analyses of a chromatographic column packed with a core-shell adsorbent for lithium isotope separation[J]. Fusion Sci. Technol.,2015,67(3):584-587.
[51] GU L,SUN X L,ZHOU W,et al. Ion exchange properties and lithium isotopes selectivity of H0.36La0.55TiO3,H4Ti5O12and H2Ti3O7[J]. Journal of Radioanalytical and Nuclear Chemistry,2016,307(2):973-983.
[52] 顾玲. 无机离子交换分离锂同位素的研究[D]. 无锡:江南大学,2015.
GU L. Study on the separation of lithium isotopes by inorganic ion exchangers[D]. Wuxi:Jiangnan University,2015.
[53] LEE D A. The enrichment of lithium isotopes by ion exchange chromatography. III. The influence of the nature of the solution phase on the separation factor[J]. Journal of the American Chemical Society,1961,83:1801-1803.
[54] LEE D A. Enrichment of lithium isotopes by ion exchange chromatography[J]. J. Chem. Eng. Data,1961(4):565-566.
[55] KIM D W,JUNG J H. Influence of chelating agents in eluent on the separation factor of lithium isotopes[J]. Journal of Radioanalytical and Nuclear Chemistry,1989,130(1):63-70.
[56] NISHIZAWA K,WATANABE H,ISHAN S,et al. Lithium isotope separation by cryptand (2B,2,1) polymer[J]. Journal of Nuclear Science and Technology,1984,21(2):133-138.
[57] KIM D W,KIM B K,PARK S R,et al. Separation of lithium isotope by azacrown tetramerrifield peptide resin[J]. Journal of Radioanalytical and Nuclear Chemistry,1998,232(1/2):257-259.
[58] KIM D W,PARK H K,KIM C S,et al. Separation of lithium isotopes with the N3O2trimerrifield peptide resin[J]. Journal of Radioanalytical and Nuclear Chemistry,1999,242(3):769-772.
[59] KIM D W,JANG Y H,LEE N S,et al. Separation of lithium isotopes by N4O2azacrown ion exchanger[J]. Journal of Radioanalytical and Nuclear Chemistry,1999,240(1):155-158.
[60] KIM D W,KIM B K,PARK S R,et al. Separation of lithium isotope by azacrown tetramerrifield peptide resin[J]. Journal of Radioanalytical and Nuclear Chemistry,1998,232(1-2):257-259.
[61] KIM D W. Separation of lithium and magnesium isotopes by hydrous manganese(Ⅳ) oxide[J]. Journal of Radioanalytical and Nuclear Chemistry, 2002, 252(3):559-563(5).
[62] ZHOU W,SUN X L,GU L,et al. A green strategy for lithium isotopes separation by using mesoporous silica materials doped with ionic liquids and benzo-15-crown-5[J]. Journal of Radioanalytical and Nuclear Chemistry,2014,300(2):843-852.
[63] 顾玲,孙晓利,任冬红,等. 离子液体/苯并15-冠-5浸渍XAD-7树脂萃取分离锂同位素[J]. 核化学与放射化学,2015,37(6):415-424.
GU L,SUN X L,REN D H,et al. Extraction separation of lithium isotopes by using XAD-7 resins impregnated with ionic liquid and benzo-15-crown-5[J]. Journal of Nuclear and Radiochemistry,2015,37(6):415-424.
[64] 李团乐,裴洪昌,袁威津,等. 苯并15-冠-5接枝聚乙烯醇制备优化及其锂同位素分离效应研究[J]. 高分子学报,2015(7):792-799.
LI T L,PEI H C,YUAN W J,et al. Preparation and characterization of polyvinyl alcohol copolymer grafted with 4'-Formoxylbenzo- 15-crown-5-ether for lithium isotopes separation[J]. Acta Polymerica Sinica,2015(7):792-799.
[65] YAN F,PEI H C,PEI Y C,et al. Preparation and characterization of polysulfone-graft-4'-aminobenzo-15-crown-5-ether for lithium isotope separation[J]. Industrial & Engineering Chemistry Research,2015,54(13):3473-3479.
[66] 张婷,严峰,李建新,等. 壳聚糖接枝苯并15-冠-5醚制备及锂同位素分离研究[J]. 胶体与聚合物,2015,33(1):3-6.
ZHANG T,YAN F,LI J X,et al. Preparation and characterization of chitosan graft 4'-formoxylbenzo-15-crown-5-ether for lithium isotopes separation[J]. Chinese Journal of Colloid & Polymer,2015,33(1):3-6.
[67] 裴艳春,严峰,李建新,等. 基于锂同位素分离的大环聚醚及其固载化聚合物研究进展[J]. 膜科学与技术,2013,33(6):102-110.
PEI Y C,YAN F,LI J X,et al. A review of macrocylic polyethers and their immobilized polymers for the separation of lithium isotopes[J]. Membrane Science and Technology,2013,33(6):102-110.
[68] HE T,SONG J F,CHEN G H,et al. Method and device for separating and enriching lithium isotopes by utilizing membrane extraction:104607046(A)[P]. 2015-5-13.
[69] 何涛. 膜化学交换富集锂同位素取得突破[J]. 膜科学与技术,2015,35(2):130-131.
HE T. A breakthrough of enrichment lithium isotopic by the method of membrane chemical exchange[J]. Membrane Science and Technology,2015,35(2):130-131.
Research progress of lithium isotope separation by chemical exchange method
XIAO Jiang1,2,JIA Yongzhong1,SHI Chenglong1,WANG Xingquan1,YAO Ying1,JING Yan1
(1Key Lab of Comprehensive and Highly Efficient Utilization of Salt Lake Resources,Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining 810008,Qinghai,China;2University of Chinese Academy of Science,Beijing 100049,China)
Lithium isotopes(lithium-6 and lithium-7),as important raw materials required in the development of nuclear energy,play a great role in energy,environment,defense-national security,and other fields. The chemical exchange methods for lithium isotopes separation include amalgam exchange process,solvent extraction,chromatography and membrane method. The separation mechanisms,advantage and disadvantage of various lithium isotopes separation methods,have been systematically analyzed,classified and summarized in this paper. The results indicated that lithium isotope separation is related to the bond effect of complexing agent and lithium ionic in the chemical exchange separation system;and lithium amalgam exchange process will be replaced by other non-mercury separation systems due to environmental concerns. In addition,the lithium isotopes separation methods of using solvent extraction,ion exchange chromatographic and membrane are very promising,which all are relatively effective separation . Based on the summarization of the current research progresses,the future researches on the separation of lithium isotopes are highlighted,such as the design and synthetics of new chelating agent,the combination of different separation process and the separation mechanism in different experiment condition.
lithium isotope;chemical exchange;separation;extraction;mechanism
O614.111;O611.7
A
1000–6613(2017)01–0029–11
10.16085/j.issn.1000-6613.2017.01.004
2016-06-02;修改稿日期:2016-07-12。
国家自然科学盐湖专项基金项目(U140710047)。
肖江(1987—),男,博士研究生,主要从事盐湖锂资源的综合利用开发。联系人:景燕,研究员。E-mail: YanJingqh001@126.com。

