煤焦异相还原N2O的反应机理
余岳溪,高正阳,季鹏,李方勇,杨维结
(1广东电网有限责任公司电力科学研究院,广东 广州 510080;2华北电力大学能源动力与机械工程学院,河北 保定 071003)
煤焦异相还原N2O的反应机理
余岳溪1,高正阳2,季鹏2,李方勇1,杨维结2
(1广东电网有限责任公司电力科学研究院,广东 广州 510080;2华北电力大学能源动力与机械工程学院,河北 保定 071003)
采用两种不同的简化煤焦模型,利用量子化学密度泛函理论研究了煤焦异相还原N2O的反应机理。通过计算反应物、中间体以及过渡态的结构和能量明确了反应的过程,并通过热力学分析和动力学分析深入分析煤焦异相还原N2O的反应机理。研究结果表明:单个碳原子无法体现N2O分子在煤焦表面的吸附和脱附过程,不适于作为煤焦模型研究煤焦异相还原N2O的反应,六环苯环簇碳基模型可以成功地研究煤焦异相还原N2O的反应。煤焦异相还原N2O的反应共经历三个过渡态和两个中间体将N2O还原成N2,N2O分子在煤焦表面的吸附反应的活化能为51.01 kJ·mol−1,煤焦表面吸附N2O的过程容易进行。煤焦异相还原N2O的反应在所研究的温度范围(298.15~1500 K)内为放热反应,可以自发发生,反应平衡常数大于105,可以完全进行,认为是单向反应。煤焦异相还原 N2O的反应在所研究的温度范围(298.15~1500 K)内反应速率较快,反应活化能为 43.55 kJ·mol−1,Arrhenius表达式为1.24×1010exp(−5238.15/T)。
煤焦;异相还原;N2O;吸附;热力学;反应动力学
引 言
N2O是一种危害性极强的温室气体,可通过消耗平流层中的臭氧破坏臭氧层[1]。燃煤电站N2O排放主要来自循环流化床机组,燃煤循环流化床N2O的排放量为50~200 ml·m−3,最高可达400 ml·m−3[2-4]。
为控制循环流化床中N2O排放,国内外学者对此进行了大量的实验研究。侯海盟等[5]通过研究循环流化床污泥燃烧特性试验发现,城市污泥同煤混燃有助于减少燃烧城市污泥的N2O排放。Shen等[6]研究了生物质与煤粉掺烧条件下氮氧化物的排放特性,研究表明掺烧可以明显降低N2O排放,且金属氧化物对低N2O排放有益。Wang等[7]在富氧燃烧的实验中得出,煤焦对N2O的还原贡献大于金属氧化物。Li等[8]研究了运行参数对N2O排放的影响,提高燃烧温度和整体的氧气浓度有助于降低 N2O排放。Noda等[9]采用同位素标记手段研究了煤焦还原N2O生成N2的反应,研究发现还原反应过程中焦炭表面的氮组分对还原 N2O作用不大,主要是N2O会进攻碳基表面的自由位点进而发生还原反应。由各学者的研究结论可以总结出煤焦在还原N2O的过程中起到了重要作用,且温度升高有助于该还原反应的进行。
目前对于煤焦异相还原 N2O的研究主要依靠实验手段,对于微观机理的理论研究不够,异相反应过程中的反应路径和过渡态结构仍不清楚,因此需要对煤焦异相还原N2O进行理论研究,进一步揭示反应的微观机理。量子化学方法是研究化学反应微观机理的有效手段,可计算反应过渡态结构分析反应过程,被广泛应用于涉及碳基的微观机理的研究[10-13]。因此,本文采用量子化学方法研究煤焦异相还原N2O的反应过程,计算反应过程过渡态明确反应路径,并进行动力学和热力学分析,揭示煤焦异相还原N2O的反应机理。
1 计算理论
1.1 模型选择
Zhou等[11]和王子剑等[14]分别以单个碳原子模型和苯环簇碳基模型研究了煤焦异相还原NO的反应机理。屈文麒等[15]和高正阳等[16]均采用六环扶手型苯环簇结构模型分别研究了CO和CO2对碳基吸附汞的影响机理。为对比不同模型对反应机理研究的影响,本文采用六环扶手型苯环簇结构和单一碳原子两种模型模拟煤焦表面。对于苯环簇结构,留出6个未饱和的碳原子模拟活性位,其他位置碳原子利用H原子封闭。具体模型结构如图1所示。
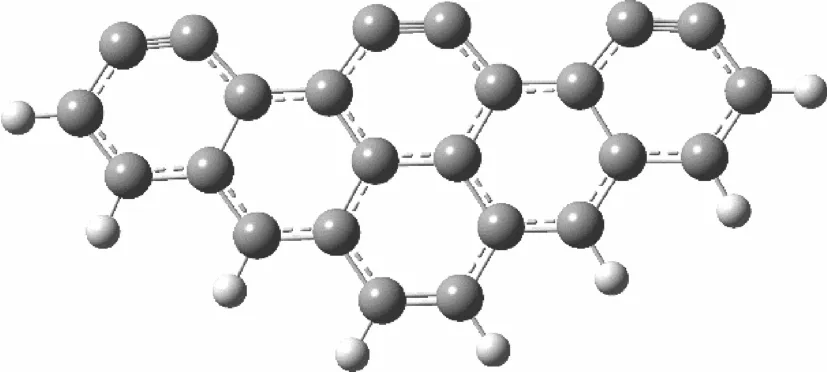
图1 煤焦表面模型Fig.1 Model of char surface
1.2 理论方法
结构优化和频率分析计算采用密度泛函理论中的B3PW91方法和6-31G(d)基组,该方法对于气固非均相反应的计算效果较好[17],能量计算中采用双杂化泛函中的B2PLYP方法和def2tzvp全电子基组。能量计算中均考虑了零点能矫正,零点能矫正为经过频率矫正计算得到[18]。反应中的过渡态结构有且仅有一个虚频,虚频振动方向指向反应方向,并对过渡态结构进行路径分析验证从而确保反应过程的正确性。计算程序为Gaussian 09[19]。
经典过渡态理论的反应速率常数计算公式如下[20]
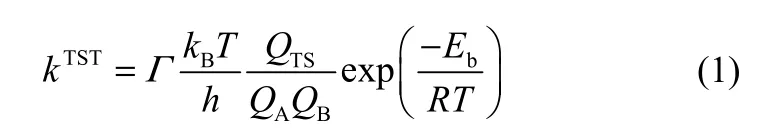
式中,Γ为量子隧道修正系数;Eb为反应势垒,kJ·mol−1;R为气体摩尔常数,J·mol−1·K−1;T为温度,K;kB为Boltzmann常数,J·K−1;h为普朗克常数,J·s;QTS、QA、QB依次为过渡态TS、反应物A和反应物B的配分函数。
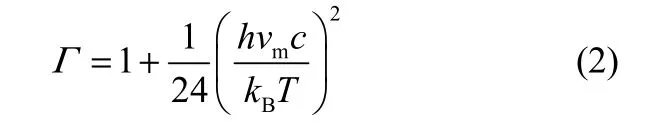
式中,vm为反应路径振动的频率,cm−1;c为光速,m·s−1。
平衡常数计算公式如下[21]
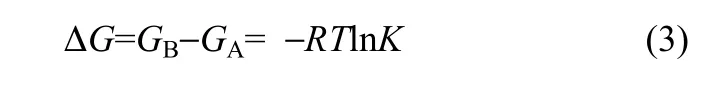
式中,GA和GB分别为反应物和产物的Gibbs自由能,kJ·K−1;K为平衡常数。
2 结果分析
2.1 反应过程
对于单个碳原子模型异相还原N2O的反应,经历1个过渡态和1个中间体最终生成产物N2和CO,反应过程和能量变化如图2所示。
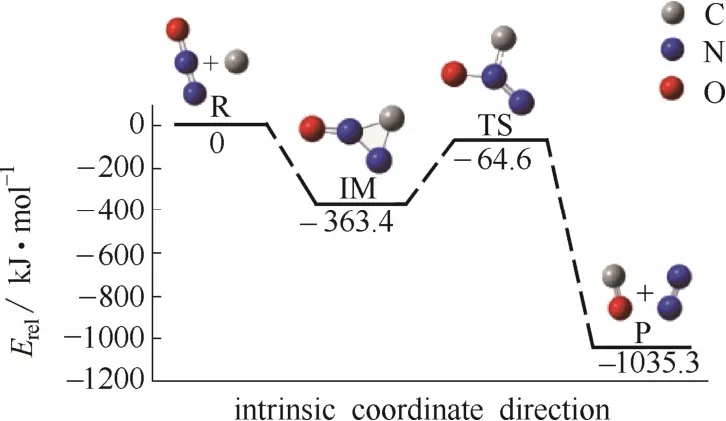
图2 反应过程能量变化(单个碳原子模型)Fig.2 Geometrical structures and relative energies of stationary points(single carbon atom model)
对于六环苯环簇碳基模型异相还原 N2O的反应,经历3个过渡态和两个中间体,还原N2O生成N2,反应过程和能量变化如图3所示,反应中涉及到的各驻点结构如图4所示。首先N2O吸附在碳基表面,C(1)—O距离缩短,由2.357 Å(TS1)(1 Å=0.1 nm, 后同)变为1.330 Å(IM1);C(2)—N距离缩短,由2.279 Å(TS1)变为1.379 Å(IM1);在吸附过程中碳基表面使得N2O活化,N2O中的N═N键有所拉长,由1.209 Å(TS1)变为1.247 Å(IM1)。随后N2O在碳基表面发生还原反应,N—O键拉长,由1.497 Å(IM1)变为2.063 Å(TS2)再变到3.200 Å(IM2)。最后N2脱离碳基表面,C(2)—N键长拉长,由1.324 Å(IM2) 变为2.408 Å(TS3),实现N2在碳基表面的脱附。
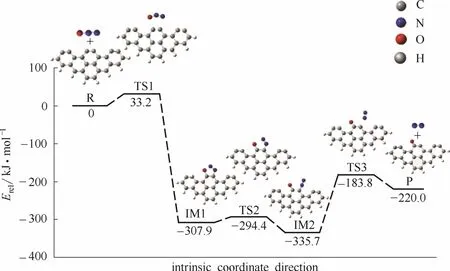
图3 反应过程能量变化(六环苯环簇碳基模型)Fig.3 Geometrical structures and relative energies of stationary points(six rings carbonaceous cluster model)
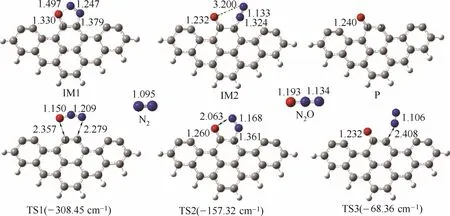
图4 各驻点结构Fig.4 Geometrical structures of stationary points
对比两种模型下的反应机理,单个碳原子模型下的反应势垒为298.8 kJ·mol−1,六环扶手型苯环簇碳基模型下的反应势垒为151.9 kJ·mol−1,不同模型下的反应过程和势垒均差异显著,不同模型对结果影响较大,单个碳原子无法体现N2O气体分子在煤焦表面的吸附和脱吸附过程,相比真实情况相差较多,因此本文对六环扶手型苯环簇碳基模型下的反应过程进行深入的研究分析,进而深刻地解释煤焦异相还原N2O的反应机理。
2.2 热力学分析
对于可逆反应来说,进行热力学分析可以得到反应性质和反应平衡常数,有助于全面理解化学反应。循环流化床的炉内温度在950~1250 K之间[6],因此本文在298.15~1500 K变化范围计算并分析异相还原反应的热力学参数,如表1所示。
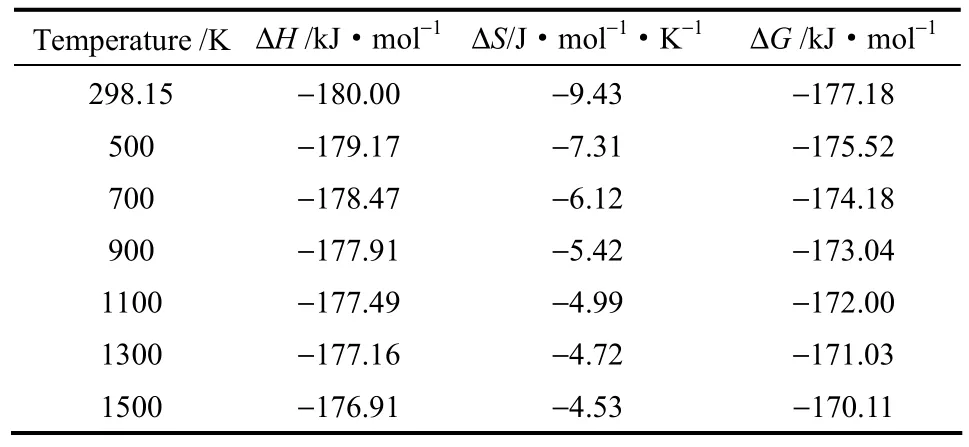
表1 不同温度下的热力学参数Table 1 Thermodynamic parameters at different temperatures
分析表 1中数据可得,不同温度下反应的ΔH<0,说明反应在研究温度范围内均为放热反应;随温度升高,ΔH的绝度值有所减小,说明随温度升高反应的放热量略有减少。不同温度下 ΔG<0,说明反应在研究范围内均可以自发发生;随温度升高,ΔG的绝对值有所减小,说明随温度升高反应的自发性略有减少。
平衡常数可以衡量平衡状态下反应进行的程度,是分析可逆化学反应的重要参数。根据表1中数据和平衡常数计算公式,计算不同温度下的平衡常数,如图5所示。
分析图5曲线可得,平衡常数在298.15~1500 K范围内始终大于 105,说明反应基本可以完全进行,可以认为是单向反应[19]。煤焦异相还原N2O的反应从热力学的角度上不但可以自发进行,而且在实际循环流化床运行温度范围内可以完全进行,可看作单向反应。
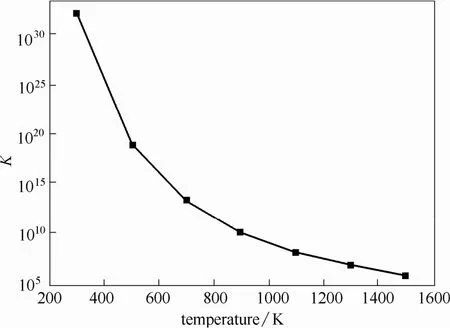
图5 不同温度下的平衡常数Fig.5 Equilibrium constants at different temperatures
2.3 动力学分析
根据经典过渡态理论计算煤焦异相还原 N2O反应不同温度下的反应速率常数,如图6所示。
由图6曲线可得,各步反应的化学反应速率常数随温度升高而增大,但各步反应随温度升高的增长快慢不同。N2O在煤焦表面的吸附过程(R→IM1)在研究温度范围内反应速率常数随温度变化明显且始终较大,该步的反应势垒为33.2 kJ·mol−1,说明N2O在煤焦表面的吸附反应容易发生且速率较快。
根据稳态近似理论,假设反应过程中的中间体处于稳态[20],计算煤焦还原N2O总体反应的反应速率常数,计算公式如下
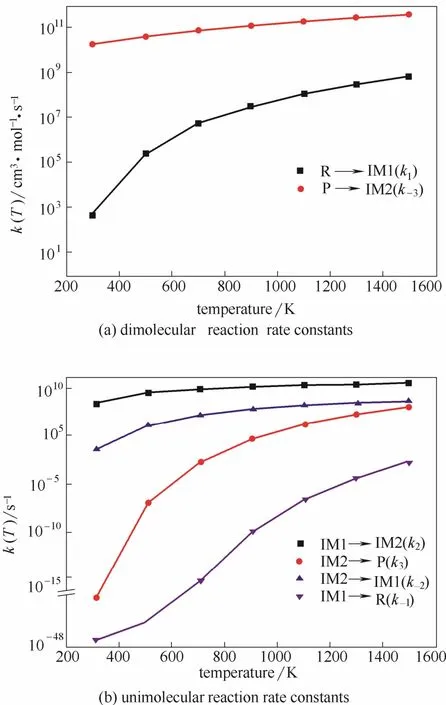
图6 不同温度下的反应速率常数Fig.6 Reaction rate constants at different temperatures
根据总体反应速率公式绘制不同温度下总体反应速率常数,如图7所示。由图7曲线可得,总体反应速率常数随温度升高而增大,这同各实验结论一致[5-9],且在研究温度范围内始终保持较大的数值,说明煤焦异相还原N2O的反应速率较快。
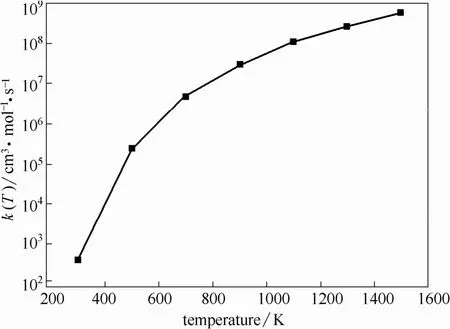
图7 不同温度下的总体反应速率常数Fig.7 Overall reaction rate constants at different temperatures
对图6和图7中反应速率曲线进行拟合,得到各步反应和总体反应的 Arrhenius方程和动力学参数,如表 2所示。总体反应的活化能为 43.55 kJ·mol−1,数值较小,反应容易发生。
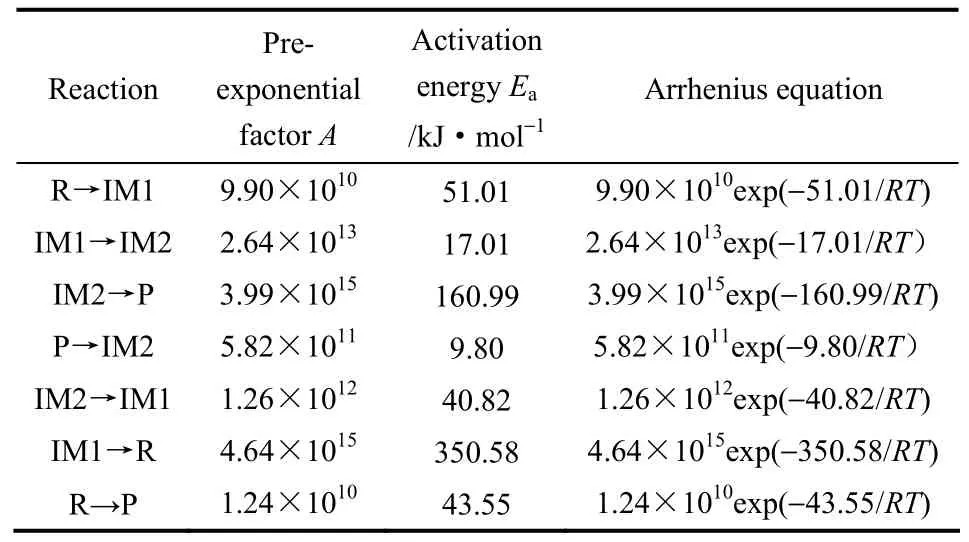
表2 各步反应动力学参数Table 2 Kinetic parameters for reaction steps
3 结 论
(1)不同模型下煤焦还原N2O反应的势垒差异显著,单个碳原子无法体现N2O分子在煤焦表面的吸附和脱附过程,不适于作为煤焦模型研究煤焦异相还原N2O的反应,六环苯环簇碳基模型可以成功地研究煤焦异相还原N2O的反应。
(2)煤焦异相还原N2O的反应共经历3个过渡态和两个中间体将N2O还原成N2,N2O分子在煤焦表面的吸附反应的活化能为51.01 kJ·mol−1,说明煤焦表面吸附N2O过程容易进行。
(3)热力学分析表明,煤焦异相还原N2O的反应在所研究的温度范围内均为放热反应,可以自发发生,反应平衡常数大于 105,可以完全进行,认为是单向反应。
(4)动力学分析表明,煤焦异相还原N2O的反应在所研究的温度范围内反应速率较快,反应活化能为 43.55 kJ·mol−1,Arrhenius表达式为 1.24× 1010exp(−5238.15/T)。
[1]谢建军, 杨学民, 张磊, 等. 循环流化床燃煤过程NO、N2O和SO2的排放行为研究[J]. 燃料化学学报, 2006, 34(2): 151-159. XIE J J, YANG X M, ZHANG L, et al. Behavior of NO, N2O and SO2emissions during coal combustion in a circulating fluidized bed combustor[J]. Journal of Fuel Chemistry and Technology, 2006, 34(2): 151-159.
[2]吴晓蔚, 朱法华, 杨金田, 等. 火力发电行业温室气体排放因子测算[J]. 环境科学研究, 2010, 23(2): 170-176. WU X W, ZHU F H, YANG J T, et al. Measurements of emission factors of greenhouse gas(CO2, N2O) from thermal power plants in China[J]. Research of Environmental Sciences, 2010, 23(2): 170-176.
[3]DE LAS OBRAS-LOSCERTALES M, MENDIARA T, RUFAS A, et al. NO and N2O emissions in oxy-fuel combustion of coal in a bubbling fluidized bed combustor[J]. Fuel, 2015, 150: 146-153.
[4]沈来宏, 铃木善三. 流化床燃烧石油焦 N2O排放特性[J]. 化工学报, 2000, 51(5): 649-653. SHEN L H, YOSHIZO S. N2O formation and reduction in fluidized bed combustion of petroleum coke[J]. Journal of Chemical Industry and Engineering(China), 2000, 51(5): 649-653.
[5]侯海盟, 李诗媛, 吕清刚, 等. 城市干化污泥循环流化床燃烧过程中 NO和 N2O的排放特性[J]. 工程热物理学报, 2012, 33(12): 2197-2201. HOU H M, LI S Y, LÜ Q G, et al. Emission characteristics of NO and N2O during dried sewage sludge combustion in circulating fluidized bed[J]. Journal of Engineering Thermophysics, 2012, 33(12): 2197-2201.
[6]SHEN B X, MI T, LIU D C, et al. N2O emission under fluidized bed combustion condition[J]. Fuel Processing Technology, 2003, 84(1): 13-21.
[7]WANG C, DU Y, CHE D. Study on N2O reduction with synthetic coal char and high concentration CO during oxy-fuel combustion[J]. Proceedings of the Combustion Institute, 2015, 35(2): 2323-2330.
[8]LI S, XU M, JIA L, et al. Influence of operating parameters on N2O emission in O2/CO2combustion with high oxygen concentration in circulating fluidized bed[J]. Applied Energy, 2016, 173: 197-209.
[9]NODA K, CHAMBRION P, KYOTANI T, et al. A study of the N2formation mechanism in carbon-N2O reaction by using isotope gases[J]. Energy & Fuels, 1999, 13(4): 941-946.
[10]信晶, 孙保民, 朱恒毅, 等. 煤焦边缘模型异相还原NO的Mayer键级变化分析[J]. 煤炭学报, 2014, 39(4): 771-775.XIN J, SUN B M, ZHU H Y, et al. Variation analysis of Mayer bond order during the heterogeneous reduction reaction between NO and char edge models[J]. Journal of China Coal Society, 2014, 39(4): 771-775.
[11]ZHOU Z, ZHANG X, ZHOU J, et al. A molecular modeling study of N2desorption from NO heterogeneous reduction on char[J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2014, 36(2): 158-166.
[12]朱恒毅, 孙保民, 信晶, 等. 富氧燃烧环境下CO对煤焦异相还原NO的量子化学研究[J]. 煤炭学报, 2015, 40(7): 1641-1647. ZHU H Y, SUN B M, XIN J, et al. Quantum chemistry research on NO heterogeneous reduction by char with the participation of CO under oxy-fuel combustion atmosphere[J]. Journal of China Coal Society, 2015, 40(7): 1641-1647.
[13]ZHANG H, LIU J, WANG X, et al. Density functional theory study on two different oxygen enhancement mechanisms during NO-char interaction[J]. Combustion and Flame, 2016, 169: 11-18.
[14]王子剑, 刘豪, 赵然, 等. 高浓度CO2气氛下煤焦异相还原NO的量子化学研究[J]. 燃烧科学与技术, 2012, 18(1): 79-84. WANG Z J, LIU H, ZHAO R, et al. Quantum chemistry research on NO heterogeneous reduction by char under high CO2concentration atmosphere[J]. Journal of Combustion Science and Technology, 2012, 18(1): 79-84.
[15]屈文麒, 刘晶, 沈锋华, 等. CO对碳基吸附汞的影响机理研究[J].工程热物理学报, 2013, 34(3): 550-553. QU W Q, LIU J, SHEN F H, et al. Effect of carbon monoxide on mercury adsorption on carbonaceous materials[J]. Journal of Engineering Thermophysics, 2013, 34(3): 550-553.
[16]高正阳, 吕少昆. 烟气中 CO2对碳基吸附铅的影响机理[J]. 动力工程学报, 2015, 35(10): 840-845. GAO Z Y, LÜ S K. Effect of carbon dioxide in flue gas on lead adsorption over carbonaceous surface[J]. Journal of Chinese Society of Power Engineering, 2015, 35(10): 840-845.
[17]LIU J, CHENEY M A, WU F, et al. Effects of chemical functional groups on elemental mercury adsorption on carbonaceous surfaces[J]. Journal of Hazardous Materials, 2011, 186(1): 108-113.
[18]GAO Z Y, LV S K, YANG W J, et al. Quantum chemistry investigation on the reaction mechanism of the elemental mercury, chlorine, bromine and ozone system[J]. Journal of Molecular Modeling, 2015, 21(6): 1-9.
[19]FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09, revision D. 01[CP]. Wallingford, CT: Gaussian Inc., 2013.
[20]ZHANG H, LIU J, SHEN J, et al. Thermodynamic and kinetic evaluation of the reaction between NO (nitric oxide) and char (N)(char bound nitrogen) in coal combustion[J]. Energy, 2015, 82: 312-321.
[21]ALI M A, RAJAKUMAR B. Thermodynamic and kinetic studies of hydroxyl radical reaction with bromine oxide using density functional theory[J]. Computational & Theoretical Chemistry, 2011, 964: 283-290.
Heterogeneous reduction reaction of N2O by char
YU Yuexi1, GAO Zhengyang2, JI Peng2, LI Fangyong1, YANG Weijie2
(1Electric Power Science Research Institute of Guangdong Power Grid Co., Ltd., Guangzhou 510080, Guangdong, China;2School of Energy and Power Engineering, North China Electric Power University, Baoding 071003, Hebei, China)
Two different simplified models of coal char were applied to investigate heterogeneous reduction mechanism of N2O by char through density functional theory in quantum chemistry method. Structure and energy of reactants, intermediates and transition states were calculated so as to determine reaction process, and thermodynamic and kinetic analysis were conducted to reveal heterogeneous reaction mechanism. The results showed that the single carbon atom was not suitable as the model of heterogeneous reaction mechanism of N2O by char due to it cannot reflect the adsorption and desorption of N2O molecule in char surface. While the heterogeneous reaction mechanism of N2O by char can be well studied by six rings carbonaceous cluster model. Through three transition states and two intermediates, N2O was reduced to N2, and energy barrier of N2O adsorption on char surface was 51.01 kJ·mol−1, indicating that adsorption process was easy to happen. In addition, the heterogeneous reduction of N2O by char was exothermic and spontaneous reaction at temperature range of 298.15—1500 K, and reaction can take place in one direction owing to reaction equilibrium constant of greater than 105. Furthermore, the reaction was fast at temperature range of 298.15—1500 K, and reaction activationenergy was 43.55 kJ·mol−1with Arrhenius expression of 1.24×1010exp(−5238.15/T).
char; heterogeneous reduction; N2O; adsorption; thermodynamics; reaction kinetic
YANG Weijie, 18331121421@163.com
TQ 534
:A
:0438—1157(2017)01—0369—06
10.11949/j.issn.0438-1157.20160815
2016-06-14收到初稿,2016-09-27收到修改稿。
联系人:杨维结。
:余岳溪(1976—),男,硕士,高级工程师。
南方电网科研项目(K-GD2014-173)。
Received date: 2016-06-14.
Foundation item: supported by the Research Project of Southern Power Grid (K-GD2014-173).

