反应萃取分离2-苯基丁酸对映体的动力学
蒋盼,张盼良,曾乐林,许卫凤,唐课文
(1湘潭大学化工学院,湖南 湘潭 411105;2湖南理工学院化学化工学院,湖南 岳阳 414006)
反应萃取分离2-苯基丁酸对映体的动力学
蒋盼1,张盼良2,曾乐林2,许卫凤2,唐课文2
(1湘潭大学化工学院,湖南 湘潭 411105;2湖南理工学院化学化工学院,湖南 岳阳 414006)
通过恒界面池法进行了羟乙基-β-环糊精反应萃取2-苯基丁酸对映体的动力学研究。采用双膜理论和均相反应模型描述了萃取过程的相际传质机理,并考察了搅拌速率、界面面积、对映体初始浓度和萃取剂初始浓度等因素对2-苯基丁酸对映体的萃取动力学的影响。实验结果表明羟乙基-β-环糊精与2-苯基丁酸对映体之间的包合反应属于“快反应”;2-苯基丁酸对映体反应分级数为1,羟乙基-β-环糊精反应分级数为2;(+)-2-苯基丁酸和(-)-2-苯基丁酸在278 K下的反应速率常数分别为2.829×10−4、1.803×10−4m6·mol−2·s−1。该萃取动力学研究为大规模生产中的反应萃取过程的设计和操作以及设备的设计和过程强化提供了科学的依据。
动力学;萃取;化学反应;2-苯基丁酸
引 言
手性药物的药理作用是通过与生物大分子之间的严格手性匹配来实现的,具有立体选择性,可引起手性药物对映体的药理学差异[1]。其中,一种对映体可能具有显著的药理活性,而另一种对映体的活性较低或没有活性,甚至具有副作用[2-6]。以2-苯基丁酸(2-phenylbutyric acid,2-PBA,图1)作为中间体合成的吲哚布芬为例,(+)-吲哚布芬的抗血栓和抗炎活性较(-)-吲哚布芬更显著[7]。因此,对光学纯药物的开发进行研究是非常重要的。
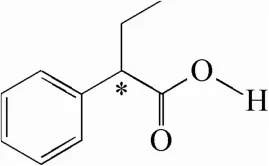
图1 2-苯基丁酸分子结构式(*表示手性中心)Fig.1 Chemical structure of 2-phenylbutyric acid (* indicates a chiral centre)
目前,通过拆分获得单一对映体的方法主要有非对映体结晶法[8-9]、动力学拆分法[10-12]、色谱法[13-14]、液膜法[15-16]、毛细管电泳法(CE)[17-18]。上述分离方法通常不具备通用性,所以对于一种新型的手性化合物来说,拆分方法的选择和优化需要相当长的时间进行探索。相比之下,液液反应萃取[19-21]是一种操作简单、成本低、易于工业放大的技术。当单级萃取可以实现部分分离时,通过多级萃取可以获得所需纯度的对映体[22]。在液液反应萃取中,手性萃取剂和两个对映体的反应程度的差异是影响手性分离效率的主要因素。因此,要求手性萃取剂必须有足够大的立体选择性和容量。相比于冠醚[20]、卟啉[23]、酒石酸衍生物[24]和杯芳烃[25],环糊精衍生物(CDs)具有疏水性空腔,可以通过范德华力、色散力、偶极作用、氢键和静电力等分子间相互作用[26]选择性地包合疏水性的客体分子,从而构建超分子识别体系;另一方面,环糊精衍生物具有较高的水溶性和较小毒性,是一种高容量、环保型的手性萃取剂[22]。
对于手性药物的拆分体系,液液反应萃取研究主要集中于萃取剂的选择、萃取体系的构建及萃取平衡的研究,而对萃取设备的选择、设计以及工业放大等过程放大的研究则较少,但这方面的研究是由实验小试走入产业化生产的必由之路。而过程放大的研究的前提之一则是需要研究该萃取过程的动力学。当前,研究萃取动力学的方法主要有液滴法[27-28]、充分混合法[29-30]、支撑液膜法[31-32]、Y-Y型微量体装置[33]和恒界面池法(Lewis cell)[34-36]。与其他方法相比,恒界面池(图 2)具有相对稳定的相界面积、简单的结构、便于操作等优势。因此,本研究选择恒界面池法研究羟乙基-β-环糊精萃取分离2-苯基丁酸的动力学特性。

图2 恒界面池装置Fig.2 Diagram of constant interfacial area cell (Lewis cell)
在前期工作中,已完成了2-苯基丁酸对映体的单级萃取实验,并得到了最佳的萃取条件。在此基础上进一步对反应萃取分离2-苯基丁酸对映体的动力学进行研究。通过实验和计算,确定了萃取反应级数和反应速率常数,为深入研究其萃取过程提供了一定的理论基础。
1 实验试剂及方法
1.1 试剂
水溶性羟乙基-β-环糊精购自淄博千汇生物科技有限公司。外消旋体2-苯基丁酸(2-PBA),含量≥98.0%,梯希爱(上海)化成工业发展有限公司;乙酸,分析纯,国药集团化学试剂有限公司;三乙胺,分析纯,含量≥99.0%,天津市福晨化学试剂厂;液相色谱所用溶剂为色谱纯;其他溶剂均为分析纯。
1.2 分析方法
水相中2-苯基丁酸对映体的浓度采用高效液相色谱测定。色谱条件为:Waters 1525型高效液相色谱仪(美国),Diamonsil C18 柱(150 mm × 4.6 mm i.d.);流动相组成为 V(0.5%的乙酸水溶液)∶V(甲醇)=9∶5,羟丙基-β-环糊精(HP-β-CD)浓度为 25 mmol·L−1,pH为4.0(用三乙胺调节pH);柱温30℃,流速0.8 ml·min−1,进样量10 μl,UV检测波长225 nm。水相pH通过pH计(Orion, model 720A, USA)测定。(+)-2-苯基丁酸的保留时间短于(-)-2-苯基丁酸(图3)。
1.3 动力学实验
采用恒界面池进行动力学实验。恒界面池主要由两个玻璃圆筒相互嵌套组成,环间通入恒温循环水保持恒定的温度(278 K);内部圆筒高7.5 cm、内径6.8 cm,通过界面环等分成两部分,两相接触面积可通过选用不同大小的界面环进行调节;两相搅拌速率通过调节电机转速控制。实验时,首先在恒 界 面 池 内 注 入 110 ml 0.1 mol· L−1NaH2PO4/H3PO4(pH=3.0,含0.1 mol·L−1HE-β-CD)水溶液,然后将等体积的含 2-苯基丁酸对映体的1,2-二氯乙烷溶液缓慢沿壁面注入恒界面池中,启动搅拌装置保持两相搅拌速度一致并开始计时,按一定时间间隔取水相样品进行液相色谱分析。
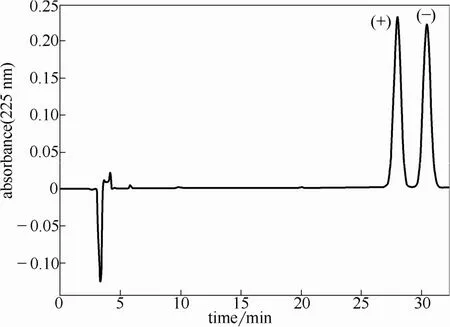
图3 2-苯基丁酸液相分析Fig.3 Chromatograms of 2-phenylbutyric acid
2 结果与讨论
2.1 搅拌速度对初始萃取速率的影响
从萃取平衡(图 4)可知,2-苯基丁酸对映体可以在两相间分配。由于环糊精具有很强的亲水性,因此羟乙基-β-环糊精(HE-β-CD,CD)与 2-苯基丁酸(A±)对映体相互作用形成的非对映体包合物仅存在于水相中。所以,化学反应只在水相中发生均相反应[20]。
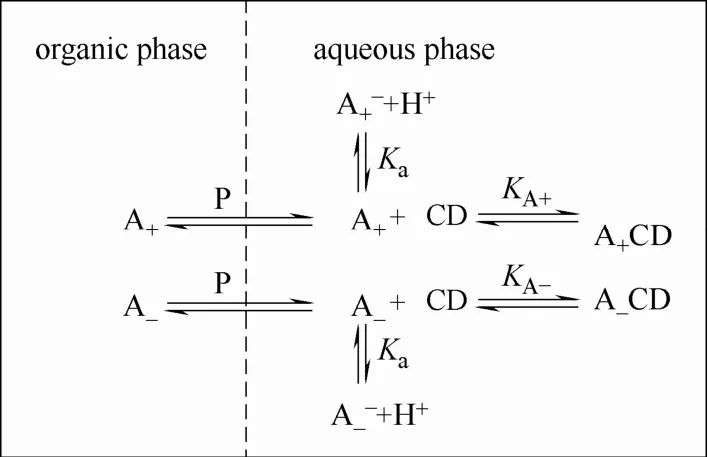
图4 反应萃取机理图(P为物理分配比,K为反应平衡常数)Fig.4 Diagram of mechanism of extraction reaction (P is ratio of physical distribution, K is constant of reaction equilibrium)
采用双膜理论来描述萃取过程的相际传质[20],其假设水相和有机相主体因各自的搅拌作用而充分混合,物理分配在两相界面处达到平衡。伴随(m, n)级化学反应的过程可分为4个区域(regime)[37],萃取反应发生的4个区域可以通过Hatta数(Ha)确定[20],也可以通过改变界面面积、搅拌速率的实验结果判定。区域判断的具体依据见表1。

表1 不可逆反应的动力学区分Table 1 Regimes analysis for irreversible reaction
通过考察两相搅拌速度对初始萃取速率的影响,可初步判别动力学控制步骤。保持两相界面面积为 12.56 cm2,改变两相搅拌速度,测定水相中2-苯基丁酸浓度,可以得到2-苯基丁酸对映体浓度随时间的变化[图5, (+)-2-PBA]。结合实验数据通过式(1)计算不同条件下的初始萃取速率 RAi,0(mol·m−2·s−1)。
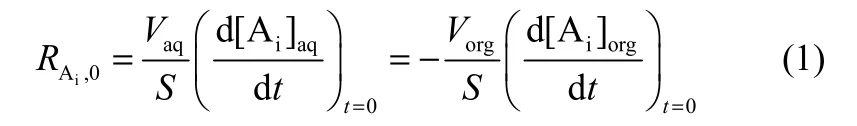
式中,S为相界面积;Vaq为水相体积;Vorg为有机相体积;[Ai]aq和[Ai]org分别为水相和有机相中 t时刻的(+)-2-苯基丁酸或(-)-2-苯基丁酸对映体浓度。
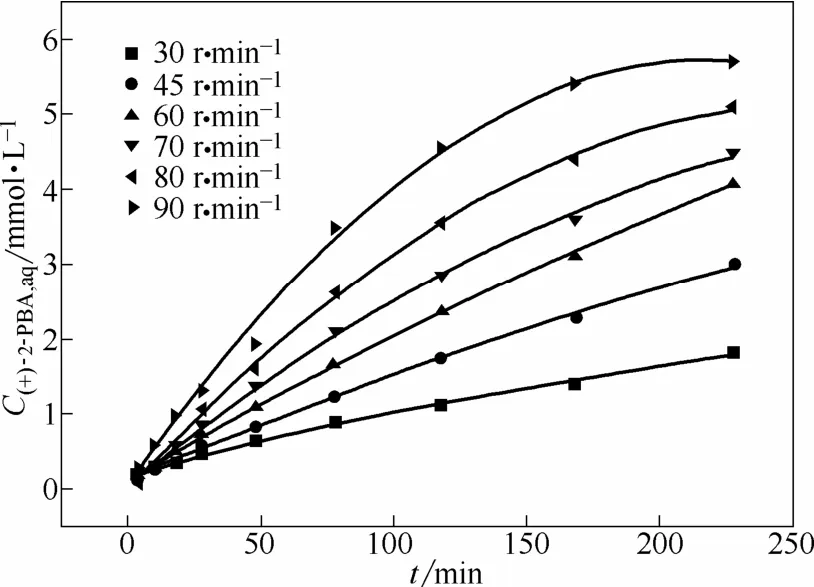
图5 不同搅拌速度下水相中(+)-2-苯基丁酸的浓度随时间的变化Fig.5 Variation of (+)-2-phenylbutyric acid concentration versus time at different stirring speed
通过式(1)求取不同转速下的初始萃取速率,其计算结果如图 6所示。当搅拌速度在 45~60 r·min−1时,萃取初始速率随着搅拌速度增加而增加。这是由于两相的薄膜厚度随搅拌速度的增加而变薄,相际传质主要受扩散过程控制。当搅拌速度在60~80 r·min−1时,初始萃取速率随搅拌速度的增加变化相当缓慢,在这一“坪区”中薄膜的厚度随搅拌速度的增加而没有明显改变。此时,可认为两相薄膜的厚度基本保持恒定,且两相主体已充分混合。结合相界面积的大小,可研究两相的萃取动力学特性。当搅拌速度高于80 r·min−1时,萃取初始速率再次随着搅拌速度的增加而显著上升。这是由于两相的接触界面的波动导致了接触面积的增大,从而导致萃取初始速率的快速增大。为了在相对稳定的界面积和黏滞膜厚度下进行萃取动力学的实验研究,在后续实验中搅拌速度均控制为 75 r·min−1。在该搅拌速度附近,增加搅拌速度对初始萃取速率无明显影响,由表1可知萃取反应发生在区域1或区域3。
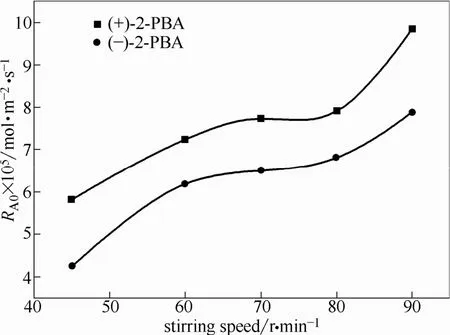
图6 搅拌速度对初始萃取速率的影响Fig.6 Influence of stirring speed on initial rate of extraction
2.2 两相接触面积对初始萃取速率的影响
为了进一步确认萃取反应发生的区域,考察了相界面积和初始速率之间的关系。通过改变界面环的大小,可改变两相接触面积(7.07~15.91 cm2),并测定不同的相界面积下的初始萃取速率。如图7所示,随着两相接触面积的增大,初始萃取速率与相界面积呈线性上升趋势。因此,从图6、图7及表1可以得出,2-苯基丁酸对映体与羟乙基-β-环糊精之间的反应发生在区域3,即羟乙基-β-环糊精萃取2-苯基丁酸对映体过程是伴随快速化学反应的反应萃取过程。
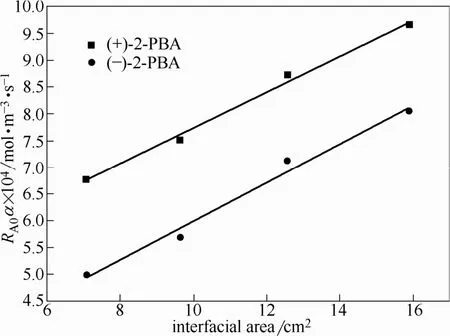
图7 两相接触面积对初始速率的影响Fig.7 Influence of interfacial area on initial rate of extraction
2.3 反应级数的确定
图8为基于双模理论的区域3[37]的传质过程示意图。在t趋近于0时,有机相黏滞薄膜中的对映体浓度与主体浓度相同,即
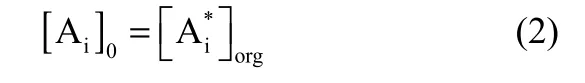
在相界面上存在以下分配
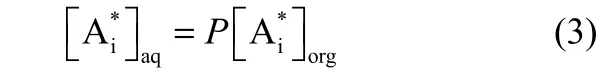
式中,[Ai]0为有机相主体中对映体的初始浓度;[Ai*]为相界面上的(+)-2-苯基丁酸或者(-)-2-苯基丁酸对映体的浓度。
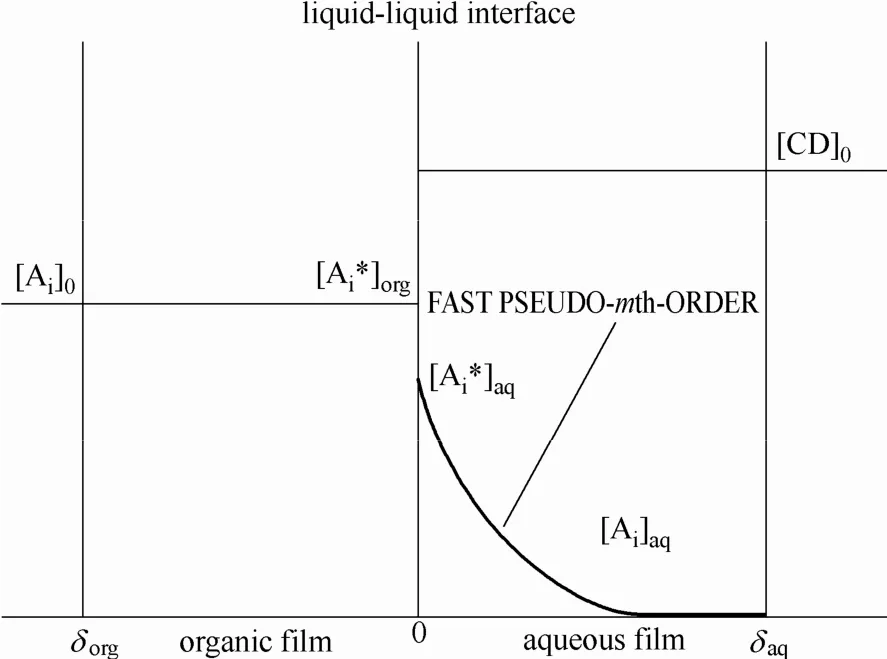
图8 2-苯基丁酸对映体与羟乙基-β-环糊精在相界面处的浓度分布示意图(区域3)Fig.8 Concentration profile of 2-PBA and HE-β-CD at liquid-liquid interface (regime 3)
在水相薄膜中2-苯基丁酸的物理扩散和化学反应同时发生,其物料衡算可表示

式中,Daq,Ai为(+)-2-苯基丁酸或(-)-2-苯基丁酸对映体的扩散系数;[CD]0为水相中羟乙基-β-环糊精的初始浓度;km,n为(m, n)级反应的速率常数。
2-苯基丁酸对映体在相界面处的传质速率可表示为

由于该萃取反应为快速反应,可认为水相薄膜中溶解的2-苯基丁酸还没来得及扩散入主体,即在薄膜中被反应完全[37]。因此,可以得到以下的边界条件
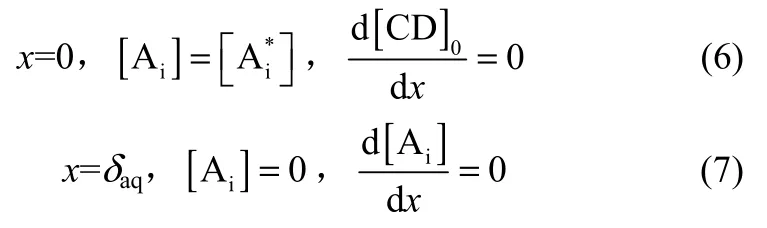
结合上述边界条件,将式(4)和式(5)积分,可以得到伴随快速化学反应的初始萃取速率表达式

通过测定不同2-苯基丁酸对映体初始浓度条件下的初始萃取速率确定萃取反应对于2-苯基丁酸对映体的反应级数。结果如图9所示,RAi,0与2-苯基丁酸对映体在有机相中的初始浓度呈现出较好的线性变化关系。根据式(8)进行线性回归分析,得m= 1,即羟乙基-β-环糊精萃取2-苯基丁酸对映体的反应对(+)-2-苯基丁酸和(-)-2-苯基丁酸均为一级反应。

图9 2-苯基丁酸初始浓度对初始萃取速率的影响Fig.9 Influence of 2-PBA concentration on initial rate of extraction
将水相中羟乙基-β-环糊精初始浓度从 0.075 mol·L−1增加到0.2 mol·L−1,得到萃取剂初始浓度与初始萃取速率的关系(图 10)。由图可知,初始萃取速率的变化与羟乙基-β-环糊精初始浓度的变化呈线性关系。根据式(8)进行回归分析,可知n = 2,即羟乙基-β-环糊精萃取2-苯基丁酸对映体的反应对羟乙基-β-环糊精为二级反应。
2.4 物理传质系数的测定
通过物理分配实验,即无萃取剂存在的条件下可得到物理传质系数KL,aq,Ai。由双膜理论可知
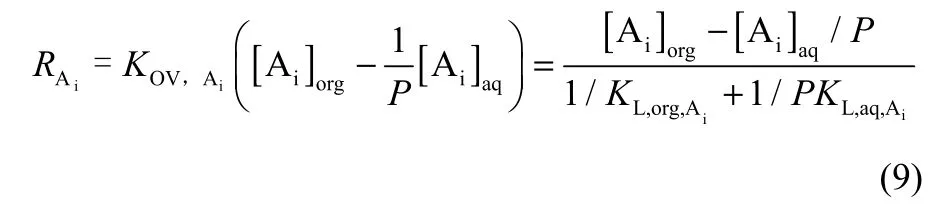
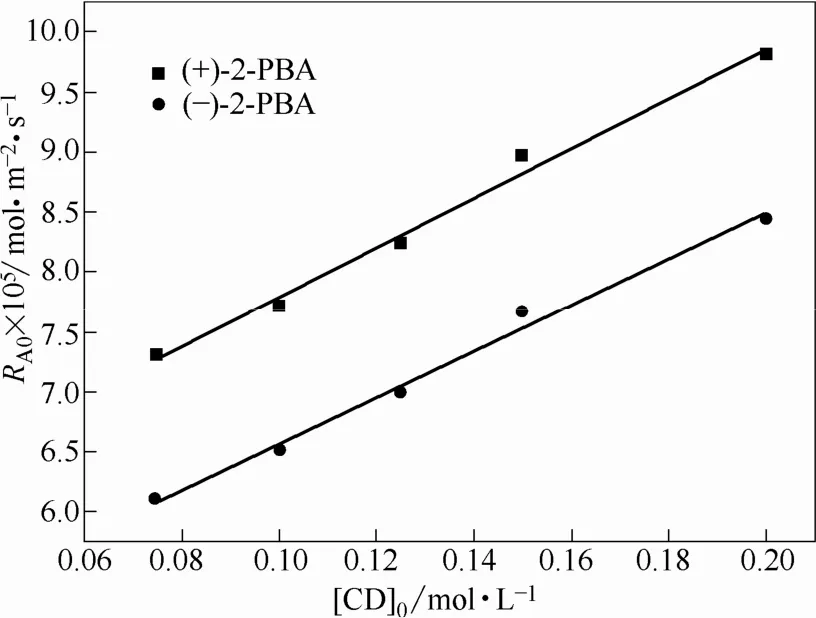
图10 羟乙基-β-环糊精初始浓度对初始萃取速率的影响Fig.10 Influence of HE-β-CD concentration on initial rate of extraction
其中,2-苯基丁酸在水相中的溶解度较小,即P值较小。因此,在KL,aq,Ai和KL,org,Ai的值相差不大的情况下,1/KL,org,Ai<<1/(PKL,aq,Ai),即有机薄膜中的传质阻力1/KL,org,Ai可忽略不计。因此,传质速率的表达式为
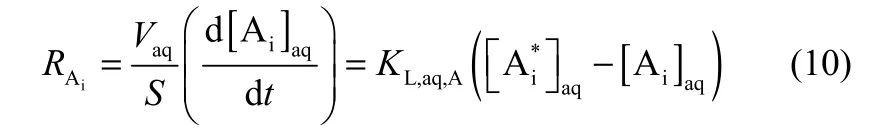
式(10)积分得到
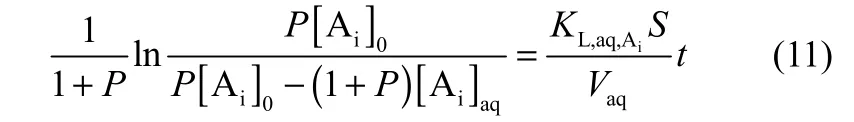
由 1/(1+P)ln[P[A+]0/(P[A+]0- (1+P)[A+]aq)]对时间(t)作图可以得到一条直线,根据直线的斜率可以求得KL,aq,A+为1.204×10−6m·s−1。
2.5 速率常数的确定
由上述结果知m = 1, n = 2,则初始萃取速率表达式[式(8)]可化为
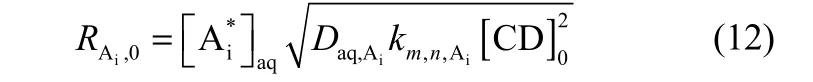
Daq,A+和 Daq,A−通过 Wilke-Chang方程计算求得,Daq,A+= Daq,A−= 3.259×10−10m2·s−1。根据图9的数据进行拟合,可得速率常数 km,n,A+= 2.829×10−4m6·mol−2·s−1,km,n,A−= 1.803×10−4m6·mol−2·s−1。
在初始时,对于正向反应速率表达式为 rA= km,n[A]m[C]n的可逆反应,其Ha表达式与发生在水相的(1, 2)级的反应的Ha表达式[式(13)]相同。
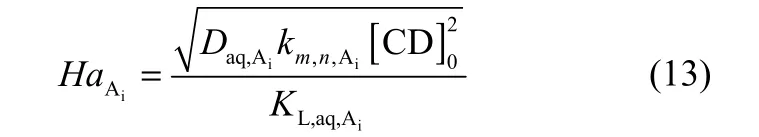
通过计算得到HaA+= 25.21,HaA−= 20.13。该结果验证了萃取反应确实发生在区域 3,即萃取过程是由伴随快速化学反应的反应萃取过程。
3 结 论
用恒界面池进行了羟乙基-β-环糊精反应萃取2-苯基丁酸对映体的动力学研究。得出以下结论:萃取过程是由伴随快速化学反应的扩散过程控制。萃取反应对2-苯基丁酸对映体浓度为一级反应,对羟乙基-β-环糊精浓度为二级反应。(+)-2-苯基丁酸,(-)-2-苯基丁酸反应速率常数分别是 km,n,(+)= 2.829×10−4m6·mol−2·s−1,km,n,(−)=1.803×10−4m6·mol−2·s−1。
符 号 说 明
A+——(+)-2-苯基丁酸
A-——(−)-2-苯基丁酸
[Ai]——(+)-2-苯基丁酸或(−)-2-苯基丁酸的主体浓度
[Ai*]——(+)-2-苯基丁酸或(−)-2-苯基丁酸的界面浓度
a ——接触面积与溶液体积的比值,m−1
[CD] ——羟乙基-β-环糊精主体浓度
D——扩散系数,m2·s−1
Ha ——Hatta数
KL——物理传质系数,m·s−1
km,n——表观速率常数,m6·mol−2·s−1
m ——2-苯基丁酸对映体反应分级数
n——羟乙基-β-环糊精反应分级数
R——萃取速率,mol·m−2·s−1
S ——两相接触面积,m2
t ——时间,s
V ——溶液体积,m3
δ ——液膜厚度
下角标
aq ——水相
org ——有机相
0 ——初始值
[1]HEFNAWY M M, ABOUL-ENEIN H Y. A validated LC method for the determination of vesamicol enantiomers in human plasma using vancomycin chiral stationary phase and solid phase extraction [J]. J. Pharm. Biomed. Anal., 2004, 35(3): 535-543.
[2]GUXMÁN A, YUSTE F, TOSCANO R A, et al. Absolute configuration of (-)-5-benzoyl-1,2-dihydro-3H-pyrrolo[1,2-alpha]-pyrrole-l-carboxylic acid, the active enantiomer of ketorolac [J]. J. Med. Chem., 1986, 29(4): 589-591.
[3]MITSCHER L A., SHARMA P N, CHU D T W, et al. Chiral DNA gyrase inhibitors (Ⅱ): Asymmetric synthesis and biological activity of the enantiomers of 9-fluoro-3-methyl-10-(4-methyl-1-piperazinyl)-7-oxo-2,3-dihydro-7H-pyrido[1,2,3-de]-1,4-benzoxazine-6-carboxylic acid (ofloxacin) [J]. J. Med. Chem., 1987, 30(12): 2283-2286.
[4]PLENGE P, MELLERUP E T, HONORÉ T, et al. The activity of 25 paroxetine/femoxetine structure variants in various reactions, assumed to be important for the effect of antidepressants [J]. J. Pharm. Pharmacol., 1987, 39(11): 877-882.
[5]SHUM W P, CHEN J, CANNARSA M J. Synthesis and enantiomeric purity determination of chiral 3-benzylglycidol, a key synthon for HIV protease inhibitors [J]. Chirality, 1994, 6(8): 681-684.
[6]HALABI A, FERRAYOLI C, PALACIO M, et al. Validation of a chiral HPLC assay for (R)-salbutamol sulfate [J]. J. Pharm. Biomed. Anal., 2004, 34(1): 45-51.
[7]CERLETTI C, MANARINI S, COLOMA M, et al. The (+)-enantiomer is responsible for the antiplatelet and anti-inflammatory activity of (±)-indobufen [J]. J. Pharm. Pharmaco., 1990, 42(12): 885-887.
[8]VIEGAS R M C, AFONSO C A M, CRESPO J G, et al. Racemic resolution of propranolol in membrane contactors: modelling and process optimization [J]. J. Membr. Sci., 2007, 305(1/2): 203-214.
[9]GOURLAY M D, KENDRICK J, LEUSEN F J J. Predicting the spontaneous chiral resolution by crystallization of a pair of flexible nitroxide radicals [J]. Cryst. Growth. Des., 2008, 8(8): 2899-2905.
[10]HUERTA F F, BÄCKVALL J E. Enantioselective synthesis of β-hydroxy acid derivatives via a one-pot aldol reaction-dynamic kinetic resolution [J]. Org. Lett., 2001, 3(8): 1209-1212.
[11]GINESTA X, PERICAS M A, RIERA A. Straightforward entry to the pipecolic acid nucleus. enantioselective synthesis of baikiain [J]. Tetrahedron. Lett., 2002, 43(5): 779-782.
[12]MAKINO K, GOTO T, HIROKI Y, et al. Stereoselective synthesis of anti-β-hydroxy-α-amino acids through dynamic kinetic resolution [J]. Angew. Chem. Int. Ed., 2004, 43(7): 882-884.
[13]SCHURIG V. Separation of enantiomers by gas chromatography [J]. J. Chromatogr. A., 2001, 906(1/2): 275-299.
[14]GUO Z, WANG H Y, ZHANG Y. Chiral separation of ketoprofen on an achiral C8column by HPLC using norvancomycin as chiral mobile phase additives [J]. J. Pharm. Biomed. Anal., 2006, 41(1): 310-314.
[15]WANG Z, CAI C Q, LIN Y T, et al. Enantioselective separation of ketoconazole enantiomers by membrane extraction [J]. Sep. Purif. Technol., 2011, 79(1): 63-71.
[16]KEURENTJES J T F, NABUURS L, VEGTER E A. Liquid membrane technology for the separation of racemic mixtures [J]. J. Membr. Sci., 1996, 113(2): 351-360.
[17]LOMSADZE K, MARTÍNEZ-GIRÓN A B, CASTRO-PUYANA M, et al. About the role of enantioselective selector-select and interactions and the mobilities of diastereomeric associates in enantiomer separations using CE [J]. Electrophoresis, 2009, 30(16) 2803-2811.
[18]YU T, DU Y X, CHEN B. Evaluation of clarithromycin lactobionate as a novel chiral selector for enantiomeric separation of basic drugs in capillary electrophoresis [J]. Electrophoresis, 2011, 32(14): 1898-1905.
[19]HOLBACH A, GODDE J, MAHENDRARAJAH R, et al. Enantioseparation of chiral aromatic acids in process intensified liquid-liquid extraction columns[J]. AIChE J., 2015, 61(1): 266-276.
[20]STEENSMA M, KUIPERS N J M, DE HAAN A B, et al. Modelling and experimental evaluation of reaction kinetics in reactive extraction for chiral separation of amines, amino acids and amino-alcohols [J]. Chem. Eng. Sci., 2007, 62(5): 1395-1407.
[21]SCHUUR B, WINKELMAN J G M, HEERES H J. Equilibriumstudies on enantioselective liquid-liquid amino acid extraction using a cinchona alkaloid extractant [J]. Ind. Eng. Chem. Res., 2008, 47(24): 10027-10033.
[22]TANG K W, FENG X F, ZHANG P L, et al. Experimental and model study on multistage enantioselective liquid-liquid extraction of ketoconazole enantiomers in centrifugal contactor separators [J]. Ind. Eng. Chem. Res., 2015, 54(35): 8762-8771.
[23]ZHANG X B, GUO C C, LI Z Z, et al. An optical fiber chemical sensor for mercury ions based on a porphyrin dimer [J]. Anal. Chem., 2002, 74(4): 821-825.
[24]PRELOG V, KOVAČEVIĆ M, EGLI M. Lipophilic tartaric acid esters as enantioselective ionophores [J]. Angew. Chem. Int. Ed., 1989, 28(9): 1147-1152.
[25]LYNAM C, JENNINGS K, NOLAN K, et al. Tuning and enhancing enantioselective quenching of calixarene hosts by chiral guest amines [J]. Anal. Chem., 2002, 74(1): 59-66.
[26]WEBB T H, WILCOX C S. Enantioselective and diastereoselective molecular recognition of neutral molecules [J]. Chem. Soc. Rev., 1993, 22(6): 383-395.
[27]SALEH M I, BARI M F, JAB M S, et al. Kinetics of lanthanum(Ⅲ) extraction from nitrate-acetato medium by Cyanex 272 in toluene using the single drop technique [J]. Hydrometallurgy, 2002, 67(1/2/3): 45-52.
[28]EI-HEFNY N E, EI-DESSOUKY S. Equilibrium and kinetic studies on the extraction of gadolinium(Ⅲ) from nitrate medium by di-2-ethylhexylphosphoric acid in kerosene using a single drop technique [J]. J. Chem. Technol. Biotechnol., 2006, 81(3): 394-400.
[29]YULIZAR Y, OHASHI A, NAGATANI H, et al. Kinetic study of Ni(Ⅱ) and Zn(Ⅱ) complexation with a pyridylazo extractant by a centrifugal liquid membrane method [J]. Anal. Chim. Acta., 2000, 419(1): 107-114.
[30]NAGATANI H, WATARAI H. Direct spectrophotometric measurement of demetalation kinetics of 5,10,15,20-tetraphenylporphyrinatozinc(Ⅱ) at the liquid-liquid interface by a centrifugal liquid membrane method [J]. Anal. Chem., 1998, 70(14): 2860-2865.
[31]PLUCINSKI P, NITSCH W. The calculation of permeation rates through supported liquid membranes based on the kinetics of liquid-liquid extraction [J]. J. Membr. Sci., 1988, 39(1): 43-59.
[32]JÖNSSON J Å, LÖKVIST P, AUDUNSSON G, et al. Mass transfer kinetics for analytical enrichment and sample preparation using supported liquid membranes in a flow system with stagnant acceptor liquid[J]. Anal. Chim. Acta., 1993, 277(1): 9-24.
[33]CICERI D, MASON L R, HARVIE D J E, et al. Extraction kinetics of Fe(Ⅲ) by di-(2-ethylhexyl) phosphoric acid using a Y-Y shaped microfluidic device [J]. Chem. Eng. Res. Des., 2014, 92(3): 571-580.
[34]EI-HEFNY N E. Kinetics and mechanism of extraction and stripping of neodymium using a Lewis cell [J]. Chem. Eng. Process., 2007, 46(7): 623-629.
[35]WASEWAR K L, HEESINK A B M, VERSTEEG G F, et al. Reactive extraction of lactic acid using alamine 336 in MIBK: equilibria and kinetics [J]. J. Biotechnol., 2002, 97(1): 59-68.
[36]BORA M M, BORTHAKUR S, RAO P G, et al. Study on the reactive extraction and stripping kinetics of certain β-lactam antibiotics[J]. Chem. Eng. Process., 2008, 47 (1): 1-8.
[37]DORAISWAMY L K. Heterogeneous Reactions: Analysis, Examples and Reactor Design: Vol. 2[M]// SHARMA M M. New York: John Wiley & Sons Inc., 1984: 17-45.
Kinetics of reaction extraction separation of 2-phenylbutyric acid enantiomers
JIANG Pan1, ZHANG Panliang2, ZENG Lelin2, XU Weifeng2, TANG Kewen2
(1College of Chemical Engineering, Xiangtan University, Xiangtan 411105, Hunan, China;2Department of Chemistry and Chemical Engineering, Hunan Institute of Science and Technology, Yueyang 414006, Hunan, China)
Kinetics research on the reactive extraction of 2-phenylbutyric acid enantiomers using hydroxyethyl-β-cyclodextrin (HE-β-CD) as extractant was performed in a Lewis cell. A homogeneous reaction model and a two-film theory were employed to describe the mass transfer mechanism of the reactive extraction process. The process parameters affecting the initial extraction rate, including agitation speed, interfacial area, pH value of aqueous phase, initial concentration of 2-phenylbutyric acid (2-PBA) enantiomers and initial concentration of extractant, were separately studied. The results showed that the reaction between hydroxyethyl-β-cyclodextrin and 2-phenylbutyric acid was a fast reaction. It was found that the reaction was first order in 2-phenylbutyric acid and second order in hydroxyethyl-β-cyclodextrin. The forward rate constants for the extraction of (+)-2-phenylbutyric acid and (-)-2-phenylbutyric acid were 2.829×10−4and 1.803×10−4m6·mol−2·s−1, respectively. The results were useful for the design and operation of reactive extraction process in large-scale production, and provide scientific basis for equipment design and process intensification.
kinetics; extraction; chemical reactive; 2-phenylbutyric acid
Prof. TANG Kewen, tangkewen@sina.com
O 643.12
:A
:0438—1157(2017)01—0163—07
10.11949/j.issn.0438-1157.20161190
2016-08-25收到初稿,2016-09-22收到修改稿。
联系人:唐课文。
:蒋盼(1991—),女,硕士研究生。
国家重点基础研究发展计划项目(2014CB260407)。
Received date: 2016-08-25.
Foundation item: supported by the National Basic Research Program of China (2014CB260407).

