P2RX7基因单核苷酸多态性与原发性痛风及高尿酸血症的相关性
应 颖,李 蓁,黄海燕,邹荣鑫,李晓可,陈 勇
(1.宁波大学医学院,浙江 宁波 310000;2.宁波市第二医院 风湿免疫科,浙江 宁波 315010)
·论著·
P2RX7基因单核苷酸多态性与原发性痛风及高尿酸血症的相关性
应 颖1,李 蓁1,黄海燕1,邹荣鑫1,李晓可1,陈 勇2
(1.宁波大学医学院,浙江 宁波 310000;2.宁波市第二医院 风湿免疫科,浙江 宁波 315010)
目的 探讨P2RX7基因的五个位点(rs2230911, rs208294, rs435309, rs1718119和rs3751143)的单核苷酸多态性与宁波地区汉族男性原发性痛风发病和高尿酸血症的相关性。方法 男性原发性痛风患者293例、男性高尿酸血症患者187例和男性健康对照者269例,用SNaPshot SNP分型技术对P2RX7基因五个位点的基因型进行检测。用Logistic回归来评估基因型与疾病的易感性程度。对各组基因型均进行Hardy-Weinberg平衡检验,用SHEsis软件对SNP位点进行连锁不平衡检验,并进行单倍型分析。结果 P2RX7基因rs2230911,rs208294和rs1752809三个位点在研究人群中符合Hardy-Weinberg平衡检验(P>0.05)。其中原发性痛风和健康对照组基因型频率差异有统计学意义(P=0.002),且原发性痛风组等位基因rs2230911-G的频率明显高于健康对照组(OR =1.755,95%CI=1.278~2.410,P<0.01);在显性模型中,原发性痛风的基因型(CG+GG)频率明显高于健康对照组(OR=1.876,95%CI=1.303~2.701,P=0.001)。结论 P2RX7基因rs2230911位点单核苷酸多态性可能与宁波地区汉族男性原发性痛风发病相关,等位基因G是痛风发病的危险因素。该研究为原发性痛风的诊疗提供了可能的新靶点。
痛风;高尿酸血症;P2RX7;多态性, 单核苷酸
原发性痛风是指由于单钠尿酸盐(monosodium urate, MSU)晶体沉积在关节及周围结缔组织而引起的炎症反应。其中,高尿酸血症是它的发病基础[1-2]。流行病学研究显示,在很多国家原发性痛风和高尿酸血症的患病率逐年增加[3-4]。在美国,高尿酸血症和原发性痛风患病率分别为21%和3.9%[5];而在中国大陆,两者的患病率分别为13.3%和1.1%[6]。
上述流行病学资料显示,并不是所有的高尿酸血症人群最终都会发展为原发性痛风。亦有文献报道,在一些无症状性高尿酸血症人群中,用双能源CT能发现有MSU晶体的沉积[7]。近年来,家系分离分析研究亦发现原发性痛风是一种多基因遗传病[8],全基因组关联分析(GWAS)通过扫描整个基因组的各个单核苷酸多态性(SNP)发现,有众多基因与原发性痛风和高尿酸血症的发病相关[9-11]。我们经过文献复习发现P2RX7基因单核苷酸多态性(rs2230911,rs208294,rs435309等)可能影响IL-1β的活化,从而在原发性痛风的发病机制中起着重要的作用[12]。因此,本研究的目的是探讨在宁波地区汉族男性人群中P2RX7基因单核苷酸多态性(rs2230911,rs208294,rs435309,rs1718119和rs3751143)与原发性痛风及高尿酸血症的相关性。
1 资料与方法
1.1 研究对象 收集来自2015年7月至2016年7月就诊于宁波市第二医院的门诊、住院患者和健康体检者,其中原发性痛风患者共293例,平均年龄为(50.9±14.6)岁;高尿酸血症患者共187例,平均年龄为(39.5±14.4)岁;健康对照者共269例,平均年龄为(44.8±10.9)岁;均为中国汉族男性。原发性痛风均符合1977年ACR制定的诊断标准[13];高尿酸血症均满足男性血尿酸(UA)>420 μmol/L(7.0 mg/dl);健康对照组均排除痛风、高尿酸血症及其家族史。3组纳入样本均排除其他风湿性疾病、癌症、严重肾病病史,且所选的人群之间亦均无血缘关系。本研究已通过宁波大学医学院宁波市第二医院的伦理委员会批准,在实施中遵守赫尔辛基宣言的伦理准则,所有研究对象均签署了知情同意书。
1.2 方法 收集静脉血至2% EDTA管中。用QIAamp DNA试剂盒(Qiagen公司,德国希尔登)提取全基因组DNA,并置于-80 ℃冰箱保存。用Primer 5.0软件对P2RX7基因的5个单核苷酸多态性(rs2230911,rs208294,rs435309,rs1718119和rs3751143)进行引物设计,SNaPshot方法进行基因分型,ABI3730测序仪进行基因分型检测及GeneMapper 4.0软件进行测序结果分析。
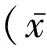
2 结 果
2.1 3组临床资料和生化指标的比较 3组年龄、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、肌酐(CREA)、UA、葡萄糖(GLU)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、甘油三酯(TG)和白细胞(WBC)计数比较差异均有统计学意义(P<0.05),见表1。

表1 3组临床资料和生化指标的比较
2.2 3组基因型和等位基因的比较 经HWE平衡检验,3组P2RX7 rs2230911,rs208294和rs435309处于遗传平衡,具有群体代表性(P>0.05)。其中P2RX7 rs2230911的基因型和等位基因频率在3组中差异有统计学意义(χ2=13.281,P=0.010和χ2=12.252,P=0.002)。原发性痛风组与健康对照组比较,基因型和等位基因频率差异有统计学意义(χ2=12.062,P=0.002和χ2=12.258,P<0.01),且原发性痛风的等位基因G频率明显高于健康对照组(OR=1.755,95%CI=1.278~2.410,P<0.01)。但是,其余两个位点(P2RX7 rs208294和rs435309)基因型或等位基因频率3组比较差异无统计学意义(P>0.05),见表2。将P2RX7 rs2230911进行显性模型CC/(CG+GG)和隐性模型(CC+CG)/GG比较,基因型频率CC/(CG+GG)3组比较差异有统计学意义(P=0.003)。其中,原发性痛风组的基因型(CG+GG)频率明显高于健康对照组(OR=1.876,95%CI=1.303~2.701,χ2=11.582,P=0.001)。见表3。然而,将P2RX7rs208294和rs435309分成显性模型TT/(TC+CC)或隐性模型(TT+TC)/CC,基因型频率在3组比较差异均无统计学意义(P>0.05)。

表2 3组rs2230911,rs208294,rs435309,rs1718119和rs3751143基因型和等位基因频率比较
注:经HWE平衡检验,3组P2RX7、rs2232911、rs208294和rs435309符合HWE平衡,rs1718119、rs3751143不符合HWE平衡

表3 3组rs2230911,rs208294和rs435309显性模型和隐性模型基因型频率的比较
2.3 连锁不平衡(LD)检验和单倍型分析 对3组的3个SNPs位点(rs2230911、rs208294和rs1752809)进行连锁不平衡分析,结果显示:3组中各位点之间存在连锁平衡状态(D′在0.014~0.340之间波动,r2在0~0.033之间波动),不能构成符合条件的单倍型(D′>0.8和r2>0.5),故无须进行单倍型分析。
2.4 原发性痛风组P2RX7 rs2230911基因型之间临床生化资料比较 将P2RX7 rs2230911的基因型分成CC、CG和GG 3组,结果显示:CC、CG和GG 之间UA和GLU水平差异有统计学意义(χ2=3.932,P=0.021和χ2=9.627,P=0.008)。见表4。在显性模型CC/(CG+GG)中,基因型(CG+GG)GLU水平明显高于基因型CC(t=-2.620,P=0.010);在隐性模型(CC+CG)/GG中,基因型GG的UA水平明显高于基因型(CC+CG)(χ2=-12.183,P=0.030)。但是其他变量在显性模型和隐性模型中差异均无统计学意义(P>0.05)。

表4 原发性痛风组rs2230911基因型与临床一般资料的比较
3 讨 论
P2X7受体由595个氨基酸组成,是嘌呤受体P2X家族中的一员[14-15],具有阳离子(Na+、K+和Ca2+)选择性[16]。已有研究发现,P2RX7基因与类风湿性关节炎和系统性红斑狼疮等免疫性疾病相关[17-18]。在原发性痛风的发病中,P2X7受体主要在NF-κB途径和NALP3炎性体途径中发挥重要作用[19-20]。ATP是其唯一的天然激动剂,当剧烈运动、寒冷刺激、酗酒及暴饮暴食等导致细胞外的ATP浓度发生急剧的变化时,P2X7受体被激活并开放,导致K+外流和Na+和Ca2+内流;胞内的低钾状态进一步激活NALP3炎性体,活化的caspase-1能催化IL-1为成熟的IL-1β,从而导致大量的IL-1β被释放出胞外[21-25]。
P2RX7基因具有高多态性,其中位点包括rs2230911,rs208294,rs435309 rs1718119和rs3751143等。在原发性痛风组和健康对照组的比较中,rs2230911位点的基因型(CG+GG)发生原发性痛风的风险是基因型CC的1.876倍,且等位基因G发生原发性痛风的风险是等位基因C的1.755倍。但是,原发性痛风组与高尿酸血症组比较,该位点的基因型和等位基因频率差异均无统计学意义。这可能与原发性痛风的发生与MSU结晶沉积的程度及时间相关。在高尿酸血症组中,有部分患者可能在数年或者数月,甚至数天后发展为原发性痛风,因此就较容易存在选择偏倚。这需要我们在后期研究中,对高尿酸血症组进行前瞻性队列研究,观察不同基因型发展为原发性痛风的情况,进一步验证rs2230911-G在原发性痛风中的发病风险。
在P2RX7 rs2230911(T357S或1096C→G)位点中,由于碱基胞嘧啶(C)突变成了鸟嘧啶(G),从而导致苏氨酸突变成丝氨酸[26]。其中,等位基因C是原始碱基,而等位基因G是突变碱基,是发生原发性痛风的危险因素。在HapMap数据库中,中国人群rs2230911-G的等位基因频率为24.4%,而在本研究中为13.4%,两者没有明显的差异,亦具有中国汉族群体代表性。此外,突变纯合型GG和突变杂合型CG患者更容易发生高血糖,并可能进展为糖尿病;而突变纯合型GG患者的尿酸水平较高,易导致尿酸盐肾病及尿酸性尿路结石。通过此项检查,我们可以对P2RX7 rs2230911基因型为GG和GC患者进行早期干预,以避免发展为糖尿病及泌尿道结石等。
P2RX7 rs208294(His155Tyr,H155Y或489T→G)是指组氨酸突变成酪氨酸,从而改变了P2X7受体胞外的结构域,并影响了受体单元结构的组装[27]。等位基因C的频率在HapMap数据库和在本研究中分别为30.5%和40.1%,差异亦不大。Sebastien等[28]指出P2RX7 rs435309(rs1752809,Val76Ala,253T→C)的突变将会导致P2X7受体功能的高度损伤,从而影响了炎症因子的释放。这两个位点在P2X7受体的功能上发挥着作用,因此可能在原发性痛风的发病中亦起到作用,后期可继续对该两个位点进行进一步的功能研究。
将上述3个位点(rs2230911,rs208294和rs435309)进行连锁不平衡检验发现,该3个位点在P2RX7基因中位置相距较远,相对独立,不受互相影响,存在连锁平衡状态。因此无法构成单倍型,无需进行单倍型分析。
Stokes等[29]的实验证实了P2RX7 rs1718119 (Ala348Thr, A348T 或1068G→A)多态性会导致IL-1β的释放。在HapMap数据库中,在中国人群中等位基因A的频率为12.2%,而在本研究中为2.79%。Gu等[30]发现rs3751143 (Glu496Ala, E496A 或者 1513A→C)处于P2X7受体的重要区域,该位点的突变将会导致K+的外流和IL-1β的释放减少。等位基因G的频率在HapMap数据库和在本研究中非常接近,分别为21.4%和27.7%。但由于样本量仍存在偏小,P2RX7 rs1718119和rs3751143单核苷酸多态性不符合HWE平衡检验,样本无群体代表性,因此本研究未对此两个位点进行基因型和等位基因频率的分析。
本研究存在着一些不足。首先,虽然P2RX7 rs2230911,rs208294和rs435309 3个位点的样本符合HWE平衡检验,但是仍由于样本量的不足导致rs1718119和rs3751143的单核苷酸多态性未能符合HWE平衡检验,从而无法进行该两个位点的基因型和等位基因频率的统计学分析。第二,所有样本均来自同一家医院,选择偏倚可能存在。但由于单核苷酸多态性的分析需要大样本,因此多个中心的研究尤为困难。第三,查阅相关文献,既往国内外无关于该基因单核苷酸多态性与原发性痛风的实验性报道,因此无法将宁波地区人群的研究结果与其他人群进行讨论比较。第四,P2RX7基因有其他多态性位点,如rs28360447,rs7958316,rs28360457,rs1653624和rs35933842等可能也与原发性痛风的发病风险相关。最后,在后期研究中,我们仍需对高尿酸血症组进行前瞻性队列研究,对不同基因型的患者进行随访研究及P2RX7基因产物及IL-1β水平的测定,进一步探讨P2RX7 rs2230911-G在原发性痛风发病中风险因素。
总之,本研究表明P2RX7 rs2230911单核苷酸多态性在宁波地区汉族男性人群中,可能与原发性痛风的发病风险相关,其中等位基因G可能是原发性痛风的危险因素。该研究为原发性痛风的诊疗提供了可能的新靶点。
[1] Robinson PC, Horsburgh S. Gout: joints and beyond, epidemiology, clinical features, treatment and co-morbidities[J]. Maturitas, 2014, 78(4):245-251.
[2] Merriman TR. An update on the genetic architecture of hyperuricemia and gout[J]. Arthritis Res Ther, 2015, 17:98.
[3] 武东, 刘湘源. 痛风的治疗进展[J]. 临床荟萃, 2015, 30(12):1344-1346.
[4] Smith EU, Diaz-Torne C, Perez-Ruiz F, et al. Epidemiology of gout: an update[J]. Best Pract Res Clin Rheumatol, 2010, 24(6):811-827.
[5] Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008[J]. Arthritis Rheum, 2011, 63(10):2136-3141.
[6] Liu R, Han C, Wu D, et al. Prevalence of Hyperuricemia and Gout in Mainland China from 2000 to 2014: A Systematic Review andMeta-Analysis [J]. Biomed Res Int, 2015, 2015:762820.
[7] Sun Y, Ma L, Zhou Y, et al. Features of urate deposition in patients with gouty arthritis of the foot using dual-energy computed tomography[J]. Int J Rheum Dis, 2015, 18(5):560-567.
[8] Roddy E, Choi HK. Epidemiology of gout[J]. Rheum Dis Clin North Am, 2014, 40(2):155-175.
[9] Choi HK, Zhu Y, Mount DB. Genetics of gout[J]. Curr Opin Rheumatol, 2010, 22(2):144-151.
[10] Kottgen A, Albrecht E, Teumer A, et al. Genome-wide association analyses identify 18 new loci associated with serum urate concentrations[J]. Nat Genet, 2013, 45(2):145-154.
[11] Phipps-Green AJ, Merriman ME, Topless R. Twenty-eight loci that influence serum urate levels: analysis of association with gout[J]. Ann Rheum Dis, 2016, 75(1):124-130.
[12] Gong QY, Chen Y. Correlation between P2X7 receptor gene polymorphisms and gout[J]. Rheumatol Int, 2015, 35(8):1307-1310.
[13] Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT)[J]. Ann Rheum Dis, 2006, 65(10):1301-1311.
[14] Surprenant AF, Rassendren E, Kawashima RA, et al. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7)[J]. Science, 1996, 272(5262):735-738.
[15] North RA. Molecular physiology of P2X receptor[J]. Physiol Rev, 2002,82(4):1013-1067.
[16] Jarvis MF, Khakh BS. ATP-gated P2X cation-channels[J]. Neuropharmacology, 2009, 56(1):208-215.
[17] Shukaili A, Kaabi J, Hassan B, et al. P2X7 receptor gene polymorphism analysis in rheumatoid arthritis[J]. Int J Immunogenet, 2011, 38(5):389-396.
[18] Nath SK, Quintero DRAI, Kilpatrick J, et al. Linkage at 12q24 with systemic lupus erythematosus (SLE) is established and confirmed in Hispanic and European American families[J]. Am J Hum Genet, 2004, 74(1):73-82.
[19] Di VF, Chiozzi P, Ferrari D, et al. Nucleotide receptors: an emerging family of regulatory molecules in blood cells[J]. Blood, 2001, 97(3):587-600.
[20] Bulanova E, Budagian V, Orinska Z, et al. ATP induces cytokine expression and apoptosis through P2X7 receptor in marine mast cells[J]. J Leukoc Biol,2009, 85(4):692-702.
[21] Eleftheriadis T, Pissas G, Karioti A, et al. Uric acid induces caspase-1 activation, IL-1β secretion and P2X7 receptor dependent proliferation in primary human lymphocytes[J]. Hippokratia, 2013, 17(2):141-145.
[22] Alves LA, Bezerra RJ, Faria RX, et al. Physiological roles and potential therapeutic applications of the P2X7 receptor in inflammation and pain[J]. Molecules, 2013, 18(9):10953-10972.
[23] Gadeock S, Pupovac A, Sluyter V, et al. P2X7 receptor activation mediates organic cation uptake into human myeloid leukaemic KG-1 cells[J]. Purinergic Signal , 2012, 8(4):669-676.
[24] Terkeltaub RA, Schumacher HR, Carter JD, et al. Rilonacept in the treatment of acute gouty arthritis: a randomized, controlled clinical trial using indomethacin as the active comparator[J]. Arthritis Res Ther, 2013, 15(1):R25.
[25] Schlesinger N, Alten RE, Bardin T, et al. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomized, multicentre, active-controlled, double-blind trials and their initial extensions[J]. Ann Rheum Dis, 2012, 71(11):1839-1848.
[26] Anne NS, Ronald S, Suran LF, et al. A Thr357 to Ser polymorphism in homozygous and compound heterozygous subjects causes absent or reduced P2X7 function and impairs ATP-induced mycobacterial killing by macrophages[J]. J Biol Chem, 2006, 281(4):2079-2086.
[27] Liliana PC, Perla NM, Mariana SB, et al. The His155Tyr (489 C>T) single nucleotide polymorphism of P2X7R gene confers an enhanced function of P2X7 receptor in immune cells from patients with rheumatoid arthritis[J]. Cellular Immunology, 2012, 276(1/2):168-175.
[28] Sebastien R, Zhu ZM, Jocelyn MB, et al. Single nucleotide polymorphisms that were identified in affective mood disorders affect ATP-activated P2X7 receptor functions[J]. J Psychiatr Res, 2012, 44(6):347-355.
[29] Stokes L, Fuller SJ, Sluyter R, et al. Two haplotypes of the P2X(7) receptor containing the Ala-348 to Thr polymorphism exhibit a gain-of-function effect and enhanced interleukin-1 beta secretion[J]. FASEB J, 2010, 24(8):2916-2927.
[30] Gu BJ, Zhang W, Worthington RA, et al. A Glu-496 to Ala polymorphism leads to loss of function of the human P2X7 receptor[J]. J Biol Chem, 2001, 276(14):11135-11142.
Correlation between P2RX7 gene polymorphism and primary gout and hyperuricemia
Ying Ying1,Li Zhen1,Huang Haiyan1, Zou Rongxin1, Li Xiaoke1, Chen Yong2
1. School of Medicine,Ningbo University, Ningbo 310000, China;2. Department of Rheumatology,Ningbo No. 2 Hospital, Ningbo 315010, China
Chen Yong,Email: nbdeyycy@163.com
Objective To investigate the relationship between P2RX7 gene single nucleotide polymorphisms and primary gout and hyperuricemia in Ningbo Han male population.Methods The genetic distributions of the single nucleotide polymorphisms rs2230911, rs208294, rs435309, rs1718119 and rs3751143 in P2RX7 were detected in 293 primary gout patients, 187 hyperuricemia patients and 269 controls using SNaPshot technology. The susceptibility of genotypes and phenotypes to disease were assessed using logistic regression with odds ratios and 95% confidence interval(CI).The genetic distributions of each group were tested by Hardy-Weinberg equilibrium (HWE). SHEsis soft was used to calculate linkage disequilibrium blocks and haplotype association risk.Results Three SNPs (rs2230911, rs208294 and rs435309) followed the Hardy-Weinberg equilibrium (P>0.05). Compared with the control group, the frequencies of rs2230911 genotypes in patient with primary gout were significantly different (P=0.002). In addition,allele G had a higher frequency in primary gout compared with control (OR=1.755,95%CI=1.278 - 2.410,P<0.001). There was also a higher frequency of genotype (CG+GG) in primary gout compared with control group(OR=1.876,95%CI=1.303 - 2.701,P=0.001). Conclusion P2RX7 rs2230911 might be associated with primary gout risk in Ningbo Han male population. Moreover, allele G might be a susceptibility factor for primary gout. The research provided a new target for primary gout diagnosis and treatment.
gout;hyperuricemia;P2RX7; polymorphism, single nucleotide
浙江省医药卫生基金项目(2015KYB346)
陈勇,Email:nbdeyycy@163.com
R589.7
A
1004-583X(2017)01-0059-05
10.3969/j.issn.1004-583X.2017.01.014
2016-11-18 编辑:张卫国

