皮质酮对肉鸡生产性能和骨骼生物学特性的影响
刘德义 ,张 华,周振雷
(1. 安徽科技学院 动物科学学院,安徽 凤阳 233100;2. 南京农业大学 动物医学院,江苏 南京 210095)
皮质酮对肉鸡生产性能和骨骼生物学特性的影响
刘德义1,张 华2,周振雷2*
(1. 安徽科技学院 动物科学学院,安徽 凤阳 233100;2. 南京农业大学 动物医学院,江苏 南京 210095)
目的:研究皮质酮对生长期肉鸡的生长性能和骨骼生物学特性的影响。方法:采用外源性皮质酮处理肉鸡的方法,80羽肉鸡随机分为对照组与皮质酮处理组,8日龄时,皮质酮处理组肉鸡每天注射皮质酮8 mg/kg,对照组注射等剂量的玉米油,为期1周。分别于15日龄和22日龄采样各组样品进行分析。结果:皮质酮可以显著降低肉鸡的体重和采食量;与对照组比较,皮质酮处理组的骨长度、骨强度、骨密度均显著降低,血钙和酸性磷酸酶水平显著增高,血磷水平显著下降。结论:皮质酮影响肉鸡的生产性能,骨代谢平衡和骨骼生长发育。
皮质酮;生产性能;骨生物学特性;肉鸡
现代肉鸡品种的选育过程中,注重肉鸡快速增重的选育方式对肉鸡的生理机能产生了显著的影响,导致腿病的发病率逐渐增加[1]。肉鸡腿病的发生,不仅影响动物福利,同时也带来了较大的经济损失。在集约化养殖环境中,高温、拥挤、免疫、抓取和运输等均会引起肉鸡的慢性应激[2]。长期慢性的应激已证实对骨骼的发育有重要影响[3]。
禽类在应激状态下,下丘脑-垂体-肾上腺素轴被激活,大量分泌糖皮质激素—皮质酮(Corticosterone, CORT),调整体内各大代谢途径和生理机能以应对各种应激源[4]。因此,血浆皮质酮的浓度可作为禽类处于应激状态的可靠标志[5]。皮质酮不仅调节水盐平衡、血压稳态和三大物质代谢等基本生理活动,还参与调控骨骼发育和免疫与炎症等过程[6]。近年来,用皮质酮处理动物来模拟生理应激的方法已经广泛的在啮齿类和禽类的研究中得以应用[7-9]。然而大量的研究都集中于皮质酮影响生长性能、营养物质代谢以及免疫系统的功能[10-12],却很少关注皮质酮对于肉鸡骨骼系统发育的影响。为了阐明应激对肉鸡骨代谢的影响,本试验通过皮质酮处理生长期肉鸡模拟应激,探讨皮质酮对生长期肉鸡生产性能以及骨骼生物学特性的影响,以期为应激对骨骼生长发育的影响的机理研究提供基础资料。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 1日龄健康Rose 308肉鸡购于嘉吉公司。试验期间试验鸡笼养,鸡舍每天24 h人工光照,自由饮食和饮水,常规免疫。严格控制鸡舍内温湿度,最初温度维持在35 ℃,之后在一星期内逐渐降到21 ℃,维持至试验结束。空气湿度维持在45 %左右。
1.1.2 主要仪器和设备 X射线机(北京万东),16级铝阶(英国Roslin研究所惠赠),CR系统(柯尼卡,日本);生化分析仪(BS-300,迈瑞公司,深圳);马弗炉(SX-2.5-10,上海洪纪仪器设备有限公司);骨强度测定仪(LR10K PLUS, Lloyd Instruments Ltd., Hampshire, 英国);Nikon光学显微镜(H5505,日本)以及数字信号拍照系统(DS-Fil)。
1.1.3 主要试剂 皮质酮(Sigma-Aldrich,上海);抗酒石酸酸性磷酸酶(trACP)测定试剂盒(A058,南京建成);血浆钙、磷、碱性磷酸酶生化检测试剂盒(迈瑞公司,深圳);其他试剂均选用国产分析纯。
1.2 试验方法
1.2.1 试验设计 1日龄健康Rose 308肉鸡80羽,随机分为2组,皮质酮处理组和对照组,每组5个重复,每个重复8只,两组的初始体重无差异。试验期21 d,8日龄开始,于每日早晨8 ∶00 ~ 9 ∶00间,CORT组皮下注射皮质酮8 mg/kg体重,对照组注射等量玉米油,连续注射一周。皮质酮以玉米油为溶剂,其浓度为8 mg/mL。
1.2.2 样品采集 15日龄时,两组随机选取15羽,称重、心脏采血,抗凝管取5 mL,断头处死后,取肝脏称重,计算肝指数。血液样本于冰盒内保存,于4 ℃ 3500 r/min离心10 min后取血浆,分装后-20 ℃保存备用;取左侧肱骨、股骨和胫骨于各自编号自封袋中,-20 ℃保存备用;22日龄时,每组随机取15只鸡,采样方法同上。
1.3 骨指数与骨长度的检测
将骨样解冻过夜,然后刮除骨上所有的软组织。称重并用游标卡尺测其长度。骨指数的表示公式是:骨重(g)/体重(kg)[13]。
1.4 骨密度测定
将骨样本与16级铝阶置于同一个暗盒上,拍片。股骨、肱骨、胫骨均采用前后位。摄片条件:焦点胶片距(FFD) 80 cm, 球管电压44 kV,3.88 mAs[14]。所摄X光片置于透射式扫描仪上扫描,用 NIH Image J 1.32j图像处理系统分析图像。骨骼样本的放射密度单位毫米铝阶厚度(mmAl)。
1.5 骨强度检测
用三点弯曲试验检测各骨样骨强度[15]。于骨中点处做标记,用游标卡尺测量此处的直径。据骨长确定跨距,将骨放置于两个支点上,预载荷速度为3 mm/min,骨骼断裂后停止。通过NEXYGEN PLUS软件(Lloyd Instruments)分析曲线的最高点即为骨强度(用N表示)。
1.6 血液生化指标的测定
取-20 ℃血样一份,4 ℃解冻,取1mL左右于1.5 mL EP管中,用血液生化试剂分别检测血浆总钙、总磷和碱性磷酸酶的水平。抗酒石酸酸性磷酸酶(Tartrateresistantacidphosphatase, trACP)的测定按说明书进行检测。
1.7 统计分析

2 结果与分析
2.1 体重、相对器官重和采食量变化
各组生产性能变化见表1,CORT显著抑制肉鸡体重;15日龄时,CORT组肉鸡的肝指数显著高于对照组,22日龄时,CORT组的肝指数与对照组无显著差异;CORT组肉鸡的采食量显著低于对照组;肝指数与采食量在日龄和处理之间存在交互效应。
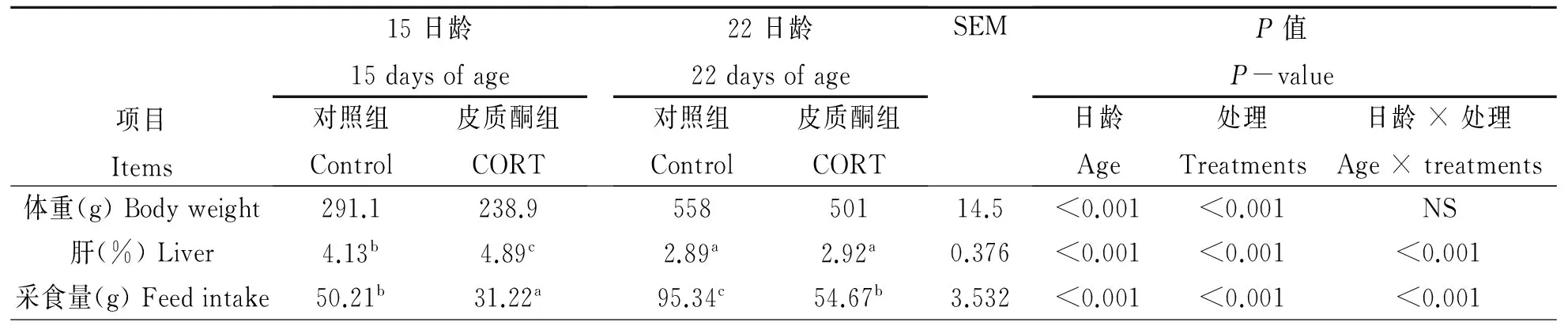
表1 CORT处理对肉鸡体重、相对器官重和采食量的影响
2.2 骨参数变化
由表2可知,CORT处理显著降低肉鸡的胫骨、股骨和肱骨的骨指数、骨长度、骨密度和骨断裂强度。且骨参数值随日龄增加。肱骨断裂强度、股骨密度、股骨断裂强度和胫骨密度在日龄和处理之间存在交互效应。
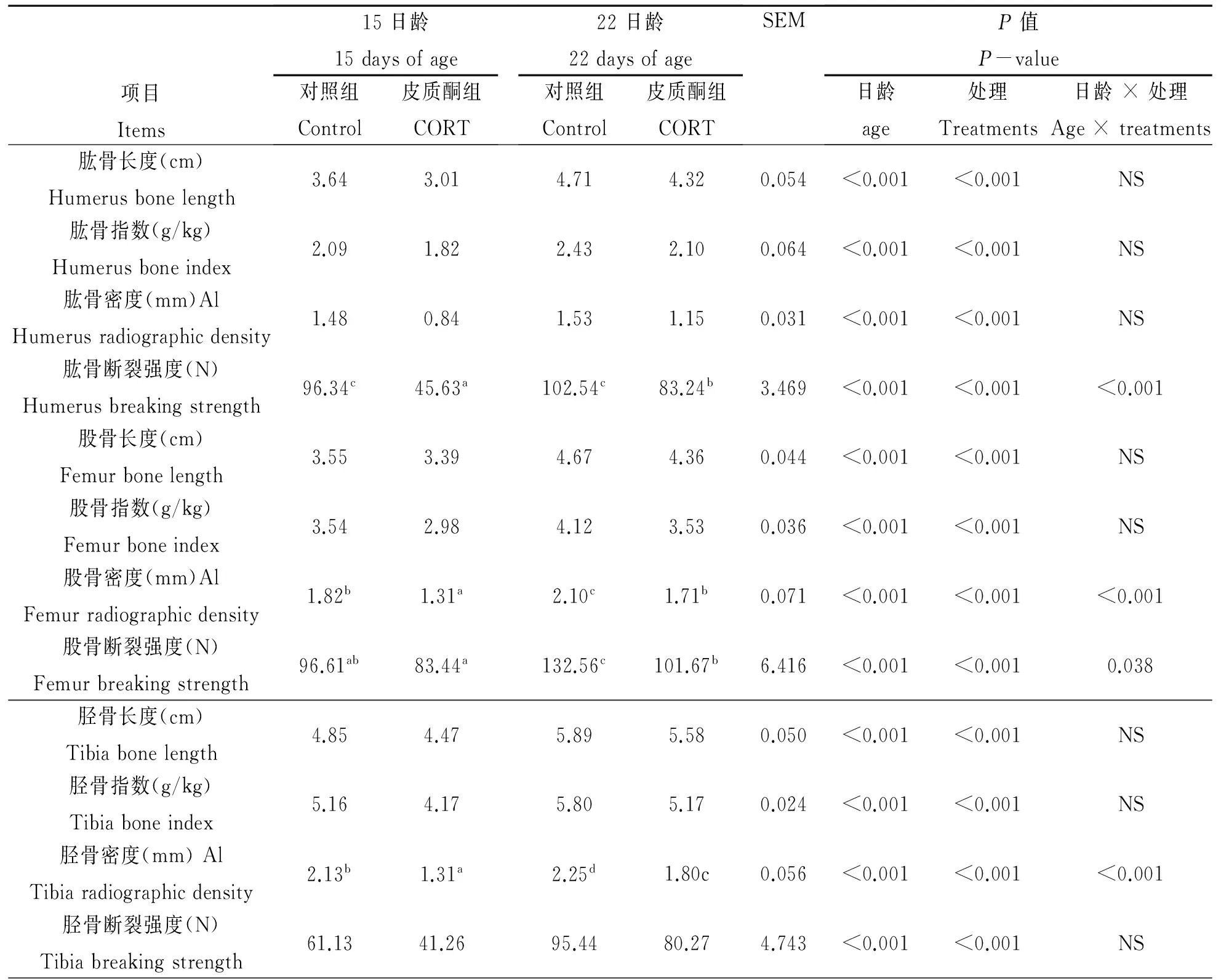
表2 CORT处理对骨参数的影响
2.3 血浆钙、磷水平、碱性磷酸酶和抗酒石酸酸性磷酸酶活性变化
由表3可得,由皮质酮诱导的应激可显著提高血浆中钙和酸性磷酸酶的含量,降低血磷水平,碱性磷酸酶水平无显著变化,日龄对各参数无影响,血磷在日龄和处理之间存在交互效应。

表3 CORT处理对肉鸡血液生化参数的影响
3 结论与讨论
皮质酮降低肉鸡的采食量,同时也降低体重的增长。本试验结果与先前的诸多研究结果相一致[8-16],皮质酮引起肉鸡体增重和饲料转化效率降低。肝脏为体内主要的代谢器官,参与机体能量和物质代谢。15日龄时,皮质酮处理组的肉鸡肝指数明显增加,这可能是由于应激状态下能量的重新分配有关,22日龄的肝指数无差异,说明此时皮质酮处理后的肉鸡能量代谢趋于恢复正常水平。
本试验皮质酮处理组的肉鸡骨长与骨指数显著降低,骨密度与骨强度均低于对照组,表明皮质酮影响骨骼的生长发育,引起骨量的减少。其机理可能在于皮质酮抑制生长板软骨细胞的增殖和分化,进而对肉鸡骨的生长产生影响[17]。
ALP一直作为骨形成与骨转化的重要指标之一,主要用于评价成骨细胞的活性;trACP由破骨细胞分泌,用于破骨细胞活性的评价。本试验结果显示,皮质酮显著提高了肉鸡血钙水平,这一结果与之前报道一致;应激状态下血液中ALP无明显变化,trACP的水平显著提高,说明皮质酮诱导破骨细胞活性增强,而成骨细胞活性无显著变化,引起大量骨钙入血,从而使血液中钙的浓度升高[16]。本研究结果同时显示,皮质酮可下调血浆中总磷的水平,相关的机理仍有待研究。本研究证实了皮质酮对肉鸡的生产性能有显著影响。
[1]TALATY P N, KATANBAF M N, HESTER P Y. Bone mineralization in male commercial broilers and its relationship to gait score[J]. Poultry Science, 2010, 89(2): 342-348.
[2]SHINI S, KAISER P, SHINI A, et al. Biological response of chickens (Gallus gallus domesticus) induced by corticosterone and a bacterial endotoxin[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2008, 149(2): 324-333.
[3]ZHOU Z-l, RATH N C, HUFF G R, et al. Bone characteristics of 16 Wk-Old-Turkeys subjected to different dietary supplements and simulated stress[J]. Int J Poult Sci, 2011, 10(5): 332-337.
[4]Castro M, Elias L L, Conde P, et al.Physiology and Pathophysiology of the HPA Axis [M]. Humana Press, 2010: 1-2
[5]COCKREM J F. Stress, corticosterone responses and avian personalities[J]. Journal of Ornithology, 2007, 148(2): S169-S178.
[6]DEHNHARD M, SCHREER A, KRONE O, et al. Measurement of plasma corticosterone and fecal glucocorticoid metabolites in the chicken (Gallus domesticus), the great cormorant (Phalacrocorax carbo), and the goshawk (Accipiter gentilis)[J]. General and Comparative Endocrinology, 2003, 131(3): 345-352.
[7]BIAGINI G, PICH E M. Corticosterone administration to rat pups,but not maternal separation,affects sexual maturation and glucocorticoid receptor immunoreactivity in the testis[J]. Pharmacol Biochem Be, 2002, 73(1): 95-103.
[8]LIN H, DECUYPERE E, BUYSE J. Oxidative stress induced by corticosterone administration in broiler chickens (Gallus gallus domesticus) - 1. Chronic exposure[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2004, 139(4): 737-744.
[9]LIN H, SUI S J, JIAO H C, et al. Impaired development of broiler chickens by stress mimicked by corticosterone exposure[J]. Comparative Biochemistry and Physiology A-molecular & Integrative Physiology, 2006, 143(3): 400-405.
[10]POST J, REBEL J J, TER HUURNE a a H M.Physiological effects of elevated plasma corticosterone concentrations in broiler chickens.an alternative means by which to assess the physiological effects of stress[J]. Poultry Science, 2003, 82(8): 1313-1318.
[11]Lin H, Buyse J, Decuypere E. Strategies for prevention of heat stress in poultry[J]. World Poult Sci J , 2006, 62: 71-85
[12]VIRDEN W S, THAXTON J P, CORZO A, et al. Evaluation of models using corticosterone and adrenocorticotropin to induce conditions mimicking physiological stress in commercial broilers[J]. Poultry Science, 2007, 86(12): 2485-2491.
[13]ZHOU Z-l, DENG Y-f, TAO Q-s, et al. Effects of gushukang, a Chinese herbal medicine, on bone characteristics and osteoporosis in laying hens[J]. Poultry Science, 2009, 88(11): 2342-2345.
[14]DENG Y-f, CHEN X-x, ZHOU Z-l, et al. Letrozole inhibits the osteogenesis of medullary bone in prelay pullets[J]. Poultry Science, 2010, 89(5): 917-923.
[15]FLEMING R H, MCCORMACK H A, MCTEIR L, et al. Medullary bone and humeral breaking strength in laying hens[J]. Research in Veterinary Science, 1998, 64(1): 63-67.
[16]NASIR A, MOUDGAL R P, SINGH N B. Involvement of corticosterone in food intake,food passage time and in vivo uptake of nutrients in the chicken(Gallus domesticus)[J]. British Poultry Science, 1999, 40(4): 517-522.
[17]LUO J-w, ZHOU Z-l, ZHANG H, et al. Bone response of broiler chickens (Gallus gallus domesticus) induced by corticosterone[J]. Comparative Biochemistry and Physiology A-molecular & Integrative Physiology, 2013, 164(2): 410-416.
(责任编辑:马世堂)
Effects of Corticosterone on the Performance and Bone Biological Characteristics of Broilers
LIU De-yi1,ZHANG Hua2,ZHOU Zhen-lei2*
(1. College of Animal Science,Anhui Science and Technology University, Fengyang 233100,China;2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China)
Objective: The present study was conducted with broilers exposed to exogenous corticosterone (CORT), with the aim of determining its effects on the performance and bone biological characteristics of growing broilers. Methods: Eighty broilers were randomly allocated to the control and CORT-treated groups. At 8 days of age, CORT-treated group broilers were injected with CORT (8 mg/kg body weight)while the control group birds were treated with corn oil for 1 week. Samples from different groups chickens were collected at 15 days and 22 days of age. Results:CORT obviously decreased body weight and feed intake. Compared with the control group, bone length, radiographic density and strength of CORT-treated group were decreased significantly, the levels of plasma Ca and trACP were increased, and plasma P was decreased. Conclusion: It implied that CORT affected the performance, bone meatabolism balance and bone development in broilers
Corticosterone;Growth performance;Bone biological characteristics;Broiler
2016-09-19
国家自然科学基金(31572579)。
刘德义(1963-),男,安徽省凤阳县人,硕士,教授,主要从事反刍动物营养与疾病防控、小动物麻醉研究;*通讯作者:周振雷,教授,E-mail:zhouzl@njau.edu.cn。
S834.1
A
1673-8772(2016)06-0007-05

