牙周膜成纤维细胞多种培养法的研究
吴忧 张军梅
(贵州医科大学,贵州 贵阳 550004)
牙周膜成纤维细胞多种培养法的研究
吴忧 张军梅△
(贵州医科大学,贵州 贵阳 550004)
目的 提高人牙周膜成纤维细胞原代培养的成功率,提高组织块贴壁率,缩短培养时间,加快细胞增殖。方法 以高血清结合改良组织块培养法培养原代HPDLCs与传统组织块法及改良组织块培养法作比较。通过免疫组化方法鉴定细胞的来源,绘制细胞的生长曲线,对三种方式的培养成功率、组织块贴壁率及细胞增殖速度进行比较。结果 三种方法所培养的原代细胞生长均趋于正常,细胞呈长梭形或多角形,波形蛋白鉴定呈阳性,角蛋白鉴定呈阴性,符合正常HPDLCs的正常形态及生物学特点。高血清结合改良组织块培养法的成功率为86.67%,明显高于其他两种方法(P<0.01)。结论 高血清结合改良组织块培养法明显提高了HPDLCs原代培养的成功率,适合在临床上运用。
原代培养; 提高培养成功率; 人牙周膜成纤维细胞
牙周膜成纤维细胞是牙周结缔组织中最为主要的一种间充质细胞,不仅具有更新与自我修复的能力[1],同时还能够分泌牙周组织中的间充质以及在口腔正畸过程中促进成骨与破骨过程的各种酶、生长因子等。离体培养的HPDLCs对研究牙周生物学、药物学、正畸力学都具有重要意义, 为近年来正畸生物力学的研究进展发挥了巨大作用[2]。 成纤维细胞体外培养的方法主要可以分为组织块法和酶消化法。酶消化法虽可缩短培养时间,但因为其操作步骤复杂,对细胞损伤大,所以很难掌握。组织块法因培养时间过长,所得细胞量也相对较少。本实验使用高血清培养基,结合改良组织块培养法共同培养HPDLCs,并将这种方法与传统组织块培养法、改良组织块培养法做比较。
1 器材与方法
1.1 主要试剂及器材 DMEM 低糖培养基(Gibco 公司,美国)、胎牛血清(FBS,Hyclone 公司,美国)、Ⅰ型胶原酶(Sigma 公司,美国)、60 mm培养皿 、24孔细胞培养板、25 mm培养瓶(NEST公司)、100 U/mL 青霉素和100 U/mL 链霉素(Hyclone公司,美国)、兔抗人波形蛋白(北京中杉金桥公司)、鼠抗人角蛋白(北京中杉金桥公司)、生物安全柜(美国THORMO)、Heraus 28 RS 低温高速 离心机 (Heraus 公司,德国)、Hereaus HERA 3180F CO2培养 箱 (Hereaus 公司, 德国)、DMIRB 倒置相差显微镜 (Leica 公司,德国)、细胞粒度分析及计数仪 (Beck-man Coulter 公司,美国)。
1.2 方法
1.2.1 HPDLCs的原代培养 我院门诊部拔除的健康正畸前磨牙,患者年龄12~16岁。拔除后立刻放入预先预冷含100 U/mL 青霉素和100 U/mL 链霉素的DMEM低糖培养基中,快速移至超净台中,将牙冠放入乙醇侵泡约1 min后,使用PBS液反复冲洗离体牙根面去除污物及冠方乙醇,并使用预先配置的含10%FBS及双抗的低糖DMEM培养基润湿根面,使用手术刀刮取根中1/3牙周膜放置于培养皿中,将刮取得到的牙周膜组织剪成约1 mm的小块待使用。(1)HPDLCs传统培养法:本法使用含15%FBS及 100 U/mL 青霉素和100 U/mL 链霉素的低糖DMEM培养基对组织块进行培养。首先在60 mm的培养皿中加入1~2 mL完全培养基润湿皿底,进而将预先预备好的组织块平铺于皿底,组织块间的间隔约4 mm。将培养皿放入CO2培养箱中约4h后,再加入完全培养基4 mL继续培养,每3 d换液一次;(2)HPDLCs改良组织块培养法:首先将预备好的组织块放入15 mL的离心管中,随后向离心管中加入2 mL 0.2%的Ⅰ型胶原酶,将离心管放入CO2培养箱中30 min,每5 min将离心管拿出摇晃使组织块与酶均匀接触,随后离心机离心800 rpm/min,3 min,将沉淀物取出均匀平铺于60 mm的培养皿中,加入1~2mL含15%及100 U/mL 青霉素和100 U/mL 链霉素的低糖DMEM培养基,再放入CO2培养箱中约4 h后,再加入完全培养基4 mL继续培养,每3 d换液一次;(3)HPDLCs改良组织块培养结合高血清培养法:本法使用含40%FBS及100 U/mL 青霉素和100 U/mL 链霉素的低糖DMEM培养基对组织块进行培养。其培养方式与改良组织法相同。
1.2.2 HPDLCs的传代 使用倒置显微镜观察细胞,待组织块周围的细胞到达融合状态时,使用探针将组织块勾除,并向皿中加入4 mL含EDTA(0.02%)的0.25%胰蛋白酶,37 ℃培养箱中消化4~5 min后加入双倍的完全培养基终止消化(沿用原代培养时使用的血清浓度),使用移液枪吹打皿底使细胞脱落后收集于15 mL的离心管中,离心机1 000 rmp/min,5 min,弃去上清液,再向离心管中加入5 mL完全培养基(除高血清法需使用含25%FBS的完全培养基外,其余两种培养法均使用含10%FBS的完全培养基),将细胞吹打至重悬后接种于培养瓶中继续培养,4~5 d换液一次。
1.2.3 细胞的纯化及鉴定 牙周膜成纤维细胞的纯化即是将其与其中的上皮细胞分离,使用含EDTA(0.02%)的0.25%胰蛋白酶对细胞进行消化传代,一般4~5 min,利用HPDLCs与上皮细胞对胰酶的耐受度不同这一性质,再传到至4~5代时,HPDLCs可完全纯化。牙周膜成纤维细胞是来自于上皮中胚层的细胞,其与上皮细胞相区别的特异性蛋白即波形蛋白,本实验即鉴定细胞中是否存在波形蛋白及角蛋白,由此来鉴定细胞的来源。
1.2.4 HPDLCs细胞生长曲线 取生长至第4代的HPDLCs,使用0.25%的胰蛋白酶消化,离心后弃去上清液,加入含20%FBS的培养基后重悬细胞,以2×105个/mL的量接种于24孔板中,放入培养箱中进行培养,每2 d对细胞进行一次换液,后每24 h消化3孔对细胞进行计数,取3孔细胞计数的平均值进行计算,连续计数7 d,根据得到的7 d细胞计数绘制出细胞生长曲线图,其中以细胞数量作为纵轴,以细胞培养天数作为横轴。
1.3 细胞形态学观察 使用倒置显微镜观察细胞的形态及变化。
1.4 统计学方法 通过统计学χ2检验比较3种实验中细胞培养的成功率,以P<0.05为差异有统计学意义。
2 结 果
2.1 三种实验方法的比较 均取15例健康牙周膜进行分析。高血清结合改良组织块培养法的组织块贴壁率为92%,从倒置显微镜下观察可见组织块呈淡黄色,边缘处略显透亮,4~7 d约90%可见细胞从组织块边缘爬出,呈放射聚集性生长,细胞形态为长梭形或多角形。去除组织块继续培养,3~4 d后细胞可生长达到融合状态。15例中有13例培养成功,成功率为86.67%。传统组织块培养法的组织块贴壁率约为45.33%,倒置显微镜下观察组织块呈褐黑色,15~20 d约50%可见细胞爬出,呈小聚落放射生长,细胞形态呈长梭形或多角形。去除组织块后继续培养,8~10 d后细胞可达到融合状态。15例中4例培养成功,成功率为26.67%。改良组织块培养法的贴壁率约54.67%,倒置显微镜下组织块呈现半透明状,10~12 d约60%有细胞爬出,细胞大部分呈正常长梭形状,小部分细胞较正常形态更为细长;在细胞的增殖过程中,有15%的细胞崩解凋亡,约8 d细胞基本达到80%融合状态,基本可以传代。15例中8例培养成功,成功率为53.33%。高血清结合改良组织块培养法的成功率明显高于其他两种培养法,且差异具有统计学意义(P<0.01),见图1。

注:A.高血清结合改良法组5 d,大量细胞从组织块边缘爬出;B.改良法组12 d, 细胞爬出组织块并生长增殖;C.传统法组16 d,少量细 胞从组织块边缘爬出;D.高血清组细胞爬出4 d后,周围细胞生长至融合状态(10×倒置显微镜拍摄)。图1 HPDOCs三种培养方式的比较
2.2 细胞鉴定免疫组化染色 对第4代细胞免疫组化染色,鉴定抗波形蛋白呈阳性,细胞内可见大量棕黄色颗粒,即可知细胞来源于上皮组织中胚层;鉴定抗角蛋白呈阴性,细胞内无阳性颗粒反应,经苏木素染色呈淡蓝,由此可判断此细胞为牙周膜成纤维细胞,见图2。

注:A.HPDLCs免疫组化染色,抗波形蛋白呈阳性(40×); B.HPDLCs免疫组化染色,抗角蛋白呈阴性(40×)。图2 HPDLCs鉴别
2.3 HPDLCs生长曲线 HPDLCs的生长可分为3期,既缓慢期,对数生长期和平台期。接种后经24 h后消化细胞进行计数,因细胞刚经过胰蛋白酶消化刺激,细胞数量较平时生长速度明显减慢,数量减少,随后逐渐增加。从第3天开始细胞的增殖速度明显加快,进入到对数生长期,到第7天细胞的数量达到顶峰。此后因细胞已长满培养皿,相互之间出现接触抵触,生长受到抑制,细胞不在进行分裂、增殖,细胞生长进入到平台期。本实验的三种培养方式中,细胞的增殖速度相似,是呈缓慢期-对数增长期-平台停滞期的形式,见图3。
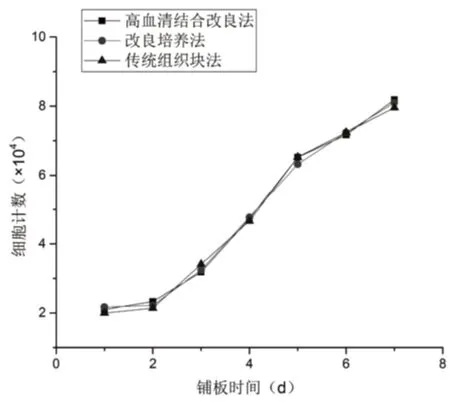
图3 HPDLCs生长曲线
3 讨 论
牙周膜细胞的培养方法一般分为组织块培养法及消化法两种。传统的组织块培养法在操作上较为简易,不容易发生污染,成纤维细胞的同源性较高,且相较于消化法所需要的组织量也较少。但其缺点在于培养时间过长,从细胞爬出到细胞接近融合状态需要2~4周,在本实验中组织块贴壁率只达到约40%,这直接影响了细胞培养的成功率,15例的实验组中仅有4例成功培养出细胞,效率只达到约26.6%,这与文献[3]报道的数据相符合。
研究[4]认为传统组织块培养法更容易掌握,所以此法得到广泛的运用。但因为传统的培养法获得的细胞量少且培养时长过久,使得效率降低,有学者对其进行了改良,即是将原有消化法中的“双酶”改为了只用Ⅰ型胶原酶消化牙周膜组织,使得组织连接部分分离,这样可以将原有消化法中两种酶对细胞的损伤尽量降低,同时也可以使细胞更快地从已经过“半消化”的组织块中分离出来,所以此方法是目前运用最广泛的培养法。从本实验的结果来看,改良组织块培养法的培养周期虽相对缩短,但组织块的贴壁率只达到约60%,这对原代细胞培养的成功率也出现了直接的影响,如无法提高组织块的贴壁率,但就改良消化的方式来说并不能真正的提高原代细胞培养的效率。
现已有研究[5]表明,含有高浓度血清的培养基有助于组织块贴壁效率,可以为细胞提供充足的营养物质。胎牛血清(FBS)的作用:(1)提供对维持细胞指数生长的激素,基础培养基中没有或量很少的营养物,以及主要的低分子营养物;(2)提供结合蛋白,能识别维生素、脂类、金属和其他激素等,能结合或调变它们所结合物的活力;(3)有些情况下结合蛋白质能与有毒金属和热原质结合,起到解毒作用;(4)是细胞贴壁、铺展在塑料培养基质上所需因子来源;(5)起酸碱度缓冲液作用;(6)提供蛋白酶抑制剂,使在细胞传代时使剩余胰蛋白酶失活,保护细胞不受伤害[6]。
对于细胞培养的血清浓度问题目前国内外学者均无明确答案,不同类型的细胞其差异很大,因血清成分复杂,过多应用血清易引起实验结果不可靠,且血清是酸性,对也细胞生长不利。在大部分的原代细胞培养实验中,大多使用15%~20%的FBS,传代后使用10%的FBS继续培养。本实验中的高血清培养法将FBS含量提高至40%,传代后使用20%的FBS继续培养。15例中有13例培养成功,效率可达到86.7% ,明显比另外两种培养法的成功效率高。因此,40%的FBS提供了丰富的结合蛋白和促进组织块贴壁的黏附因子,与另外两种培养法相比较,其组织块贴壁率达到90%,明显高于另外两种,说明此血清浓度可以很好地促进组织块贴壁。本实验中4~7 d约90%可见细胞从组织块边缘爬出,呈放射聚集性生长,细胞形态为长梭形或多角形。去除组织块继续培养后,因为血清提供了较高的养分,细胞生长旺盛、均匀,使得3~4 d后细胞可生长达到融合状态,速率明显高于另两种培养方式。本实验采取的高血清结合改良组织块培养法,将两种方法结合不仅仅可以降低消化酶对细胞的损伤,同时运用高血清浓度提高组织块贴壁率这一效果,使得原代细胞培养的速率及效率都得到了提高。同时,本实验运用的FBS浓度是常用浓度的2倍,从倒置显微镜观察细胞的形态及增值状况,显示都趋于正常,这说明高浓度的血清并不影响细胞的形态及生长。
通过本实验的三种培养方式,我们认为高血清结合改良组织块培养法的成功率较高、操作较已掌握、不容易发生污染,同时缩短了培养时间,获得相对较大数量的细胞,是一种较为适用、高效的HPDLCs的原代培养方式。
[1] 侯睿,陈新民,巢永烈,等.体外不同动态力学应变对人牙周膜成纤维细胞增殖和功能活性的影响[J].南方医科大学学报,2010,30(2):252-256.
[2] Zaman KU , Sugaya T , Kato H. Effect of recombinant human plate let derived growth factor and bone mophogenctic protein 2 application Demineralized dentinon early periodon cell retalligment[J].Response J Periodontal Res,1999,34 (5)∶244- 250.
[3] 司徒镇强,陈建元.体外培养的人牙龈牙周膜牙髓纤维细胞生长及形态特点[J].实用口腔医学杂志,1993,64(8):1026-1030.
[4] 张明珠,雷雅燕,刘晓,等.原代人牙周膜成纤维细胞的培养及培养方法的改进[J].昆明医学院学报,2004,25(1):53-56.
[5] 季钟涅,纪念研制牛血清白蛋白合格产品40周年 [J]生命的化学,2004,24(5):1.
[6] Adams AM, Soames JV, Seral RF. Cultural and morphological characteristics of human periodontal ligament cells in vitro [J].Arch Oral Biol, 1993,38(8):657-662.
Study on the various culture methods of periodontal ligament fibroblast cell
WuYou,ZhangJunmei△.
GuizhouMedcialUniversity,Guiyang550004,China.
Objective To improve the successful rate of primary culture of periodontal fibroblast cells and tissue block adherence rate, reduce culture time and increase cell production. Methods Culture primary HPDLCs by combining high serum and improved tissue block, which was compared with traditional tissue block method and improved block method. Recognize the source of cell by immunity group, draw the growing curve of cell, and make comparison of successful rate, adherence rate and production rate of three methods. Results The primary cells cultured by three methods are all normal. The cells look like fusiform and multi-angle shape, vimentin positive, Keratin negative, which conform of normal morphology of HPDLCs and biological characteristics. The successful rate of improved tissue block with high serum totals 86.7%, obviously higher than that of other two groups (P<0.01). Conclusion The method of high serum improved tissue block obviously is increased the successful rate of primary cultivation, which shall be applied in clinical cases.
Primary culture; Improve the successful rate of primary culture; Human periodontal ligament cells
R781
A
1000-744X(2016)05-0469-03
2015-10-25)
△通信作者,E-mail:zjm46688@126.com

