脓毒症患儿内皮细胞损伤标记物水平变化及其与严重程度的关系
凌萍 杨勤 陈建丽 唐熔 罗艳
(1.贵阳市妇幼保健院 贵阳市儿童医院PICU,贵州 贵阳 55003;2.贵州医科大学病理生理学教研室,贵州 贵阳 550004)
脓毒症患儿内皮细胞损伤标记物水平变化及其与严重程度的关系
凌萍1杨勤2△陈建丽1唐熔1罗艳1
(1.贵阳市妇幼保健院 贵阳市儿童医院PICU,贵州 贵阳 55003;2.贵州医科大学病理生理学教研室,贵州 贵阳 550004)
目的 探讨脓毒症患儿内皮细胞损伤标记物水平变化,以及与脓毒症严重程度之间的关系。方法 选择0~14岁急性脓毒症及脓毒性休克小儿各30例为研究对象,对照组为非脓血症对象60例,入院后第1,3,7天对内皮细胞损伤相关的标记物进行检测,并比较两组对象之间标记物水平。结果 脓毒血症患者观察循环内皮祖细胞(cEPCs)、内皮细胞特异性分子-1(ESM-1)、可溶性血栓调节蛋白(sTM)和可溶性E-选择素(sE-选择素)的浓度均明显高于正常对照组,差异有统计学意义(P<0.01),且此四种标记物水平在病程的发展早期中均呈逐渐上升,发病第7天的 cEPCs、ESM-1、sTM和sE-选择素水平明显高于第1天(P<0.05)。严重脓毒症和/或脓毒性休克组患者在早期cEPCs和ESM-1的水平明显高于脓毒血症组,差异均有统计学意义(P<0.01),但sTM和sE-选择素的水平在两组患者之间的差异无统计学意义。结论 内皮细胞损伤与脓毒血症的发生和发展均显著相关,且cEPCs和ESM-1与脓毒血症严重程度存在显著关联。
脓毒症; 内皮细胞损伤标记物; 儿童
脓毒症(sepsis)是宿主防御系统对入侵病原微生物产生的过度炎症反应,是儿童重症医学科最主要的死亡原因之一,病死率高达 18%~29%,而且由脓毒症及其相关疾病造成的死亡率仍然呈上升趋势[1]。脓毒症致病机制较为复杂,其中血管内皮细胞(vascular endothelial cell,VEC)损伤并发生功能性改变是脓毒症发生发展的重要病理基础[2]。内皮细胞的功能发生显著的改变,作为宿主整体反应的一部分,能够在特定的部位启动并促进炎症、凝血系统活化及细胞间相互作用,最终导致微血管闭塞、组织缺氧及器官功能障碍。在临床上检测内皮细胞损伤相关的标记物,对脓毒症的早期诊断、指导治疗和判断预后有着重要作用。本研究拟通过对脓毒症患儿内皮细胞损伤相关标记物进行检测,观察循环内皮祖细胞(endothelial progenitor cells,cEPCs)、内皮细胞特异性分子-1(Endothelial cell specific molecule-1, ESM-1)、可溶性血栓调节蛋白(Soluble thrombomodulin, sTM)和可溶性E-选择素(soluble E-selectin, sE-选择素)的水平变化,监测内皮细胞功能,并探讨上述指标与脓毒症严重程度之间的关系[3]。
1 材料和方法
1.1 临床资料 以2013年1月至2015年9月本院收治的0~14岁急性脓毒症及脓毒性休克小儿为研究对象,共60例,其中急性脓毒症30例,包括男16例,女14例,平均年龄(5.57±2.78)岁;脓毒性休克30例。包括男性 18例,女性 12例,平均年龄(5.90±3.01)岁。脓毒症和 SIRS 诊断标准根据脓毒症及脓毒性休克纳入标准采用中华医学会儿科学分会急救学组2005年制订的诊断标准[4]。另外选择非脓血症对象60例,包括男38例,女22例,平均年龄(5.88±2.58)岁,作为正常对照组;三组年龄无明显差异(F=0.154,P=0.857),性别构成亦无显著差异(χ2=0.833,P=0.659)。
1.2 研究内容 入院后第1,3,7天对内皮细胞损伤相关的标记物cEPCs、ESM-1、sTM、sE-选择素行检测。同时于入院后第1,3,7天监测血常规、肝肾功能、心肌酶、体温、呼吸、心率、血压等生命体征。治疗按脓毒症及脓毒性休克的诊疗指南进行治疗。另外,正常对照组也分别检测上述四种细胞损伤标记物。
1.3 方法 cEPCs以CD34+、CD133+、VEGFR-2+为表型标志,采用流式细胞学方法进行检测;ESM-1、sTM、sE-选择素和Ang-2均采用ELISA检测。

2 结 果
2.1 血清内皮细胞损伤标记物水平变化 脓毒血症组患者发病过程中 cEPCs、ESM-1、sTM和sE-选择素四种标记物的浓度均显著高于正常对照组,差异有统计学意义(P<0.05),且此四种标记物水平在病程的发展早期中均呈逐渐上升,发病第7天的 cEPCs、ESM-1、sTM和sE-选择素水平明显高于第3天(P<0.05),第3天的 cEPCs、ESM-1、sTM和sE-选择素水平明显高于第1天(P<0.05),见表1。
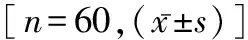
表1 脓毒血症患者四种内皮细胞损伤标记物 水平变化
注:与第1天相比,*P<0.05;与第3天相比,△P<0.05;与对照组相比,#P<0.05。
2.2 早期内皮细胞损伤标记物水平与严重程度的关系 比较脓毒血症组(n=30)和脓毒性休克组(n=30)在发病第 1天的血清四种内皮细胞损伤标记物的水平,结果见表2。脓毒性休克组患者在早期cEPCs和ESM-1的水平明显高于脓毒血症组,差异均有统计学意义(P<0.05),但sTM和sE-选择素的水平在两组患者之间的差异无统计学意义。
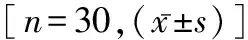
表2 两组患者发病第 1天四种内皮细胞损伤 标记物水平的比较
3 讨 论
脓毒症是一种常见的病症。儿童与成年人之间脓毒症的病理机制存在一定的差异,儿童脓毒血症和感染性休克的治疗也需要与成人相异的治疗方案。因此,掌握儿童脓毒症发展的特点以及严重脓毒症或者感染性休克的危险因素,对儿科脓毒症治疗策略的制定具有积极意义。内皮细胞是一个靶器官,同时也是全身炎症反应综合征进一步扩展的基础[4]。实验研究[5]已经证实,内皮细胞损伤和功能障碍,是脓毒症发生和发展的最主要病理基础。
本研究以0~14岁急性脓毒症及脓毒性休克小儿为研究对象,入院后第1,3,7天分别检测内皮细胞损伤相关的标记物浓度,并与正常人群对照,探讨脓毒症患者发生发展的特点。研究发现脓毒血症组四种内皮细胞损伤标记物浓度均显著高于正常对照组,且随着病程的发展,四种标记物浓度逐渐增加,可见内皮细胞损伤与脓毒症的发生和发展均显著相关。研究表明,内皮细胞被激活或者发生功能障碍时,通过表达多种炎症介质和凝血调节因子参与调节作用,因此在脓毒症和凝血反应失调中起着重要作用[6]。内皮祖细胞(EPCs)可以通过维持微循环内皮层的完整性和刺激 ECs 增殖发挥重要作用[7]。在正常情况下,人体内cEPCs浓度相对较低,但在病理情况下cEPCs浓度增加明显[8-9]。ESM-1是复杂的和高度多样化的分子,以一个糖化蛋白质核为特征[10]。张亮等[11]比较了脓毒症和非脓毒症病人的血清中 ESM-1含量的变化,结果发现与非脓毒症组病人比较,脓毒症病人血清中 ESM-1含量增加较为明显,因此 ESM-1可能是与脓毒症发生和发展有关的特异性分子。E-选择素在炎症刺激或组织损伤过程中,介导了白细胞沿着损伤部位的血管壁滚动,是白细胞与内皮细胞黏附以及穿越血管壁的必要条件。有研究[12]显示,在受到炎症介质激活后6 h,E-选择素的合成会大量增加,因此,E-选择素是内皮细胞早期活化的有效标志。有研究[13]表明,脓毒症患者除了炎症反应发生异常以外,凝血系统也会发生异常,且两者互为影响,TM在凝血系统与炎症反应中起重要的调节作用,具有与凝血酶紧密结合的能力,使凝血酶底物转变为蛋白质 C发挥抗凝作用。
本研究还比较了轻微脓毒血症患者和脓毒性休克患者之间四种血管内皮损伤标记物水平,以探讨血管内皮损伤标记物与脓毒血症严重程度之间的关系,结果发现脓毒性休克组患者在早期cEPCs和ESM-1的水平明显高于脓毒血症组,差异均有统计学意义,表明cEPCs和ESM-1水平可在一定程度上反映脓毒血症严重程度。S.Sarrazin等[14]的研究提出ESM-1 不仅在脓毒症的发病机制中扮演一个重要角色,还可作为严重脓毒症的标记物。在正常生理条件下,人体的内皮细胞可以通过脱落进入体液循环,形成CECs,但是脱落的量相对较少,然而在病理状态下,脱落进入体液循环系统的内皮细胞会大量增多,因此CECs数量和浓度与血管内皮损伤的严重程度密切相关[15],进而与脓毒血症的严重程度显著相关。
综上所述,脓毒症组cEPCs、ESM-1、sTM和sE-选择素水平均显著高于正常对照组,且随着病程的发展,四种标记物浓度逐渐增加,可见内皮细胞损伤与脓毒血症的发生和发展均显著相关,且cEPCs和ESM-1与脓毒血症严重程度存在更显著关联。
[1] Martin GS,Mannino DM,Eaton S,et al. The epidemiology of sepsis in the United States from 1979 through 2000[J]. N Engl J Med,2003,348:1546-1554.
[2] Vincent JL, Marshall JC,amendys-Silva SA, et al. Assessment of the worldwide burden of critical illness: the Intensive Care Over Nations (ICON) audit[J]. Lancet Res Med,2014;2(5):380-386.
[3] Palud A, Parmentier-Decrucq E, Pastre J,et al. Evaluation of endothelial biomarkers as predictors of organ failures in septic shock patients[J]. Cytokine,2015,73(2):213-218.
[4] 中华医学会儿科学分会急救学组,中华医学会急诊学分会儿科组,中华儿科杂志编辑委员会. 儿科感染性休克(脓毒性休克)诊疗推荐方案[J].中华儿科杂志2006,44(8):596-598.
[5] Warren L,Leea W,Conrad L.Endothelial activation,dysfunction and permeability during severe infections[J].Curr Opin Hematol,2011,18: 191-196.
[6] Benoít V. Endothelial cell dysfunction in severe sepsis: a role in organ dysfunction[J].Crit Care,2003,7(2) : 130-138.
[7] Tslotou AG,Sakorafas GH,Anagnostopoulos G,et al. Septic shock: current pathogenetic concepts from a clinical perspective[J]. Med Sci Monit,2005,11(3):76-85.
[8] Cribbs SK,Sutcliffe DJ,Taylor WR,et al.Circulating endothelial progenitor cells inversely associate with organ dysfunction in sepsis[J].Intensive Care Med,2012,38(3) : 429-436.
[9] George J, Goldstein E,Abashidze S,et al. Circulating endothelial progenitor cells in patients with unstable angina: association with systemic inflammation [J].Eur Heart,2004,25 (11) :1003-1008.
[10] Burnham EL,Taylor WR,Quyyumi AA,et al.Increased circulating endothelial progenitor cells are associated with survival in acute lung injury[J].Am J Respir Crit Care Med,2005,172 (9) :854-860.
[11] 张亮,陈林,黄显凯.多发伤患者血 ESM-1的动态变化与脓毒症的关系[J].重庆医学,2007,36(22) : 2259-2260.
[12] Roldan V, Marin F, BlannA, et al. Soluble E-selectin , interleukin-6 and tiss ue factor in two cases of meningococcal septicaemia [J]. Blood Coagul Fibrinolysis,2004,15( 2): 179-182.
[13] Levi M,van der Poll T. Inflammation and coagulation[J].Crit Care Med,2010,38 ( 2 Suppl) : S26 -S34.
[14] Sarrazin S, Adam E, Lyon M,et al. Endocan or endothelial cell specific molecule-1 (ESM-1): a potential novel endothelial cell marker and a new target for cancer therapy[J]. Biochim Biophys Acta,2006,1765(1):25-37.
[15] David Béchard,Arnaud,Scherpereel,et al.Human endothelial-cell Specific Molecule-1Binds directly to the integrin CD11a /CD18 ( LFA-1) and blocks binding to intercellular adhesion molecule-1[J].J Immunol,2001,167: 3099-3106.
Relationship with severity of sepsis and changes of endothelial cell injury markers in children with sepsis
LingPing1,YangQin2△,ChenJianli1,TangRong1,LuoYan1.
1.DepartmentofPediatricIntensivecareUnit,GuizhouProvincialMaternalandChildCareServiceCenter,GuiyangCityChildHealthHospital,Guiyang550003,China. 2.DepartmentofPathophysiology,GuizhouMedcialUniversity,Guiyang550004,China.
Objective To investigate the relationship with the severity of sepsis and detect the changes of endothelial cell damage markers in children with sepsis. Methods Subjects with 0~14 years old were recruited from sepsis and septic shock patients in our hospital, from January 2013-2015 September, the study subjects were divided into three groups, endothelial cells damage related markers were detected at the 1st, 3rd, 7th day, and compared endothelial cell damage markers between the two groups. Results The levels of cEPCs, ESM-1, sTM and Se-selectin in sepsis patients were significantly higher than those in the normal control group, and there were statistical significantly differences (P<0.01). With the progress of disease, the levels of four kinds of markers were raised gradually. The levels of cEPCs, ESM-1, sTM and Se-selectin on the 7th day were higher than those on the 1st day (P<0.05). On the first day, cEPCs and ESM-1 level in severe sepsis and / or septic shock group patients were significantly higher than those in the sepsis group, and there were statistical significantly differences (P<0.01), but there were no statistical significantly differences for sTM and Se-selectin levels between the two groups. Conclusion Endothelial cell injury was significantly correlated with the occurrence and development of sepsis, and cEPCs and ESM-1 level were associated with severity of sepsis.
Sepsis; Endothelial cell injury markers; Children
贵阳市科技计划项目,2013社会发展与民生科技计划,[筑科合同(2013103)10号]
R725.9
A
1000-744X(2016)05-0463-03
2016-01-22)
△通信作者,E-mail:Qinyang @gmc.edc.cn

