唑来膦酸对内分泌治疗绝经前乳腺癌患者所致骨丢失的效果观察
宋亚琪 牛凤玲 林婷 王秀丽 段韩立
(唐山市人民医院乳腺中心,河北 唐山 063000)
唑来膦酸对内分泌治疗绝经前乳腺癌患者所致骨丢失的效果观察
宋亚琪 牛凤玲△林婷 王秀丽 段韩立
(唐山市人民医院乳腺中心,河北 唐山 063000)
目的 观察唑来膦酸对戈舍瑞林与芳香化酶抑制剂联合治疗绝经前转移性乳腺癌患者所致骨丢失的临床效果和安全性,为临床应用提供参考。方法 收集90例在我院乳腺科接受戈舍瑞林联合芳香化酶抑制剂治疗的绝经前转移性乳腺癌患者的临床资料,分为三组,A组(30例)和B组(30例)在戈舍瑞林联合芳香化酶抑制剂治疗的同时使用唑来膦酸,疗程分别为5年和2年;C组(30例)在戈舍瑞林联合芳香化酶抑制剂治疗期间未使用唑来膦酸。所有患者通过双能X线骨密度测量仪检测各时间点各组骨密度值,使用视觉模拟评分法进行肢体骨痛评定,观察记录骨质疏松性骨折的发生率。结果 随访60个月,A组患者各时间点骨密度均较C组升高(P<0.05):A组患者在治疗第48,60个月骨密度较B组患者升高(P<0.05):四肢疼痛视觉模拟评分A组低于B组和C组(P<0.05):A组患者骨质疏松性骨折的发生率显著低于 B组和C组(P<0.05)。结论 绝经前转移性乳腺癌患者行戈舍瑞林联合芳香化酶抑制剂治疗期间,早期足疗程应用唑来膦酸可减少骨量丢失和相关骨折发生,缓解骨痛。
唑来膦酸; 绝经前乳腺癌; 戈舍瑞林; 芳香化酶抑制剂; 骨密度
内分泌治疗耐受性好,是激素受体阳性病情进展缓慢的晚期转移性乳腺癌患者重要的治疗选择。尤其对于他莫昔芬耐药的患者,卵巢功能抑制联合芳香化酶抑制剂治疗可取得较好的生存获益。然而这一治疗可导致患者骨量降低,增加骨质疏松骨折风险。本资料收集了90例绝经前转移性乳腺癌患者的临床资料,观察卵巢功能抑制联合芳香化酶抑制剂治疗的同时应用唑来膦酸治疗的临床效果及不良反应,以指导临床应用。现报告如下。
1 资料与方法
1.1 一般资料 收集2010年5月至2013年6月在我院接受治疗的90例绝经前转移性乳腺癌患者的临床资料。所有病例病理均为ER或PR阳性;经病理诊断明确复发或经两种以上影像方法诊断的远处转移乳腺癌患者;内脏转移无明显临床症状者(不包括骨转移患者);排除既往有骨质疏松史或影响骨代谢的疾病患者;心、肺、肝肾及血液学指标基本正常。根据有无使用唑来膦酸治疗及疗程长短,将绝经前转移性乳腺癌患者分为A、B、C三组,各组患者的临床一般资料差异无统计学意义,具有可比性。
1.2 方法 三组患者均接受戈舍瑞林联合芳香化酶抑制剂治疗,并同时给予维D钙咀嚼片,2片, 口服, 1次/d;戈舍瑞林3.6 mg,皮下注射,28d 1次;芳香化酶抑制剂包括阿那曲唑1 mg或来曲唑2.5 mg,口服,1次/d。A组和B组患者接受戈舍瑞林联合芳香化酶抑制剂治疗的同时给予唑来膦酸,疗程分别为 5年和2年,唑来膦酸4 mg(天晴依泰,江苏正大天晴药业,批准文号:H20041346)加入0.9%氯化钠100 mL,静滴30 min以上,每6个月一次。C组患者未接受唑来膦酸治疗。治疗期间定期复查血肝肾功能、钙离子、碱性磷酸酶等生化指标。
1.3 观察指标 随访60个月,分时间段使用双能X线骨密度检测仪测量记录入组患者的腰椎和股骨颈骨密度。采用视觉模拟评分法(visualanaloguescale,VAS)评价四肢骨痛情况。记录随访期间骨质疏松性骨折发生率。
1.4 统计学处理 采用SPSS19.0软件分析处理,数据用均数±标准差表示,两组数据比较采用t检验,多组数据之间的差异比较采用方差分析,率的比较用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组骨密度变化 A、B和C组患者基线腰椎及股骨颈骨密度比较无明显差异(P>0.05)。A组患者随访期间和B组患者随访36个月内的骨密度均较C组升高,差异具有统计学意义(P<0.05):A组患者在治疗第48、60个月骨密度较B组患者升高,差异具有统计学意义(P<0.05)。见表1。
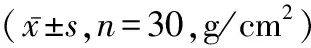
表1 各组患者骨密度比较
注:与C组比较,*P<0.05;与B组比较,#P<0.05。
2.2 肢体疼痛视觉模拟评分 A组患者各时间点和B组患者随访36个月内的四肢疼痛视觉模拟评分均低于C组患者,差异具有统计学意义(P<0.05);A组患者在治疗第48、60个月四肢疼痛视觉模拟评分低于B组患者,差异具有统计学意义(P<0.05)。见表2。

表2 各组肢体疼痛视觉模拟评分比较±s,n=30)
注:与C组比较,*P<0.05;与B组比较,#P<0.05。
2.3 骨质疏松性骨折发生情况 将骨密度降低后,轻微外伤所致或日常生活中自发的骨折定义为骨质疏松性骨折。随访60个月,C组患者骨质疏松性骨折的发生率最高,且发生时间提前,A组患者最低,各组间差异具有统计学意义(P<0.05)。见表3。

表3 各组骨质疏松骨折发生率比较(n=30)
注:与C组比较,*P<0.05;与B组比较,#P<0.05。
2.4 唑来膦酸不良反应 患者使用唑来磷酸期间的不良反应,主要发生在初次使用后3 d 内,常见的表现为骨骼及肌肉疼痛,头痛,发热,疲乏等流感样症状,且大多患者在 24~28 h内自行缓解。 1例体温39 ℃以上患者给予物理降温联合口服布洛芬缓释片治疗逐渐缓解。随访期间监测血液学指标、电解质、肝肾功能未见明显异常,也未观察到下颌骨坏死等并发症。A组和B组患者在使用唑来膦酸的不良反应发生率及程度方面无显著差别。
3 讨 论
药物性卵巢功能抑制,因其可逆性、副作用小等优势得到了临床广泛应用[1]。临床研究[2-3]证实对于绝经前转移性乳腺癌患者,联合应用戈舍瑞林和芳香化酶抑制剂治疗临床疗效确切。尤其对于他莫昔芬耐药或禁忌的激素受体阳性的绝经前转移性乳腺癌患者,戈舍瑞林联合芳香化酶抑制剂已被推荐为标准治疗方案之一[4]。然而上述联合内分泌治疗方案,虽可有效降低体内雌激素水平, 但却增加 骨量丢失,增加骨折风险[5]。因此防治内分泌治疗导致的骨质疏松是近年的研究热点之一。临床研究证实[6-7],以唑来膦酸为代表的第三代双磷酸盐类可减少乳腺癌患者内分泌治疗相关骨丢失,安全性好。本资料结果显示,唑来膦酸治疗可显著延缓戈舍瑞林联合芳香化酶抑制剂治疗引起的骨丢失,降低骨质疏松性骨折的发生率,这一结果和一些临床研究一致[8-9]。本资料结果证实,与2年疗程相比,唑来膦酸与戈舍瑞林联合芳香化酶抑制剂同时使用5年可更显著地减少骨密度降低,减轻四肢骨痛,延缓骨折发生风险。通过比较唑来膦酸治疗2年和5年的不良反应,发现唑来膦酸常见的流感样症状和骨痛发生情况与疗程无相关。据报道唑来膦 酸长期应用有增加肾功能损害及下颌骨坏死风险[10]。本组随访60个月的结果未发现以上副作用,提示唑来膦酸治疗前进行必要的牙科检查,并排除肾功不全患者,治疗期间注意口腔清洁,密切监测病情,可有效避免药物不良反应。
总之,戈舍瑞林和芳香化酶抑制剂的联合内分泌治疗方案为绝经前转移性乳腺癌患者的治疗提供了新的选择。由此引起的骨量丢失、骨痛等不良反应可通过早期足疗程地 合理使用唑来膦酸治疗来改善,以提高患者生活质量。但目前国内这方面的研究鲜见,尚需大样本量的前瞻性研究进一步观察,为唑来膦酸在内分泌治疗中的应用提供更为可靠的依据。
[1] 孙伟玲.赵艳滨,蔡莉.乳腺癌药物卵巢去势新讲展[J].实用肿瘤学杂志,2014,28(1):81-84.
[2] 杨婷婷,王涛,边莉,等.卵巢功能去势联合芳香化酶抑制剂治疗绝经前转移性乳腺癌的临床研究[J].临床肿瘤学杂志,2013,18(6):521-524.
[3] 刘芊,王涛,江泽飞,等.药物性卵巢去势联合阿那曲唑治疗绝经前转移性乳腺癌患者的临床研究[J].肿瘤研究与临床,2012,24(6): 392-394.
[4] Yao S,Xu B,Li Q,et al .Goserelin pius letrozole as first-line or second-line hormonal treatment in permenopausal patients with advanced breast cancer[J].Endocr J,2011,58(6):509-516.
[5] Servitja S,Nogras X,Prieto AD,et al,Bone health in a prospective cohort of postmenopausal women receiving aromatase inhiditors for early breast cancer[J].Breast,2012,21(1):95-101.
[6] Brufsky AM,Bosserman LD,Caradonna RR,et al.Zoledronic acid effectively prevents aromatase inhibitor-associated bone loss in pqst menopausalwomen with early breast cancer receiving adjuvant letrozole:Z-FAST study 36-minths follow-up results[J].Clin Breast Cancer,2009,9(2):77-85.
[7] 陈晓霞.唑来膦酸联合化疗治疗胃癌骨转移性疼痛的护理体会[J].贵州医药,2015, 39(5):472-473.
[8] Gnant M, Mlineritsch B, Stoeger H, et al. Adjuvant endocrine therapy plus zoledronic acid in oremenopausal women with early stage breast cancer:62 month follow-up from the ABCSG-12 randomised trail[J]. Lancet Oncol,2011,12(7):631-641.
[9] Kalder M, Kyvernitakis I, Albert U S,et al. Effects of zoledronic acid versus placebo on bone mineral density and bone texture analysis assessed by the trabecular bone score in premenopaLisal women with breast cancer treatment-induced bone loss: results of the ProBONE Ⅱ substudy[J]. Osteoporosis International, 2015, 26(1):353-360.
[10] Diel IJ,Berger R,Grota KA.Adverse effects of bisphosphonates:current issues[J] J Support Onco1,2007,5(10):475-482.
河北省卫生厅科研基金资助项目[编号:13010520152128]
R737.9
B
1000-744X(2016)08-0831-03
2016-03-14)
△通信作者,E-mail:Ymyynfl@163.com

