环介导等温扩增法检测熊蜂中的微孢子虫
(潍坊出入境检验检疫局,山东潍坊 261041)
环介导等温扩增法检测熊蜂中的微孢子虫
郭礼强,韩 亮,张丽萍,田国宁,赵 晗
(潍坊出入境检验检疫局,山东潍坊 261041)
为快速检测进口熊蜂中的微孢子虫,建立了环介导等温扩增技术(Loop-mediated isothermal amplifcation,LAMP)。针对熊蜂微孢子虫核糖体保守基因设计LAMP引物,以熊蜂微孢子虫DNA、家蚕微孢子虫DNA、蝗虫微孢子虫DNA、兔脑炎微孢子虫DNA作为LAMP反应的模板,分别采用浊度法和显色法验证LAMP引物的特异性;并将含微孢子虫基因的质粒模板10倍梯度稀释,考察方法的敏感性。结果表明,LAMP法能有效、特异地检测出熊蜂寄生微孢子虫DNA,灵敏度比PCR法高10倍。该方法简单、快速、敏感,可应用于熊蜂寄生微孢子虫的便捷检测中。
环介导等温扩增;熊蜂;微孢子虫;检测
熊蜂属于膜翅目蜜蜂科熊蜂属,其体毛长且密集,喙长,对低温适应性强,在封闭的温室作物上能专心授粉,因而成为温室中比蜜蜂更理性的授粉昆虫。我国的设施栽培果蔬面积居世界第一位,熊蜂授粉应用潜力巨大[1]。随着现代农业的发展,从国外进口优质熊蜂成为一些蔬果种植企业的迫切需求。然而,熊蜂可能携带病原微生物,如微孢子虫等有害外来物种,会给国内熊蜂和蜜蜂等昆虫带来新物种入侵风险。Valeriya等[2]报道,在西班牙捕获的16个种727个熊蜂中,有64个样本显示微孢子虫阳性。熊蜂中主要有3种微孢子虫,分别为Nosena bombi、Apicystis bombi和Crithidia bombi。熊蜂微孢子虫存在于血淋巴细胞、马氏管、脂肪体和直肠,为熊蜂的一种严重病害。其孢子长4.6 ~7.0 μm,宽1.8~4.0 μm。孢子虫入侵熊蜂腹部,可导致其腹泻,并抑制其交尾,患重病的蜂后不能越冬即死亡。中度感染的蜂后虽然可以越冬,但很难形成蜂群,即使形成小种群,蜂后也会早死。同时,微孢子虫宿主非常广泛,可以是昆虫、鱼类、啮齿类及灵长类等动物的寄生病原[3],其潜在的传入风险不容低估。为此,日本因欧洲生产的熊蜂对其生态环境带来了不利影响[4],在2005年开始实施“特定外来生物法”。外来熊蜂的不利因素主要有两个方面:一是外来熊蜂可破坏国内昆虫和植物间的授粉关系;二是进口熊蜂本体易携带寄生虫。
目前对微孢子虫的检验主要是肉眼鉴定、显微镜镜检和分子生物学检测[5-12]。肉眼鉴定和显微镜镜检比较方便、成本低,不需要专业的检测技术,但监控手段滞后,只有当病害发展到一定程度时,才能发现,损失和风险无法避免。分子生物学检测技术虽然检测成本略高,但灵敏度高、特异性好,在病虫害的早期就能发现,从而能做到提前预防和有针对性地治疗。本研究利用 LAMP技术的高灵敏度和特异性,建立的熊峰微孢子虫检测方法,为监管部门和熊峰养殖企业提供了技术支持。
1 材料与方法
1.1 仪器与试剂
熊蜂微孢子虫DNA:USDA-ARS Pollinating Insects Research Unit(Department of Biology,Utah State University)提供。家蚕微孢子虫DNA、蝗虫微孢子虫DNA、兔脑炎微孢子虫DNA:北京蓝谱生物科技有限公司提供;环介导等温扩增法FDR荧光检测试剂盒:北京蓝谱生物科技有限公司(试剂盒组成:2×反应混合液,Bst DNA聚合酶,显色液);2xTaq PCR Master mix:TIANGEN,货号:KT201;台式高速离心机:5417R,德国Eppendorf公司;PCR仪:伯乐CFX96;超微量核酸蛋白分析仪:DU-800,美国Beckman公司;实时浊度仪:LA-320c,荣研生物科技(中国)有限公司。
1.2 DNA提取
参照文献[12]提取样品DNA。
1.3 引物序列
本研究根据美国NCBI GenBank数据库微孢子虫线粒体(GenBank Accession No.AY741101.1)基因序列,以微孢子虫保守基因为靶标,通过日本荣研化学公司的引物在线设计网页(http:// primerexplorer.jp/e/),设计5套微孢子虫引物,序列见表1。引物由生工生物工程(上海)股份有限公司合成,HPLC纯化。

表1 引物序列
1.4 反应条件
1.4.1 LAMP反应条件。根据环介导等温扩增法,利用FDR荧光检测试剂盒配制25 µL反应混合物:2×反应混合液 12.5 µL,引物混合液(引物浓度40 pmol FIP 和BIP,5 pmol F3 和 B3,20 pmol LB和LF)2.6 µL,双蒸水5.9 µL,Bst DNA聚合酶1 µL,样本DNA 2 µL,显色液1 µL。反应条件:65 ℃,60 min,80 ℃,10 min,在实时浊度仪上完成反应。
1.4.2 PCR反应条件。引物为P2-F3、P2-B3。25 µL PCR 反应总体积的组成:2×Taq MIX 12.5 µL,各10 pmol引物,模板2 µL,补水至25 µL。扩增循环条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环;最后延伸7 min。
1.5 引物特异性
用熊蜂微孢子虫DNA、家蚕微孢子虫DNA、蝗虫微孢子虫DNA、兔脑炎微孢子虫DNA作为LAMP反应的模板,验证LAMP引物的特异性,分别采用浊度法和显色法来检测结果。
1.6 灵敏度试验
将含微孢子虫基因的质粒模板10倍梯度稀释,通过LAMP 反应和PCR反应检测验证方法的敏感性。
2 结果与分析
2.1 引物的选择
利用5套引物对含保守DNA基因片段的质粒(质粒浓度108拷贝/µL)进行LAMP扩增,以最先开始扩增DNA序列的引物组合为最佳引物。从图1中可以看出引物P2最先开始发生LAMP反应,故将P2引物组选为最佳引物。
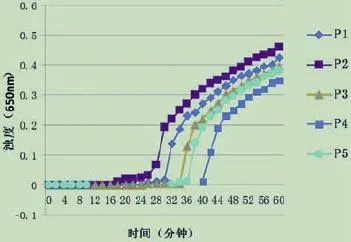
图1 最佳引物筛选实验结果
2.2 引物特异性试验
阳性对照用含熊蜂微孢子虫的DNA为模板,并用家蚕微孢子虫、蝗虫微孢子虫、兔脑炎微孢子虫为对照样本检测其特异性。当反应体系中存在熊蜂微孢子虫基因时,便发生LAMP扩增反应,从而产生大量的焦磷酸镁白色沉淀,反应液的浊度上升。从图2中可以看出,只有阳性对照出现典型的扩增双曲线,这表明设计的引物具有良好的特异性。采用显色法来观察结果,其结果与浊度法一致(图3)。
2.3 灵敏度试验
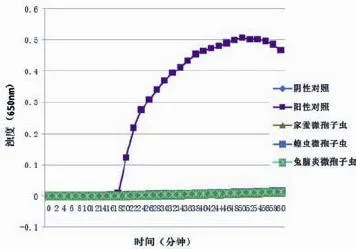
图2 最佳引物的特异性浊度法实验结果

图3 显色法比对结果
为考察方法的敏感性,将含微孢子虫基因的质粒模板10倍梯度稀释,浓度分别为105、104、103、102、101、100拷贝/µL,通过LAMP 反应来检测,结果见图4。从浊度扩增曲线可以看出,LAMP方法的最低检测浓度可以达到10 拷贝/µL(图4)。取PCR 产物8 µL,在1% 含EB琼脂糖凝胶电泳上100 V 电泳35 min,在凝胶成像系统下照像检测。从图5可以看出,PCR最低检测浓度为102拷贝/µL,说明LAMP方法的灵敏度至少要比PCR方法高10倍。
2.4 反应时间的确定
LAMP反应时间越长,其灵敏度越高,但过分追求灵敏度会造成假阳性的几率升高。从图4中的敏感性浊度扩增试验结果可知,质粒浓度为103拷贝/µL时,LAMP反应时间为60 min时最佳。
3 结论
本研究探索建立的熊蜂微孢子虫LAMP鉴别方法,具有良好的稳定性和灵敏度,与常规PCR方法比较,灵敏度至少可以提高10倍,并省去了常规PCR方法需要电泳分析的操作,显著降低了检验检疫的监控成本,易于推广普及。

图4 最佳引物检测的敏感性浊度法实验结果

图5 PCR敏感性的实验结果
[1] 张体银, 陈艳, 张伯强, 等. 进境熊蜂风险分析[J]. 昆虫知识, 2015,52(2):343-350.
[2]VALERIYA V,IRINA S,MICHAL W,et al. Distribution and diversity of Nosema bombi (Microsporidia:Nosematidae)in the natural populations of bumblebees(Bombus spp)from West Siberia[J]. Parasitol Res,2015,114:3373-3383.
[3]王强,周婷,代平礼,等. 蜜蜂微孢子虫研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2009,27(2):171-174.
[4]王凤鹤,袁宝玲,杨甫. 引进外来熊蜂谨防病虫害侵入[J]. 蜜蜂杂志,2008,28(9):29-30.
[5]RIJK P D,CAERS A,PEER Y V,et al. Database on the structure of large subunit ribosomal RNA[J]. Nucl.Acids Res,1998,26(1):183-186·
[6]潘敏慧,万永继,鲁成. 不同种类微孢子虫DNA制备方法的研究[J]. 西南大学学报(自然科学版),2001,23(2):111-112,116.
[7]刘骏,钱科,沈中元. 家蚕微粒子病PCR快速检测技术研究及诊断试剂盒的研制[J]. 中国动物检疫,2009,26(10):49-53.
[8]马兰,李灿,刘莹. 10 株微孢子虫Hsp70 基因克隆及系统发育分析[J]. 江西农业学报, 2012,24(7):146-150.
[9]陈文锋,吴杰,李继莲,等. 蜜蜂及熊蜂微孢子虫rRNA基因研究[J]. 昆虫知识,2009,46(3):344-349.
[10]罗洁,邓远洪,黄为,等. 一个家蚕微孢子虫新基因的序列分析及蛋白质在酿酒酵母细胞中的定位[J]. 蚕业科学,2013,39(2):0302-0309.
[11]陈文锋,吴杰,李继莲,等. 蜜蜂及熊蜂微孢子虫rRNA基因研究[J]. 昆虫知识,2009, 46(3):344-349.
[12] BLAKER E A,STRANGE J P,JAMES R R,et al. PCR reveals high prevalence of non/low sporulating Nosema bombi(microsporidia)infections in bumble bees(Bombus)in Northern Arizona[J].Journal of Invertebrate Pathology,2014,123:25-33.
(责任编辑:朱迪国)
Detection of Microsporidia in Bumble Bees by Loop-mediated Isothermal Amplification
Guo Liqiang,Han Liang,Zhang Liping,Tian Guoning,Zhao Han
(Weifang Entry-exit Inspection and Quarantine Bureau,Weifang,Shandong 261041)
In order to rapidly detect Microsporidia in imported bumble bees,a method of loop-mediated isothermal amplifcation(LAMP)was developed. Firstly,the LAMP primers were designed according to the conservative gene of Microsporidia ribosome in bumble bees,then through different DNA templates including Nosema bombi,Nosema bombycis,Nosema locustae and Encephalitozoon cuniculithe,the specifcity of this LAMP method was verifed by both turbidimetric and color-developing method. Meanwhile,its sensibility was investigated by using plasmid templates of Nosema bombi gene of 10-fold serial dilution. It's showed that the developed LAMP method could detect Nosema bombi DNA effectively and specifcally,and its sensitivity was ten times higher than that of PCR method. Due to the characteristics of simplicity,speediness and accuracy,this method could be applied to the detection of Microsporidia in bumble bees.
loop-mediated isothermal amplifcation(LAMP);bumble bees;Microsporidia;detection
book=97,ebook=103
S851.34+7.32
A
1005-944X(2017)01-0097-04
10.3969/j.issn.1005-944X.2017.01.027
山东出入境检验检疫局科研基金 (SK201627);潍坊市2015年科学技术发展计划(2015ZJ1101)
——一道江苏高考题的奥秘解读和拓展

