生姜糖蛋白提取工艺优化及抗氧化活性研究
赵文竹,张瑞雪,于志鹏,*,陈月皎,张宏玲,王欣珂,刘静波,励建荣,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.吉林大学营养与功能食品研究室,吉林长春 130062)
生姜糖蛋白提取工艺优化及抗氧化活性研究
赵文竹1,张瑞雪1,于志鹏1,*,陈月皎1,张宏玲1,王欣珂1,刘静波2,励建荣1,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.吉林大学营养与功能食品研究室,吉林长春 130062)
以生姜为原料,在单因素实验基础上采用三元二次回归正交组合设计优化生姜糖蛋白的提取工艺,采用红外光谱初步分析了生姜糖蛋白的结构特征。同时,考察了生姜糖蛋白的抗氧化活性和凝集素芯片的荧光强度。结果表明,生姜糖蛋白的最优提取条件:提取温度为90 ℃,液固比为35.5∶1,pH为7.5,在此条件下提取3 h,蛋白质得率为2.437 mg/g,糖得率为117.126 mg/g;经分离纯化获得的生姜糖蛋白,采用红外光谱分析表明其存在多糖和蛋白质的特征吸收峰。抗氧化实验与凝集素芯片实验结果表明,生姜糖蛋白在蛋白表面具有糖链结构,且可以螯和金属离子,具备一定的还原能力与重要的生理功能。
生姜,糖蛋白,正交组合设计,红外光谱,抗氧化活性,凝集素芯片
糖蛋白是一类由糖类与多肽或蛋白质以共价键连接而成的结合蛋白,具有驱寒、止呕、健胃解毒、延缓衰老、降低胆固醇、抗癌、抑菌及抗阿尔兹海默症等多种功能[1-3]。糖蛋白广泛存在于动物、植物和微生物中,是生物体内重要的一类大分子,是构成细胞膜、血浆、黏液和激素的重要成分,也是生物体内的重要活性物质[4]。目前,研究者广泛从海带[5]、甘薯[6]、山药[7]及油茶籽中提取制备糖蛋白。生姜(RhizomaZingiberisRecens)作为香辛调味料及中医药材,主要以保鲜姜等初加工产品为主。目前针对生姜的研究主要侧重姜酚、姜油萜、姜多糖和姜酮等多种成分的提取、纯化及活性的研究[8],但在国内对生姜糖蛋白的研究却仅仅局限在生姜蛋白酶。
糖蛋白作为一种结合蛋白,兼具多糖和蛋白质的某些性质,大多数可溶于水及稀盐、稀酸和稀碱等溶液中。因此,天然糖蛋白的提取方法主要有水提法[9]、稀盐溶液或缓冲溶液提取法[10]、酸碱溶液提取法[11]、酶解法[12]、超声与微波辅助法[13]等方法。其中水提法操作工艺简单,但受脂质和游离蛋白质的影响大;稀盐溶液或缓冲盐溶液中的盐离子可以与蛋白质部分结合保护蛋白质使其不易变性,进而最大限度地保护糖蛋白的完整性和生物活性,但后续需进行透析等脱盐处理;酸碱溶液提取法专一性强,但要注意防止过酸或过碱导致蛋白质构象的不可逆变化;酶解法提取糖蛋白不仅可以缩短提取时间和增大提取效率,而且因酶具有高度专一性和选择性可以选择性地去除杂质,对各种成分起到很好的浓缩富集作用。但酶制剂的种类和酶解条件需要进一步探索;超声与微波辅助提取法,具有溶剂用量少、热效率高、提取时间短等优点,但工业化提取时,受设备限制。由此,本实验选取稀盐和缓冲溶液提取法,同时采用三元二次回归正交组合设计优化生姜糖蛋白的提取工艺参数[14],从最优条件下的提取液中经醇沉、透析后得到生姜糖蛋白,并分析其红外光谱特性和抗氧化活性,旨在为生姜及其糖蛋白的基础研究和高值化利用提供理论基础。
1 材料与方法
1.1 材料与仪器
生姜 购于兴隆大家庭购物中心(锦州);磷酸氢二钾、磷酸二氢钾、氯化钠、苯酚、浓硫酸、三氯乙酸、考马斯亮蓝G250 均为分析纯;凝集素GNA、ECA、Jacalin、LotusA、WGA、SNA、PNA、MAL、LCA、VVA、ConA、STL及LEL等 购于 Sigma 公司;Cy3 荧光染料 购自于 GE 公司;Ferrozine(菲洛嗪)及DPPH 购于Sigma 公司。
FA1204B数显恒温水浴锅 金坛市鑫鑫实验仪器厂;KF20002电子天平 凯丰集团有限公司;SHE-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;KQ-100DB台式数控超声波清洗器 成都一科仪器设备有限公司;UV-5100紫外-可见分光光度计 上海元析仪器有限公司;DHG-9070A鼓风干燥箱 上海-恒科学仪器有限公司;Lambda 750紫外/可见/近红外分光光度计 珀金埃尔默公司;TG16KR台式离心机 东旺仪器厂;IRPrestige-21红外光谱仪 日本岛津。
1.2 实验方法
1.2.1 生姜的预处理 为了保证实验原料在实验过程中的稳定均一性,本实验将生姜洗净后切片,于60 ℃烘箱中干燥24 h,取出后磨成细粉过100目筛,获得的生姜粉密封后保存待用。
1.2.2 生姜糖蛋白的提取工艺 取2 g生姜粉置于提取烧瓶中,按照已设定好的提取条件,加入磷酸钾缓冲溶液,根据所加入缓冲液的体积加入NaCl固体粉末使NaCl的浓度为0.1 mol/L,待水浴温度达到设定温度时开始浸提,同时开启冷凝装置,提取一定时间后,经布氏漏斗抽滤,获得提取液。
1.2.3 生姜糖蛋白提取的单因素实验 经单因素实验初步考察提取温度、提取时间、液固比和pH四个因素对生姜糖蛋白提取效果的影响。
1.2.3.1 提取温度对生姜糖蛋白提取效果的影响 设定生姜糖蛋白的提取温度分别为40、50、60、70、80和90 ℃,并在液固比20∶1、NaCl的浓度为0.1 mol/L条件下提取3 h,研究温度对生姜糖蛋白提取效果的影响。
1.2.3.2 提取时间对生姜糖蛋白提取效果的影响 将生姜糖蛋白的提取时间分别设定为1.5、2.0、2.5、3.0、3.5和4.0 h,并在温度为70 ℃、液固比20∶1和NaCl的浓度为0.1 mol/L条件下提取,研究提取时间对生姜糖蛋白提取效果的影响。
1.2.3.3 液固比对生姜糖蛋白提取效果的影响 将磷酸钾缓冲溶液:生姜粉的液固比分别设定为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1,并在温度为70 ℃、NaCl的浓度为0.1 mol/L条件下提取3 h,研究液固比对生姜糖蛋白提取效果的影响。
1.2.3.4 pH对生姜糖蛋白提取效果的影响 将设定磷酸钾缓冲溶液的pH分别为5.8、6.3、6.8、7.3、7.8、8.3,并在温度为70 ℃、液固比20∶1、NaCl的浓度为0.1 mol/L条件下提取3 h,研究pH对生姜糖蛋白提取效果的影响。
1.2.4 生姜糖蛋白提取回归模型的建立 经单因素实验研究发现,提取时间为3 h时,对糖蛋白提取效果影响最大,综合考虑固定提取时间为3 h,选取提取温度、液固比和pH,采用三元二次回归正交组合设计,确立生姜蛋白的二次回归模型,三元二次回归正交设计因素编码表见表1。

表1 因素水平编码表
1.2.5 测定方法 由于糖蛋白中的蛋白质与多糖通过糖肽共价键相连,不同类型的糖蛋白中蛋白质和糖的含量不同,因此糖蛋白的测定相对比较复杂,李婷婷[15]等人采用苯酚-硫酸法和考马斯亮蓝法分别测定糖蛋白提取液中的糖和蛋白质的含量,以全面反映糖蛋白的提取率。本文采用李婷婷等人建立的糖蛋白的测定方法进行生姜糖蛋白的测定,采用凝集素芯片法测定生姜糖蛋白中糖链组成。
1.2.6 生姜糖蛋白的分离纯化和红外光谱分析 将最优条件下提取出的生姜糖蛋白提取液,浓缩。浓缩液用4倍体积的无水乙醇于4 ℃冰箱进行沉淀,去除杂蛋白、杂多糖,以提高生姜糖蛋白纯度。静置过夜后于4000 r/min下离心得到沉淀物。沉淀物用适量水溶液,并于4 ℃进行透析,然后经冷冻干燥得到糖蛋白粗品。采用KBr压片法在波数为400~4000 cm-1,测定糖蛋白的红外光谱图。
1.2.7 生姜糖蛋白抗氧化活性
1.2.7.1 清除DPPH·能力 取不同浓度(0.2~1.2 mg/mL)的样品液(冷冻干燥得到的糖蛋白粗品)2 mL,依次加入2 mL、2×10-4mol/mL DPPH溶液,室温下避光反应30 min,测定波长517 nm的吸光度A,同时以无水乙醇为空白对照测定A0,以VC为阳性对照[16]。每组实验平行三次,生姜糖蛋白对DPPH·的清除率计算公式为:

1.2.7.2 还原能力测定 取不同浓度(3~8 mg/mL)的样品液(冷冻干燥得到的糖蛋白粗品)1 mL,依次加入2.5 mL磷酸盐缓冲液(0.2 mol/L,pH6.6)、2.5 mL的K3Fe(CN)6(1%,w/v)溶液,在50 ℃水浴下反应20 min,加入0.5 mL的三氯乙酸(10%,w/v)摇匀,终止反应。反应终止后,取出2.5 mL加入2.5 mL水,再加入0.5 mL的FeCl3(0.1%,w/v)溶液,反应后于700 nm测定吸光度A[17]。每组实验平行三次,本实验以VC为阳性对照。
1.2.7.3 金属离子螯合活性测定 取不同浓度(0.1~1.0 mg/mL)的样品液(冷冻干燥得到的糖蛋白粗品)2 mL与0.05 mL FeCl2(2×10-3mol/L)混合后加入0.2 mL ferrozine(5×10-3mol/L),振荡摇匀,在室温下反应10 min,在562 nm处测吸光度A,同时以水为空白对照测定A0,阳性对照为EDTA[18]。每组实验平行三次,生姜糖蛋白对Fe2+的清除率计算公式为:

1.2.8 凝集素芯片技术检测生姜糖蛋白 将生姜糖蛋白样品经过cy3荧光标记,纯化后与凝集素芯片孵育,得到糖蛋白中糖链组成[19]。
1.2.9 统计分析 采用Excel和SPSS 13.0软件对数据进行处理,实验结果以均值±标准偏差(Mean±SD)表示。采用组间t检验,p<0.05具有显著性差异。
2 结果与分析
2.1 单因素实验
2.1.1 温度对提取效果的影响 提取温度对生姜糖蛋白的蛋白质及糖得率的影响如图1所示,由图1可知,提取温度在40~70 ℃范围内随着温度升高,蛋白质和糖的得率均在逐步升高。当温度继续升高时,蛋白质因变性得率降低,糖的得率基本处于稳定水平。由此,生姜糖蛋白的提取在70 ℃的温度下进行后续的单因素实验。
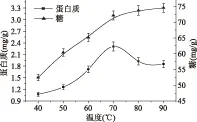
图1 温度对提取效果的影响Fig.1 Effect of temperature on the yeild of protein and saccharide
2.1.2 时间对提取效果的影响 由图2可以看出,提取时间在1.5~3 h增长过程中,蛋白质和糖的得率均在逐渐升高。当时间继续增加时,蛋白质和糖得率的增加幅度降低,并对提取3、3.5和4 h得到的生姜糖蛋白中蛋白质和糖的得率进行分析发现,蛋白质的得率于3 h达到最高,3.5 h后其得率均趋向于平稳,糖的得率于3.5 h达到最高并趋向于平稳。相比糖而言,蛋白质对提取条件显出更大的敏感性,由此应该最大可能的保证蛋白质的得率最大,同时考虑到经济因素,故确定提取时间为3 h。由此,生姜糖蛋白的提取在70 ℃,3 h条件下进行后续的单因素实验。
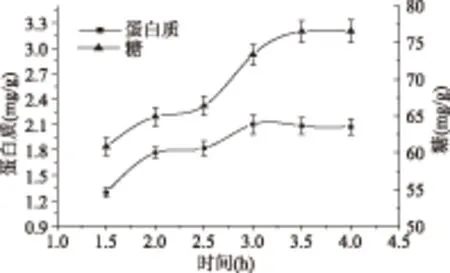
图2 时间对提取效果的影响Fig.2 Effect of time on the yeild of protein and saccharide
2.1.3 液固比对提取效果的影响 由图3可以看出液固比在10∶1~30∶1增加时,由于溶剂量不同可以形成不同的浓度梯度,浓度梯度愈大,胞内物扩散动力也愈大,浸出物相应增多使蛋白质和糖的得率均在逐步升高。当液固比继续增加时,蛋白质和糖的得率均趋于平缓,可能由于随着液固比的增加,杂质扩散增多,从资源节约和后续样品处理角度考虑,液固比不宜太大,故得出30∶1为最佳提取液固比。由此,生姜糖蛋白的提取在70 ℃,3 h和液固比为30∶1条件下进行后续的单因素实验。
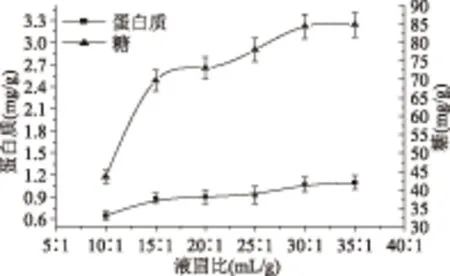
图3 液固比对提取效果的影响Fig.3 Effect of liquid-solid ratio on the yeild of protein and saccharide
2.1.4 pH对提取效果的影响 pH的变化可以使蛋白质的带电情况发生改变,直接影响到蛋白质之间,以及蛋白质与水之间的相互作用。图4表明在不同pH条件下生姜糖蛋白的提取效果,结果表明在pH6.8之后蛋白质和糖的得率开始趋于平缓,并且pH在6.8、7.3、7.8、8.3四个条件下得到的蛋白质和糖的得率在α=0.05水平上差异不显著,由此初步确定pH6.8为最佳提取参数。

图4 pH对提取效果的影响Fig.4 Effect of pH on the yeild of protein and saccharide
2.2 提取回归模型的建立
在单因素实验基础上进行了三元二次回归正交组合设计及回归系数的显著性检验、回归方程检验和失拟检验。
2.2.1 三元二次回归正交组合设计 三元二次回归正交组合设计的结果见表2。

表2 三元二次回归正交组合实验结果
2.2.2 生姜糖蛋白中蛋白质得率回归模型 根据相关系数得到回归方程:Y1=1.897+0.133X1+0.092X2+0.123X3+0.079X1X3-0.052X12-0.064X22-0.186X32
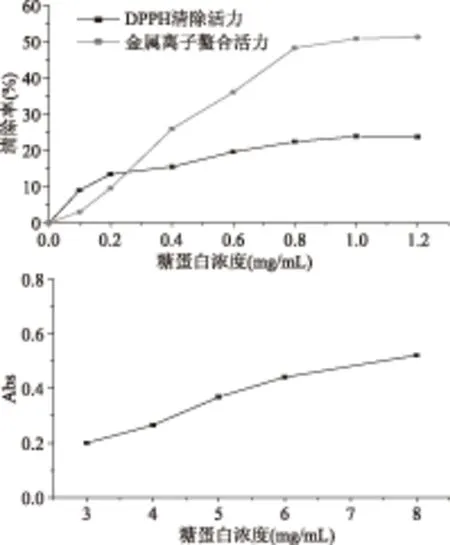
F0.01(5,11)=5.32,表明方程在0.01水平下显著,即置信度为99%。Flf=(Slf/flf)/(Se/fe)=1.876 D1=-0.104<0;D2=0.013>0;D3=-0.005<0 由于D1<0,D2>0,D3<0,可以判定方程有极大值,利用求驻点方法求得当蛋白质得率取得极值时,X1=1.82,X2=0.72,X3=0.72。通过回归系数检验、回归方程检验和失拟检验,可以认为该方程为最优回归方程。将中心化处理公式和因素编码表代入方程中,通过计算当蛋白质的得率取得最大值时对应各因素水平值分别为Z1=90、Z2=35.5,、Z3=7.5。即在提取温度为90 ℃,液固比为35.5∶1,pH为7.5条件下提取3 h,蛋白质得率的理论值为2.096 mg/g。 2.2.3 生姜糖蛋白中糖得率回归模型 根据相关系数得到回归方程:Y2=73.522+3.211X1-3.610X2+7.02X3+3.595X2X3-1.095X12-3.330X22-5.574X32 在蛋白质得率的最优条件下,即X1=1.82,X2=0.72,X3=0.72,糖得率的理论值为75.442 mg/g。 2.2.4 回归模型的验证实验 按照模型所得到的最优工艺条件进行验证实验,重复9次,得蛋白质得率为2.437 mg/g,糖得率为117.126 mg/g,可见所得的回归方程预测的蛋白得率最优值均略低于实际数值,回归方程模型可提供生姜糖蛋白提取得率的变化趋势,由此可作为生姜糖蛋白提取情况的参考。 2.3 生姜糖蛋白红外光谱分析 生姜糖蛋白的红外光谱分析见表3和图5。由生姜糖蛋白红外图谱得知:生姜糖蛋白分别在3300、3100、1650、1300 cm-1附近有吸收峰,这些区域的吸收峰都是多糖和蛋白质的特征吸收峰。 表3 生姜糖蛋白的红外光谱分析结果 其中,在3300 cm-1左右的吸收峰是O-H的伸缩振动,由于分子内羟基形成氢键而使吸收峰变宽;在3100 cm-1左右的吸收峰是糖的C-H伸缩振动引起的;在1650 cm-1附近出现的吸收峰是C=O伸缩振动和N-H变角振动引起的;在1000~1022 cm-1处出现的吸收峰表明糖蛋白分子中含吡喃环;在890 cm-1处有特征吸收峰,表明其糖链与β-糖苷链相连[21]。 图7 生姜糖蛋白的凝集素荧光强度Fig.7 Lectin fluorescence intensity of ginger glycoprotein 图5 生姜糖蛋白红外光谱扫描结果Fig.5 IR spectroscopy scanning of the ginger glycoprotein 2.4 生姜糖蛋白抗氧化活性 采用3种抗氧化活性评价方法(DPPH·自由基的清除能力、还原能力和金属离子螯合能力)考察了生姜糖蛋白的体外抗氧化活性。其具体活力见图6。由图6可知,生姜糖蛋白对DPPH·自由基的清除能力较弱,且无明显的剂量效应关系,其清除作用远远小于VC(其IC50值为5 μg/mL)。生姜糖蛋白具有螯合金属离子的能力,其IC50值为1 mg/mL,而阳性对照EDTA的IC50值为4.8 μg/mL。根据以上实验结果,表明生姜糖蛋白具有一定的抗氧化活性,进一步的纯化可以提高其抗氧化活性。另外,本文对生姜糖蛋白还原能力进行了测定,8.0 mg/mL的生姜糖蛋白其吸光度值可达到0.63,而0.08 mg/mL的VC其吸光度值便可达到0.63。 图6 生姜糖蛋白的抗氧化活性Fig.6 Antioxidant activities of ginger glycoprotein 2.5 凝集素芯片技术检测生姜糖蛋白结果 经凝集素芯片分析发现凝集素VVA、ConA、STL、LCA及LEL 有阳性结果,凝集素微阵列获得的生姜糖蛋白的凝集素荧光强度见图7,且荧光值 VVA>ConA>STL>LCA>LEL,表明生姜中的糖蛋白表面可能存在GlaNAc、mannose、GlcNAc、mannose和LacNAC这些糖链结构。 本文以生姜为原料提取糖蛋白,得到在提取温度为90 ℃,液固比为35.5∶1,pH为7.5条件下提取3 h,提取效果最好,所得的蛋白质得率为2.437 mg/g,糖得率为117.126 mg/g。经红外光谱分析可知,所提取的生姜糖蛋白为一种含有吡喃环的糖蛋白,其糖链是与β-糖苷链相连。DPPH·自由基的清除能力、还原能力和金属离子螯合能力结果表明,生姜糖蛋白具有一定的抗氧化活性,其中金属螯合能力IC50值为1 mg/mL。生姜中的糖蛋白表面可能存在GlaNAc、mannose、GlcNAc、mannose和LacNAC这些糖链结构。本文的研究对生姜和糖蛋白基础性理论研究具有指导意义。 [1]Chrubasik S,Pittler M H,Roufogalis B D. Zingiberis rhizoma:a comprehensive review on the ginger effect and efficacy profiles[J]. Phytomedicine,2005,12(9):684-701 [2]Yeh H Y,Chuang C H,Chen H C,et al. Bioactive components analysis of two various gingers(Zingiber of cinale Roscoe)and antioxidant effect of ginger extracts[J].LWT-Food Science and Technology,2014,55:329-334. [3]Rafiquzzaman SM,Kim EY,Lee JM,et al. Anti-Alzheimers and anti-inflammatory activities of a glycoprotein purified from the edible brown alga Undaria pinnatifida[J].Food Research International,2015,77:118-124. [4]吕克凡,高世勇,季宇彬. 天然糖蛋白的提取和抗肿瘤研究[J]. 哈尔滨商业大学学报:自然科学版,2013,29(1):1-3. [5]Kim E Y,Kim Y R,Nam T J,et al. Antioxidant and DNA protection activities of a glycoprotein isolated from a seaweed,Saccharina japonica[J]. International Journal of Food Science & Technology,2012,47(5):1020-1027. [6]Xia X,Li G,Zheng J,et al. Immune activity of sweet potato(IpomoeabatatasL.)glycoprotein after enzymatic and chemical modifications[J]. Food & Function,2015(6):2026-2032. [7]孙宇婧,韩涛,卞科,等.山药糖蛋白纯化条件及其理化方法鉴定[J].中国粮油学报,2011,26(3):81-85. [8]赵文竹,张瑞雪,于志鹏,等.生姜的化学成分及生物活性研究进展[J].食品工业科技,2016,37(11):383-389. [9]雷利芳,游静,曾华金,等. 微孔板结合化学发光法快速测定覆盆子中总糖蛋白的抗氧化活性[J]. 发光学报,2013,34(5):650-655. [10]王艳,胡一鸿,陈秋志,等. 玉竹糖蛋白分离纯化及其体外抗氧化能力[J]. 食品科学,2015,36(2):52-56. [11]张黎明,王艳乔,左北梅,等. 微碱法提取山药糖蛋白的工艺研究[J]. 食品科技,2012(3):206-209. [12]赵希,张黎明,王玲玲. 酶法提取山药中多种水溶性成分的工艺研究[J]. 精细化工,2009(1):28-32. [13]任涛,钟洁. 响应曲面法优化超声波辅助提取蒲公英糖蛋白工艺[J].食品工业科技,2011(7):297-301. [14]刘静波,于志鹏,赵文竹,等.蛋清肽酶解工艺及血管紧张素转化酶抑制活性研究[J].农业机械学报,2010,41(7):147-152,113. [15]李婷婷,张晖,吴彩娥,等.油茶籽糖蛋白提取工艺优化及抗氧化性[J].农业机械学报,2012,43(4):148-155. [16]Brand W W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30. [17]Xin L,Zhang M,Kai G,et al. Cellulase-assisted extraction,characterization,and bioactivity of polysaccharides from Polygonatum odoratum[J]. International Journal of Biological Macromolecules,2015,75(2):258-265. [18]Ozer M S,Sarikurkcu C,Tepe B,et al. Essential oil composition and antioxidant activities of alkanet(Alkannatinctoriasubsp. tinctoria)[J]. Medical Journal of Australia,1953,2(11):405-407. [19]简强,于汉杰,陈超,等. 凝集素芯片技术检测糖蛋白方法的建立及初步应用[J].生物化学与生物物理进展,2009,36(2):254-259. [20]任露泉. 实验优化设计与分析[M].北京:高等教育出版社,2003:440-442. [21]Huang G,Chen Y,Wang X. Extraction and deproteinization of pumpkin polysaccharide.[J]. International Journal of Food Sciences & Nutrition,2011,62(6):568-571. Study the extraction and antioxidant activity of ginger glycoprotein ZHAO Wen-zhu1,ZHANG Rui-xue1,YU Zhi-peng1,*,CHEN Yue-jiao1, ZHANG Hong-ling1,WANG Xin-ke1,LIU Jing-bo2,LI Jian-rong1,* (1.College of Food Science and Engineering,Bohai University;National & Local Joint Engineering Research Center of Storage Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China; (2.Lab of Nutrition and Functional Food,Jilin University,Changchun 130062,China) On the base of single factor experiment,the optimum extraction technology of ginger glycoprotein was performed by the quadratic regression orthogonal combination design,and the antioxidant activity of ginger glycoprotein was examined. The optimized condition of ginger glycoprotein was as follows:extraction temperature 90 ℃,liquid-solid ratio 35.5∶1 and extraction pH value 7.5. At the optimum conditions,the yield of protein reached 2.437 mg/g,and the yield of saccharide reached 117.126 mg/g. The typical characteristic absorption peaks of polysaccharide and protein were analyzed by the IR spectrum. The results of antioxidant tests and lectin microarray experiment demonstrated that the ginger glycoprotein has important physiological activities. ginger;glycoprotein;orthogonal combination design;infrared spectrum;antioxidant activity;lectin 2016-05-24 赵文竹(1986-),女,博士,讲师,研究方向:植物活性成分研究,E-mail:zhaowenzhu777@163.com。 *通讯作者:于志鹏(1984-),男,博士,讲师,研究方向:蛋白质及活性肽,E-mail:yuzhipeng20086@sina.com。 励建荣(1964-),男,博士,教授,研究方向:水产品加工,E-mail:lijr6491@163.com。 国家自然科学基金项目(31601479);渤海大学博士启动项目(0515bs020)。 TS201 B 1002-0306(2016)22-0309-06 10.13386/j.issn1002-0306.2016.22.052


3 结论

