亚麻种子中胰蛋白酶抑制剂的分离纯化及性质研究
陈颖璐,石亚伟
(山西大学生物技术研究所,教育部化学生物学与分子工程重点实验室,山西太原 030006)
亚麻种子中胰蛋白酶抑制剂的分离纯化及性质研究
陈颖璐,石亚伟*
(山西大学生物技术研究所,教育部化学生物学与分子工程重点实验室,山西太原 030006)
将亚麻种子去壳粉碎,经丙酮脱脂和Tris-HCl缓冲液提取后,Q-SepharoseTMFast flow离子交换层析一步纯化,获得电泳纯的亚麻胰蛋白酶抑制剂(LUTI),纯化倍数可达9.62,活力回收率为6.25%,比活力为55.35 U/mg,SDS-PAGE电泳显示LUTI分子量大小约为8 ku。质谱鉴定属于Potato型胰蛋白酶抑制剂,其抑制活性在pH2.0~6.0以及70 ℃以下有较好的稳定性,最适pH为6.0,最适温度为40 ℃,属于一种非竞争性抑制剂,Ki值为9.18×10-4mol/L。DTNB法检测LUTI含有一对二硫键,二硫键存在有助于提高LUTI的稳定性和活性。
亚麻种子,胰蛋白酶抑制剂,分离纯化,酶活测定
亚麻(LinumusitatissimumL.)是一种亚麻科亚麻属的一年生草本植物[1],在我国西北,华北地区种植广泛。亚麻籽中含有多种生物活性物质:亚麻蛋白、亚麻酸、木酚素以及亚麻胶等[2]。亚麻籽中粗蛋白含量可达到23%~33%,主要为球蛋白和白蛋白,是植物中优质蛋白,具有很高的食用和医药价值[3]。
胰蛋白酶抑制剂(Trypsin inhibitor,TI)是一类可以抑制胰蛋白酶水解活性的小分子多肽,属于丝氨酸蛋白酶抑制剂家族,广泛存在于植物、动物和微生物中[4]。胰蛋白酶抑制剂的传统来源为豆科植物和动物肝脏[5],在植物贮藏器官中,其含量通常高达总蛋白的10%左右[6]。Bowman-Birk于1944年首次从大豆中提取出大豆胰蛋白酶抑制剂(BBI)[7],近年来也陆续从其他豆类作物如豇豆、菜豆以及黑豆种子[8-10]和谷类作物荞麦、莜麦[11-12]种子中分离出不同类型的胰蛋白酶抑制剂。它们的生理功能和临床应用受到研究者的广泛关注,在临床上用来治疗急性胰腺炎、防治脑水肿、脑缺血、脑血管痉挛等[13],目前还发现具有抗病毒、抗肿瘤、抗真菌和抗虫等重要作用[14-17]。
天然提取的胰蛋白酶抑制剂环境兼容性好、安全、开发成本低,具有比较好的开发和应用前景[18]。植物中的胰蛋白酶抑制剂,大多通过离心、盐析后再利用纯化效率比较高的层析法进行纯化,多为两种以上的层析方法[6]。Lingaraju等[19]通过硫酸铵分级沉淀、胰蛋白酶-琼脂糖凝胶亲和层析、DEAE-纤维素离子交换层析从刀豆中分离出一种分子量为19.7 ku的Kunitz型胰蛋白酶抑制剂(ESTI),纯化倍数为2.3。王竞等[20]采用热沉淀、硫酸铵分步盐析法制备了油菜种子胰蛋白酶抑制剂粗提物,进一步使用DEAE阴离子交换层析,Sephadex G50分子筛凝胶过滤,纯化得到电泳纯度的抑制剂,制备得率为2.3%。Kowalska等[21]以紫茉莉花种子和菠菜种子为原料,采用固定化胰凝乳蛋白酶亲和层析,离子交换层析或制备电泳,反相HPLC,分离、纯化得到4种胰蛋白酶抑制剂。刘同祥等[22]研究了绿豆胰蛋白酶抑制剂的分离纯化,采用酸抽提、加热变性、硫酸铵分步沉淀法,制备了抑制剂的粗提物,然后通过Pellicon 5000超滤膜超滤,Sephorase 4B.胰蛋白酶亲和纯化得到纯品。亚麻种子亚麻籽中也含有丰富的胰蛋白酶抑制剂,本实验以去壳亚麻种子为材料,从中分离得到一种天然的胰蛋白酶抑制剂(LUTI),并首次研究了其酶学性质,如最适温度、最适pH及抑制剂类型等,丰富了胰蛋白酶抑制剂的种类,拓宽了亚麻籽的开发领域。
1 材料与方法
1.1 材料与仪器
去壳亚麻种子 市售;N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)、对硝基苯胺(PNA) Sigma公司;牛胰蛋白酶(Trpysin) 250 U/mg,索莱宝公司;Q-SepharoseTMFast flow阴离子柱 GE公司;二硫苏糖醇(DTT) 上海励瑞生物科技有限公司;其他试剂 均为国产分析纯。
U-2010紫外分光光度计 日本日立公司;HS-800D恒温水浴锅 太仓市科教器材厂;精密数显酸度计 上海天达仪器厂;LTQ VELO飞行时间质谱仪、高速冷冻离心机、蛋白垂直电泳槽、电泳仪 Thermo公司;-80 ℃冰箱 Eppendorf中国有限公司;冷冻干燥仪 GOLD-SIM公司;3 ku离心式浓缩管 Millipore公司;凝胶成像系统 上海复日科技有限公司;Bio-Kine圆二色谱仪 Bio Logic;AKTA Prime蛋白纯化系统 GE公司。
1.2 实验方法
1.2.1 亚麻种子中胰蛋白酶抑制剂的分离纯化 去壳亚麻种子粉碎后,加入6倍体积量的丙酮,于4 ℃浸泡脱脂8 h,用短颈漏斗过滤后,滤渣在通风橱中自然干燥,待丙酮自然挥发后得到亚麻粉末。将脱脂亚麻粉末溶于6倍体积量的0.05 mol/L Tris-HCl(pH8.0)缓冲液中,4 ℃搅拌过夜,12000 r/min离心30 min,收集上清,上清4 ℃自然静置过夜,待不溶物自然沉淀,12000 r/min离心30 min,收集上清,得到澄清的亚麻蛋白粗提液[11],在AKTA Prime蛋白纯化系统上,取5 mL粗提液样品上样至用相同缓冲液平衡好的Q-SepharoseTMFast flow阴离子柱,流速为2 mL/min,在收集盘上收集穿透样品,用3 ku离心式浓缩管在高速冷冻离心机上,3000 r/min进行离心浓缩,浓缩后样品经透析除盐,再经冷冻干燥仪抽真空冷冻干燥成蛋白粉,蛋白样品保存于-80 ℃冰箱中。将纯化过程中每个样品进行活性测定及SDS-PAGE电泳分析。
1.2.2 亚麻胰蛋白酶抑制剂的质谱分析 考马斯亮蓝染后的LUTI样品经DTT还原,烷基化处理,乙腈脱色后,37 ℃下胰酶过夜胶内酶解[23],转移酶解原液至新的1.5 mL离心管中,加入100 μL 抽提液(60%乙腈/0.1%三氯乙酸),超声15 min,功率80 W,超声10 s,间歇15 s,工作次数10次,超声后将提取液与酶解原液合并,冻干后取出。加入0.1%乙酸溶液60 μL复溶进行LC-ESI-MS分析,分析条件:349 nm氮分子激光,反射模式;加速电压:15 kV,grid1电压7.264 kV;激光强度:3200;扫描范围:800~4000,扫描累加次数1000,延迟时间600 ns;质谱图肽段质量范围选择在10~180 ku[24]。质谱分析结果用BioworksBrowser 3.3软件检索UniProt数据库,鉴定蛋白质。
1.2.3 亚麻胰蛋白酶抑制剂的酶学分析
1.2.3.1 牛胰蛋白酶产物(PNA)的标准曲线测定 精确称取一定量的PNA,将其溶于0.05 mol/L Tris-HCl(pH8.0)的缓冲液中,配制浓度为5×10-6、1×10-5、1.5×10-5、2×10-5、2.5×10-5mol/L的PNA溶液,测量410 nm处吸光值。以PNA浓度为横坐标,OD410吸光值为纵坐标绘制标准曲线。
1.2.3.2 胰蛋白酶抑制剂的活性测定 测定方法参照Erlanger[25]的方法,以BAPNA为底物,LUTI 0.4 mL(50 μg/mL)与0.4 mL牛胰蛋白酶(0.2 mg/mL,用0.001 mol/L HCl溶液配制)于37 ℃恒温水浴保温10 min后,再加入2 mL BAPNA溶液(0.5 mg/mL,用少量DMSO溶液溶解后,加入0.05 mol/L Tris-HCl,0.02 mol/L CaCl2·2H2O,pH8.0的缓冲液补足2 mL),在37 ℃反应10 min后,加入0.5 mL 33%醋酸溶液终止反应,在410 nm处测其吸光值,以不加LUTI试样为空白对照。胰蛋白酶活力单位定义为:37 ℃下,pH为8.0的缓冲体系中,每分钟水解BAPNA生成1 μmol/L PNA所需要的酶量为一个活力单位。胰蛋白酶抑制剂活力单位定义为:在相同条件下,降低一个酶活性单位所需的抑制剂量。
本文中蛋白测定均采用UV紫外吸收法[26]在280 nm下进行测定,计算公式如下:
蛋白浓度(μmol/L)=A280/ε×D×106
其中:A280为280 nm处的吸光度值,ε为LUTI的消光系数,D为稀释倍数,106为mol与μmol之间的转化关系。
1.2.3.3 pH对抑制活性的影响 称取2 mg LUTI加入以下体系:pH2.0~5.0,0.05 mol/L的HAc-NaAc缓冲溶液;pH6.0~8.0,0.05 mol/L的NaH2PO4-Na2HPO4缓冲溶液;pH9.0~10.0,0.05 mol/L的H3BO3-Na2B4O7缓冲溶液,测定不同pH条件下抑制胰蛋白酶的活性,最终确定其最适pH。pH稳定性的测定,则采取将样品在上述缓冲液中室温放置30 min,取相同量的LUTI按1.2.3.2方法测定其抑制胰蛋白酶的活性。
1.2.3.4 温度对抑制活性的影响 称取2 mg LUTI纯品溶于0.05 mol/L Tris-HCl(pH8.0)缓冲液中,按照前述方法分别在30、40、50、60、70、80、90、100 ℃体系中测定不同温度条件下抑制胰蛋白的活性,最终确定其最适温度。温度稳定性的测定,则采取上述不同温度处理30 min,然后快速冰浴冷却,取相同量的LUTI按1.2.3.2方法测定其抑制胰蛋白酶的活性。
1.2.3.5 抑制剂动力学参数的测定 以BAPNA为底物,反应终浓度分别为0.25、0.5、1、2、2.5 mmol/L;胰蛋白酶量为120 μg(酶活力为1.91 U);LUTI终浓度分别为0.612、1.424 mg/mL,反应时间为5 min,测定反应速度。采用双倒数(Lineweaver-Burk)作图法,确定LUTI抑制类型和抑制常数。
1.2.4 胰蛋白酶抑制剂中半胱氨酸残基及二硫键数目的测定
1.2.4.1 游离巯基含量的测定 根据Ellman[27]的方法,准确量取1.0 mL LUTI蛋白样品,向其中加入2 mL Tris-Gly(0.086 mol/L Tris,0.09 mol/L Gly,pH8.0)溶液和50 μL DTNB(0.01 mol/L DTNB,0.2 mol/L Tris-HCl,pH8.0)溶液,迅速混匀后于37 ℃保温5 min后在412 nm处测其吸光值,并以0.5 mol/L Tris-HCl溶液代替样品作空白对照。LUTI样品作3次平行实验,最终结果取其平均值,利用如下公式进行计算[28]:
游离巯基含量(μmol/g)=73.53×A412×D/C,其中A412是412 nm处的吸光值,D为稀释因子,C为蛋白浓度(mg/mL)。
1.2.4.2 总的巯基数的测定 向经8 mol/L尿素37 ℃处理4 h的0.5 mL LUTI蛋白样品中加入2 mL Tris-Gly(0.086 mol/L Tris,0.09 mol/L Gly,pH8.0)溶液和50 μLβ-巯基乙醇溶液,37 ℃温浴1 h后加入10 mL 12%三氯乙酸溶液,继续在37 ℃温浴1 h,11000 r/min离心30 min,用5 mL 12%三氯乙酸溶液重悬沉淀两次,最后用2 mL Tris-Gly(0.086 mol/L Tris,0.09 mol/L Gly,pH8.0)重新溶解沉淀,加入50 μL DTNB溶液,迅速混匀后于37 ℃保温5 min后在412 nm处测其吸光值,并以0.5 mol/L Tris-HCl溶液代替样品作空白对照。LUTI样品作3次平行实验,最终结果取其平均值,利用如下公式进行计算[28]:
总巯基含量(μmol/g)=游离巯基含量+还原二硫键后的巯基含量=73.53×A412×D/C,其中A412是412 nm处的吸光值,D为稀释因子,C为蛋白浓度(mg/mL)。
1.2.4.3 二硫键含量测定 二硫键含量按以下公式计算[28]:
二巯键含量(μmol/g)=(总巯基含量-游离巯基含量)/2
1.2.5 胰蛋白酶抑制剂二级结构测定 LUTI的圆二色谱分析在Bio-Kine仪上进行,反应测定温度为室温,具体设置参数如下:光谱扫射范围为190~300 nm,谱带宽带为1.0 nm,扫描速度为100 nm/min,扫描模式为Average(扫描次数三次,累加求平均值),记录CD光谱。
1.2.6 二硫苏糖醇对亚麻胰蛋白酶抑制剂活性及结构稳定的影响 称取2 mg LUTI纯品溶于0.05 mol/L Tris-HCl(pH8.0)缓冲液中,加入终浓度为5×10-3mol/L的二硫苏糖醇(DTT),室温下保温60 min后,在20、40、60、80、100 ℃恒温水浴保温30 min,以在相同温度下未加入DTT的LUTI样品作为对照,比较DTT对LUTI活性和结构稳定的影响。
1.3 数据处理
本实验数据处理均采用Origin 9.0、Photoshop cs4软件进行处理和作图。质谱分析结果采用BioworksBrowser 3.3进行分析。
2 结果与分析
2.1 亚麻胰蛋白酶抑制剂的分离与鉴定
脱脂后的亚麻蛋白粗提液,上样于用0.05 mol/L Tris-HCl(pH8.0)的缓冲液平衡好的Q-SepharoseTMFast flow柱,使粗提液中杂蛋白结合在Q-SepharoseTMFast flow柱上,目标蛋白不结合,以穿透液形式从柱上流出,一步得到了LUTI纯品,纯化倍数达到9.62,与其他多步提取胰蛋白酶抑制剂的方法[19-21]相比,简单快捷,可操作性强,大大降低纯化过程的繁琐。经SDS-PAGE确定LUTI的分子量大小约为8 ku,如图1所示。

图1 经纯化的LUTI的SDS-PAGE电泳图Fig.1 The electrophoretogram of LUTI by SDS-PAGE注:Mr:标准分子量蛋白质;1:亚麻胰蛋白酶抑制剂粗提液;2:Q-Sepharose穿透样品。
将纯化得到的LUTI进行LC-ESI-MS分析。所得到三个肽片段NAWPELVGK(m/z=1973.264),SGNMAAATVER(m/z=1107.224)和VWVIVNDH GVVTSVPHIT(m/z=1014.16),经BioworksBrowser 3.3软件检索UniProt数据库,表明该蛋白肽段与亚麻科植物亚麻中胰蛋白酶抑制剂相似度为100%。证明从亚麻种子中分离得到的大小为8 ku的蛋白为亚麻胰蛋白酶抑制剂(LUTI),根据氨基酸序列同源性分析LUTI属于PotatoⅠ型胰蛋白酶抑制剂家族(图2、表1)。Potato型抑制剂,是一类诱导型抑制剂,主要分为PotatoⅠ型和PotatoⅡ型,前者主要抑制胰蛋白酶,后者对胰蛋白酶和糜蛋白酶均有一定程度的抑制作用[29]。

表1 LUTI肽片段氨基酸序列比对

图2 LUTI的质谱分析结果Fig.2 LC-ESI mass spectrum analyse LUTI from naked flax seeds注:A:NAWPELVGK肽段的指纹图谱;B:SGNMAAATVER肽段的指纹图谱;C:VWVIVNDHGVVTSVPHIT肽段的指纹图谱。
2.2 亚麻胰蛋白酶抑制剂的酶学分析
2.2.1 牛胰蛋白酶底物(PNA)标准曲线 见图3。
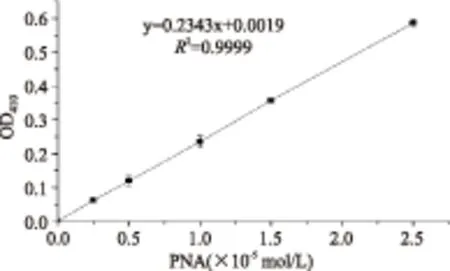
图3 PNA的标准曲线Fig.3 The standard curve of PNA
2.2.2 胰蛋白酶抑制剂的活性测定 对亚麻蛋白粗提液和Q-SepharoseTMFast flow柱穿透样品分别进行胰蛋白酶抑制剂的活性检测,穿透样品中得到的LUTI纯品,比活力为55.35 U/mg,与粗提液相比提升了9.62倍,同时活性回收率为6.25%,结果如表2所示。

表2 LUTI的纯化过程
2.2.3 pH对胰蛋白酶抑制剂活力的影响 按1.2.3.2方法测定不同pH下LUTI对胰蛋白酶的抑制作用。图4结果表明,LUTI的最适pH为6.0。在pH2.0~6.0的缓冲液中放置30 min后,LUTI的抑制活性逐渐上升,当pH大于6.0时,抑制活性有了明显下降,在pH为10.0时,抑制活性下降了40%,但仍保留60%的抑制活性。表明LUTI是一种对酸性条件比碱性条件相对稳定的胰蛋白酶抑制剂。

图4 LUTI的最适pH及pH稳定性Fig.4 The optimum pH and pH stability of LUTI from flax
2.2.4 反应温度对酶活力的影响 按1.2.3.2方法测定不同温度下LUTI对胰蛋白酶的抑制作用。图5结果表明,LUTI的最适温度为40 ℃。在20~70 ℃加热30 min,LUTI抑制活性受温度影响的变化幅度较小,仍保留80%以上。当温度大于70 ℃时,抑制活性显著下降,当温度达到100 ℃时,抑制活性仅剩余20%左右。表明LUTI是一种活性在20~70 ℃相对稳定的耐热型胰蛋白酶抑制剂。

图5 LUTI的最适温度及稳定稳定性Fig.5 The optimum temperature and temperature stability of LUTI from flax
2.2.5 抑制剂动力学参数的测定 按Lineweaver Burk作图法,以BAPNA为底物,由图6可知,与未加抑制剂组相比较,随着加入LUTI浓度的增加,1/v逐渐增加,而-1/Km并未改变,证明亚麻中的LUTI为非竞争性抑制剂,经计算LUTI的Km值为1.56×10-3mol/L,根据公式1/v′=1/vmax(1+[I]/Ki)计算得到,Ki值为9.18×10-4mol/L。从植物种子如大豆、黑豆、鹰嘴豆等种子[7,13,18]中所分离出的胰蛋白酶抑制剂多为竞争型抑制剂,LUTI作为一种非竞争型抑制剂,与Ki值为8.8×10-3mol/L的黑豆胰蛋白酶抑制剂[30]和Ki值为2.1×10-3mol/L的葵花籽中的胰蛋白酶抑制剂[31]相比较,LUTI对胰蛋白酶具有更强的抑制作用。而LUTI的这种非竞争型抑制模式,可能避免竞争型抑制剂造成的植物体内其它同样以丝氨酸为活性中心的正常蛋白酶失活而引起的不良反应[31],但是LUTI与胰蛋白酶的具体作用位点还需进一步研究。

图6 LUTI抑制动力学Fig.6 Lineweaver-Burk plots of trypsin activity
2.3 胰蛋白酶抑制剂中半胱氨酸残基及二硫键数目的测定
利用DTNB法检测LUTI中的游离巯基数,测得A412为0.01,根据公式计算可知:LUTI中基本没有游离巯基;测总巯基数时,测得A412为0.24,根据公式计算可知:经尿素处理的LUTI中游离巯基数为25.05 μmol/g,即一分子蛋白中有1.97个-SH,约为2个,与一级结构序列相符合。LUTI中2个半胱氨酸残基参与1对二硫键形成。
2.4 胰蛋白酶抑制剂二级结构测定
LUTI样品溶液在Bio-Kine仪上进行分析,图7结果显示在216 nm处出现轻微的负峰谱带,195~198 nm处有一个正峰谱带;在208 nm和222 nm处出现特征的双负峰谱带,192 nm处有一个正峰谱带[32],说明LUTI的二级结构以α螺旋和β折叠为主。经Pole Bioinformatique Lyonnais网站进行二级结构预测,结果显示LUTI中α螺旋为20.29%,β折叠为25.43%。

图7 圆二色谱对LUTI二级结构的分析Fig.7 Analysis the secondary structure of LUTI from flax by circular dichroism
2.5 二硫苏糖醇对亚麻胰蛋白酶抑制剂活性和稳定性影响
在相同温度下,加入DTT组与未加DTT组相比较,抑制活性显著下降,在60 ℃时,两者差别最明显,加DTT组抑制活性下降了40%,未加DTT组仅仅下降了8%左右。随着温度升高,与不加DTT组相比较,其抑制活性显著下降(图8)。LUTI与苦荞中胰蛋白酶抑制剂(rBTI)和苦瓜中胰蛋白酶抑制剂(BGIT)空间结构相似[14,33],DTNB法表明LUTI中有一对二硫键,DTT打开二硫键的LUTI抑制活性会降低。LUTI中的这对二硫键使得该蛋白首尾相连成环状紧密结构,这样的结构可以增强LUTI的稳定性,使得其对高温和酸性环境具有比较强的耐受性。

图8 DTT对LUTI活性的影响Fig.8 Effect of DTT on trypsin inhibitory activity and stability of LUTI
3 结论
本文将亚麻蛋白粗提液经Q-SepharoseTMFast flow柱处理,使杂蛋白全部结合在柱上,目标蛋白不结合,以穿透液形式从柱上流出,一步得到了电泳纯的LUTI纯品,纯化倍数达到9.62。LUTI属于PotatoⅠ型胰蛋白酶抑制剂,是一种耐酸、耐热的小分子量蛋白质,其最适pH为6.0,最适温度为40 ℃。Lineweaver Burk作图法显示LUTI属于一种非竞争型抑制剂,其Ki为9.18×10-4mol/L。LUTI的二级结构包含20.29%的α螺旋,25.43%的β折叠。LUTI含有一对二硫键,其对维持LUTI的稳定性具有重要作用。鉴于大多胰蛋白酶抑制剂具有抗病毒、抗肿瘤、抗真菌和抗虫等生物活性,后续的实验将对LUTI其它生物活性做进一步的研究。
[1]王克臣,冷超,李明. 亚麻形态发生的生理生化特性[J]. 中国农学通报,2010,26(12):30-34.
[2]魏长庆,刘文玉,许程剑. 胡麻籽活性成分研究应用进展[J]. 粮食与油脂,2012(4):6-8.
[3]孙中义. 亚麻籽饲用研究进展[J]. 中国麻业科学,2010(1):37-41.
[4]王荣春,孙建华,何述栋,等. 胰蛋白酶抑制剂的结构与功能研究进展[J]. 食品科学,2013,34(9):364-368.
[5]张宁,王凤山. 胰蛋白酶抑制剂研究概况[J]. 中国生化药物杂志,2004,25(2):115-117.
[6]Hibbettts K,Hines B,Williams D. An overview of proteinase inhibitors[J]. Journal of Veterinary Internal Medicine,1999,13(4):302-308.
[7]Kunitz M. Crystalline soybean trypsin inhibitor[J]. The Journal of General Physiology,1946,29(3):149-154.
[8]Jones G,Moore S,Stein W H. Properties of chromatographically purified trypsin inhibitors from lima beans[J]. Biochemistry,1963,2(1):66-71.
[9]Xu D,Xue Q,McElroy D,et al. Constitutive expression of a cowpea trypsin inhibitor gene,CpTi,in transgenic rice plants confers resistance to two major rice insect pests[J]. Molecular Breeding,1996,2(2):167-173.
[10]邵彪,汪少芸,饶平凡. 黑豆种子中一种耐热型胰蛋白酶抑制剂的分离及性质表征[J]. 中国生物化学与分子生物学报,2011,27(1):90-95.
[11]Wang L,Zhao F,Li M,et al. Conformational Changes of rBTI from Buckwheat upon Binding to Trypsin:Implications for the Role of the P 8′ Residue in the Potato Inhibitor I Family[J]. PloS one,2011,6(6):e20950.
[12]闫永飞. 莜麦中α-淀粉酶抑制剂的分离纯化与性质研究[D]. 太原:山西大学,2011:29-31.
[13]蔡祖花,王凤山. 胰蛋白酶抑制剂的临床研究概况[J]. 中国生化药物杂志,2000,21(3):157-159.
[14]han Y S,Zhang Y,Sze S C W,et al. A thermostable trypsin inhibitor with antiproliferative activity from small pinto beans[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2014,29(4):485-490.
[15]Zhu M J,Zhang G Q,Wang H X,et al. Isolation and characterization of a Kunitz-type trypsin inhibitor with antiproliferative activity from Gymnocladus chinensis(Yunnan bean)seeds[J]. The Protein Journal,2011,30(4):240-246.
[16]Bleackley M R,Hayes B M,Parisi K,et al. Bovine pancreatic trypsin inhibitor is a new antifungal peptide that inhibits cellular magnesium uptake[J]. Molecular Microbiology,2014,92(6):1188-1197.
[17]Nath A K,Kumari R,Sharma S,et al. Biological activity ofDolichosbiflorusL. trypsin inhibitor against lepidopteran insect pests[J]. Indian Journal of Experimental Biology,2015,53:594-599.
[18]赵欣,付煊赫,张宗申,等. 鹰嘴豆种子胰蛋白酶抑制剂的分离纯化与鉴定[J]. 中国生物化学与分子生物学报,2011,27(3):287-292.
[19]Lingaraju M H,Gowda L R. A Kunitz trypsin inhibitor of Entada scandens seeds:another member with single disulfide bridge[J]. Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2008,1784(5):850-855.
[20]王竞,康庄,廖海,等.白菜型油菜种子胰蛋白酶抑制剂纯化及部分性质研究[J].天然产物研究与开发,2005,17(3):275-279.
[21]Kowalska J,Pszczota K,Wilimowska-Pelc A,et al.Trypsin inhibitors from the garden four o’clock(Mirabilisjalapa)and spinach(Spinaciaoleracea)seeds:Isolation,characterization and chemical synthesis[J].Phytochemistry,2007,68:1487-1496.
[22]刘同祥,牛建昭,许惠玉,等.绿豆胰蛋白酶抑制剂的分离和纯化[J].中国生化药物杂志,2007,28(3):145-148.
[23]Mao Y,Kunapuli S P. Trypsin causes platelet activation independently of known protease-activated receptors[J]. Thrombosis and Haemostasis,2013,110(6):1241.
[24]Wisniewski J R,Zougman A,Nagaraj N,et al. Universal sample preparation method for proteome analysis[J]. Nature Methods,2009,6(5):359.
[25]Erlanger B F,Kokowsky N,Cohen W. The preparation and properties of two new chromogenic substrates of trypsin[J]. Archives of Biochemistry and Biophysics,1961,95(2):271-278.
[26]曹红翠. 紫外分光光度法测定蛋白质的含量[J]. 广东化工,2007,34(8):93-94.
[27]Ellman G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics,1959,82(1):70-77.
[28]Riener C K,Kada G,Gruber H J. Quick measurement of protein sulfhydryls with Ellman’s reagent and with 4,4′-dithiodipyridine[J]. Analytical and Bioanalytical Chemistry,2002,373(4-5):266-276.
[29]王长良. Bowman-Birk型大豆胰蛋白酶抑制剂的分离纯化及性质研究[D]. 哈尔滨:东北农业大学,2008:2-3.
[30]赵伟伟. 黑豆胰蛋白酶抑制剂的分离纯化及活性鉴定[D].太原:山西大学,2016:18-19.
[31]张俏. 葵花籽中非竞争型胰蛋白酶抑制剂的发现和纯化[D]. 长春:吉林大学,2008:33.
[32]王静云,刘丹,唐乾,等. 圆二色谱研究Asp44在稳定肌红蛋白结构中的作用[J]. 光谱学与光谱分析,2008,28(2):426-429.
[33]Miura S,Funatsu G. Isolation and amino acid sequences of two trypsin inhibitors from the seeds of bitter gourd(Momordicacharantia)[J]. Bioscience,Biotechnology,and Biochemistry,1995,59(3):469-473.
Purfication and properies of the trypsin inhibitor from flax seeds
CHEN Ying-lu,SHI Ya-wei*
(Institute of Biotechnology,Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education,Shanxi University,Taiyuan 030006,China)
TheLinumusitatissimumtrypsin inhibitor(LUTI)had been isolated from naked flax seeds by acetone fractionation,Tris-HCl buffer extraction and Q-SepharoseTMFast flow. With the purification steps mentioned above,the overall recovery of enzymatic activity of 6.25%,the specific activity of 55.35 U/mg and the purification fold of 9.62 for LUTI from crude extraction was achieved.The LC-ESI-MS showed LUTI belonged to Potato trypsin inhibitor family and the relative molecular weight was 8 ku by SDS-PAGE. The trypsin inhibitory activity of LUTI was stable below 70 ℃,as well as pH2.0~6.0. The optimum temperature of LUTI was 40 ℃ and the optimum pH was 6.0. LUTI was a non-competitive inhibitor by kinetic assay with an inhibition constant Kiof 9.18×10-4mol/L and contained a pair of disulfide bond by DTNB assay,which was related with the stability and activity of LUTI.
Linumusitatissimumseeds;trypsin inhibitor;purification;enzyme activity assay
2016-06-17
陈颖璐(1991-),女,硕士研究生,研究方向:亚麻功能蛋白,E-mail:513916778@qq.com。
*通讯作者:石亚伟(1971-),男,博士,教授,研究方向:蛋白质工程,E-mail:yaweishi@sxu.edu.cn。
2016年山西农业特色资源创新专项支持。
TS210.1
A
1002-0306(2016)22-0234-06
10.13386/j.issn1002-0306.2016.22.037

