9种蔬菜发酵体系真核微生物群落结构的分析
燕平梅,荆雪娇,李艳琴,*,柴 政,乔宏萍,赵文婧,王 琪
(1.太原师范学院生物系,山西太原 030012;2.山西大学生物技术研究所,山西太原 030031)
9种蔬菜发酵体系真核微生物群落结构的分析
燕平梅1,荆雪娇2,李艳琴2,*,柴 政1,乔宏萍1,赵文婧1,王 琪2
(1.太原师范学院生物系,山西太原 030012;2.山西大学生物技术研究所,山西太原 030031)
目的:为了探究发酵蔬菜体系中真菌微生物的群落结构。方法:以市售9种发酵蔬菜为对象,提取其中所有微生物宏基因DNA,通过聚合酶链式反应结合变性梯度凝胶电泳(PCR-DGGE)技术,分离9种发酵蔬菜体系微生物混合真菌18S rDNA V(1-2)区基因片段,采用Quantity One软件分析真核微生物Shannon-Wiener多样性指数和9种发酵蔬菜真菌群落结构相似性聚类分析。通过回收DGGE电泳中荧光强度强、不同时间差异的电泳带,经克隆后测定碱基序列、与GenBank 库序列对比鉴定。结果:泡菜、榨菜、酱菜和酸菜真核Shannon-Wiener指数差异显著,其中,泡菜真菌的多样性指数差异相对最小。四种工艺发酵蔬菜真核微生物相似性为20%,而酱菜与泡菜的相似性较与榨菜的高。同一工艺不同原料发酵蔬菜真核微生物相似性38%。同一工艺袋装与散装泡菜真核微生物相似性为51%。碱基序列鉴定结果:所有的测序条带均为酵母菌,Trichosporonmucoidessp.、Zyqosaccharomycessp.存在于市售9种发酵蔬菜样品中,且为优势菌;Candidapalmioleophila存在于泡菜、榨菜、酱菜工艺发酵蔬菜中;Dabaryomycessp.为散装榨菜中所特有的真菌菌群。结论:实验结果表明泡菜工艺下制得的发酵蔬菜制品真菌区系相对于榨菜、酱菜和酸菜稳定;加工工艺对发酵蔬菜真核微生物群落的影响较原料、包装条件的影响显著;同一工艺条件下原料较包装的影响显著。
PCR-DGGE,发酵蔬菜,微生物群落结构,宏基因组学
发酵蔬菜是利用乳酸发酵的一种“冷加工”方法,没有经过高温加工,保持了蔬菜的营养、色香味,比烘干、冷冻的菜具有更多优点,成为蔬菜加工保藏的主流产业。蔬菜发酵采用不同工艺可得到泡菜、酸菜、腌制和酱制等多种形式的发酵蔬菜产品。蔬菜的自然发酵是借助于天然附着在蔬菜表面上微生物的作用进行。据施安辉研究报道[1],蔬菜收获后表面所含的微生物数量大,种类多,其中有细菌、酵母和霉菌等。蔬菜发酵过程微生物群落的种类和数量不断演替,最终使发酵蔬菜形成特有的风味。其中对风味和品质起主要作用的有乳酸菌、

表1 发酵蔬菜样品信息表
酵母菌等的微生物[2-10]。前人研究蔬菜发酵体系酵母菌的种类和其随发酵时间的变化规律是基于传统微生物学方法[11-16]。但是,现在已培养的微生物可能不到自然界微生物总量的1%[14],大量未培养的微生物在相应生境中存在种类到底有多少,如何发挥功能,传统微生物学方法已经不能全面解答[15]。宏基因组学的出现和兴起扩展了人们对微生物群落的认识。基于宏基因组的微生物多样性检测技术如DGGE/TGGE技术[17]、克隆文库分析法[18-19]和高通量测序技术[20]等被广泛应用于发酵蔬菜微生物检测中。其中DGGE/TGGE技术具有一些不可替代的优点能够更加直观比较和分析微生物群落结构的变化规律[21]。本研究以基于宏基因组DGGE技术探究蔬菜发酵体系真核微生物群落结构,为阐明蔬菜发酵的机理提供参考数据和方法,同时,为改进蔬菜发酵的工艺提供技术支持。
1 材料与方法
1.1 材料与仪器
9种市售发酵蔬菜 购置于山西省太原市美特好超市,于-4 ℃冰箱保存,详细信息见表1;凝胶回收试剂盒 购自天根生化科技(北京)有限公司;X-gal、氨苄(Amp) 购自北京全式金生物技术有限公司;PCR引物 由上海生工生物工程公司合成。
DcodeTM凝胶成像系统、TC-96(G)H(b)B PCR仪、Hercules,Calif变性梯度凝胶电泳仪、NanoDrop 2000DNA浓度仪 Bio-Rad公司。
1.2 实验方法
1.2.1 样品中菌体的收集 供试样品为9份市售发酵蔬菜的发酵液。取25 mL发酵液于50 mL的离心管中,2000×g离心10 min;取上清液,10000×g 离心10 min,弃上清,沉淀即为所要收集的菌体。在沉淀中加入1 mL STE 缓冲液(0.1 mol/L NaCl,10 mmol/L Tris-Cl pH8.0,1 mmol/L EDTA pH=8.0),漩涡振荡混匀,移至1.5 mL 无菌EP管中,10000×g离心3 min,重复洗涤3次。将菌体悬浮于500 μL ddH2O中,用于总DNA的提取。
1.2.2 样品中微生物总DNA的提取 按照天根生物技术有限公司的DNA提取试剂盒操作步骤提取DNA。
1.2.3 PCR扩增 引物序列NS1:GTAGTCCTA TGCT,Fung-GC:CGCCCGCCGCGCCCCGCGCCC-GG
CCCGCCGCCCCCGCCCCATTCCCCGTTACCCGTTG[22],NS1/Fung-GC扩增片段理论值分为350 bp。反应程序:94 ℃ 5 min,94 ℃ 30 s,42 ℃ 30 s,72 ℃ 45 s,72 ℃ 8 min,35循环。PCR产物用1.2%的琼脂糖凝胶电泳检测,上样量3 μL,电泳后4S RedPlus染色,并用凝胶成像系统拍照。
1.2.4 变性梯度凝胶电泳(DGGE) 真菌变性剂梯度为5%~45%。先将缓冲液预热至60 ℃,上样3200 ng,200 V恒压、60 ℃恒温、1×TAE缓冲液,电泳240 min。染色后的胶置于灯箱上,用灭菌的洁净刀片割下目的条带,放入1.5 mL EP管中,用移液枪吸取ddH2O 50 μL,快速冲洗两次,后用枪头碾碎,再加入ddH2O 40 μL,-4 ℃过夜。以回收的DNA为模板进行PCR,将所得PCR产物与PMD18-T克隆载体连接、转化,筛选阳性菌落送去华大基因测序公司测序,且将测序结果经Blast系统比对。
1.2.5 DGGE图谱分析 DGGE图谱采用Quantity One软件对每个发酵蔬菜样品的电泳条带的多少、条带密度进行数字化。进行聚类分析和相似性分析;多样性指数的计算公式如下[23]:
式中:H为Shannon-Wiener多样性指数;S为丰度;Ni为样品DGGE图谱中第i条带灰度;N为该样品所有条带的总灰度;Pi为第i条带灰度占该泳道总灰度的比率。
2 结果与分析
2.1 PCR扩增结果
以总DNA为模板,NS1/Fung-GC引物对进行扩增,产物用1.2%琼脂糖凝胶电泳进行检测。图1结果表明,7号样品未扩增出产物,可能是由于其中的真菌较少。其他样品扩增产物片段清晰、降解少、无非特异性扩增,且长度与理论值350 bp一致,可直接用于后续实验。
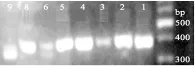
图1 8种发酵样品真菌PCR产物琼脂糖凝胶电泳图Fig.1 The PCR products of fungus in eight fermented samples by agarose gel electrophoresis 注:1~6、8、9表示的发酵样品见表1。
2.2 真菌18S rDNA V(1-2)区DGGE图谱
2.2.1 图谱分析 由图2可知,加工工艺、包装工艺、原料不同的发酵蔬菜样品具有不同的DGGE图谱,说明这些因素都影响了发酵蔬菜的真菌菌群群落结构。同时,这些样品中均含有共同的条带a,说明不同的样品间,有着一样的优势真菌菌种;同样迁移率的条带,亮度不同,如条带f,说明同一种真菌菌种在不同的样品内,菌量不同;不同迁移率的条带,亮度也不尽相同,说明不同的样品的其优势真菌菌群的差异。此外,#8号和#9号均为袋装酸菜,但其原料不同,其条带差异很大,说明酸菜工艺制得的发酵蔬菜制品,原料对其真菌群落结构影响显著。

图2 发酵蔬菜真菌18S rDNA DGGE图谱Fig.2 The DGGE profile of fungal 18S rDNA from fermented vegetables注:1~9表示见表1;a、b、c、d、e、f、g、h、i、j表示回收测序的电泳条带。
2.2.2 Shannon-wiener多样性指数分析 多样性指数是研究群落物种数和个体数及分布均匀度的综合指标[24]。8个样品的真菌多样性指数如图3所示,泡菜(1、2、3),榨菜(4、5),酱菜(6),酸菜(8、9)中真菌的多样性指数具有差异,说明不同的加工工艺对发酵蔬菜制品中真菌多样性有显著影响。泡菜工艺(1、2、3号),真菌的多样性指数差异相对最小,说明泡菜工艺下制得的发酵蔬菜制品真菌区系相对稳定;酸菜工艺(8、9),真菌的多样性指数差异显著。

图3 发酵蔬菜真菌多样性指数分析Fig.3 Shannon-Wiener analysis ofthe fungus in eight fermented vegetables
2.2.3 聚类分析 由图4可知,8种发酵蔬菜聚类分析得知聚为5类,三种泡菜(#1、#2、#3)聚为一类,且泡菜#1、#2相似性较低,说明袋装与散装泡菜真核微生物相似性不高。榨菜(#4、#5)的聚为一类。酸菜#8、#9虽同为袋装酸菜,聚类分析为不同类型,聚类相似度很低,而酸菜#8与泡菜聚为一类,酸菜#9为一类,说明酸菜工艺下的不同原料蔬菜的真核微生物相似性很低。四种工艺发酵蔬菜真核微生物相似性为20%,而酱菜与泡菜的相似性较与榨菜的高。同一工艺不同原料发酵蔬菜真核微生物相似性38%。同一工艺袋装与散装泡菜真核微生物相似性为51%。总之,不同加工工艺发酵蔬菜真核微生物相似性低,而酱菜与泡菜的相似性较与榨菜的高;同一工艺不同原料发酵蔬菜真核微生物相似性很低。同一工艺袋装与散装泡菜真核微生物相似性不高。实验结果表明加工工艺对发酵蔬菜真核微生物群落的影响较原料、包装条件的影响显著;同一工艺条件下原料较包装的影响显著。

表2 8种发酵蔬菜的相似性分析(%)

图4 发酵蔬菜真菌的聚类分析Fig.4 Cluster analysis of fungus in nine fermented vegetables注:#1~#9对应表1的1~9样品。
注:表格中的1~6、8、9号样品见表1。2.2.4 相似性系数(CS%)分析 对DGGE图谱数据化处理得出不同泳道间的相似性系数(表2)。样品1和#2、#3的相似性系数分别为51.7%、51.3%,样品#2、#3之间的相似性系数为62%,可知,泡菜样品#1、#2、#3的相似度最高,说明泡菜工艺下发酵蔬菜真菌群落结构的稳定性高于其他的工艺;榨菜样品#4、#5的相似性系数为53.1%;酸菜样品#8、#9的相似性系数为18.1%,可见,酸菜工艺下,发酵蔬菜的真菌群落结构的稳定性最差。和上述多样性指数、聚类分析结果相吻合。

表3 回收条带的测序结果的分析比对
2.2.5 测序结果 DGGE电泳后(图2),对其中10条优势带进行切胶回收、克隆,每条带选阳性克隆子进行测序,并与GeneBank 数据库比对,结果见表3。结果显示:所有的测序条带均为酵母菌,说明发酵蔬菜中优势真菌为酵母菌。且10条带中,c、g、h、i、j五条带鉴定是Trichosporonmucoidessp.(粘性丝孢酵母)的不同菌种,说明Trichosporonmucoidessp.在发酵蔬菜中占优势。其中,条带a为Zyqosaccharomycessp.(无对应中文名称)是所有发酵蔬菜样品所共有的优势条带;条带b为Basidiomyceteyeastsp.(担子菌类酵母),是泡菜(1、2、3)和榨菜(4、5)所共有;条带d 鉴定是Saccharomycessp.(酿酒酵母),是酱菜(6)和酸菜(8)所共有;条带e为Dabaryomycessp.(德巴利酵母),是#5号散装榨菜所特有的真菌;条带f鉴定是Candidasp.,(假丝酵母)是泡菜(2、3)、榨菜(4、5)和酱菜(6)所共有。
3 讨论与结论
尽管发酵蔬菜的制作可以追随到两千多年前,但是直到20世纪初,人们才将发酵蔬菜和微生物的活动联系起来。大量学者研究了发酵蔬菜中乳酸菌的多样性[25-26]。此外,国内外很多学者也对发酵蔬菜中真菌群落结构进行了研究,已经从发酵蔬菜中分离得到了yeast、Saccharomyces、Candida、Pichia等酵母菌。本研究结果可知泡菜、榨菜、酱菜和酸菜真核Shannon-Wiener指数差异显著,其中,泡菜真菌的香农指数差异相对最小。四种工艺发酵蔬菜真核微生物相似性为20%,而酱菜与泡菜的相似性较与榨菜的高。同一工艺不同原料发酵蔬菜真核微生物相似性38%。同一工艺袋装与散装泡菜真核微生物相似性为51%。碱基序列鉴定结果:所有的测序条带均为酵母菌,Trichosporonmucoidessp.、Zyqosaccharomycessp.存在于市售9种发酵蔬菜样品中,且为优势菌;Candida.sp 存在于泡菜、榨菜、酱菜工艺发酵蔬菜中;Dabaryomycessp.为散装榨菜中所特有的真菌菌群。张先琴[27]对四川地区自然发酵泡菜进行研究,结果表明:也蒙假丝酵母(Meyerozymaguilliermondii)为四川地区自然发酵泡菜中的优势菌种,几乎存在于所有的样品中,此外还有奥默柯达酵母菌(Kodamaeaohmeri),汉逊德巴利酵母(Debaryomyceshansenii),以及曲霉菌(Aspergillus)、热带假丝酵母菌(Debaryomyceshansenii)和非培养的真菌(unculturedfungus)。由此可见,Saccharomyces(酿酒酵母)、Candida在蔬菜发酵中广泛存在。本实验优势条带回收克隆的测序结果表明:在不同的原料,加工工艺及包装工艺下,真菌的DGGE指纹图谱均不相同。其中,Trichosporonmucoidessp.在发酵蔬菜中占优势,Zyqosaccharomycessp.为不同发酵蔬菜共有的优势菌种,Saccharomycessp.为泡菜和榨菜所共有的优势菌种。此外,也检测到了Dabaryomycessp.,与张先琴对自然发酵的泡菜中的测序结果相吻合。
综合对比市售发酵蔬菜中的真菌,发现不同加工工艺下的市售发酵蔬菜中,真菌的群落丰度相近。而加工工艺对微生物群落结构的稳定性有一定的影响。在泡菜工艺下,真菌的群落结构均最稳定,而酸菜工艺下,真菌的群落结构稳定性均最差。加工工艺对发酵蔬菜真核微生物群落的影响较原料、包装条件的影响显著;同一工艺条件下原料较包装的影响显著。
[1]施安辉,周波. 蔬菜传统腌制发酵工艺过程中微生物生态学的意义[J]. 中国调味品,2002(5):32-35.
[2]陈弦,张雁,陈于陇,等. 发酵蔬菜风味形成机制及其分析技术的研究进展[J].中国食品学报,2014,14(2):217-223.
[3]燕平梅,薛文通,畅晓晖,等.自然发酵和接种发酵方法对白菜品质的影响[J]. 农业工程学报,2008,24(3):286-290.
[4]Shin M S,Han S K,Ryu J S,et al.Isolation and partial characterization of a bacteriocin produced by Pediococcus pentosaceus K23-2 isolated from Kimchi[J].Journal of Applied Microbiology,2008,105(2):331-339.
[5]Marquina D,Peres C,Caldas EV. Characterize aof the yeast population in olive rines[J].Letters in Applied Microbiology,1992,14:279-283.
[6]Yan PM,Xue WT,Ten SS,et al. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control,2008(12):50-55.
[7]Yan PM,Chai Z,Chang XH,et al. Screening and identification of microorganism degrading nitrite in Chinese sauerkraut[J]. Lab of Food Microbiology,2015,26(1):6-8.
[8]张兰威.发酵食品[M].哈尔滨:哈尔滨工程大学出版社,1997:132-151.
[9]曾骏,陈安均,蒲彪,等. 传统四川泡菜中酵母菌的动态变化规律[J]. 食品科学,2014,35(7):81-85.
[10]贺稚非,李洪军,任俊琦.发酵蔬菜低温贮藏酵母菌动态变化研究[J].食品科学,2011,32(13):165-168.
[11]杨珺,吴永娴,曾凡坤. 四川榨菜后熟时期微生物区系的初探[J]. 食品科学,1999(12):49-81.
[12]罗松明,刘书亮,杜晓华,等.四川泡菜微生态分布及其与盐度、酸度的关系[J].食品与发酵工业,2013,39(2):29-34.
[13]张鹏.四川泡菜中酵母菌的分离筛选及其应用研究[D].哈尔滨:东北农业大学,2007.
[14]Amann RI,Ludwig W,Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews,1995,59(1):143-169.
[15]Jansson JK,Prosser JI.The life beneath our feet[J].Nature,2013,494(7435):40-41.
[16]Park EJ,Chun J,Cha CJ,et al. Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J]. Food Microbiology,2012,30:197-204.
[17]李正国,付晓红,邓伟.传统分离培养结合DGGE法检测榨菜腌制过程的细菌多样性[J].微生物学通报,2009,36(3):371-376.
[18]翁佩芳,陈希,沈锡权,等.榨菜低盐腌制细菌群落多样性的分析[J].中国农业科学,2012,45(2):338-345.
[19]沈锡权,赵永威,吴祖芳,等.冬瓜生腌过程细菌种群变化及其品质相关性[J].食品与生物技术学报,2012,31(4):411-416.
[20]侯强川,郭壮,张家超,等. 俄罗斯卡尔梅克共和国发酵蔬菜中细菌多样性研究[J]. 食品与发酵工业,2014,40(7):16-22.
[21]夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):1489-1499.
[22]Zhang J,Zeng G,Chen Y,et al. Effects of physico-chemical parameters on the bacterial and fungal communities during agricultural waste composting[J]. Bioresource Technology,2011,102(3):2950-2956.
[23]Lee JS,Heo GY,Lee JW,et al. Analysis of kimchi microflora using denaturing gradient gel electrophresis[J]. International Journal of Food Micro Biology,2005,102:143-150.
[24]程新胜,杨建卿.熏蒸处理对土壤微生物及硝化作用的影响[J].中国生态农业学报,2007,15(6):51-53.
[25]Sang HJ,Ji YJ,Se HL,et al. Microbial succession and metabolite changes during fermentation of dongchimi,traditional Korean watery kimchi[J]. International Journal of Food Microbiology,2013,164:46-53.
[26]张锐,吴祖芳,沈锡权,等. 榨菜低盐腌制过程的微生物群落结构与动态分析[J]. 中国食品学报,2011,11(3):175-180.
[27]张先琴,张小平,敖晓琳,等. PCR-DGGE分析四川地区家庭制作泡菜中微生物多样性[J]. 食品科学,2013,34(12):129-134.
The community structure of eukaryotic microorganisms in nine kinds vegetable fermentation system
YAN Ping-mei1,JING Xue-jiao2,LI Yan-qin2,*,CHAI Zheng1, QIAO Hong-ping1,ZHAO Wen-jing1,WANG Qi2
(1.Department of Biology,Taiyuan Normal University,Taiyuan 030012,China; 2.College of Life Science,Shanxi University,Taiyuan 030031,China)
Objective:In order to explore the community structure of fungus in fermented vegetable system.Methods:The experiment took nine kinds of commercially available fermented vegetables as the research object and extracted macro gene DNA from them. By combining polymerase chain reaction with denaturing gradient gel electrophoresis(DGGE)technology,mixed fungal 18S rDNA V(1-2)gene fragment of nine kinds of vegetable fermentation microbial system were separated and then Shannon Wiener diversity of microbial eukaryotes and similarity cluster analysis of fungi community structures of nine kinds of fermented vegetable were analyzed by Quantity One software. Electrophoresis bands which have strong fluorescence intensity and different time difference in DGGE electrophoresis were recycled and compared with the GenBank sequences after nucleotide sequences by cloning is determined. Results:Shannon-Wiener index of fungus of pickled cabbage,mustard,soy sauce pickles and sauerkraut had significant differences and the Shannon index differences of fungus of pickled vegetables is relatively small. The similarity of eukaryotic microorganism of fermented vegetables under the four process was 20%.Compared with mustard,the similarity of pickled cabbage and soy sauce pickles was high. In the same process,the simwereilarity of eukaryotic microorganism in fermented vegetables with different raw materials was 38%. in the same process and the bulk of the same process was 51%.Base sequence identification results:All the sequencing bands who were yeast.Trichosporonmucoidessp.,Zyqosaccharomycessp were existed in 9 kinds of fermented vegetable samples which were sold in the market and they were dominant fungus.Candidapalmioleophilawas existed in pickled cabbage,mustard,soy sauce pickles.Dabaryomycessp. was endemic fungal flora in bulk mustard.Conclusion:Experimental results showed that fungal flora of the fermented vegetable products under pickle process were relatively stability compared with mustard,soy sauce pickles and sauerkraut. Processing technology of fermented vegetable had an prominant effect on eukaryotic microbial communities compared with the raw material and packing and under the same process conditions,raw materials had an prominant influence on eukaryotic microbial communities compared with packaging.
PCR-DGGE;fermented vegetables;microbial community structure;metagenomics
2016-05-27
燕平梅(1968-), 女,博士, 教授, 主要从事微生物生态学方面的研究,E-mail:yanpingmei1968@163.com。
*通讯作者:李艳琴(1960-),女, 教授, 主要从事微生物生理学方面的研究,E-mail:yanqin@sxu.edu.cn。
国家自然基金项目(31171743);山西省基础条件平台项目(2014091003-0107)。
TS255
A
1002-0306(2016)22-0185-05
10.13386/j.issn1002-0306.2016.22.028

