离子交换色谱法测定10种热带水果中的葡萄糖、蔗糖和果糖
于 璐,周光明,沈 洁,余艳丽
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
离子交换色谱法测定10种热带水果中的葡萄糖、蔗糖和果糖
于 璐,周光明*,沈 洁,余艳丽
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
建立了高效阴离子交换-脉冲安培检测(High performance anion exchange-pulsed amperometric detection,HPAE-PAD)测定火龙果、莲雾、牛油果等10种热带水果中葡萄糖、蔗糖和果糖的检测方法。热带水果中的多糖经超声萃取后,用METROSEP CARB 1(150 mm×4.0 mm)色谱柱进行分离,以30.0 mmol/L NaOH为流动相,等度洗脱,用安培检测器检测,18 min可完成对样品多糖的分离和定量分析。经测定,葡萄糖和蔗糖的检出限分别为0.1209 μg/mL和0.2827 μg/mL,线性范围为1.0~70.0 μg/mL;果糖的检出限为0.5501 μg/mL,线性范围为5.0~80.0 μg/mL。样品溶液连续5次进样,3种糖的相对标准偏差为0.67%~7.04%,平均回收率为78.70%~117.75%。该方法前处理简单、选择性好、灵敏度高,可用于热带水果中可溶性糖的测定。
离子交换色谱,脉冲安培检测,热带水果,葡萄糖,蔗糖,果糖
近年来,我国热带水果进口逐年增加,消费需求日益加强[1],因此其营养成分也引起了人们的关注。热带水果营养丰富,富含糖类、有机酸、膳食纤维以及各种维生素[2-6]。其中糖类是热带水果中一类重要的有机化合物,主要是由葡萄糖、蔗糖和果糖组成。大量实验表明,葡萄糖是生物体内新陈代谢不可缺少的营养物质和主要的热量来源之一;蔗糖热量高,摄取过量易导致蛀牙,引起人体肥胖和糖尿病;果糖的升糖指数(GI)低,故食用后引起蛀牙和糖尿病的几率比葡萄糖或蔗糖等天然糖小,且易被机体吸收利用,适用于葡萄糖代谢及肝功能不全的患者补充能量[7]。因此,有必要建立测定热带水果中葡萄糖、蔗糖和果糖含量的方法。
有关于糖类的测定方法主要有比色法[8]、气相色谱法[9]、高效毛细管电泳色谱法[10]以及高效液相色谱法[11-12]等。其中,比色法是一种传统测糖的方法,它只能测定糖类总量,不能完成糖的分离,不具备选择性[13]。气相色谱法要求样品易挥发且分析物热稳定性良好,高效毛细管电泳色谱法中所常用的紫外检测器要求分析物对紫外光有较好的吸收,但大部分糖类没有紫外吸收且不易挥发,所以它们测定糖类事先均需衍生化处理,其操作繁琐,给实际分析工作带来较大的不便和误差[14]。对于高效液相色谱法其常规的检测器为紫外检测器和示差折光检测器,若采用示差折光检测器虽无需衍生,但其灵敏度较低,易受温度和流动相的影响,仅适用于常量样品的分析。近年来,离子交换色谱-脉冲安培检测法已普遍用于糖类化合物的测定[15-18],该方法可直接对糖类进行检测,无需进行柱前衍生,且灵敏度高、检测速度快、检测结果准确[19-20],可用于热带水果中葡萄糖、蔗糖和果糖含量的测定。
目前对于北方常见水果中糖含量的测定已有很多报道,如王忠民[21]用比色法分析了葡萄中多糖的组成;吕明霞[22]等人用气相色谱法对山楂、梨、苹果、杏等水果中的单糖进行了分析测定,而用离子色谱法对热带水果中糖的分析测定尚未见报道。所以,本文采用离子交换色谱-脉冲安培检测法同时完成了热带水果中葡萄糖、蔗糖和果糖的分离和含量分析,为热带水果经济价值的评价和指导消费者提供了科学依据。
1 材料与方法
1.1 材料及仪器
NaOH、葡萄糖和蔗糖 分析纯,重庆川东化学有限公司;D-果糖 生化试剂,成都市科龙化工试剂厂;超纯水 电导率≥18.2 MΩ·cm;菠萝、菠萝蜜、火龙果、莲雾、木瓜、芒果、牛油果、山竹、西番莲和杨桃 均购买于当地超市。
861 Advanced Compact IC型离子色谱仪、817型脉冲安培检测器、METROSEP CARB 1(150 mm×4.0 mm)阴离子交换柱、化学抑制器、低脉冲串联式双活塞往复泵、双通道蠕动泵、Metrohm IC-Net 2.3色谱工作站 瑞士万通公司(Metrohm);FA2004A型电子天平 上海精天电子仪器有限公司;CQ50超声波清洗器 上海必能信超声波有限公司;GM-0.33Ⅱ隔膜真空泵 天津市腾达过滤器件厂。
1.2 实验方法
1.2.1 色谱条件 分离柱:METROSEP CARB 1(150 mm×4.0 mm)阴离子交换柱;检测器:四电位脉冲安培检测器;再生液:200 mmol/L NaOH再生液;淋洗液:30 mmol/L NaOH溶液;流速:1.0 mL/min;柱温:32 ℃;进样量:20 μL。
1.2.2 色谱条件的选择 分别配制5.0、10.0、20.0、30.0、50.0 mmol/L的NaOH溶液作为淋洗液,选择最佳浓度。分别使用20、25、32、35 ℃的柱温检测样品,选择最佳柱温。分别考察了流速为1.5、1.2、1.0、0.8 mL/min时对实验的灵敏度、标准样品的分离度以及出峰时间的影响,选择最佳流速。
1.2.3 标准溶液的配制 精确称取葡萄糖、蔗糖和D-果糖的标准样品各0.1000 g,加入超纯水溶解于烧杯中,再分别转移至100 mL的容量瓶中并定容至刻度,得到质量浓度为1000 μg/mL的标准溶液。最后用移液管从1000 μg/mL葡萄糖,蔗糖和果糖的标准溶液中分别吸取一定量的溶液至100 mL的容量瓶中,配制得到葡萄糖和蔗糖浓度为1.0、5.0、10.0、20.0、30.0、50.0、70.0 μg/mL,果糖浓度为5.0、10.0、20.0、30.0、50.0、70.0、80.0 μg/mL的混合标准溶液,摇匀后用0.45 μm水系过滤膜过滤、待测。
1.2.4 样品前处理 芒果洗净去核,切碎,用陶瓷研钵研磨成均匀的浆糊状。精确称取0.1000 g,加入10.0 mL室温下的超纯水超声(功率为100 W)萃取30 min。用布氏漏斗过滤,将滤液转移至100 mL容量瓶中定容,摇匀后用0.45 μm水系过滤膜过滤、待测。
菠萝、菠萝蜜、火龙果、莲雾、木瓜、牛油果、山竹、西番莲和杨桃的前处理方法同芒果,由于牛油果中含糖量极少,所以其中牛油果的称取量为2.0000 g。
1.2.5 样品中多糖提取单因素实验 称取0.1000 g浆糊状的芒果,加入一定量室温下的超纯水超声萃取一定时间,按照1.2.3的方法处理,1.2.1中的条件测定,计算各单糖的提取率。各因素水平为:加水量0.1∶10、0.1∶20、0.1∶30、0.1∶40、0.1∶50和0.1∶60 g∶mL;萃取时间10、20、30、40、50和60 min。
提取率(%)=单糖的实验测定值/样品称取量×100
1.2.6 数据处理 本实验采用外标法对其峰面积定量,通过Excel作出峰面积(Y)对其质量浓度(X)的线性回归方程,根据方程计算出其测定值。每种样品重复进样5次,计算出各种单糖的平均测定值,相对标准偏差和平均含量。采用加标定性法对3种糖进行定性分析,并计算其加标回收率。
单糖的平均含量(%)=单糖的平均测定值/样品称取量×100
单糖的加标回收率(%)=(加标试样测定值-平均测定值)/加标量×100
2 结果与讨论
2.1 样品中多糖提取单因素实验
2.1.1 提取料液比的选择 由图1可知,料液比对葡萄糖、蔗糖和果糖的提取率的影响都很小,所以依据节约用料的原则选择料液比为0.1∶10 g/mL。
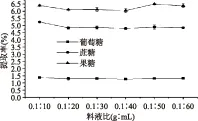
图1 料液比对3种糖提取率的影响Fig.1 Effect of liquid ratio on three kinds of sugar extraction rate
2.1.2 萃取时间的选择 从图2中可以看出,葡萄糖和蔗糖随着萃取时间的增加,提取率变化不明显,说明萃取时间对葡萄糖和蔗糖的影响较小。而果糖在不同萃取时间的提取率差异较大,当萃取时间大于30 min时,果糖的提取率稍有下降。实验发现超声时间越长,溶液中的杂质越多,过滤的时间越长,故最终考虑选取30 min为萃取时间。
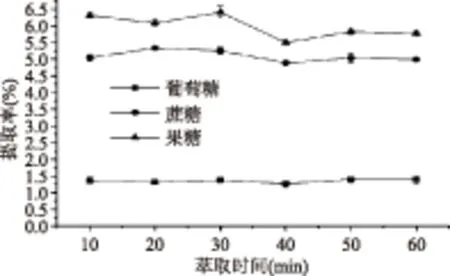
图2 萃取时间对3种糖提取率的影响Fig.2 Effect of extraction timeon three kinds of sugar extraction rate
2.2 色谱条件的选择
2.2.1 淋洗液的选择 本实验使用氢氧化钠溶液作为流动相洗脱样品(结果见图3),其出峰顺序为葡萄糖、蔗糖、果糖。实验发现NaOH溶液浓度与保留时间呈反比,浓度越高,保留时间越短;浓度越低,保留时间越长。当NaOH溶液浓度高于10.0 mmol/L,低于30.0 mmol/L时,葡萄糖和蔗糖无法实现分离;而浓度高于30.0 mmol/L时,发现果糖峰与蔗糖峰严重重叠,无法分离。当NaOH溶液浓度为5.0 mmol/L和30.0 mmol/L时,三种糖的分离效果理想,但在NaOH溶液浓度为5.0 mmol/L时总分析时间需要35min,而当NaOH溶液浓度为30.0 mmol/L时,三种糖可在18 min以内完成分离,所以本实验最终确定淋洗液的浓度为30.0 mmol/L。
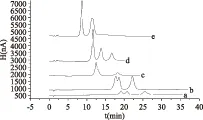
图3 淋洗液浓度对实验的影响Fig.3 Effect of the eluent concentration on experiment注:a. 5.0 mmol/L;b. 10.0 mmol/L;c. 20.0 mmol/L;d. 30.0 mmol/L;e. 50.0 mmol/L。
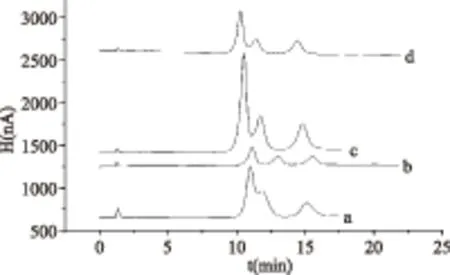
图4 柱温对实验的影响Fig.4 Effect of the column temprature on experiment注:a. 35 ℃;b. 32 ℃;c. 25 ℃;d. 20 ℃。
2.2.2 色谱柱温度和淋洗液流速的选择 改变色谱柱温度,观察标准样品的色谱峰发现(图4):色谱柱的温度对色谱峰的分离度的影响很大,当温度降低,峰底随之变宽,柱压逐渐升高,而温度的升高又使得色谱峰的分离度变差,故综合考虑选择柱温为32 ℃。
流速的改变对实验的灵敏度以及糖的分离度、出峰时间均有一定的影响(结果见图5)。当流速增大,分析时间缩短,但柱压增大,造成灵敏度下降及分离度降低;当流速减小,保留时间却增加。因此最终选择洗脱流速为1.0 mL/min最为适宜。
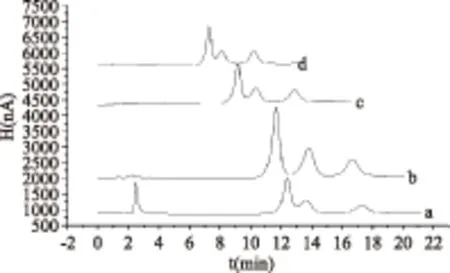
图5 淋洗液流速对实验的影响Fig.5 Effect of the eluent flow rate on experiment注:a. 0.8 mL/min;b. 1.0 mL/min;c. 1.2 mL/min;d. 1.5 mL/min。
2.3 标准曲线的绘制和检出限的测定
分别测定1.2.2项条件下配制的混合标准溶液,绘制标准曲线。50 μg/mL葡萄糖、50 μg/mL蔗糖和70 μg/mL果糖混合标准溶液谱图如图6所示。本实验采用外标法对峰面积定量,以3种糖的峰面积(Y)对其质量浓度(X)进行线性回归,根据S/N=3计算仪器检出限。结果如表1所示。
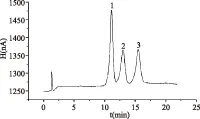
图6 标准样品色谱图Fig.6 Chromatogram of three kinds of standard samples注:1.葡萄糖;2.蔗糖;3.果糖。
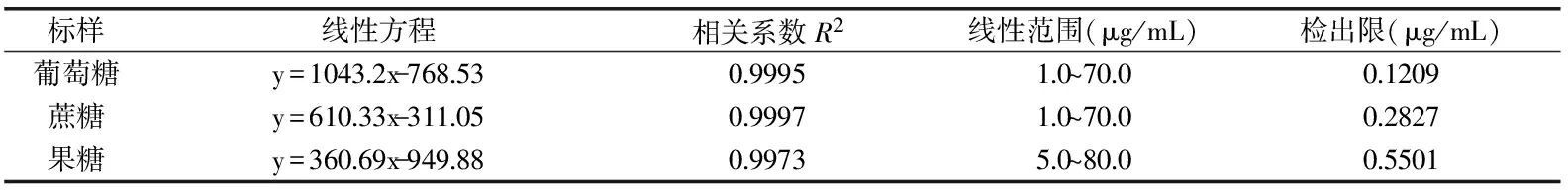
表1 线性方程,线性范围与仪器检出限
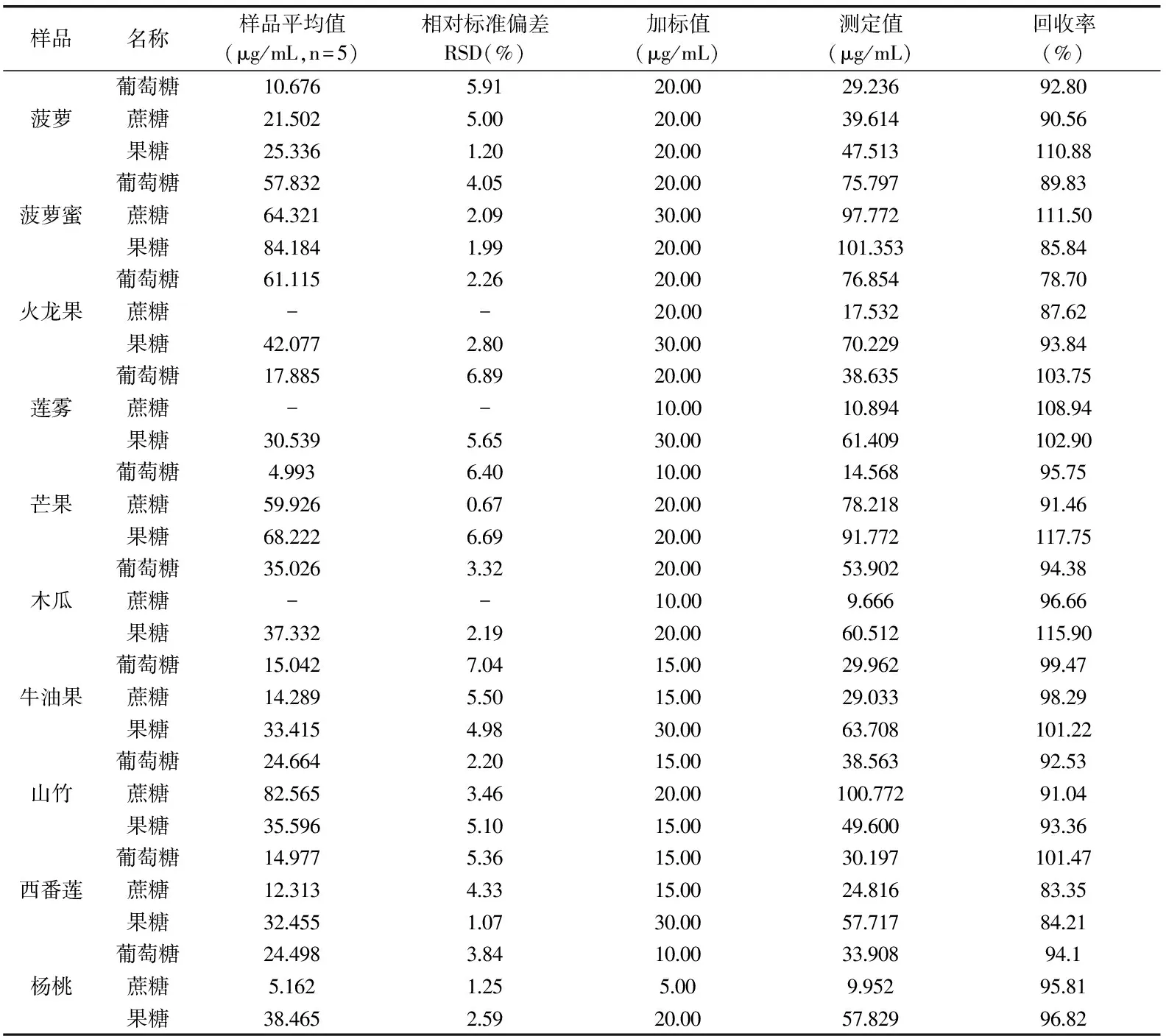
表2 重现性实验和加标回收率结果
注:-表示未检出。2.4 重现性实验和加标回收率
按照1.2.3项中样品处理方法处理样品,在1.2项中优化的色谱条件下连续对样品进行5次测定做重复性实验,计算平均值和样品测定值的相对标准偏差,测定结果如表2所示。
为了减小误差,本实验采用加标定性法对其进行定性分析。在测出本底值后,准确称取0.1000 g菠萝、菠萝蜜、火龙果、莲雾、木瓜、牛油果、山竹、西番莲和杨桃,2.0000 g牛油果,分别向其中加入定量的标准物质,采用1.2.3项中样品处理方法处理样品,进样测定,计算回收率如表2所示。
由表2可知,10种样品测定值的相对标准偏差为0.67%~7.04%(n=5),平均回收率为78.70%~117.75%。其中火龙果、莲雾和木瓜中均未检测出蔗糖,查阅文献[23-25]得知,火龙果与木瓜中几乎不含蔗糖,而莲雾中尚未检测到蔗糖可能是由于它本身蔗糖含量较低,在经过前处理后其样品含量低于检出限。
2.5 样品测定结果及色谱图
将处理好的样品按照1.2项中的色谱条件进行色谱分析,其中火龙果和西番莲的色谱图见图7~图8。从谱图中可以发现,三种糖的分离效果好。

图7 火龙果色谱图Fig.7 Chromatogram of pitaya注:1.葡萄糖;3.果糖。
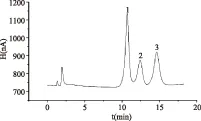
图8 西番莲色谱图Fig.8 Chromatogram of passionflower注:1.葡萄糖;2.蔗糖;3.果糖。
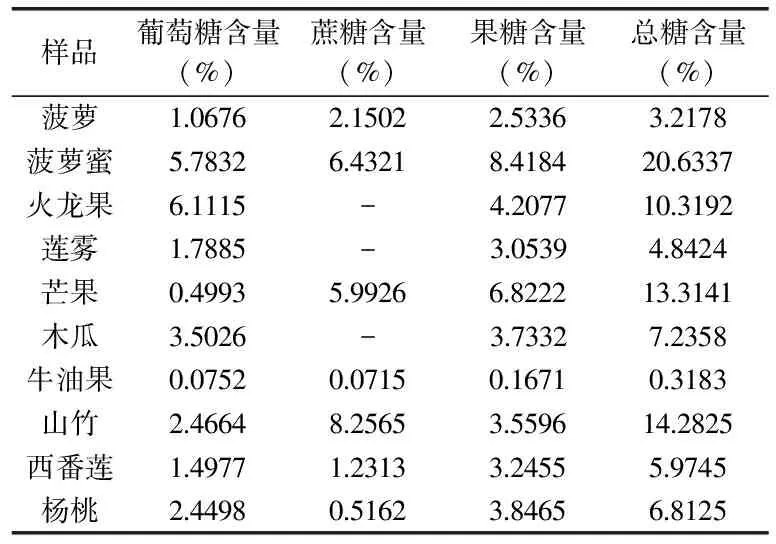
表3 样品测定结果
10种热带水果的测定结果如表3所示。由表3数据可知,几种水果中牛油果总的含糖量(0.3183%)最低,菠萝蜜总的含糖量(20.6337%)最高,山竹(14.2825%)、火龙果(10.3192%)以及芒果(13.3141%)的含糖量相对较多,其他几种水果总糖含量差异不大,在3.2178%~7.2358%之间。其中葡萄糖含量最高的是火龙果(6.1115%),其次是菠萝蜜(5.7832%),含量较低的是芒果(0.4993%)和牛油果(0.0752%),其含量低于1%,其他几种水果中葡萄糖的含量在1.0676%~2.4664%之间;蔗糖含量较高的是山竹(8.2565%),菠萝蜜(6.4321%)和芒果(5.9926%),而杨桃(0.5162%)和牛油果(0.0715%)的含量低于1%,火龙果、莲雾和木瓜中的蔗糖含量由于低于仪器检出限而未被检测出;在10种热带水果中,除山竹和火龙果之外,果糖的含量在多糖总含量中所占的比例最高,尤其是菠萝蜜(8.4184%)和芒果(6.8222%),其中菠萝、莲雾、木瓜、西番莲以及杨桃的果糖含量在2.5336%~3.8465%之间,而果糖含量最低的是牛油果(0.1671%),但也远高于牛油果中葡萄糖和蔗糖的含量,说明果糖是热带水果中可溶性多糖最重要的组成部分。
由此可见,患有肥胖症和糖尿病等的特殊人群可以选择牛油果、火龙果、莲雾和木瓜等蔗糖含量少的水果食用,葡萄糖代谢和肝功能不全的患者可以选择葡萄糖含量少,但勿选择果糖含量较多的芒果食用,这样人们不仅可以享受水果的风味,还不用担心由于摄入过多而引起身体不适。
3 结论
本文采用超声萃取10种热带水果中的葡萄糖、蔗糖和果糖,采用离子交换色谱-脉冲安培检测法对葡萄糖、蔗糖和果糖的含量进行了分离和定量分析。该方法检测成本低、灵敏度高、准确性好,为热带水果中葡萄糖、蔗糖和果糖的含量测定提供了一个快速、简便的方法。经测定,葡萄糖和蔗糖的检出限分别为0.1209 μg/mL和0.2827 μg/mL,果糖的检出限为0.5501 μg/mL;3种糖的相对标准偏差为0.67%~7.04%,平均回收率为78.70%~117.75%。实验表明,在所测定的10种热带水果中葡萄糖(0.0752%~6.1115%)、蔗糖(0.0715%~8.2565%)和果糖(0.1671%~8.4184%)的含量丰富,且不同水果主要含糖量有所差异,为热带水果经济价值的评价和指导消费者提供了一定的参考。
[1]陈新建,陈道明. 中国热带水果生产贸易现状及发展对策[J]. 中国热带农业,2010(3):14-17.
[2]陈仪新,卫智权,陆广利,等. 芒果不同部位化学成分和药理作用的研究近况[J]. 广西中医药大学学报,2015,18(2):102-105.
[3]房一明,张彦军,谷风林,等. 菠萝蜜的营养成分与鉴别比较研究[J]. 热带作物学报,2014,35(10):2088-2092.
[4]鲁力,叶玉屏,郑艳燕,等. 油梨果实营养成分分析[J]. 广西热作科技,1991(3):36-37.
[5]王晓红. 莲雾的营养成分分析[J]. 中国食物与营养,2006,12(4):53-54.
[6]邓博一,申铉日,邓用川. 海南百香果、莲雾、青枣营养成分的比较分析[J]. 食品工业科技,2013,34(12):335-338.
[7]陈洁,杨红芸. 果糖的研究进展[J]. 华西药学杂志,2000,15(2):111-112.
[8]李晓旭,李家政. 优化蒽酮比色法测定甜玉米中可溶性糖的含量[J]. 保鲜与加工,2013,13(4):24-27.
[9]Ruiz-Aceituno L,Carrero-Carralero C,Ramos L,et al. Development of a carbohydrate silylation method in ionic liquids for their gas chromatographic analysis[J]. Analytica Chimica Acta,2013,787(1):87-92.
[10]Wang T,Yang X,Wang D,et al. Analysis of compositional carbohydrates in polysaccharides and foods by capillary zone electrophoresis[J]. Carbohydrate Polymers,2012,88(2):754-762.
[11]李静芳,张素文,彭美纯,等. 高效液相色谱法检测乳制品中果糖、葡萄糖、蔗糖和乳糖的含量[J]. 食品工业科技,2011,32(6):391-393.
[12]Ouchemoukh S,Schweitzer P,Bey M B,et al. HPLC sugar profiles of Algerian honeys[J]. Food Chemistry,2010,121(2):561-568.
[13]Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,2002,28(3):350-356.
[14]林慧,冯云,颜春荣,等. 糖类化合物的分析方法研究进展[J]. 食品与药品,2014,16(6):448-452.
[15]张磊,周光明,张丽君,等. 离子色谱法测定鲜果和干果中的三种糖[J]. 四川大学学报:自然科学版,2014,51(4):791-796.
[16]许丽. 离子色谱法在没食子酸和可溶性糖类分析中的应用研究[D]. 重庆:西南大学,2012:23-26.
[17]Cai L,Xiaojun S U,Xiong X. Analysis of sugar components of fermented rice wine by ion chromatography[J]. Agricultural Science & Technology,2013,13(10):1500-1502.
[18]Eggleston G,Borges E. Multiple applications of ion chromatography oligosaccharide fingerprint profiles to solve a variety of sugar and sugar-biofuel industry problems.[J]. Journal of Agricultural & Food Chemistry,2015,63(11):2841-2851.
[19]李仁勇,梁立娜,牟世芬. 高效阴离子交换色谱-脉冲安培检测食品中糖的应用进展[J]. 食品与发酵工业,2010,36(7):97-101.
[20]丁永胜,牟世芬. 高效阴离子交换色谱-脉冲电化学检测方法和应用[J]. 分析化学,2005,33(4):557-561.
[21]王忠民,吴谋成,李小定,等. 葡萄多糖的提取及含量测定[J]. 新疆农业大学学报,2002,25(2):57-58.
[22]吕明霞,李媛,张飞,等. 气相色谱法分析北方水果中膳食纤维的单糖组成[J]. 中国食品学报,2012,12(2):213-218.
[23]秦复霞. 火龙果多糖提取纯化及单糖组成检测[J]. 南方农业,2016(15):103-105.
[24]王文. 皱皮木瓜多糖的提取、分离、表征及化学修饰[D]. 郑州:河南工业大学,2011:27-28.
[25]陈静,吴光斌,陈发河. HPLC测定采后莲雾果实中可溶性糖含量及在贮藏期的变化[J]. 食品与机械,2012,28(6):103-105.
Determination of glucose,sucrose and fructose in 10 kinds of tropical fruits by ion chromatography
YU Lu,ZHOU Guang-ming*,SHEN Jie,YU Yan-li
(Key Laboratory on Luminescence and Real-Time Analysis,Ministry of Education,School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
A high performance anion exchange-pulsed amperometric detection chromatographic method was applied to determine glucose,sucrose and fructose in pitaya,wax apple,avocado and other 7 kinds of tropical fruits. After ultrasonic extraction,the polysaccharide in tropical fruits was separated by METROSEP CARB 1(150 mm×4.0 mm)anion exchange column and detected by pulsed amperometric detector. 30.0 mmol/L NaOH was used for isocratic elution. Analysis of the samples could be finished within 18 min. Detection limit of glucose and sucrose were 0.1209 μg/mL and 0.2827 μg/mL respectively. The linearity ranged from 1.0 μg/mL to 70.0 μg/mL. Detection limit of the fructose was 0.5501 μg/mL. The linearity range was 5.0~80.0 μg/mL. The RSDs of 3 polysaccharide contents for 5 consecutive determinations were between 0.67% and 7.04%,and the spike recoveries were between 78.70% and 117.75%. The method had the characteristics of simple pretreatment,good selectivity and high sensitivity,and it could be applied in the determination of soluble sugars in tropical fruits.
anion exchange chromatography;pulsed amperometric detection;tropical fruits;glucose;sucrose;fructose
2016-06-13
于璐(1993-),女,硕士研究生,研究方向:离子色谱,E-mail:yulu444595301@qq.com。
*通讯作者:周光明(1964-),男,博士,教授,研究方向:色谱及其联用技术,E-mail:gmzhou@swu.edu.cn。
国家自然科学基金项目(2127710)。
TS207.7
A
1002-0306(2016)22-0094-06
10.13386/j.issn1002-0306.2016.22.010
——血糖

