灵芝液体深层发酵高产胞内多糖菌株的筛选及其动力学研究
王国瑞,冯 杰,冯 娜,唐传红,张劲松*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业遗传育种重点开放实验室,上海 201403)
灵芝液体深层发酵高产胞内多糖菌株的筛选及其动力学研究
王国瑞1,2,冯 杰2,冯 娜2,唐传红2,张劲松2*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业遗传育种重点开放实验室,上海 201403)
对实验室保藏的72株灵芝菌株液体深层发酵的终生物量和胞内多糖两个指标进行了分析,以胞内多糖得率为依据,筛选出了其中得率最高的G0041,G0045和G0059菌株,得率分别为(2.39±0.06)g/L、(2.28± 0.03)g/L和(2.74±0.12)g/L,且3菌株在5%和1%水平上均存在显著性差异。对3个菌株进行动力学模型构建,得到了菌丝体生长、产物胞内多糖生成和底物葡萄糖消耗的动力学方程和方程参数;方程的建立为后续灵芝液体深层发酵胞内多糖的优化及其规模化生产提供了理论研究基础。
灵芝;胞内多糖;液体深层发酵;发酵动力学
灵芝(Ganoderma lucidum Karst.),属担子菌纲(Basidiomycota)、多孔菌目(Polyporales)、灵芝科(Ganodermataceae)、灵芝属(Ganoderma),是一种药、食两用真菌。灵芝多糖是灵芝的主要活性成分之一,具有调节免疫、抗肿瘤、抗氧化、降血脂、抗辐射、抗疲劳等多种生物活性。灵芝多糖的研究一直受到国内外学者的广泛关注,已分离到的有200多种,大部分为β-型的葡聚糖,少数为α-型的葡聚糖[1]。
目前,灵芝的发酵生产主要有固体培养法和液体深层发酵法。液体深层发酵具有不受季节影响,生产周期短,显著提高生产效率等优点,受到人们的广泛关注,液体深层发酵技术成为获取灵芝多糖类化合物的重要手段。Hsieh等[2]报道了在灵芝菌丝液体深层发酵中,氮限制能提高多糖的产量;Tang等[3]发现镁离子和钾离子能够提高块菌中的多糖含量;袁术斌[1]对不同灵芝菌株进行了筛选,发现液态发酵灵芝菌丝体胞内多糖含量最高的菌株含量可达到15.4%,胞外多糖含量最高的可达到14.2%;乔双逵[5]研究发现,液体发酵中,灵芝胞外多糖在第5天积累到最高值,为0.472 g/L,发酵结束时,多糖产量降至最低值0.108 g/L;Fang等[6]发现小菌球有利于灵芝多糖的合成,当灵芝菌球直径分别为<1.2 mm、1.2—1.6 mm及>1.6 mm,其单位菌体胞内多糖产量分别为85 mg/g、69 mg/g、55 mg/g;王磊等[1]对8种灵芝菌株进行筛选,其中济宁圆芝菌丝体中多糖含量最高,为117.59 μg/mg;宋频然等[3]筛选出1株强耐自身代谢产物胞外多糖反馈抑制、高产胞外多糖的灵芝菌株GL029,该菌株的胞外多糖产量达3.07 g/L;Zhu等[2]在培养中加入从菌块中提取的多糖和蛋白激发因子,胞内多糖的含量和产量分别达到了(12.91±1.05)mg/(100 mg)和(1.94±0.18)g/L。
之前的研究报道中大多都是对灵芝液体深层发酵优化灵芝菌丝体的生产量以及胞外多糖产量的研究[10-13],但是对灵芝菌丝体液态发酵过程中菌丝体生长的变化,底物的利用,以及胞内产物灵芝多糖的过程变化的系统研究则较少。系统研究灵芝菌丝体液体深层发酵的过程变化对于菌丝体生长的控制和调控灵芝多糖的产量具有重要的意义。通过液体深层发酵对实验室保藏的72株灵芝菌株进行筛选,以期获得高产胞内多糖的灵芝菌株,在前期筛选的基础上对获得的高产菌株进行动力学的研究,构建其动力学模型,通过动力学模型参数的解析,进一步了解灵芝液体深层发酵过程的动态变化,为后续的优化和规模化生产提供依据。
1 高产胞内多糖菌株的筛选
1.1 材料与方法
1.1.1 供筛选菌株
供筛选菌株的编号、名称、来源见表1。

表1 供试灵芝菌株编号、名称和来源Table 1 Codes,names and sources of G.lucidum strains tested
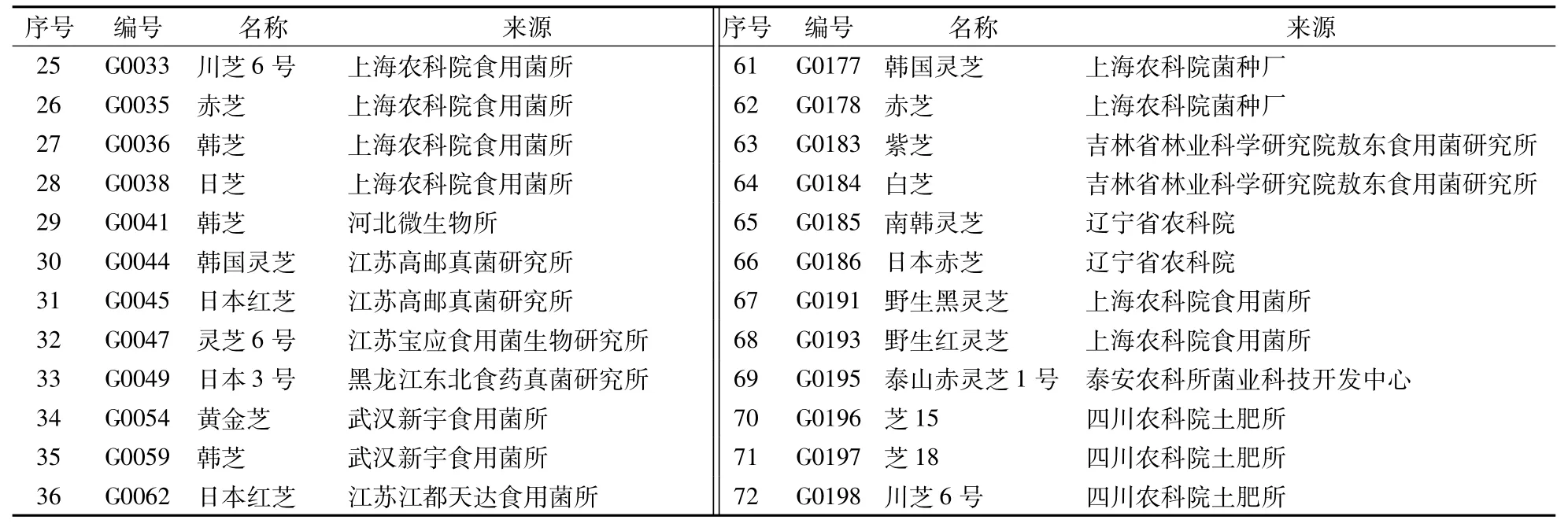
(续表1)
1.1.2 试验设备
酶标仪,美国Bio-Tek公司Biotek-Synergy HT多功能酶标仪;离心机,美国Beckman公司Allegretm25R Centrifuge离心机;摇床,上海杜科自动化设备有限公司DKY-Ⅱ恒温调速回转式摇床;生化培养箱,上海一恒科技有限公司LRH-250生化培养箱。
1.1.3 供试培养基
斜面培养基:马铃薯葡萄糖琼脂培养基(PDA),美国BD公司生产,称取39 g固体粉末溶于1 000 mL蒸馏水,121℃灭菌15 min。
液体种子培养基:豆饼粉20 g/L;葡萄糖25 g/L;MgSO4·7H2O 1.5 g/L;KH2PO43 g/L;pH 5.4,121℃灭菌30 min。
液体发酵培养基:豆饼粉20 g/L;葡萄糖20 g/L;可溶性淀粉10 g/L;MgSO4·7H2O 1.5 g/L;KH2PO43 g/L;pH 5.4,121℃灭菌30 min。
1.2 方法
1.2.1 菌株培养
将菌种在固体平板上进行活化,26℃培养7 d,待菌丝布满平板后,挑取黄豆大小的菌块接入种子培养基中,然后置于旋转式摇床上培养6—8 d(150 r/min,26℃),待小菌球基本布满摇瓶;从摇床上取下摇瓶,按定量接种法将每个菌株接到发酵培养基中(接种量10%),在摇床上培养8 d(150 r/min,26℃),本试验均设3个重复。
1.2.2 菌丝体生物量的测定
取适量发酵培养液将其在15 317 g下离心20 min,收集菌丝体于60℃烘箱烘干至恒重,称重,求3个重复的平均值,以g/L计量。
1.2.3 菌丝体中含胞内多糖粗提液的制备
将烘干后的灵芝菌丝体研磨成粉末,称取100 g加入100 mL蒸馏水,沸水浴提取3 h。冷却后定容至100 mL,将溶液在15 317 g下离心15 min后取上清液备用[14]。
1.2.4 总糖含量的测定
采用苯酚-硫酸法[15]。
1.2.5 还原糖含量的测定
采用3,5-二硝基水杨酸法[16]。
1.3 灵芝液体深层发酵动力学模型的构建
发酵动力学是研究发酵过程中菌体浓度、底物浓度和产物浓度等状态变量随发酵时间变化规律及控制变量之间的关系。研究灵芝液体深层发酵动力学可以清楚地了解发酵过程的动态变化。
1.3.1 菌体生成动力学模型的构建
本试验中选择Logistic[17]方程建立发酵过程菌丝体生长的动力学模型,方程如下:

当t=0时,X=X0为初始条件,(1-1)积分变形后为:

两边同时取对数得:

对方程(1-3)采用拟线性法作图,直线的斜率为μm,截距为-ln(Xm/X0-1)。
式中:X——菌体干重(g/L);X0——菌体的初始生物量(g/L);Xm——菌体的最大生物量(g/L);μm——最大比生长速率(h-1);t——发酵时间(h)
1.3.2 产物生产动力学模型的建立
灵芝发酵产生胞内多糖与菌体的生长属于部分相关的关系,可采用Luedeking-Piret[17]模型表示:

积分变换,结合(1-2)式得:

两边同时取对数,有

采用拟线性法求取参数α和β。
式中:P——产物(胞内多糖)的浓度(g/L);P0——产物(胞内多糖)的初始浓度(g/L);α、β——常数
1.3.3 底物消耗动力学模型的建立
对于葡萄糖消耗模型,采用Luedeking-Piret[17]方程

积分变换后,结合(1-2)式得:

两边同时取对数,得:

同样采取拟线性法求得A和B。
式中:S——基质(葡萄糖)的浓度(g/L);S0——基质(葡萄糖)的初始浓度(g/L);A、B——常数
1.4 数据处理
试验数据采用SPSS 20.0和DPS v 7.05数据处理软件进行分析。
2 结果与分析
2.1 灵芝菌株液体深层发酵生理生化指标分析
对72株供试菌株进行液体发酵培养,分别测定其菌丝体生物量,胞内总糖含量和胞内还原糖含量,得出胞内多糖含量和胞内多糖得率。试验结果如表2所示。
由表2分析可知,生物量较大的分别是G0068、G0099、G0157,含量分别为(21.81±5.75)g/L、(23.16± 2.16)g/L、(21.13±3.17)g/L;多糖含量较高的分别是G0059、G0100、G0195,含量分别为(21.10± 0.18)g/100 g菌丝体、(24.67±0.54)g/100 g菌丝体、(14.60±0.21)g/100 g菌丝体;胞内多糖得率较大的分别是G0041、G0045、G0059,含量分别为(2.39±0.06)g/L、(2.28±0.03)g/L、(2.74±0.12)g/L。

表2 不同菌株各参数试验结果Table 2 Experimental results of different strains
菌丝体生物量和胞内多糖产量是判断菌株性能优劣的重要指标,在筛选的72株菌株中,上述两类却具有不一致性,因此,将两者统筹考虑,即以胞内多糖得率作为筛选依据,我们将72株菌株中胞内多糖得率排名前二十的菌株,即G0059、G0041、G0045、G0100、G0157、G0033、G0186、G0007、G0062、G0047、G0099、G0159、G0154、G0067、G0069、G0063、G0152、G0093、G0003、G0178,采用统计学中显著性差异分析方法进行深入研究。菌株胞内多糖得率显著性分析结果见表3。
通过差异显著性分析可知,在5%显著水平上,G0059、G0041、G0045、G0100和G0157差异显著;G0157和G0033差异不显著;G0186和G0007差异不显著;G0007和G0062差异不显著;G0062、G0047、G0099、G0159、G0154、G0067、G0069、G0063和G0152差异显著;G0152和G0093之间差异不显著;G0093、G0003和G0178差异显著。在1%显著水平上,G0059、G0041、G0045、G0100和G0157差异显著;G0157和G0033差异不显著;G0186、G0007和G0062差异不显著;G0062和G0047差异不显著;G0047、G0099、G0159、G0154、G0067、G0069、G0063和G0152差异显著;G0152和G0093之间差异不显著;G0003和G0178差异不显著。此20株菌株中,G0059胞内多糖得率最高,为2.74 g/L,G0178胞内多糖得率最低,为1.53 g/L。

表3 20个菌株胞内多糖得率显著性分析Table 3 Significance test for 20 strains’intracellular polysaccharide yields

图1 灵芝液体深层发酵菌丝体生物量在发酵过程中的变化Fig.1 Biomass variation of G.lucidum mycelia during liquid submerged fermentation
2.2 高产胞内多糖灵芝菌株液体深层发酵过程研究
以上述研究为基础,选取胞内多糖得率最高的3株菌,即G0059、G0041和G0045进行分析研究。对三株菌的菌丝体生物量、还原糖消耗量以及胞内多糖产量的过程曲线进行分析,如图1—3所示。由图1分析可知,3个菌株几乎没有延滞期,很快进入对数期,在发酵1 d后进入稳定期,G0045和G0059稳定期均比较长,G0041在第6天生物量又有大幅增长,达到9.25 g/L。图2中,3株菌还原糖均在第1天消耗比较快,第8天降到最低点,为17.54 g/L,其中G0059消耗较缓慢,G0045消耗最多。图3中,胞内多糖产量呈逐渐增加趋势,G0059第1天增长最快,之后平稳增长,G0041和G0045前4 d呈指数增长,之后平稳增长,发酵第8天达到最大值,为1.70 g/L。
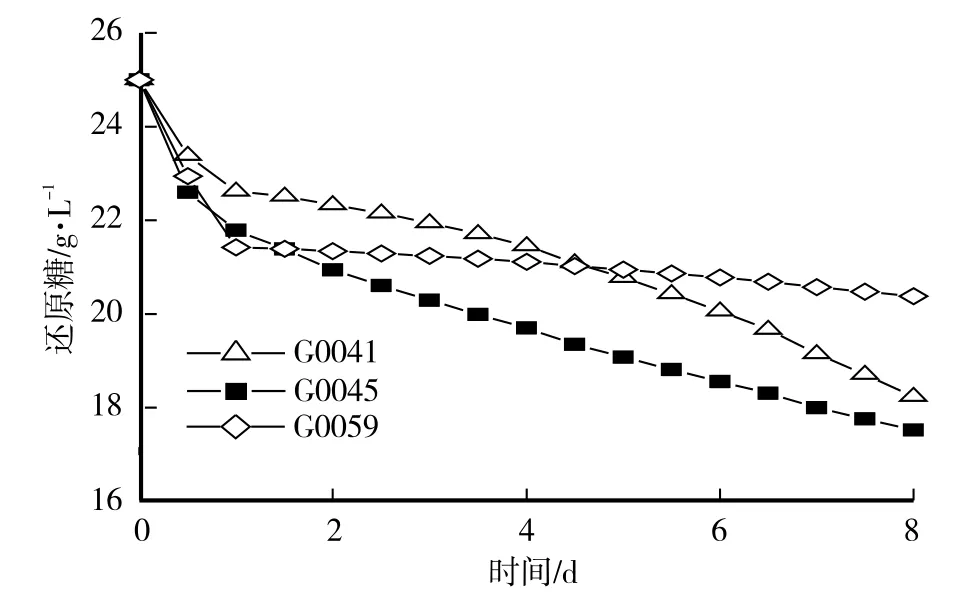
图2 灵芝液体深层发酵培养液中还原糖的消耗Fig.2 Consumption of reducing sugar of G.lucidum liquid submerged fermentation medium

图3 灵芝液体深层发酵胞内多糖产量Fig.3 Intracellular polysaccharide yield of G.lucidum liquid submerged fermentation
2.3 高产胞内多糖灵芝菌株液体深层发酵动力学参数比较
在5 L发酵罐中进行试验,探讨在发酵罐中分批发酵灵芝胞内多糖的条件和动力学特征,利用发酵试验数据分别求得三个菌株动力学方程的各个参数。以G0041动力学方程参数求解过程为例,说明参数求解过程[18-19]。
G0041菌丝体生长动力学方程求解如下:

G0041产物生成动力学方程求解如下:

G0041底物消耗动力学方程求解如下:

用同一方法分别求得菌株G0045和G0059的动力学方程参数,最终所求的参数结果如表4所示。

表4 发酵动力学模型参数估计值Table 4 Parameter estimation of fermentation kinetic models
由表4分析可知,Xm为菌体的最大生物量,在相同的发酵条件下,G0041的最大生物量达到12.479 g/L,相比G0045和G0059分别高出89.19%、169.23%。X0为通过建立动力学模型求得的菌体初始生物量,三株菌相差较小,G0041分别比G0045和G0059高出9.27%、10.85%。μm为最大比生长速率,G0041、G0045、G0059分别达到了0.518 h-1、0.684 h-1、0.647 h-1,G0045和G0059分别比G0041高出32.05%、24.90%。α表示与菌体生长相关的产物生成系数,β表示与菌体浓度相关的产物生成系数,三组数据中α和β均不为0,灵芝菌丝体发酵属于部分相关模型。A表示菌体生长相关的底物消耗系数,B表示与菌体浓度相关的底物消耗系数。
由表可见,在菌丝体生长期β非常小,接近于0,其意义为发酵在对数生长期,菌体大量生长,而产物只有少量合成,进入稳定生长期后,产物大量连续合成,因此发酵过程应属于部分相关型发酵。
将表4所得到的参数分别代入公式(1-1),(1-4)和(1-7)即可得到G0041,G0045和G0059三株菌的发酵动力学方程(表5)。

表5 发酵动力学方程Table 5 Fermentation kinetic equations
3 结论
通过对72株菌株的筛选,获得高产胞内多糖菌株3株,分别为G0041、G0045、G0059。对筛选获得的3株菌进行了详细的发酵过程研究,最大菌丝体生物量达到(23.16±2.16)g/L,最大胞内多糖产量达到(24.67±0.54)g/100 g菌丝体,最大得率达到(2.74±0.01)g/L。根据已有的动力学模型,对筛选获得的三株菌的动力学参数进行求解,由动力学试验得到菌丝体生物量,产物胞内多糖合成量,底物葡萄糖消耗量的动力学方程,方程反应了三者的变化规律及其相互关系。发酵动力学模型的建立对发酵过程如何进行有效调控、发酵工艺的最优化,以及最大限度地提高胞内多糖产量具有重大的意义。如卫功元等[20]研究谷胱甘肽不同温度下细胞生长动力学参数之间的内在联系,得到谷胱甘肽分批发酵过程中细胞浓度的变化同温度以及底物浓度之间的关系,并验证了模型的适用性。发酵动力学的研究有助于深入认识和掌握发酵过程,为确定最佳发酵工艺条件和建立发酵过程中菌体浓度、基质浓度、温度、pH、溶氧等工艺参数的控制方案打下一定的基础,为设计放大发酵规模和从分批发酵过渡到连续发酵提供一定的理论支持。发酵动力学模型的建立对于了解发酵过程中的动态行为,如菌丝体的生长,碳源和氮源的消耗等起到重要作用,为更加全面深刻地认识G0119发酵过程及大规模生产的发酵优化控制提供依据。
近年来,功能性食品的种类和数量不断增多,灵芝多糖的生物活性越来越受到人们关注,所以,进一步全面研究发酵动力学,了解其发酵机理,开发高附加值的灵芝多糖产品,最大限度地开发和利用灵芝多糖将成为未来的研究重点。
[1]刘佳,王勇.灵芝多糖的研究进展[J].现代药物与临床,2012,26(6):629-634.
[2]HSIEH C,TSENG M,LIU C.Production of polysaccharides from(CCRC 36041)under limitations of nutrients[J].Enzyme Microb Technol,2006,38(1-2):109-117.
[3]TANG Y J,ZHU L L,LIU R S,et al.Quantitative response of cell growth and Tuber polysaccharides biosynthesis by medicinal mushroom Chinese truffle Tuber sinense to metal ion in culture medium[J].Bioresource Technology,2008,99(16):7606-7615.
[4]袁术斌.三萜、多糖高产灵芝菌株育种及生物特性测定[D].南京:南京农业大学,2013.
[5]乔双逵.液态发酵过程发酵条件对灵芝形态及灵芝多糖合成影响研究[D].无锡:江南大学,2014.
[6]FANG Q H,TANG Y J,ZHONG J J.Significance of inoculation density control in production of polysaccharide and ganoderic acid by submerged culture of Ganoderma lucidum[J].Process Biochem,2002,37(12):1375-1379.
[7]王磊,宿红艳,王仲礼,等.八种灵芝菌株的比较及筛选[J].食用菌学报,2008,15(4):53-56.
[8]宋频然,常继东.灵芝胞外多糖高产菌株筛选及其深层发酵培养基的优化[J].食用菌学报,2003,10(2):9-16.
[9]ZHU L W,ZHONG J J,TANG Y J.Significance of fungal elicitors on the production of ganoderic acid and Ganoderma polysaccharides by the submerged culture of medicinal mushroom Ganoderma lucidum[J].Process Biochem,2008,43:1359-1370.
[10]TANG Y J,ZHONG J J.Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid[J].Enzyme Microb Technol,2002,31:20-28.
[11]TANG Y J,WEI Z,ZHONG J J.Performance analyses of a pH-shift and DOT-shift integrated fedbatch ferm entation process for the production of ganoderic acid and Ganoderma polysaccharides by medicinal mushroom Ganoderma lucidum[J].Bioresource Technol,2009,100:1852-1859.
[12]TANG Y J,ZHANG W,LIU R S,et al.Scale-up study on the fed-batch fermentation of Ganoderma lucidum for the hyperproduction of ganoderic acid and Ganoderma polysaccharides[J].Process Biochem,2011,46:404-408.
[13]MA D B,TANG K W,ZHANG S T,et al.Influence of nutritional and cultural parameters on polysaccharide formation by Ganoderma lucidum grown in submerged culture[J].Acta edulis fungi,2011,18(1):18-29.
[14]余素萍,张劲松,杨炎,等.灵芝胞内多糖高产菌株G7深层发酵工艺的研究[J].中国食用菌,2004,23(6):36-39.
[15]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[16]余志坚,陈传红,赵晋宇.DNS法检测食用菌多糖含量条件优化研究[J].江苏农业科学,2012,40(1):259-260.
[17]戚以政,汪叔雄.生化反应动力学与反应器[M].2版.北京:化学工业出版社,1999.
[18]王林松.苹果酒专用酵母的构建及发酵动力学研究[D].西安:西北农林科技大学,2007.
[19]马波.产多糖海洋菌的筛选与发酵动力学研究[D].南宁:广西大学,2006.
[20]卫功元,李寅,堵国成,等.温度对谷胱甘肽分批发酵的影响及动力学模型[J].生物工程学报,2003,19(3):358-363.
(责任编辑:程智强)
Screening and kinetic study of high-yield intracellular polysaccharide strains of Ganoderma lucidum in liquid submerged fermentation
WANG Guo-rui1,2,FENG Jie2,FENG Na2,TANG Chuan-hong2,ZHANG Jing-song2*
(1College of Food Science,Shanghai Ocean University,Shanghai 201306,China;2Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences;Key Laboratory of Southern Edible Fungi Resources and Utilization,Ministry of Agriculture;National Engineering Research Center of Edible Fungi;National R&D Subcenter for Edible Fungi Processing;Shanghai Key Laboratory of Agricultural Genetics and Breeding,Shanghai 201403,China)
The 72 strains of Ganoderma lucidum preserved in the laboratory were analyzed in terms of final biomass and synthetic intracellular polysaccharide indicators of liquid submerged fermentation,and 3 highest yield strains(G0041,G0045 and G0059)were selected according to intracellular polysaccharide yield,their yields being(2.39±0.06)g/L,(2.28±0.03)g/L and(2.74±0.12)g/L respectively and significantly different at 5%and 1%levels.The 3 strains’kinetic models were also established,obtaining their kinetic equations and equation parameters of mycelial growth,intracellular polysaccharide production and glucose consumption.The established equations provided a subsequent research basis for G.lucidum liquid submerged fermentation optimization and mass production.
Ganoderma lucidum;Intracellular polysaccharide;Liquid submerged fermentation;Fermentation kinetics
S567.3;S646
A
1000-3924(2016)06-010-08
2015-10-22
上海市科技兴农重点攻关项目[沪农科攻字(2016)第5-4号]
王国瑞(1989—),女,在读硕士,研究方向:药用真菌
*通信作者,E-mail:syja16@saas.sh.cn

