海南红树林湿地可培养硫酸盐还原菌的垂直分布特征研究
丁 海,姚素平,刘桂建,刘常宏
1.安徽省煤田地质局勘查研究院,合肥230088;2.中国科学技术大学地球与空间科学学院,合肥230026;3.南京大学地球科学与工程学院,南京210023;4.南京大学生命科学学院,南京210093
海南红树林湿地可培养硫酸盐还原菌的垂直分布特征研究
丁 海1,2,姚素平3*,刘桂建2,刘常宏4
1.安徽省煤田地质局勘查研究院,合肥230088;2.中国科学技术大学地球与空间科学学院,合肥230026;3.南京大学地球科学与工程学院,南京210023;4.南京大学生命科学学院,南京210093
利用厌氧微生物分离技术,对深度为1.2m的海南红树林湿地沉积物钻孔样品进行了分离培养,共获得11株厌氧sulfate-reducing bacteria(SRB)菌株。经显微观察和16S rDNA序列分析,可归纳为6个属,其中已经报道有芽孢杆菌属(Bacillus)、弧菌属(Vibrio)和梭状芽胞杆菌属(Clostridium),另外3个属分别为伯克霍尔德菌属(Burkholderia)、希瓦氏菌属(Shewanella)和海杆菌属(Marinobacterium)。不同属的细菌对硫酸盐还原的速率最低为14.71%,最高可达56.78%,并且以上6属11株菌都能将+6价的硫还原生成-2价硫,并与培养基中的Fe2+结合生成黑色FeS沉淀,而这些无定形FeS沉淀是生成黄铁矿的前体。红树林湿地SRB种群数量随沉积物深度的增加而降低,结合沉积物的地球化学分析测试结果表明,表层(0 cm)水界面的沉积物由于处于氧化-还原界面,氧气的周期性输入在一定程度上抑制了SRB的生长;随着深度增加(10~40 cm),充足的有机质、偏中性的pH值以及厌氧环境的增强,使得SRB种类和数量明显增加;而60 cm以下沉积物中因TOC含量降低,减少了微生物可利用的碳源,pH值明显降低,Na+和Ca2+离子浓度明显增加,这些因素都抑制了SRB的生长,使得深部沉积物中SRB的种类和数量显著减少。
红树林沼泽;氧化还原环境;可培养硫酸盐还原菌;硫酸盐还原率
红树林湿地一般分布于热带、亚热带低能海岸潮间带上部,受周期性潮水浸淹,以红树植物为主体的常绿灌木或乔木组成的海岸湿地,是中国重要的海岸湿地类型,主要分布在海南、广东、广西、福建、台湾、香港和澳门等省区(何斌源等,2007)。红树林湿地是地球上生产力最高的生态系统之一,具有很高的有机物质含量,在全球生态碳循环中起着重要作用。陆地生态系统的中10%的碳由红树林湿地输入海洋,海洋沉积物碳总量的15%来自红树林湿地(Jennerjahn and Ittekkot,2002;Dittmar etal.,2006)。红树林湿地是典型的厌氧湿地,由于海水的潮汐作用,其最显著的特征之一是沉积物中硫含量很高,且以循环快速的无机硫为主,尤其是硫酸盐(Alongietal.,1989;Giblin and Wieder,1992)的还原作用。由于其高硫酸盐特性,硫酸盐还原菌是有机物质分解代谢的主要参与者(Mackin and Swider,1989),其硫酸盐还原作用消耗红树林湿地中超过50%的有机物质(Jørgensen,1977),同时硫酸盐被还原为硫化氢,大部分的硫化氢与环境中铁离子发生反应,以FeS和FeS2化合物的形式沉积下来(Moeslund etal.,1994)。硫酸盐还原菌是红树林湿地有机物质主要分解者,在碳、硫循环过程中扮演重要角色,目前有关红树林湿地微生物的研究主要集中在微生物的种群结构和生物多样性分析、降解有机污染物微生物的筛选等方面(Jørgensen,1978;Bharathi et al.,1991;何斌源等,2007;钦佩,2006),而对于SRB的种群结构、分布特征以及在S循环中的作用等鲜有报道。开展红树林湿地SRB优势种群的分离、鉴定以及在S循环过程中的作用研究具有重要的生物学和生态学意义,并对深入了解SRB参与地球化学循环过程的机理具有一定参考价值。
1 样品和方法
1.1 背景和样品
红树林湿地样品取自海南岛东北部的东寨港(E110°32′-110°37′、N 19°51′-20°01′)的红树林自然保护区,研究区年年平均气温24.5℃,年均降水约1156.5mm(林鹏,1997)。2010年7月在红树林湿地中(图1)用PVC管(Φ140,长2m)钻孔取样1处,获得钻孔样品长度为1.2m,将采集好的样品密封并冷冻保存在-4℃的冰箱中。在实验室将钻孔样品进行分装,为了研究SRB种群数量及分布随垂直深度的变化,采集深度为0、10、20、30、40、60、90、120(cm)的集钻孔沉积物样品,每层取约200 g沉积物分别保存于2个50mL灭菌螺口离心管中,一份用于可培养硫酸盐还原菌的分离,另一份置于-80℃冰箱中冷冻保存。
1.2 红树林湿地沉积物理化性质的测试方法
沉积物理化实验测试主要包括pH、有机元素和金属离子等。首先利用梅特勒-托利多pH测量设备直接测试沉积物的pH值。取约100 g沉积物离心获得约5~10 mL孔隙水,利用离子色谱仪(Metrohm 790 IC)测定Cl-、SO42-、Na+、K+、Mg2+、Ca2+等离子浓度;称重约50 g沉积物冷冻干燥,称取其中的2 g干燥样品用玛瑙碾钵碾磨至200目,取100 mg粉末样品由Elementar®Vario MACROCHNS元素分析仪测试获得N、S、H等有机元素含量;另取其中1 g粉未样加入1N HCl在25℃反应24 h去除无机碳后由Elementar®元素分析仪测试TOC含量。取2 g混合均匀的粉末样品用环氧树脂胶结固定后抛光制成光片进行显微镜(Nikon)下观察和测量;另将约500mg沉积物样品喷上铂金后在扫描电子显微镜(SEM,JEOL)下观察样品中有机质和矿物的微观形貌特征,同时利用电子探针完成部分样品的微区成分分析。
1.3 沉积物样品中可培养SRB的种群数量测定
SRB筛选平板培养基的配方如下(Widdel and Bak,1992;Hines etal.,1999):NaCl,30 g/L;NaSO4,84 g/L;KCl,0.3 g/L;MgCl2·6H2O,2 g/L;MgSO4· 7H2O,1 g/L;CaCl2·2H2O,0.147 g/L;K2HPO4,0.2 g/L; NH4Cl,0.26 g/L;NaHCO3,1.68g/L;乳酸钠,10mmol/L,酵母膏,0.1g/L;Fe(NH4)2(SO4)2·6H2O,1.66g/L;琼脂20 g,定容至1 L,调节pH至7.0,选择5种不同底物的电子供体(A):乙酸钠,乙醇,乳酸钠均20mmol/L,苯甲酸钠5mmol/L,丙酸钠10mmol/L。
利用“Forma 1029厌氧培养系统”进行系列稀释涂布法分离培养沉积物中可培养的SRB菌群。称取沉积物样品1 g左右,置于50mL无菌塑料管中,加入无菌水至10mL,振荡10min,依次稀释至10-5、10-6、10-7倍;然后分别取稀释液200μl倾注至培养基平板上进行涂布培养,每个浓度的稀释液均涂布于5种培养基平板上,并且重复2个平板。用于分离SRB菌群的平板置于厌氧培养箱中,加热至35℃,在混合气体(10%H2,10% CO2,80%N2)和氮气以及钯催化剂共同的作用下进行厌氧培养6d,并记录各种底物平板上的细菌菌落形态及各种形态菌落的数目。
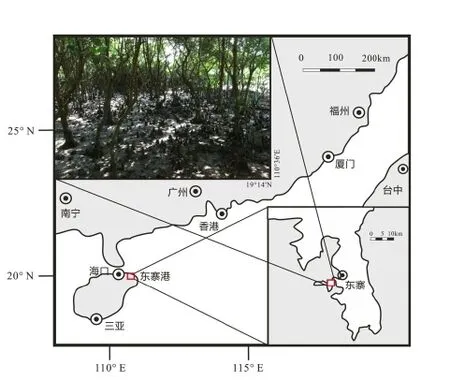
图1 红树林湿地沉积物采样点Fig.1 Map showing the location ofmangrove swamp sedimentsampling sites
1.4 可培养SRB菌种鉴定
厌氧培养至出现黑色菌落,挑取单菌落进一步重复接种操作直至得到纯化的菌株,然后进行16S rRNA基因序列的分析(Shuang etal.,2006)。首先将已纯化的SRB菌种划线接种至相应的固体培养基平板上,35℃培养6 d,提取细菌DNA,然后进行细菌16SrDNA目标片断的PCR扩增。16SrDNA序列扩增引物8f(5’→AGA GTT TGA TCC TGG CTCAG→3’)(Chen etal.,2008)和907r(5’→CCG TCA ATTCCT TTR AGT TT→3’)(Brinkhoff et al.,1998)由上海英骏生物技术有限公司合成。PCR反应试剂盒和纯化试剂盒分别购自北京天为时代科技有限公司和OMEGA公司。
PCR的反应体系(50μl)为10×PCR Buffer(含Mg2+)5μl;引物8f(10μmol/L)1μl,引物907r(10μmol/L)1μl;dNTP混合物(每种2.5mmol/L)4μl;挑取少量菌落作为模板DNA;Taq酶(5U·μl-1)0.5μl;ddH2O补足至50μl。PCR的反应条件为95℃5min;94℃30 sec,57℃1min,72℃1min,25个循环;72℃10min。4℃结束。1%琼脂糖凝胶电泳检测PCR产物后,用OMEGA公司生产的D6492-01 E.Z.N.A.TMCycle-Pure试剂盒纯化PCR产物。纯化后的PCR产物送至南京大学医药与生物技术国家重点实验室完成测序工作。采用序列图谱软件Chromas对所得序列进行核对,并使用BLASTN(Basic Local Alignment Search Tool,http:// www.ncbi.nlm.nih.Gov)在enBank+EMBL+DDBJ+ PDB基因库中对每株菌的16SrDNA序列进行同源性搜索和比对,以获得参考序列,然后应用MEGA4生物学软件构建系统进化树。
1.5 SRB硫酸根还原速率及还原产物的测定
将已测序鉴定的SRB纯化菌种接种至12mL相应的液体培养基中,在33℃的条件下静置培养。定时取1mL培养液测定硫酸根含量,30天后计算各SRB菌株的硫酸盐还原速率,每个样品设置3个重复。SRB菌培养产物经过冷冻干燥,密封保存后真空环境喷涂铂金,通过扫描电镜(JEOL JSM-6490)分析SRB还原产物的形貌特征,设置工作距离为10mm,电压20 kV。
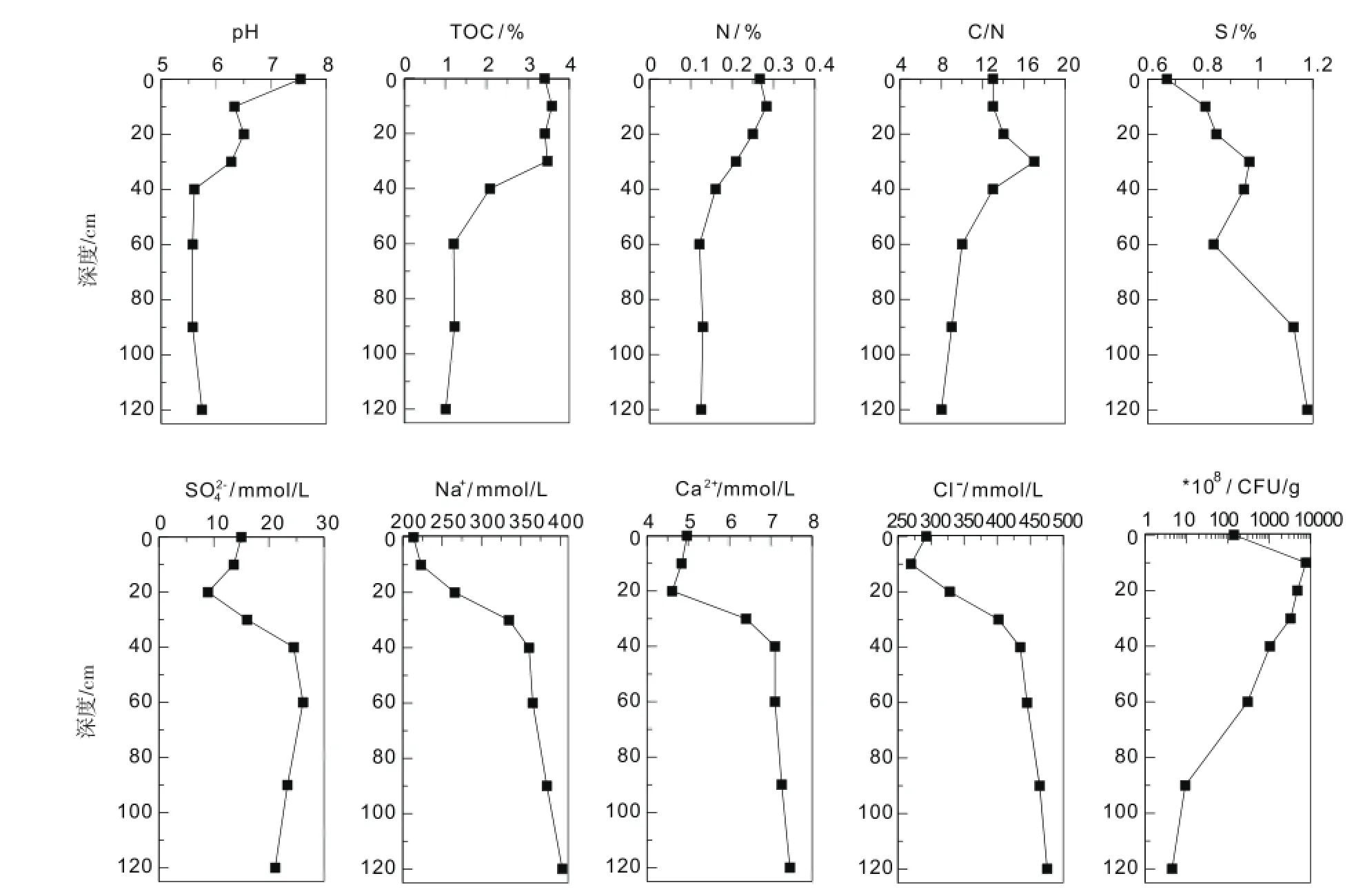
图2 红树林湿地沉积物不同深度元素含量、离子浓度及可培养SRB数量Fig.2 Changes in elementcontent,ion concentration,and thenumberof culturable SRB in the sedimentsof themangrove swampswith depth
2 实验结果
2.1 红树林湿地的理化性质
不同深度沉积物中的pH检测结果显示,表层(0 cm)pH最高,为7.53,随后降低到pH6.33(10 cm),并在60~90 cm时降到最低pH 5.57。
TOC含量在0~10 cm沉积物略有升高,10 cm之后含量呈现下降趋势,TOC在10 cm沉积物含量最高为3.58%,在120 cm含量最低为1.01%(图2)。N含量较低,在10 cm处达到最高值0.28%,并随着深度增加持续降低,最低值出现在60 cm深度约为0.12%。C/N比值在30 cm处出现最大值17,随后持续降低直至120 cm处的最低值8。S含量除了在60 cm略有降低外,整体呈现上升趋势,含量在0.67%~1.18%之间,在120 cm含量最高为1.18%。红树林湿地的SO42-除在20 cm处浓度最低(约8.91 mmol/L),皆在10mmol/L以上,平均约13.39mmol/L。Na+浓度持续增加,从0cm处的最低值213.4mmol/L,持续增高至120 cm达到最高值为402.6mmol/L。Ca2+浓度除了20 cm沉积物浓度最低为4.61mmol/L,整体呈现升高趋势,在120 cm深度达到最高值为7.46mmol/L。Cl-浓度在表层0~10 cm较低,20 cm以下样品明显增高,在120 cm达到最高位475.6mmol/L。SO42-浓度在20 cm以上出现降低趋势,而30 cm之后显著升高,60 cm处达到最大值(图2)。
红树林湿地中所有层位样品均有黄铁矿(FeS2)存在,呈星散状均匀分布在沉积物中,主要晶形有八面体自形晶和草莓状体(图3)。自形的黄铁矿一般较小,直径在2μm左右(图3 B),而草莓状黄铁矿的粒径一般达到10μm,也可见20μm以上的草莓状球体(图3C)。

图3 红树林湿地沉积物显微图像Fig.3 Microscopic imagesof sediments from themangrove swamps
2.2 可培养SRB的鉴定
通过选择性培养,形态学特征,参照细菌学鉴定手册,将获得的可培养厌氧菌株归为11株SRB(表1)。
11个菌株的16SrDNA-PCR片段大小约900 bp,测序结果经同源性分析,归为6个SRB属,主要属于变形菌门和厚壁菌门。其中8株归为变形菌门,3株归为厚壁菌门。在变形菌门中,有5株属于β-变形菌纲,3株为γ-变形菌纲,2株为芽孢杆菌纲,1株为梭状芽胞杆菌纲。

表1 SRB菌株的菌落形态特征描述Table 1 Themorphology description of SRB strains colony

图4 株菌系统发育树Fig.4 A phylogenetic tree of the bacterial strains isolated in this study
参考系统发育树(图4),菌株S1、S2、S3与伯克氏菌属(Burkholderia)的Burkholderia fungorum同源性为99%,菌株S7和S8与伯克氏菌属(Burkholderia)的Burkholderia fungorum同源性为100%(Witzig etal.,2007);菌株S9与溶血弧菌(Vibrio parahaemolyticus)的同源性为100%(Eiler and Bertilsson,2006);菌株S11与海杆菌属(Marinobacterium)同源性为94%(Kim etal.,2007);菌株S13与希瓦氏菌属(Shewanella)的同源性为96%(Nakagawa etal.,2006);菌株S15与梭状芽胞杆菌属(Clostridium)同源性为98%(Carlier et al.,2006);S4与芽孢杆菌属(Bacillus)的坚强芽孢杆菌(Bacillus firmus)同源性为99%,而S6的同源性达到100%(Gontangetal.,2007)。
2.3 SRB在沉积物中数量及垂直分布
采用系列稀释涂布平板法测定了各层沉积物中可培养SRB的种群数量。结果显示SRB的种群数量随沉积物深度而呈现先上升后下降的趋势(图2),最高数量出现在10 cm深度,为7.74×1011CFU/g土壤,在120 cm深度数量最低,为4.45×108CFU/g土壤。在不同沉积物中每个属的SRB分布不同,6个属11株SRB分布如表1所示。SRB主要分布60 cm以上。在沉积物最表层(0 cm)只有Shewanella分布;10 cm,20 cm,30 cm深度均有1株B.fungorum SRB分布;在40 cm处获得的可培养SRB的种类最多,其中2株B.fungorum、2株B. firmus、1株Marinobacterium。在60 cm处有1株Clostridium。在90 cm沉积物无可培养SRB分布。在120 cm有1株V.parahaemolyticus。伯克氏菌属B.fungorum在10~40 cm都有分布,是优势种群。
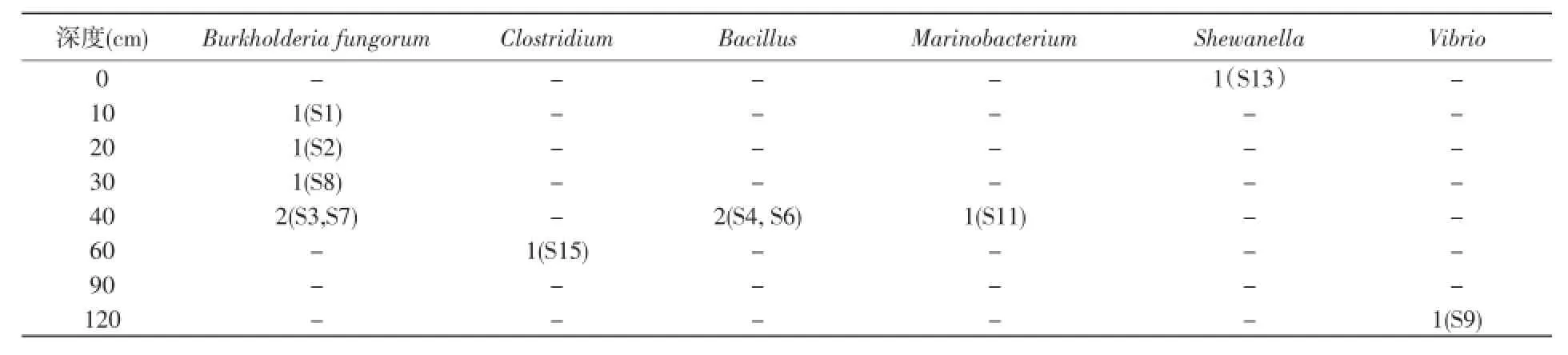
表2 红树林沉积物中11株可培养SRB的垂直分布Table 2 The verticaldistribution of the 11 strainsof culturable SRB in the sedimentsamples from mangrove swamps

图5 SRB还原产物SEM图像Fig.5 SEM imagesof the productsof SRB reduction
2.4 SRB硫酸根的还原速率及还原产物
培养30 d后,V.parahaemolyticus S9还原率速率最高,可达到56.78%,B.fungorum S1还原率为41.4%,B.firmus S4和Clostridium sp.S15为在30%~40%。Marinobacterium sp.S11和Shewanella sp.S13还原率较低,约15%(表3)。
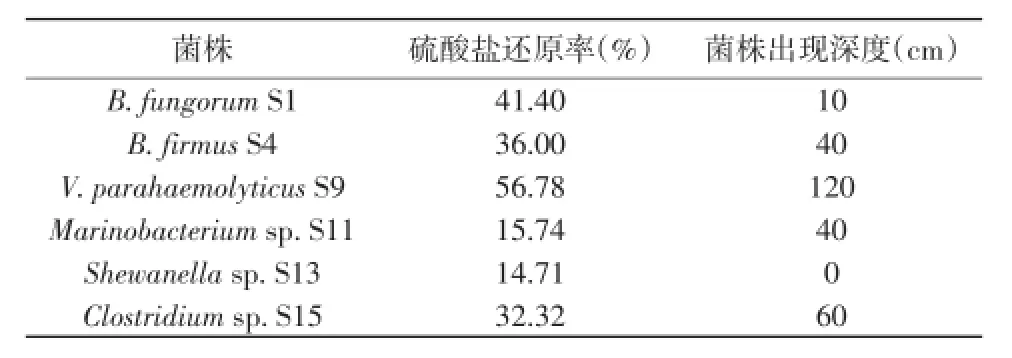
表3 可培养SRB的硫酸盐还原率Table 3 Sulfate reduction ratesof culturable SRB
模拟实验的过程中SRB产生大量有特殊臭味的H2S气体,在培养基中生成大量黑色沉淀,SEM能谱揭示沉淀产物主要由Fe和S元素组成(图5),Fe/S原子比介于1和2之间,如图6中#1和#2两个能谱点显示Fe/S原子比分别为0.9和1.5,表明在SRB的作用下,硫酸根离子被还原成S2-,而S2-与培养基中二价铁盐反应可生成不稳定无定形FeS黑色沉淀或由无定形FeS向稳定的黄铁矿(FeS2)转化的过渡产物,如马基诺矿(mackinawite;tetragonal FeS,即四方硫铁矿)、胶黄铁矿(greigite,cubic Fe3S4)和磁黄铁矿(pyrrhotite; e.g.,Fe7S8)等(Sweeney and Kaplan,1973;Wilkin and Barnes,1996)。
3 讨论
3.1 SRB的多样性
SRB是能够还原硫酸盐产生硫化氢的一类微生物的总称,是根据功能来定义的一类微生物,目前发现的SRB分布于19属,包括革兰氏阳性细菌,革兰氏阴性嗜微温菌和古生菌的嗜热硫还原细菌(Klepac-Cerajetal.,2004)。本研究采用传统的硫酸盐还原菌分离方法从红树林湿地分离到11株SRB,经鉴定属于6个属,分别为伯克霍尔德菌属、芽孢杆菌属、弧菌属、希瓦氏菌属、梭状芽胞杆菌属、海杆菌属。其中芽孢杆菌属、弧菌属(陈皓文,1999)和梭状芽胞杆菌属中的Clostridium tunisiense(Olfa Ben Dhia Thabetet al.,2004)已有相关报道为硫酸盐还原菌,如本次研究分离获得的Bacillus firmus S4,Bacillus firmus S6以及Vibrio parahaemolyticus S9等菌株。而伯克霍尔德菌、希瓦氏菌属和海杆菌属中至今未见有SRB菌种的报道。本研究能够分离获得新的SRB菌种的主要原因可能与本研究采样地的生境、采样沉积物部位以及分离手段有关。
3.2 可培养SRB在红树林湿地的垂直分布规律
对SRB种群数量的研究多数集中在浅层样品中,一般集中在5~20 cm深度(Niko Finke et al., 2007;Leloup etal.,2005)的沉积物,本研究自1.2m的沉积物钻孔中间隔一定距离取沉积物分析,用硫酸盐还原菌选择培养基在厌氧条件下系统地分离研究了SRB的种群数量,结果显示SRB的种群数量随沉积物深度而呈现先上升后下降的趋势,最高数量出现在10 cm深度,为7.74×1011CFU/g土壤,是表层(0 cm)的56倍;之后,SRB种群数量随深度增加而急剧下降,这与前人研究结果相类似,例如报道的北部湾东侧沉积物表层SRB数量是50~370 cm沉积物数量的5.1倍(Chen and Xu,1999)。
造成SRB这种分布的可能原因是:表层处于氧化还原界面,与氧气接触,并且硫酸盐含量较低,不利于厌氧还原环境的产生,使得SRB生长受到抑制,从而导致种群数量较低;而10 cm以下氧气含量降低,逐步向还原带过渡,且含有丰富的有机物质,TOC高达3.58%,从而为SRB的活动提供丰富的有机质来源。
浅钻样品其它深度SRB数量可能受到以下几方面因素的综合影响:(1)红树林有机物组成:红树林40 cm以上沉积物中高有机质含量促进了SRB的繁茂,底部沉积物中由于TOC含量以及C/N值的明显降低,表明其有机质来源较单一,以藻类体为主,这就可能极大地抑制了SRB的发育。此外,有研究表明红树林根际细菌数量变化受红树根以及根系分泌有机物质的影响(Moriarty et al.,1986),即植物根系释放的有机酸刺激了硫还原菌的活动,有助于促进硫酸盐还原过程(Alongi et al.,2001;张薇等,2005;张小李等,2000);(2)沉积物温度和pH值:Moosa等(2005)研究曾研究了温度对SRB还原活性的影响,结果表明培养温度在20~35°C之间时还原活性随温度升高而增加,但在40°C还原活性反倒降低,红树林沉积物温度在各沉积物可能是不同的,对SRB的影响也不同;沉积物pH值与SRB生长也密切相关,通常SRB生活的环境pH值在6~9之间(Willow and Cohen,2003),Kimura等(2006)报道SRB不能在pH值低于5.5的条件下生长。海南红树林湿地沉积物环境偏酸性,且随着沉积物深度增加pH值呈现下降趋势,10 cm沉积物pH值在6.33,40~120 cm沉积物pH小于6,最低在5.57,下层沉积物可能因酸度偏大对SRB生存造成不良影响;(3)沉积物孔隙水中的离子浓度:Na+浓度与SRB生长呈负相关(张小里等,1999),Ca2+对SRB生长及活性也有抑制作用(Maree and Strydom,1987)。海南红树林沉积物中Na+浓度随着沉积物深度增加而升高,在120 cm沉积物达到402.6mmol/L,Ca2+浓度在20 cm以后也呈逐渐升高趋势。
4 结论
(1)对红树林1处浅钻研究表明,该区域存在丰富的SRB,经过分离培养纯化共获得6属11株SRB菌株,其中已经报道的种属为芽孢杆菌属、弧菌属和梭状芽胞杆菌属,新发现的种属为伯克霍尔德菌属、希瓦氏菌属和海杆菌属。
(2)该红树林钻孔中,SRB在沉积物中的垂直分布受到沉积物理化特征影响因素导致差异较大,如上部沉积物(40 cm)高TOC值和偏中性的pH值促进了SRB的生长,而40 cm以下沉积物中TOC含量明显降低,偏酸性的pH值(pH<6)和显著增加的Ca2+、Na+离子浓度可能抑制了SRB的生长。
(3)SRB菌种模拟培养实验显示V.parahaemo⁃lyticus S9还原率速率最高,可达到56.78%,Mari⁃nobacterium sp.S11和Shewanella sp.S13还原率较低,约15%。6属11株SRB均能将+6价的硫还原生成-2价硫,并与培养基中的Fe2+结合生成无定形FeS黑色沉淀,而这些FeS沉淀为沉积物中出现大量黄铁矿提供了可能。
Re ferences)
陈皓文.1999.胶州湾潮间带和沿岸区硫酸盐还原菌含量分布[J].海洋环境科学,18(2):27-30.
何斌源,范航清,王瑁,等.2007.中国红树林湿地物种多样性及其形成[J].生态学报,27(11):4859-4870.
林鹏.1997.中国红树林生态系[M].北京:科学出版社:1-318.
钦佩.2006.海滨湿地生态系统的热点研究[J].湿地科学与管理,2(1):7-11.
张小里,刘海洪,陈开勋,等.1999.硫酸盐还原菌生长规律的研究[J].西北大学学报(自然科学版),29(5):397-402.
张小李,陈志昕,刘海洪.2000.环境因素对硫酸盐还原菌生长的影响[J].中国腐蚀与防护报,20(40):224-229.
张薇,魏海雷,高洪文.2005.沉积物微生物多样性及其环境影响因子研究进展[J].生态学杂志,24(1):48-52.
Alongi D M.1989.Benthic processes across mixed terrigenous-carbonate sedimentary facies on the central Great Barrier Reef continental shelf [J].Continental ShelfResearch,9:629-663.
Alongi D M,Wattayakorn G,Pfitzner J,et al.2001.Organic Carbon Accumulation and Metabolic Pathways in Sediments of Mangrove Forests in Southern Thailand[J].Marine Geology,179(1-2):85-103.
Bharathi P A L,Oak S and Chandramohan D.1991.Sulfate-reducing bacteria from mangrove swamps 2.Their ecology and physiology[J]. Oceanologica Acta,14(2):163-171.
Brinkhoff T,Santegoeds CM and Sahm K.1998.A polyphasic approach to study the diversity and vertical distribution of sulfur-oxidizing Thiom icrospira species in coastal sediments of the German Wadden Sea [J].Applied and EnvironmentalMicrobiology,64:4650-4657.
Carlier JP,Manich M,Loiez C,et al.2006.First isolation of clostridium amygdalinum from a patientwith chronic osteitis[J].J.Clin.Microbiol,44(10):3842-3844.
Chen Haowen and Xu Jiasheng.1999.Content of sulphate-reducing bacteria in the sediment on the east side of Beibu Gulf and its significance[J]. JournalofGuangxiAcademy ofSciences,15(3):103-107.
Chen Yuqing,Ren Guanju,An Shuqing,et al.2008.Changes of bacterial community structure in copper mine tailings after colonization of reed phragmites communis[J].Pedosphere,18(6):731-740.
Dittmar T,Hertkorn N,Kattner G,et al.2006.Mangroves,amajor source of dissolved organic carbon to the oceans[J].Glob.Biogeochem.Cycles, 20:1012-1029.
Eiler A and Bertilsson S.2006.Detection and quantification of Vibrio populations using denaturant gradient gelelectrophoresi[J]Journal of MicrobiologicalMethods,67(2):339-348.
Giblin A E and Wieder R K.1992.Sulphur Cycling in Marine and Freshwater Wetlands[M].SCOPE 48,Chichester:John&Sons:85-124.
Gontang E A,FenicalW and Jensen P R.2007.Phylogenetic diversity of gram-positive bacteria cultured from marine sediments[J].Applied and EnvironmentalMicrobiology,73(10):3272-3282.
Hallberg K B and Johnson D B.2006.Sulfidogenesis in low p H(3.8-4.2) media by amixed population ofacidophilic bacteria[J].Biodegradation,17(2):57-65.
Hines M E,Evans R Sand Genthner B R S.1999.Molecular phylogenetic and biogeochem ical studies of sulfate-reducing bacteria in the rhizosphere of Spartina alterniflora[J].Applied and Environmental Microbiology,65:2209-2216.
Kim H,Choo Y J,Song J,et al.2007.Marinobacterium litorale sp.nov.in the order Oceanospirillales[J].International Journal of Systematic and EvolutionaryMicrobiology,57:1659-1662.
Jennerjahn T C and Ittekkot V.2002.Relevance of mangroves for the production and deposition of organic matter along tropical continental margins[J].Die Naturwissenschaften,89:23-30.
Jørgensen B B.1977.The sulfur cycle of a coastal marine sediment[J]. Limnology and Oceanography,22:814-831.
Jørgensen B B.1978.A comparison of methods for the quantification of bacterial sulfate reduction in coastal marine sediments[J]. Geomicrobiology,1:49-64.
Kimura S,Hallberg K B and Johnson D B.2006.Sulfidogenesis in lowp H (3.8-4.2)media by a mixed population of acidophilic bacteria[J]. Biodegradation,17(2):57-65.
Klepac-Ceraj V,Bahr M and Crump B C.2004.High overall diversity and dominance of microdiverse relationships in salt marsh sulphatereducingbacteria[J].EnvironmentalMicrobiology,6:686-698.
Leloup J,Petit F,Boust D,et al.2005.Dynamics of sulfate-reducing microorganisms(dsrAB genes)in two contrastingmud flats of the Seine Estuary(France)[J].M icrobial Ecology,50:307-314.
Mackin JE and Swider K T.1989.Organic matter decomposition pathway and oxygen consumption in coastal marine sediments[J].Journal of MarineResearch,47:681-716.
Maree JP and Strydom Wilma F.1987.Biological sulphate removal from industrial effluents in an upflow packed bed reactor[J].Water Research,21(2):141-146
Moeslund L,Thamdrup B and Jørgensen B B.1994.Sulfur and iron cycling in a coastal sediment:radiotracer studies and seasonal dynamics[J]. Biogeochem istry,27:129-152.
Moosa M,NematiM and Harrison ST L.2005.A kinetic study on anaerobic reduction ofsulphate.Part II.Incorporation of temperature effects in the kineticmodel[J].ChemicalEngineering Science,60(13):3517-3524.
Moriarty D JW.1986.Bacterial productivity in ponds used for culture of penaeid prawns[J].M icrobial Ecology,12:259-269.
Nakagawa T,TakaiK,SuzukiY,et al.2006.Geomicrobiological exploration and characterization of a novel deep-sea hydrothermal system at the TOTO caldera in the Mariana Volcanic Arc[J].Environmental Microbiology,8(1):37-49.
Niko Finke,Verona Vandieken and Bo Barker Jørgensen.2007.Acetate, lactate,propionate,and isobutyrate as electron donors for ironand sulfate reduction in Arcticmarine sediments,Svalbard[J].Fems Microbiology Ecology,59:10-22.
Olfa Ben Dhia Thabet,Marie-Laure Fardeau,Catherine Joulian,etal.2004. Clostridium tunisiense sp.nov.,anew proteolytic,sulfur-reducingbacterium isolated from an olivemillwastewater contaminated by phosphogypse[J]. Anaerobe,10:185-190
Shuang J L,Liu C H and An SQ.2006.Some universal characteristics of intertidalbacterial diversity as revealed by 16S rRNA gene-based PCR clone analysis[J].Journal of Microbiology and Biotechnology,16(12):1882-1889.
Sweeney R E and Kaplan IR.1973.Pyrite framboid formation-laboratory synthesis and marine sediments[J].Economic Geology,68(5):618-634.
W iddel F and Bak F.1992.The Prokaryotes:Gram-negative Mesophilic Sulfate-reducing Bacteria[M].New York:Springer:3352-3378.
W ilkin R T and Barnes H L.1996.Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species[J]. Geochimicaet Cosmochim ica Acta,60(21):4167-4179.
Willow M A and Cohen R RH.2003.pH,dissolved oxygen,and adsorption effects on metal removal in anaerobic bioreactors[J].Journal of EnvironmentalQuality,32:1212-1221.
Witzig R,Aly H A,Strompl C,etal.2007.Molecular detection and diversity of novel diterpenoid dioxygenase DitA1 genes from proteobacterial strains and soil samples[J].Environmental Microbiology,6(5): 1202-1218.
Diversity and VerticalDistribution ofCu lturab leSulfate-reducing Bacteria in CoastalMangroveSwamps from Hainan Island,China
DING Hai1,2,YAO Suping3*,LIU Guijian2,Liu Changhong4
1.Exploration Research Institute,AnhuiProvincial Bureau ofCoalGeology,Hefei230088,China; 2.Schoolof Earth and Space Science,University of Scienceand Technology ofChina,Hefei230026,China; 3.SchoolofEarth Sciencesand Engineering,Nanjing University,Nanjing210023,China; 4.Schoolof Life Sciences,Nanjing University,Nanjing210093,China
Utilizing an anaerobic method of isolating microorganisms,we identified and cultured a total of 11 strains of anaerobic sulfate-reducing bacteria(SRB)from sediment samples collected from 1.2 m-deep mangrove swamps in Hainan.These SRB were classified into 6 genera based on theirmorphology thatwas observed under amicroscopy and through sequence analysis of their 16S ribosomal DNA(16S rDNA).These include three reported genera:Bacillus,Vibrio,and Clostridium.They also include three newly discovered genera:Burkholderia,Shewanella,and Marinobacterium.The minimum rate of sulfate reduction of these bacteria was 14.71%,and themaximum ratewas 56.78%.Moreover,all the 11 strainswere able to reduce sulfur S6+to S2-,which was subsequentlybound with iron(Fe2+)to produceblack iron(II)monosulfide(FeS)precipitate.FeSprecipitate is the precursorofpyrite.The population of SRB in themangrove swamps decreased with depth.Geochemical analysis of the sediments reveal that the oxidation and reduction interfacewas located at interface of sedimentand water(0 cm),and the periodic inputof oxygen partially inhibited the growth of SRB. In contrast,as the depth of sediment increased(10-40 cm),an adequate supply oforganicmatter,a near-neutral pH,and an enhanced anaerobic environment led to a significant increase in both the number of SRB strains and the population of SRB.However,at depths greater than 60 cm,the total organic carbon(TOC)content in the sediment decreased,which reduced the carbon source available for microorganisms.In addition,both a significant reduction in pH levels and significant increases in sodium cation(Na+)and calcium cation(Ca2+)concentrations inhibited SRB growth,greatly decreasing the number of SRB strains and the total SRB population in the deep sediments.Thegeochemical characteristicsof the sedimentswere themain factorsaffecting vertical distribution of SRB species in themangrove swamp samples.
mangrove swamps;redox condition;culturable SRB;sulfate reduction rate;sulfur cycle;pyrite.
YAO Suping,Professor;E-mail:spyao@nju.edu.cn
P593
A文献标识码:1006-7493(2016)04-0621-10
10.16108/j.issn1006-7493.2016043
2016-03-25;
2016-08-11
国家自然科学基金项目(41372127;40973051);及安徽省博士后基金项目(2016B121)联合资助
丁海,男,1983年生,博士后,研究方向为有机地球化学;E-mail:dna75@163.com
*通讯作者:姚素平,博士,教授,研究方向为有机地球化学;E-mail:spyao@nju.edu.cn

