气肿疽梭菌HLJ-1株分离鉴定及系统进化分析
周金玲,吴丹丹,周玉龙,朱战波,朴范泽
(黑龙江八一农垦大学动物科技学院,大庆 163319)
气肿疽梭菌HLJ-1株分离鉴定及系统进化分析
周金玲,吴丹丹,周玉龙,朱战波,朴范泽
(黑龙江八一农垦大学动物科技学院,大庆 163319)
2015年6月,内蒙古某牛场爆发疑似气肿疽疫病,为了有效防控该病,无菌采集炎性气肿的肌肉进行需氧和厌氧菌的分离鉴定和药敏试验,结果在厌氧条件下从患病牛肌肉内分离出无荚膜,革兰氏染色呈阳性两端钝圆的杆菌。经表型特征和生化鉴定表明分离菌株与气肿疽梭菌相符,进一步对16S rDNA通用引物扩增得到的基因测序结果分析表明,其与气肿疽梭菌株同源性最高达95.8%,毒素检测表明含有α毒素。以上结果证明该菌株为气肿疽梭菌。分离菌株对蒽诺沙星、环丙沙星等药物高度敏感。为该病的防制提供了理论依据和物质基础。
牛;气肿疽梭菌;分离;鉴定
气肿疽梭菌(Clostridium chauvoei)又名费氏梭菌,俗称黑腿病杆菌,是气肿疽(Gangraena emhhysematosa)的病源。此病主要是反刍动物的一种急性败血性传染病,以皮下组织和肌肉丰满部位发生气性肿胀为特征。病变肌肉常呈暗红棕色到黑色[1]。本病具有一定的区域性,但没有明显的季节性。一般放牧牛以夏季多发,舍饲牛则一年四季均可发生[2]。其呈散发或地方性流行,牛发病一般多呈急性经过,食欲和反刍减少或停止,体温升高,精神不振,轻度跛行,触诊肿胀部位有捻发音[3]。
2015年6月,内蒙古某牛场2周内死亡了4头牛。该牛场位于大山中,周围人烟稀少,主要饲养断奶后的犊牛。冬季舍饲,5月中下旬至10月中旬在草原上放牧。2013年春季曾发生过气肿疽,当时死亡8头小牛,确诊后注射气肿疽疫苗,每年春季注射一次。该牛场有两个放牧场,在其中一块放牧场地放牧时发生,另一牛群正常。今年发病牛日龄在9月龄左右,尚未放牧,仅在舍饲期间就发生了。突然发病,来不及治疗。均表现为前肢肩关节(肘部)肌肉肿胀,然后迅速蔓延,向小腿及背部,可见肘部皮肤明显突起,用手指按压可听到清晰地捻发音。病牛初期跛行,患病肢不敢着地,精神沉郁,厌食,体温升高达41℃。后期瘫痪,病程2~3 d死亡。病中消瘦。剖检观察切开的肘部肿胀肌肉可见皮下炎性水肿,呈黄色胶冻状,肌肉出血,呈黑色。肌肉间有蜂窝状空泡。皮下胶冻状浸润至腕关节上部至颈及脊柱。脾脏未见异常。肾脏表面有出血,白色坏死灶。肝脏肿大。胆囊肿大。胆汁呈绿色。小肠黏膜增生。肺脏左侧心叶有化脓灶,呈化脓性肺炎及小叶性肺炎。另一侧未见异常。
从病死牛的肌肉内分离到一种呈梭状或者汤勺状的革兰氏染色阳性杆菌。同时对分离菌株进行生物学特征性检查,生化试验,16S rDNA系统进化分析,以及药物敏感性试验,结果证实该分离株属于气肿疽。现将试验结果报告如下。
1 材料
1.1 病料
2015年,内蒙古某牛场爆发疑似气肿疽疫病,无菌采集新病死牛的肌肉,肠。标记并放入无菌培养皿中。
1.2 培养基
新鲜的10%的绵羊血液营养琼脂培养基在无菌条件下按常规方法制备,购自青岛高科园海博生物技术有限公司。厌气肝汤培养基自己制作。
1.3 主要试剂
Premix Taq和DNA Marker(2000)均购自TaKaRa公司;上下游引物与琼脂糖购自上海生工;琼脂糖凝胶DNA回收试剂盒购自杭州爱思进生物有限公司。细菌微量生化反应管和常用药敏试纸均购自杭州天和微生物试剂有限公司,批号分别为:140311和150401。 1.4试验动物
健康昆明系小白鼠5只,30~40 g,购自哈药集团黑龙江省生物制品一厂。
2 方法
2.1 细菌分离培养
将肌肉和肠内容物分别接种于新制备的血液营养琼脂培养基中,在焦性没食子酸和氢氧化钠反应缸里完全厌氧的条件下培养。并且将病变的肌肉组织接种于厌气肝汤中,封上石蜡。37℃培养12~24 h。观察血液琼脂培养基菌落的形态及生长状况,观察厌气肝汤浑浊产气情况,在血液琼脂培养基上挑取可疑菌落纯培养。
2.2 生化试验
选取葡萄糖、蔗糖、靛基质、尿素、甘露醇和半乳糖等15种微量生化反应管。抽取浑浊的厌气肝汤1 mL于离心管中,12 000 rpm离心1 min,弃掉上清,用灭菌接种环蘸取管底沉淀并分别接种于各反应管中,上部用石蜡封上。37℃恒温箱中培养24~48 h后观察结果。
2.3 细菌16S rDNA PCR扩增以及鉴定
2.3.1 引物设计16S rDNA分子大小适中,在结构与功能上具有高度的保守性和存在的普遍性,人们根据这些保守区,设计PCR通用引物,这样可以用来扩增出所有细菌的16S rDNA片段。若在可变区设计特异性引物,则可区分不同细菌。它既能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列。根据Lane等的报道合成扩增细菌16S rDNA的通用引物扩增的DNA片段约1.7kb,引物如下[4-5]:
上游引物5′-AGAGTTTGATCCTGGCTCAG-3′8-27
下游引物5′-ACGGTTACCTTGTTACGACTT-3′1512-1492
α、β、ε和l 4种毒素的16S rDNA的通用引物扩增的DNA片段分别为324 bp、196 bp、655 bp和446 bp。
α毒素上游引物5′-GCTAATGTTACTGCCGTTGA-3′
下游引物5′-CCTCTGATACATCGTGTAAG-3′
β毒素上游引物5′-GCGAATATGCTGAATCATCTA-3′
下游引物5′-GCAGGAACATTAGTATATCTTC-3′
ε毒素上游引物5′-GCGGTGATATCCATCTATTC-3′
下游引物5′-CCACTTACTTGTCCTACTAAC-3′
l毒素上游引物5′-ACTACTCTCAGACAAGACAG-3′
下游引物5′-CTTTCCTTCTATTACTATACG-3′
2.3.2 细菌基因组DNA提取参照参考文献[6]进行细菌基因组制备。
2.3.3 菌体DNA制备和PCR反应煮沸法进行细菌基因组制备。采用25μL反应体系:PremixTaq12.5 μL,上下游引物各为0.5 μL,DNA模版2 μL,补充去离子水至总体积为25 μL。反应程序为95℃预变性5 min,25个循环(94℃变性30 s,52℃退火1 min,72℃延伸2 min),72℃延伸10 min。用EB染色1%的琼脂糖凝胶,在1×TAE电泳液中电泳,在凝胶成像系统(Gel Doc 2000)中观察扩增结果。
2.3.4 PCR产物16S rDNA测序分析将大量扩增分离株16S rDNA,用DNA凝胶回收试剂盒(Biospin Gel Extraction Kit)回收DNA。北京华大基因研究中心测序,将序列进行同源性的百分率比较,应用DNAStar软件中的ClustaⅡ方法。绘制系统进化树,然后把分离株与其他菌株的亲缘关系进行分析。
2.3.5 PCR毒力检测与PCR扩增细菌16S rDNA相同的反应体系,测定是否含有α、β、ε、l毒素。
2.4 药敏试验
取蒽诺沙星、米诺环素、环丙沙星、卡那霉素和万古霉素等药敏片进行药敏试验,实验按常规方法操作。37℃完全厌氧条件下培养24 h后,观察结果。
2.5 动物接种试验
将在厌气肝汤中分离得到的菌液注射到3只小鼠体内各0.5 mL,1只作为对照只注射0.5 mL厌气肝汤。记录小鼠精神状态、毛色、进食进水情况、死亡数量及死亡时间。
3 结果与分析
3.1 细菌学检查结果
经血液营养琼脂培养基厌氧条件下培养24 h后,可见在培养基上长出大的、透明并有β溶血的菌落(见图1);在厌气肝汤培养基中,肉汤均匀浑浊产气。革兰氏染色阳性、杆状。无荚膜和芽孢(见图2)。

图1 Clostridium chauvoei在培养基厌氧条件下培养24 h的菌落形态Fig.1 Colonial morphology of Clostridium chauvoei cultured 24 hour under the condition of anaerobic of agar medium with blood

图2 Clostridium chauvoei革兰氏染色镜检结果Fig.2 Results of Gram staining for Clostridium chauvoei
3.2 生化试验结果
经鉴定得到的结果见表1。可见大部分生化与参考文献[7]结果相符。

表1 生化试验结果Table 1 The results of biochemistry
3.3 细菌16S rDNA PCR扩增以及毒力测定结果
3.3.1 细菌16S rDNA PCR扩增结果分离株应用PCR方法扩增出分离菌株的部分16S rDNA基因片段,目的片段大小约为1.7 kb,结果见图3。

图3 分离菌株16S rDNA PCR扩增结果Fig.3 Results of isolated strains 16S rDNA
3.3.2 分离菌株PCR毒力测定1和2为α毒素320 bp和β毒素190 bp的DNA片段。3和4为ε毒素和l毒素没有目的片段。见图4。

图4 分离菌株毒素测定结果Fig.4 Results of isolated strains toxin
3.3.3 分离菌株16S rDNA基因片段测序结果同源性比较结果经测序得出结果进行同源性比较分析发现分离株16S rDNA基因序列与C.chauvoei2585,C. chauvoeiATCC10092T,C.chauvoeiCC4,C.chauvoeiCC7和C.chauvoeiisolate CC7同源性最高,相似性都在90%以上,最高达95.8%。与C.haemolyticum菌株和C.septicum等菌株同源性较远,分离株也与其他的菌株差异性较大。各分离菌株与GeneBank上菌株16S rDNA基因序列同源性比较结果见图5。

图5 各个菌株之间16S rDNA基因序列比较结果Fig.5 The results of 16S rDNA genes sequence comparison between different strains
3.3.4 系统进化树分析分离菌株16S rDNA基因片段测序后的结果应用DNAStar软件中ClustaⅡ方法将测序结果与GeneBank上的相似序列绘制系统进化树后进行分析发现,分离株16S rDNA基因序列虽与C.chauvoei菌株和C.septicum菌株在同一群,但与和已经报道的C.chauvoeiCC7、C.chauvoeiisolateCC7、C.chauvoeiCC4C.chauvoei2585和C.chauvoeiATCC10092T菌株亲缘关系还是比较远;与C. perfringens菌株和C.haemolyticum等菌株的亲缘关系更远。详细的系统进化树分析结果见图6。
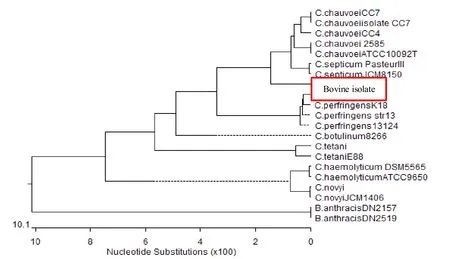
图6 分离菌株与GeneBank上菌株之间16S rDNA基因进化分析结果Fig.6 The analysis result of gene evolution about 16S rDNA between the isolated strains and that in GeneBank
3.4 药敏试验
根据药物敏感性试验确定分离菌株对环丙沙星、蒽诺沙星药物高度敏感,而对克林霉素、四环素、先锋必等药物具有耐药性。
3.5 动物接种试验
4只小白鼠接种分离菌株后,没有发生死亡。一个星期内均没发现异常。
4 小结与讨论
实验成功分离到气肿疽梭菌。并且详细介绍了引起气肿疽的病例;药物敏感性试验表明分离的Clostridium chauvoei对蒽诺沙星、环丙沙星等药物高度敏感。而对四环素、万古霉素、杆菌肽等具有耐药性。动物试验小鼠并没有死亡,是由于本菌对豚鼠最易感,仓鼠也易感,而小鼠次之[8]。通过进化分析该分离株虽与已被报道的气肿疽同源性高,但还存在一定的差异。所以,还需对这一梭菌做进一步分析。研究是否现有疫苗对该菌株具有免疫原性或与其他菌株存在哪些差异,并为该病的疫苗研制提供了候选株,用于防控该病具有重要意义。
2006年在日本出现了人感染气肿疽导致死亡的事件,虽不能确定气肿疽是否会感染免疫力正常的人类。但有效的做好防护措施也是非常有必要的[9]。气肿疽梭菌的芽孢具有很强的抵抗力,可以在土壤里存活5年以上。腐尸中也可存活3个月[10]。对于患病地区,畜舍、场地、用具等需全面消毒,尸体以及被污染的饲料和粪尿要一起进行焚毁与深埋。牛群转移放牧地点并进行紧急免疫接种[11]。只有建立比较健全的气肿疽综合防治体系,并做好防治工作,才能有效控制和减少该病的发生[12]。如遇本病要提早治疗,避免造成病牛死亡,带来经济损失。该牛群可以采用蒽诺沙星灌服或磺胺类药物的使用。尽量不要再去那个牧场放牧。
[1]陈承平.兽医微生物学第[M].4版.北京:中国农业出版社,2007.
[2]王茂,王耀平,樊天喜.牛气肿疽疫情的防制报告[J].畜牧兽医杂志,2013,32(1):121.
[3]陈莹莹,金鑫,姜成国.气肿疽梭菌菌体抗原分析[J].安徽农业科学,2012,40(17):9267-9269.
[4]Lane D J.16S/23S rRNA Sequencing.In:Stackebrandt E,Goodfellow.ed.Nucleic acid techniques in bacterial systematics[J].Chichester:JohnWiley&Sons,1991,23:115-147.
[5]Marcelino T,Suzuki,Stephen J.Giovannoni bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J].American Society for Micro-biology,1996(2):625-630.
[6]奥斯伯FM,金斯顿RE,赛德曼JG,等.精编分子生物学实验指南[M].北京:科学出版社,2005.
[7]孙怀民,裴树坤,孙立明.牛气肿疽病的诊治[J].现代畜牧兽医,2012(9):51-52.
[8]李一经.兽医微生物[M].北京:高等教育出版社,2011.
[9]KIJIMA-TANAKA M,TAMURA Y,SUZUKI S,et al. Antigenie mimiery of Clostridium chauvoei flagella by polyelonal antiidiotypic antibodies[J].Med Microbiol, 1994(2):225-235.
[10]邢思毅,倪宏波,周玉龙,等.牛群爆发口腔黏膜溃疡类疾病的实验室诊断[J].黑龙江八一农垦大学学报,2015,27(4):46-49.
[11]朱龙泉,李秀眉,张新权.一起牛气肿疽病的诊治[J].畜牧兽医杂志,2009,28(5):93.
[12]云巾宴,任春宇,车达.气肿疽的病因分析及防治措施[J].黑龙江畜牧兽医,2015(16):89-91.
Isolation,Identification and Phyletic Evolution Analysis of Clostridium chauvoei HLJ-1 Strain
Zhou Jinling,Wu Dandan,Zhou Yulong,Zhu Zhanbo,Pao Fanze(College of Animal Science and Technology,Heilongjiang Bayi Agriculture University,Daqing 163319)
In June,2015,a suspected Blackleg disease broke out in a certain dairy farm in Inner Mongolia.To effectively prevent and control this disease,an inflammatory muscle was aseptic collected to isolate and identify aerobic and anaerobic bacteria and then was performed drug sensitive test.The gram-positive decapsulated bacilli with both ends obtus was isolated from the muscle of the diseased cattle.The phaenotype features and the results of biochemistry experiments showed that the obtained bacterium was very similar to Clostridium chauvoei.The result of 16S rDNA sequence analysis exhibited its homology with C.chauvoei from GenBank was up to 95.8%.Toxicity testing indicated that it contained toxins α.These findings suggested that this strain was Clostridium chauvoei.Drug testing showed that it was hypersensitive to enrofloxacin base and ciprofloxacin.This study provided theoretical basis and material basis for prevention and control of this disease.
bovini;Clostridium chauvoei;isolation;identification
S855.1+2
A
1002-2090(2016)06-0083-06
10.3969/j.issn.1002-2090.2016.06.017
2015-09-10
黑龙江省教育厅项目(12531471)。
周金玲(1992-),女,黑龙江八一农垦大学动物科技学院2015级硕士研究生。
周玉龙,男,副教授,E-mail:zhouyulong1980@163.com。

