添加不同甲烷抑制剂对绵羊瘤胃发酵指标及甲烷产量的影响
杨坤,姜宁,张爱忠,吴琼,于治国,李凌岩,解堂东,王发亮
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.五大连池风景区大庆石油管理局农场)
添加不同甲烷抑制剂对绵羊瘤胃发酵指标及甲烷产量的影响
杨坤1,姜宁1,张爱忠1,吴琼1,于治国2,李凌岩1,解堂东1,王发亮1
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.五大连池风景区大庆石油管理局农场)
为探究不同甲烷抑制剂对绵羊瘤胃发酵指标及甲烷产量的影响,试验选取16只体况良好,体重相近(28±1.0 kg)安装永久性瘤胃瘘管的绵羊,随机分为4组,对照组饲喂基础日粮,试验组A、B、C组分别在基础日粮中添加延胡索酸40 mg·kg-1、蒽醌20 mg·kg-1和大蒜素300 mg·kg-1。试验结果表明:与对照组相比,日粮中添加甲烷抑制剂对绵羊饲喂后9 h内瘤胃pH值没有显著影响(P>0.05),显著升高了大蒜素组12 h的pH值(P<0.05);添加不同甲烷抑制剂对瘤胃内氨态氮、BCP浓度具有显著影响,其中显著提高了大蒜素组的瘤胃氨氮浓度(P<0.05)和菌体蛋白的含量(P<0.05);添加三种不同甲烷抑制剂显著降低了瘤胃内甲烷产量,添加大蒜素6 h后有最为明显的效果,降低幅度最高为38.28%(P<0.05)。
甲烷抑制剂;瘤胃发酵指标;甲烷;绵羊
Yang Kun1,Jiang Ning1,Zhang Aizhong1,Wu Qiong1,Yu Zhiguo1,Li Lingyan2,Xie Tangdong1,Wang Faliang1
(1.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;
2.Petroleum Adminstration Bureau Farm of Wadalianchi Scenic Area)
近年来,由于空气中CH4、CO2等一些气体浓度的上升而产生的温室效应已经备受世界各国的高度重视。虽然甲烷在大气中的浓度只是CO2的0.49%倍,但是甲烷气体的单位体积所影响的温室效应却是CO2的30倍[1]。全世界每年畜牧业甲烷的排放量占总甲烷排放量的97%,其中反刍动物所产生的甲烷的产量高达7.7×107t,反刍动物排放的甲烷气体占据每年扩散到大气中的甲烷气体总量的15%[2]。而且反刍动物所排放的甲烷气体还以每年1%的速度快速的上升[3]。所以,在提高饲粮的转化率的同时,减少甲烷气体的排放量,不仅可提高畜牧业的经济效益,还有利于环境的保护。如何找到既能促进反刍动物瘤胃发酵,又能减少瘤胃内甲烷气体产量,减少动物瘤胃发酵过程中能量的损失的绿色添加剂已成为反刍动物营养研究的重点。为此试验就以绵羊为试验材料,添加三种不同种类、不同浓度的甲烷抑制剂,探究其对绵羊瘤胃发酵指标及甲烷产量的影响,为甲烷抑制剂的推广应用提供理论基础。
1 材料与方法
1.1 试验动物及分组
选择16只体况良好,体重相近,安装永久性瘤胃瘘管的绵羊羯羊。随机分为4组,分别为对照组,试验A组、B组和C组,每组4只羊。
1.2 试验日粮及试验方法
精粗比为3∶7的日粮,对照组饲喂基础日粮,试验组A、B、C组分别在基础日粮中添加延胡索酸40 mg·kg-1、蒽醌20 mg·kg-1和大蒜素30 mg·kg-1,三种甲烷抑制剂均在每日早6:00、晚18:00饲喂时分两次投喂。预试期2周,正试期4 d,测定瘤胃发酵指标。于正试期0 h(早晨饲喂前)、饲喂后3、6、9、12 h采集样品,用自制的负压装置先抽取瘤胃内气体,收集于集气袋中待测甲烷浓度。然后从瘤胃瘘管采集绵羊瘤胃内不同位置的瘤胃液及食糜,将采集的瘤胃液直接测定pH值后,用四层灭菌纱布过滤,滤液在3 500 r·min-1条件下离心15 min,取1 mL上清液用来测定NH3-N,其余的上清液用来测定瘤胃细菌蛋白(BCP)。

表1 试验用基础日粮组成与营养水平Table 1 Composition and nutrient level of basal diet
1.3 测定指标及方法
pH值的测定:采用PHS-3C酸度计进行测定(上海雷磁分析仪器厂,玻璃电极)。
NH3-N浓度的测定:参照冯宗慈等[4]方法进行测定。
BCP的测定:采用高速差速离心法对培养液中的菌体蛋白进行测定。
甲烷气体的测定:使用气相色谱法,仪器为GC-9790,仪器编号979017540,室温22℃,室内相对湿度25.8%,进样体积为1 mL,色谱柱的担体是GD×(-104)高分子多孔微球60~80目,柱长3 m。气流载气(氮气)20 mL·min-1、燃气(氢气)25 mL·min-1、助燃气(氧气)4 000 mL·min-1。
1.4 数据处理
采用Excel对原始数据进行处理,采用SAS 9.2统计分析软件进行均值比较和单因素ANOVA分析,多重比较用Duncan氏法。
2 结果与分析
2.1 添加甲烷抑制剂对瘤胃pH值的影响
添加不同甲烷抑制剂在12 h内瘤胃pH值变化见表2,采食前至采食后9 h各组之间的瘤胃pH没有显著差异(P>0.05),而12 h时添加大蒜素的试验C组瘤胃内的pH最高,与试验A组之间无显著差异(P>0.05),但显著高于对照组和添加蒽醌的试验B组(P<0.05)。
2.2 添加甲烷抑制剂对瘤胃氨态氮的影响
添加不同甲烷抑制剂在12 h内瘤胃氨态氮变化见表3,各组均是在采食后3 h瘤胃内的氨态氮的浓度升高,之后随时间的延长呈下降趋势。采食前0 h,各组间氨态氮浓度没有显著差异(P>0.05);采食后3 h,添加蒽醌的B组的氨态氮浓度显著低于其他三组(P<0.05),而对照组、试验A组、试验C组之间无显著差异(P>0.05);6 h时,试验C组的氨态氮浓度显著高于另外三组(P<0.05),试验A、B组显著低于对照组(P<0.05),以添加蒽醌的B组最低;9 h时,试验C组的氨态氮浓度显著高于其他三组(P<0.05),添加蒽醌的B组与对照组无显著差异(P>0.05),二者均显著高于添加延胡索酸的A组(P<0.05);12 h时,添加大蒜素的C组氨态氮浓度显著高于其他三组(P<0.05),试验A、B组则显著低于对照组(P<0.05)。

表2 添加甲烷抑制剂对瘤胃pH值的影响Table 2 Effect of methane inhibitor on the pH in rumen

表3 添加甲烷抑制剂对瘤胃氨态氮浓度的影响(mg·100 mL-1)Table 3 Effect of methane inhibitor on the NH3-N in rumen(mg·100 mL-1)
2.3 添加甲烷抑制剂对瘤胃BCP的影响
添加不同甲烷抑制剂在12 h内对瘤胃菌体蛋白(BCP)的影响结果见表4。表4表明,日粮中添加甲烷抑制剂对瘤胃内的菌体蛋白浓度有显著影响。采食前各组之间无显著差异(P>0.05);采食3 h时,三个试验组的瘤胃BCP浓度显著高于对照组(P<0.05),而三个试验组之间无显著差异(P>0.05);6 h和9 h时,添加大蒜素的C组的瘤胃BCP浓度均显著高于另外三组(P<0.05),其中6 h时,试验A组、B组与对照组无显著差异(P>0.05),而9 h时,A、B组则显著高于对照组(P<0.05);12 h时,B和C组间无显著差异,二者均显著高于A组和对照组(P<0.05),且A组也显著高于对照组(P<0.05)。

表4 添加甲烷抑制剂对瘤胃BCP浓度的影响(mg·100 mL-1)Table 4 Effect of methane inhibitor on the BCP in rumen(mg·100 mL-1)
2.4 添加甲烷抑制剂对瘤胃甲烷气体的抑制效果
由表5可知,添加不同甲烷抑制剂在饲喂后的12 h内对瘤胃内甲烷气体的产量有显著影响。0 h时各处理之间无显著差异(P>0.05);饲喂后3 h,添加大蒜素的C组和添加延胡索酸的A组的甲烷产量显著低于对照组和添加蒽醌的B组(P<0.05),C组也显著低于A组(P<0.05);6 h时,A、B、C组均显著低于对照组(P<0.05),而C组与B组之间无显著差(P>0.05),但二者均显著低于A组(P<0.05);9 h和12 h,三个试验组均显著低于对照组(P<0.05),C组与A组之间无显著差异(P>0.05),但二者均显著低于添加蒽醌的B组(P<0.05)。
与对照组相比,在12 h培养时间内甲烷产量平均最低的一组是添加大蒜素的C组,甲烷产量在培养到6 h时降低程度最高,分别为B组37.61%、C组38.28%。0 h时,与对照组相比降低程度最高的是C组1.96%,其次是B组1.66%;3 h时,与对照组相比降低百分比最高的是C组,达到16.4%,其次是A组为10.26%;6 h,与对照组相比降低程度最高的是添加大蒜素的C组为38.28%,其次是添加蒽醌的B组为37.61%,最后是添加延胡索酸的A组16.83%;9 h和12 h,与对照组相比降低程度最高的是C组,其次是A,最后是B组,其中C组降低最多为33.16%。
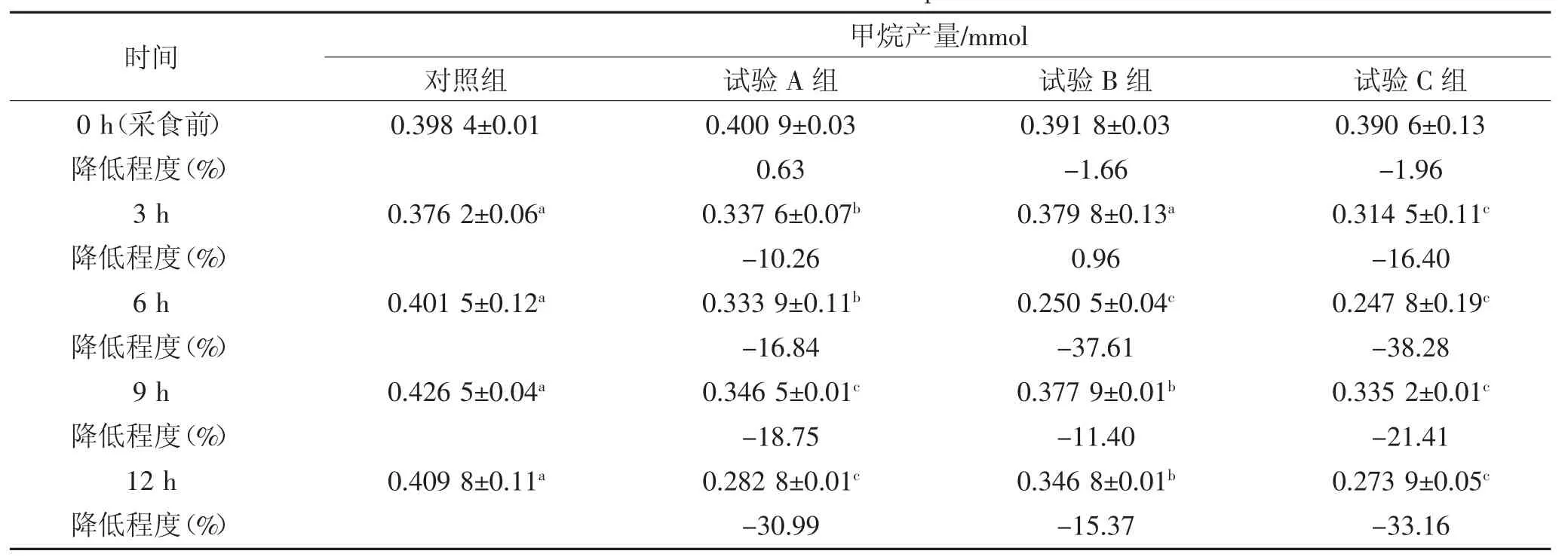
表5 添加甲烷抑制剂对瘤胃甲烷产量的影响(mmol)Table 5 Effect of methane inhibitor on the methane production in rumen(mmol)
3 讨论
瘤胃中的pH值受唾液分泌量、饲料性质以及瘤胃内挥发性脂肪酸含量和有机酸的生成、吸收和排出有所关联,而且也间接反映了瘤胃微生物代谢产物中的有机酸产生、吸收、排除及酸碱平衡的状况[5]。试验结果表明添加不同甲烷抑制剂在采食前至采食后9 h内各处理组的pH没有显著差异(P>0.05),而12 h时添加大蒜素显著提高了瘤胃内的pH(P<0.05)。刘敏[6]研究发现,在绵羊日粮中添加大蒜素可能影响了瘤胃内碳水化合物的发酵速度,使瘤胃内挥发性脂肪酸的产生速度减慢,从而使得试验期pH值升高。与研究结果相似。
氨氮浓度能够反映瘤胃微生物分解含氮物质产氨的速度以及对氨的摄取利用率,瘤胃内的氨氮主要来源于饲料中蛋白质氨基酸的脱氨基作用、非蛋白氮及通过血液-瘤胃肝脏氮素循环进入瘤胃的尿素降解。试验各组的氨氮浓度均是在采食后3 h升高,然后降低,这符合反刍动物采食后蛋白质的降解与吸收规律。在采食后的不同时间点,添加蒽醌的试验B组的氨氮浓度始终显著低于其它三组,可能是添加蒽醌抑制了蛋白分解菌的作用,导致瘤胃内食糜蛋白质降解量的减少;添加大蒜素的试验C组在采食6 h后的瘤胃氨氮浓度显著高于其他三组,可能与大蒜素抑制了甲烷的生成,从而有更多的碳源用于微生物蛋白的合成,瘤胃菌群中蛋白分解菌的增殖,促进了饲料蛋白质氨基酸的脱氨基作用等原因所致。
菌体蛋白是反映瘤胃发酵程度的重要指标之一。Trevaskis等[7]研究了碳水化合物和氮源同步性对合成瘤胃菌体蛋白的作用,结果表明日粮蛋白水平过低,不能满足瘤胃微生物对氮源的需求,同时抑制了瘤胃微生物对碳水化合物的利用。试验中添加不同甲烷抑制剂后瘤胃内的BCP的产量显著高于对照组(P<0.05),以添加大蒜素的试验C组最为显著,可能是由于其减少了甲烷的生成,从而有更多的碳源用于微生物蛋白的合成,促进了瘤胃微生物的增殖,提高了菌体蛋白的含量。
瘤胃内甲烷气体的产量是引起瘤胃发酵能量损失的主要指标之一。降低甲烷的产量,对提高能量的利用率有重要的意义。赵广永[8]通过采用人工瘤胃技术探究了皂化菜籽油对体外发酵产气量的影响,结果发现随着皂化油脚水平的提高,甲烷产量具有减少趋势。Busquet等[9]在体外产气试验中,分别添加二烯丙基二硫化物(DAD)、大蒜素、烯丙硫醇(ALM),甲烷产气量分别相应的降低了68.5%、73.6%、19.5%,在这三种含硫化合物中抑制甲烷的效果最显著的是大蒜素,与试验研究结果相类似。郑杰等[10]研究表明,离子载体化合物等能够抑制甲酸脱氢酶的活性,进而改变瘤胃内的发酵类型,降低甲烷的排放量;延胡索酸能够改善瘤胃内其他微生物对氢等的利用率。因此,在日粮中添加适量的延胡索酸也能够抑制甲烷生成菌、纤维素分解菌、原虫等活性从而减少甲烷气体的排放量。据报道畜牧业中所排放的甲烷气体的量约占全球温室效应气体总量的2%[11]。因此,降低反刍动物瘤胃内甲烷产量有重要意义。在试验的研究结果中添加不同甲烷抑制剂在饲喂后12 h内显著降低甲烷产的量,其中甲烷产量最低的一组是大蒜素,甲烷产量在6 h时降低百分比最高为38.28%。杨承剑等[12]研究发现,在日粮中添加延胡索酸二钠能够减少瘤胃甲烷生成,其作用效果在高粗料条件下更为显著,与研究结果相类似。瘤胃发酵过程中产生的氢被甲烷产气菌利用,与碳结合合成甲烷,通过嗳气排出体外。甲烷抑制剂可有效抑制甲烷菌的生长,并能促进氢的其他途径的利用而减少氢与碳的结合,使更多的碳与氮被有益微生物利用合成微生物蛋白,提高营养物质的利用率。
4 小结
添加三种不同甲烷抑制剂对瘤胃内pH值没有显著影响,三种甲烷抑制剂瘤胃pH值均较高。整个试验期内保持在6.50~6.63之间。添加三种不同甲烷抑制剂对瘤胃内氨态氮具有显著影响,其中大蒜素组显著提高了瘤胃氨氮浓度。添加三种不同甲烷抑制剂对瘤胃BCP有显著影响,添加甲烷抑制剂后大蒜素组的菌体蛋白的含量最高。添加三种不同甲烷抑制剂对瘤胃内甲烷产量有显著影响,添加大蒜素6 h后有最为明显的效果,降低百分比最高为38.28%。
[1]巴哈提古丽·马那提拜.绞股蓝皂甙调控山羊瘤胃甲烷生成的时间效应及作用机制的研究[D].南京:南京农业大学,2013.
[2]李燕.外源酶对山羊甲烷排放及饲料利用率影响的研究[D].成都:四川农业大学,2013.
[3]安娟,赵晓川.反刍动物甲烷排放机制及其调控[J].饲料工业,2006(27):57-59.
[4]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6-7):37.
[5]刘文,袁雪,王成双,等.pH和纤维水平对苜蓿纤维吸附铜的影响[J].黑龙江八一农垦大学学报,2015,26(2):32-34.
[6]刘敏,张志军,米热古丽·伊马木.大蒜素对哈萨克羊瘤胃发酵的影响[J].中国草食动物,2012(1):22-25.
[7]Trevaskis L M,fulk erson W J,Gooden J M.Provision of centain carbohydrate-based supplements to pasture-fed sheep,as well as time of havesting of pasture,influences pH,ammonia concentration and microbial protein syntheses in the rumen[J].Aust J Exp Agr,2001,41:21-27.
[8]赵广永.肉牛饲喂前后瘤胃液对饲料体外发酵产气量及pH值和氨态氮的影响[J].中国畜牧杂志,2006,42:51-53.
[9]Busquet M,Calsamiglia S Ferret A.Effects of cinnamaldehyde and garlic oil on rumen microbial fermentation in a dual flow continuous culture[J].Journal of Dairy Science,2005,88:2508-2516.
[10]郑杰,刘霜,罗斌,等.山羊INHA和INHBA基因的cDNA克隆、序列分析及组织表达研究[J].西南民族大学学报:自然科学版,2015,41(6):672-677.
[11]胡伟莲,吕建敏,翟少伟,等.瘤胃纤毛虫对甲烷菌和甲烷产量的影响[J].中国畜牧杂志,2004(12):39-42.
[12]杨承剑.延胡索酸二钠对山羊瘤胃甲烷生成的调控研究及相关瘤胃微生物菌群分析[D].南京:南京农业大学,2011.
Effect of Different Methane Inhibitor on Indices of Rumen Fermentation and Methane Production in Sheep
To explore the effect of different inhibitors on the indexes of ruminant fermentation and methane yield,16 healthy and same weigh(28±1.0kg)sheep with ruminal fistula were selected and divided into 4 groups at random.Four treatments were the control fed basal diet without any additive,group A fed basal diet added with fumaric 40 mg·kg-1,group B with anthraquinone 20 mg·kg-1,and group C with allicin 300 mg·kg-1.The results showed that there was no significant effect on pH in rumen for sheep fed diet with methane inhibitors in 9 h(P>0.05),but the pH of rumen increased at 12 h for sheep with allicin(P<0.05).Obviously the different treatments took effect on the NH3-N,and bacterial crude protein(BCP)in rumen,especially allicin in diet increased the NH3-N(P<0.05)and BCP(P<0.05).Methane production in rumen decreased significantly to sheep fed with three inhibitors in diet,and at 6 h,allicin decreased the methane production in rumen more obvious(P<0.05),the decrease amplitude was 38.28%.
inhibitor of methane;index of rumen fermentation;methane;sheep
S816.32
A
1002-2090(2016)06-0016-05
10.3969/j.issn.1002-2090.2016.06.003
2015-10-20
国家科技支撑计划项目(2013BAD21B01-1);黑龙江省农垦总局科技攻关项目(HNK125B-12-04,HNK125B-11-05)资助。
杨坤(1988-),女,黑龙江八一农垦大学动物科技学院2013级硕士研究生。
姜宁,女,教授,E-mail:jiangng_2008@sohu.com。

