白背飞虱对南方水稻黑条矮缩病传毒效率的影响
黄所生,吴碧球,秦碧霞,李战彪,李 成,孙祖雄,谢慧婷,黄凤宽*,蔡健和
(1.广西农业科学院植物保护研究所,广西 南宁 530007;2.广西作物病虫害生物学重点实验室,广西 南宁 530007;3.广西防城港市植保站,广西 防城港 538001)
白背飞虱对南方水稻黑条矮缩病传毒效率的影响
黄所生1,2,吴碧球1,2,秦碧霞1,2,李战彪1,2,李 成1,2,孙祖雄3,谢慧婷1,2,黄凤宽1,2*,蔡健和1,2
(1.广西农业科学院植物保护研究所,广西 南宁 530007;2.广西作物病虫害生物学重点实验室,广西 南宁 530007;3.广西防城港市植保站,广西 防城港 538001)
为完善水稻对南方水稻黑条矮缩病抗性的评价方法提供理论依据,运用RT-PCR检测法及其他常规方法研究不同虫态、不同接虫密度对白背飞虱传播SRBSDV的能力、不同水稻生育期对白背飞虱传毒效率影响、白背飞虱饲毒时间和传毒时间对南方水稻黑条矮缩病发病率的影响。结果表明,同一虫态白背飞虱不同的接虫密度水稻发病率不同,接虫密度增加发病率增高;随着虫龄增大而白背飞虱传毒效率增高。接虫密度2头/苗、3头/苗时,4~5龄和长、短白背飞虱型成虫传毒引起水稻发病率均达到100.00 %。不同水稻生育期影响白背飞虱传毒效率。接虫后,1叶期至30 d苗龄水稻发病率均为100.00 %,40、50、60和70 d苗龄水稻发病率依次为91.30 %、4.17 %、0.00 %和0.00 %。随着白背飞虱饲毒时间或传毒时间加长,水稻发病率会不断增高。当白背飞虱饲毒时间为60.18 h或传毒时间为26.34 h时,水稻发病率均达到100.00 %。因此,进行水稻品种抗SRBSDV人工接种鉴定时,传毒介体白背飞虱饲毒时间不应低于60.18 h,待测苗20~25 d苗龄时接虫,接虫密度为每苗接2头带毒4~5龄若虫或成虫,传毒时间不应低于26.34 h。建议对现有的抗白背飞虱水稻品种(材料)进行抗SRBSDV鉴定,从中发掘抗病材料,为水稻抗性育种工作者选择提供抗源材料。
南方水稻黑条矮缩病毒;白背飞虱;获毒效率;传毒效率
南方水稻黑条矮缩病是近年来发现并命名的一种新的水稻病毒病[1-2],其病原为南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)。南方水稻黑条矮缩病已经在我国华南、华中、华东、西南等广大稻区以及越南、日本等国家的部分稻区分布和流行[3-4]。南方水稻黑条矮缩病的发生流行对水稻生产和粮食安全构成了严重威胁,如何控制该病的危害对水稻生产乃至粮食安全至关重要。迁飞性昆虫白背飞虱(Sogatellafurcifera,Horvath)是主要能传播SRBSDV的介体[5],同时也是水稻重要害虫之一。该虫具有迁飞性、毁灭性和暴发性等特点,一旦被SRBSDV感染,其可终身携毒,且传毒效率非常高。经有关实践证明,利用抗性品种是低成本控制病虫害的有效措施,但目前水稻品种对SRBSDV的抗病性仍缺乏规模、高效的评价方法,因此,研究水稻品种对SRBSDV抗病性的评价方法,对该病害抗源筛选、抗病品种选育以及综合防控有重要意义。目前,有关水稻品种(材料)对南方水稻黑条矮缩病抗性评价方法的报道较少,主要集中在采取田间自然诱发南方水稻黑条矮缩病的方式进行了田间水稻抗该病的评价方面[6-10],此评价方法由于田间白背飞虱密度和带毒率的不确定性,造成水稻发病率无法保障,且费时费力,难以满足抗源筛选工作规模化、高效的要求。秦碧霞等[11]采用集团接种法进行室内人工接种抗病性鉴定,初步建立了水稻品种(材料)对南方水稻黑条矮缩病抗性的有效评价方法。目前采用的室内人工接种抗病性鉴定法中传毒介质的虫态为成虫,由于白背飞虱成虫有不易捕捉、不易大批量繁殖等特点,一定程度上影响了该方法进行大批量水稻品种(材料)对南方水稻黑条矮缩病鉴定工作。SRBSDV在白背飞虱体内度过循回期才传毒。传毒介体的获毒效率和传毒效率,是进行水稻品种对SRBSDV抗病性评价是否成功的关键。接虫密度、虫态、取食时间及水稻生育期都影响到介体获取、传播SRBSDV的效率,目前这方面的研究报道比较少。刘丹凤等[12]研究了温度(22、27和32 ℃)、水稻生育期(三叶期、分蘖期和孕穗期)和白背飞虱若虫龄期(3和5龄)对白背飞虱获毒效率的影响,但该研究中并未涉及这几个因素对白背飞虱传毒效率的影响。研究接虫密度、虫态、取食时间及水稻生育期等因素对白背飞虱传播SRBSDV病毒效率的影响,结果可为完善水稻对南方水稻黑条矮缩病抗性的评价方法提供理论依据。
1 材料与方法
1.1 传毒媒介准备
在白背飞虱发生期间,从田间采集怀卵的成虫,然后在室内用TN1饲养繁殖2~3代,经抽样检测虫体不携带SRBSDV,即作为无毒试虫供试验使用。
1.2 毒源准备
从田间采集南方水稻黑条矮缩病疑似病株,RT-PCR检测确认感染SRBSDV,病株经白背飞虱传毒纯化后扩大繁殖,种植在防虫笼中备用。
1.3 携毒媒介准备
分批将初孵无毒白背飞虱若虫移到SRBSDV病株上饲养至不同生育期虫态备用。
1.4 试验方法
1.4.1 水稻和白背飞虱携带SRBSDV的RT-PCR检测 参考秦碧霞等[11]检测水稻和白背飞虱携带SRBSDV的方法,采用Trizol法分别提取水稻、白背飞虱总RNA,采用刘红艳等[13]报道的SRBSDV特异引物,上游引物SRBSDV-F:5′-cgatcttatccataatggtg-3′,下游引物SRBSDV-R:5′-gccatagtgtgtcacgtctg-3′,扩增片段约650 bp。用Quant一步法RT-PCR试剂盒进行SRBSDV带毒情况检测,扩增产物在1.00 %琼脂糖凝胶中电泳,出现650 bp目的条带的样品即视为带毒。
1.4.2 不同虫态不同接虫密度对白背飞虱传播SRBSDV能力的影响 将TN1种子浸种催芽后直接播于装有泥巴的瓦盆(r=20 cm,h=12 cm,下同)内,每盆播种2~3粒,出苗后每盆保留健壮苗1株,其余全部拔除。为保证秧苗不带毒,特制网罩盖在盆口,待秧苗长到1叶期时接虫。试验设接携毒1龄若虫、2~3龄若虫、4~5龄若虫、短翅成虫、长翅成虫及相应虫态无毒虫(CK)6个处理。每处理接虫量设1、2和3头/株,各重复20~30次,每重复各一虫一苗。待发现疑似病株后,即按1.4.1方法逐株采样检测,出现650 bp目的条带的植株即确认为发病株,据此统计各处理稻株发病率。
1.4.3 不同水稻生育期对白背飞虱传毒效率的影响 分批将TN1种子浸种催芽后直接播于装有泥巴的瓦盆内,每盆播种2~3粒,出苗后每盆保留健壮苗1株,其余全部拔除。为保证秧苗不带毒,特制网罩盖在盆口。待水稻苗长到试验要求时,按2头/株虫量(根据1.4.2结果)接入高龄携毒试虫(饲毒时间7~8 d)。试验设1、2和3叶期,20、30、40、50、60和70 d苗龄共9个处理,每处理重复20~25次,每重复1盘苗。待发现疑似病株后,即逐株采样检测,统计各处理稻株发病率。
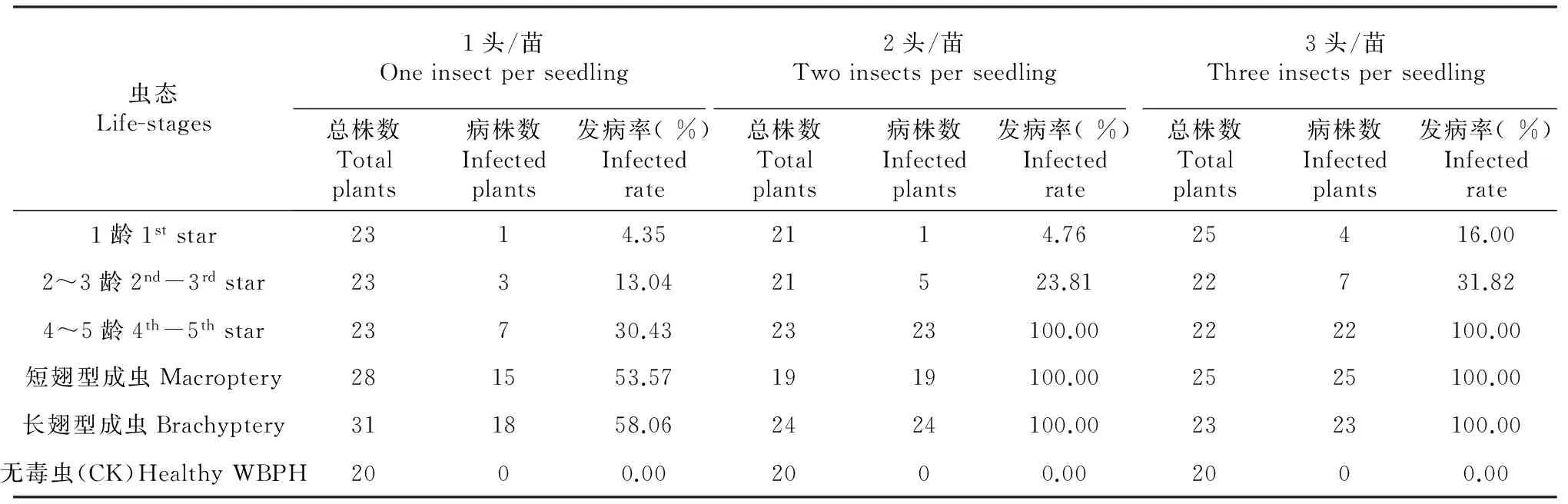
表1 白背飞虱不同虫态不同接虫密度水稻发病率
1.4.4 白背飞虱饲毒时间对南方水稻黑条矮缩病发病率的影响 将无毒4~5龄白背飞虱若虫移至南方水稻黑条矮缩病病株上取食,到设定的取食时间后即按1头/苗的虫量移至2叶期TN1健苗上,并罩上防虫罩。试验设取食时间5和15 min,1、6、12、24和48 h共7个处理,每个处理重复20~30次,每重复1健苗。待发现疑似病株后,即逐株采样检测,统计各处理稻株发病率。将病株上取食时间设为自变量,TN1苗的发病率设为因变量,建立一元线性回归方程,得到TN1苗100.00 %发病率时白背飞虱的最短获毒时间。
1.4.5 白背飞虱传毒时间对南方水稻黑条矮缩病发病率的影响 将携毒4~5龄白背飞虱若虫(饲毒时间7~8 d)按1头/苗的虫量移至预先准备好的2叶期TN1健苗上,并罩上防虫罩,取食一定时间后将白背飞虱移走。试验设取食时间5 min、15 min、30 min、1 h、6 h、12 h和24 h共7个处理,每个处理20~30个重复,每重复各1健苗。待发现疑是病株后,即逐株采样检测,统计各处理稻株发病率。将TN1健苗上取食时间设为自变量,TN1苗的发病率设为因变量,建立一元线性回归方程,得到TN1苗100.00 %发病率时白背飞虱的最短传毒时间。
2 结果与分析
2.1 白背飞虱不同虫态不同接虫密度对SRBSDV的传毒效率
从表1可看出,白背飞虱对SRBSDV的传毒效率随着虫龄增大而增高;同一虫态不同的接虫密度水稻发病率不同,接虫密度增加发病率增高。接虫密度2头/苗、3头/苗时,4~5龄和长、短白背飞虱型成虫传毒引起水稻发病率均达到100.00 %。
2.2 不同水稻生育期对白背飞虱传毒效率的影响
接虫后,1叶期至30 d苗龄水稻发病率均为100.00 %(表2);40、50、60和70 d苗龄水稻发病率依次为91.30 %、4.17 %、0.00 %和0.00 %。

表2 白背飞虱传毒后不同生育期水稻的发病率
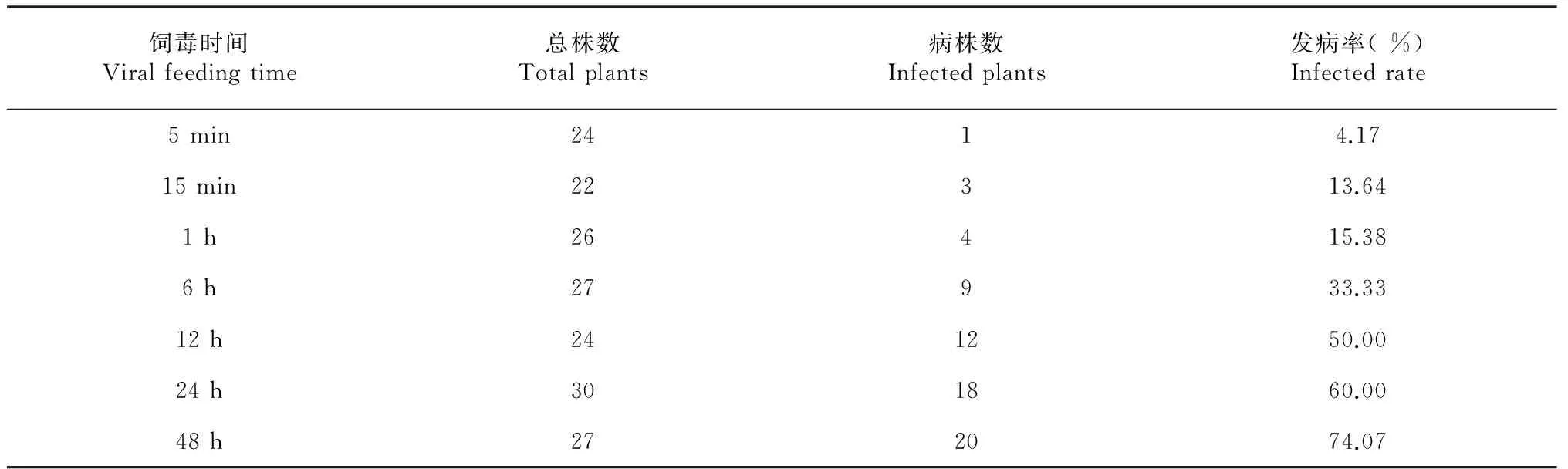
表3 白背飞虱不同饲毒时间的水稻发病率

表4 白背飞虱不同传毒时间水稻发病率
2.3 白背飞虱饲毒时间对南方水稻黑条矮缩病发病率的影响
从表3可看出,随着白背飞虱饲毒时间加长,水稻发病率会不断增高。以对白背飞虱的饲毒时间为自变量(x),水稻发病率为因变量(Y),建立一元线性回归方程,得到模型:
Y=18.0363+0.02273x(R2=0.9119)
当白背飞虱饲毒时间为60.18 h时,水稻发病率达到100.00 %。
2.4 白背飞虱传毒时间对水稻发病率的影响
随着白背飞虱传毒时间加长,水稻发病率会不断增高(表4)。以对白背飞虱的传毒时间为自变量(x),水稻发病率为因变量(Y),建立一元线性回归方程,得到模型:
Y=21.1269+0.0499x,R2=0.9121
当白背飞虱传毒时间为26.34 h时,水稻发病率达到100.00 %。
3 讨 论
作物品种抗病鉴定方法主要有田间自然传毒鉴定法和人工接种鉴定法。由于鉴定过程中毒源、接虫密度、虫态、取食时间及水稻生育期等都是在可控条件下进行,相对于田间自然传毒鉴定法,人工接种鉴定法较易满足抗源筛选工作中规模化、高效和可重复性等要求。
介体传播的植物病毒的传毒效率与介体昆虫的虫态或龄期有关。进行作物品种抗病人工接种鉴定时,传毒介质用量多少及采用何种虫态是首先需要解决的问题。本研究结果发现,在南方水稻黑条矮缩病人工接种鉴定中,接虫密度为2或3头/苗,4~5龄和长或短翅型白背飞虱成虫传毒引起水稻发病率均达到100.00 %。相对于成虫,4~5龄白背飞虱可大量获得、易捕捉,利于人工接种鉴定,故接毒时可以按2头/苗选取带毒4~5龄白背飞虱。本研究结果表明,1叶期至30 d苗龄水稻接毒后发病率均达到100.00 %,苗龄越大水稻发病率越低。大田移栽时,水稻苗一般为20~25 d苗龄。故水稻抗病人工接种鉴定时,待测苗的苗龄应尽可能接近田间水平,选取20~25 d苗龄。传毒介体的获毒时间和传毒时间影响植物病毒的传播效率。本研究结果表明,当白背飞虱饲毒时间为60.18 h、传毒时间为26.34 h时,水稻发病率达到100.00 %。曹杨等[14]研究SRBSDV在不同虫态白背飞虱体内的循回期,5龄若虫体内SRBSDV的循回期为3~7 d。进行水稻品种抗SRBSDV人工接种鉴定,传毒介体白背飞虱饲毒时间不应低于60.18 h,待测苗20~25 d苗龄时接虫,接虫密度为每苗接2头带毒4~5龄若虫,传毒时间不应低于26.34 h。为使传毒介体度过循回期,实际操作过程中可适当延长饲毒时间或传毒时间,饲毒时间从2龄饲毒到4~5龄(约5.0~7.5 d);传毒时间可以延长至2 d(48 h),不宜延长过长时间,避免5龄若虫变成虫后在待测苗上产卵,增加后期管理难度。
水稻病毒病综合防治对策中“抗”是最重要的环节,抗病品种利用是防治水稻病毒病成本最低的有效的措施,因此要加大对抗病品种筛选力度。南方水稻黑条矮缩病与其传毒介体白背飞虱是水稻重要的病害与害虫,在进行抗源筛选时,不仅要以南方水稻黑条矮缩病为目标,还需针对白背飞虱,建议对现有的抗白背飞虱水稻品种(材料)进行抗SRBSDV鉴定,进一步发掘抗虫、抗病材料,为水稻抗性育种工作者提供抗源材料。
[1]周国辉,许东林,李华平. 广东发生水稻黑条矮缩病病原分子鉴定[A]//中国植物病理学会2004年学术年会论文集[C].北京:中国农业科学技术出版社,2004:210-212.
[2]周国辉,温锦君,蔡德江,等. 呼肠孤病毒科斐济病毒属一新种:南方水稻黑条矮缩病毒[J]. 科学通报,2008,53(20):2500-2508.
[3]周国辉,张曙光,邹寿发,等. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J]. 植物保护,2010,36(2):144-146.
[4]Hoang A T,Zhang H M,Yang J,et al. Identification,characterization,and distribution of southern rice black-streaked dwarf virus in Vietnam[J]. Plant Disease,2011,95(9):1063-1069.
[5]Pu L L,Xie G H,Ji C Y,et al. Transmission characteristics of southern rice black-streaked dwarf virus by rice planthoppers [J].Crop Protection,2012,41:71-76.
[6]潘凤英,廖咏梅,海 博,等. 19个水稻雄性不育系对南方水稻黑条矮缩病的抗性评价[J]. 南方农业学报,2011,42(4):399-402.
[7]刘琳琳. 24个水稻品种对南方水稻黑条矮缩病的抗性研究[D]. 福州:福建农林大学,2012.
[8]莫千持,范大泳,王 鹏,等.桂林市水稻主栽品种对南方水稻黑条矮缩病的抗性评价[J]. 现代农业科技,2014(22):109-110.
[9]龙玉宁,陆金鹏,陈丽莉,等. 不同水稻品种对南方水稻黑条矮缩病的田间抗性试验[J]. 植物医生,2014,27(5):34-35.
[10]杨昌勇. 水稻不同品种对南方水稻黑条矮缩病的抗性比较分析[J]. 农业与技术,2014,34(9):95-96.
[11]秦碧霞,蔡健和,李战彪,等. 广西水稻品种抗水稻南方黑条矮缩病鉴定[J]. 南方农业学报,2014,45(1):38-42.
[12]刘丹凤,李 沛,弓少龙,等. 温度、水稻生育期和白背飞虱若虫龄期对南方水稻黑条矮缩病毒介体获毒率的影响[J]. 植物保护,2016,42(1):129-133
[13]刘红艳,潘凤英,李建勇,等. 广西南方水稻黑条矮缩病毒的RT-PCR检测[A]//中国植物病理学会2010年学术年会论文集[C].北京:中国农业科学技术出版社,2010:369.
[14]曹 杨,潘 峰,周 倩,等. 南方水稻黑条矮缩病毒介体昆虫白背飞虱的传毒特性[J].应用昆虫学报,2011,48(5):1314-1320.
(责任编辑 汪羽宁)
Effects of White-backed Planthopper,Sogatellafurcifera, Horvath on Transmission Rates of Southern Rice Black Streaked Dwarf Virus
HUANG Suo-sheng1,2, WU Bi-qiu1,2, QIN Bi-xia1,2, LI Zhan-biao1,2,LI Cheng1,2, SUN Zu-xiong3,XIE Hui-ting1,2, HUANG Feng-kuan1,2*, CAI Jian-he1,2
(1.Plant Protection Research Institute,Guangxi Academy of Agricultural Sciences,Guangxi Nanning 530007,China;2.Guangxi Key Laboratory for Biology of Crop Diseases and Insect Pests,Guangxi Nanning 530007,China;3.Plant Protection Station of Fangchenggang City, Guangxi Fangchenguang 538001,China)
In order to provide a theoretical basis for improving the evaluation method on rice resistance to Southern rice black streaked dwarf virus (SRBSDV), the effects of different life-stages, different insect density and different rice growth stages on the SRBSDV transmission efficiency of WBPH, and the viral acquisition periods and the effect of the viral inoculation time of WBPH on the incidence rate of rice were studied, using the RT-PCR method and other conventional methods. The results showed that different insect density could cause different infected rates of rice when WBPH was at the same life-stage. The rice infected rates increased with the inoculation density increased and the transmission efficiency of WBPH increased with the nymphae instars increased. With an inoculation density of two or three insects per seedling, the virus transmission of fourth instar nymphae, or fifth instar nymphae, or macroptery and brachyptery could cause a 100.00 % incidence of rice. Different rice growthstages affected the virus transmission efficiency of WBPH. The infected rates of rice from one leaf stage to 30 d seedlings were 100.00 %, and the infected rates of 40 d seedlings,50 d seedlings,60 d seedlings and 70 d seedlings were 91.30 %, 4.17 %, 0.00 % and 0.00 % respectively. With the feeding time or the inoculation time increased, the rice infected rates continued to increase. When the viral feeding time was 60.18 h or the viral transmission time was 26.34 h, the rice infected rate of was 100 %.In evaluation of rice resistance to SRBSDD, the viral acquisition period should not be less than 60.18 hours, and the seedlings were twenty to twenty-five days old, the inoculation density should be two viral nymphaes (fourth or fifth instars) or adults per seedling. The viral transmission time should not be less than 26.34 hours. It was suggested that the resistance of the existing WBPH resistance rice varieties (materials) to SRBSDD should be evaluated to explore virus-resistance materials, and provide resistant materials for SRBSDD-resistance rice breeders.
Southern rice black streaked dwarf virus;White-backed planthopper;Viralacquisition rate;Viraltransmission rate
1001-4829(2016)12-2840-05
10.16213/j.cnki.scjas.2016.12.014
2016-08-05
广西科学研究与技术开发计划项目(桂科合1412500 7-2-4);“十二五”国家科技支撑计划项目(2012BAD19B03);广西自然科学基金项目(2015GXNSFAA139055,2015GXNSFAA139054);广西农业科学院基本科研业务专项(桂农科2016YM51)
黄所生(1974-),广西邕宁人,副研究员,主要从事水稻抗性研究工作,E-mail:huangss@gxaas.net;*为通讯作者,E-mail:huangfengkuan@gxaas.net。
S511
A

