微生物转化连翘苷制备连翘脂素的研究
梅建凤, 董志红, 易 喻, 陈建澍, 张彦璐, 应国清
浙江工业大学 药学院,浙江 杭州 310014
微生物转化连翘苷制备连翘脂素的研究
梅建凤, 董志红, 易 喻, 陈建澍, 张彦璐, 应国清
浙江工业大学 药学院,浙江 杭州 310014
本文旨在开发一种微生物转化工艺,将连翘苷转化为活性更高的连翘脂素。结果从土壤中分离筛选到一株桔青霉(Penicilliumcitrinum)LB菌株,转化连翘苷为连翘脂素的专一性较高。经培养基主要组成和转化条件优化,得出较佳的产酶培养组成为:蔗糖7 g/L,(NH4)2SO45 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO40.5 g/L,pH 6.0。LB菌株经产酶培养后,过滤收集菌体悬浮于2倍发酵液体积的磷酸盐缓冲液中,加入2 g/L的底物连翘苷,于30 ℃、200 r/min转化20 h,连翘脂素的转化得率可达94.1%。利用微生物将连翘苷转化为连翘脂素,具有方法简单、转化得率高、产物容易纯化和副产物少等优点,有潜在的工业化应用价值。
连翘苷; 连翘脂素; 生物转化; 桔青霉
中药材连翘(Frucutusforsythiae)是木犀科(Oleaceae)连翘属(Forsythia)植物连翘[Forsythiasuspense(Thunb) Vahl]的干燥果实,又称黄花条、连壳和落翘等,是中国临床常用的传统中药之一[1]。连翘具有清热解毒、排脓化瘀、抗氧化、抗病毒等功效[2-4]。连翘的主要有效成分为连翘苷(phillyrin)和连翘酯苷A(forsythoside A),中国药典规定合格的连翘中,连翘苷的含量不低于0.15%,连翘酯苷A的含量不低于0.25%[1]。
连翘中另一活性成分往往被人们忽视,即连翘脂素(phillygenin),它是连翘苷的苷元(结构式见图1),由于含量比较低,药典对其含量没有要求。然而许多研究表明,相比于连翘苷,连翘脂素具有更好的药理活性,如在抗肿瘤方面,连翘脂素对人胃癌细胞株SGC7901的生长有一定的抑制作用,IC50值为379 μg/mL,而连翘苷的抑制作用不明显,在对人肝癌细胞SMMC-7721研究中,连翘脂素的抑制作用大于连翘苷[5];在治疗肝纤维化与肝损伤方面,连翘脂素对免疫性大鼠肝纤维化有较好的治疗作用[6];对乙酰氨基酚导致的肝损伤,对于抗肿瘤药物顺铂导致的肝损伤,四氯化碳导致的急慢性肝损伤,D-氨基半乳糖导致的肝损伤,以及D-氨基半乳糖和脂多糖导致的肝衰竭均具有很好的治疗效果,且其治疗肝损伤及肝衰竭的效果显著优于连翘苷[7]。另外,有研究表明连翘苷的口服吸收效果较差[8],在体内分解成连翘脂素后发挥效用[9]。可以看出,连翘脂素具有较好的药理活性,如将连翘苷转化为连翘脂素,对连翘资源的深度开发具有重要意义。

图1 微生物转化连翘苷为连翘脂素的反应式
目前已有酶法转化连翘苷为连翘脂素的研究报道,但该方法的纤维素酶用量较大,是底物质量的1~10倍,酶的成本无疑较高[10, 11];如果采用酸水解法,存在的问题则是副产物较多,构型容易转变,生成的同分异构体难以分离。本文研究微生物法将连翘苷转化为连翘脂素,则具有成本低、流程简单、转化得率高和副产物少等优点。
1 材料和方法
1.1 试剂
连翘苷标准品购自阿拉丁试剂有限公司,批号为F104482,纯度97%;连翘脂素标准品购自上海源叶生物技术有限公司,批号为B20726,纯度97%,其他试剂均为市售分析纯、色谱纯或生物试剂。
1.2 培养基
平板培养基采用马铃薯葡萄糖琼脂培养基(PDA),种子培养基采用马铃薯液体培养基(PDB)[12];初始产酶培养基的组成为:葡萄糖 8 g/L,蛋白胨 5 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO40.5 g/L,pH 7.0。所有培养基均经121 ℃高压蒸汽灭菌20 min。
1.3 方法
1.3.1 菌种分离
采集花坛有机质含量较高的土壤,用无菌水稀释适当倍数后涂布于PDA平板培养基,于28 ℃培养3 d,挑取形态和颜色不同的霉菌菌落转接PDA平板,置于28 ℃恒温培养2 d,多次纯化得到纯种菌株。
1.3.2 连翘苷的生物转化
菌种筛选时,用接种环挑取分离得到的菌株孢子直接接种100 mL产酶培养基,于30 ℃、200 r/min振荡培养3 d,加入1 mg 连翘苷(溶于1 mL甲醇)后继续培养18 h。培养基组成优化时,接种霉菌孢子2环于50 mL的PDB中,30 ℃、200 r/min振荡培养2 d,再移取种子液5 mL接种100 mL产酶培养基中,接种后的产酶培养基于30 ℃、200 r/min振荡培养2 d,加入1 mg 连翘苷(溶于1 mL甲醇)后继续培养18 h。
1.3.3 连翘苷和连翘脂素的分析
转化结束后,100 mL转化液用同等体积的乙酸乙酯萃取2次,45 ℃下减压蒸干后,用3 mL甲醇溶解残留物,经0.45 μm微孔滤膜过滤待测。
高效液相色谱法(HPLC)分析萃取样品中连翘苷和连翘脂素的浓度。仪器为岛津LC-20AD型高效液相色谱仪(日本岛津仪器有限公司),色谱柱为Phenomenex Luna C18键合硅胶柱(5 μm,250 mm×4.6 mm);检测条件为:流动相为乙腈和水梯度洗脱(0 min~30 min,乙腈10%~100%,水90%~0%)。流速0.8 mL/min,柱温25 ℃,检测波长277 nm,进样量20 μL,由相同分析条件下的连翘苷和连翘脂素浓度-峰面积标准曲线计算样品中的两者的浓度。
2 结果与讨论
2.1 转化菌株的分离、筛选和鉴定
2.1.1 转化菌株的分离与筛选
从土壤中分离出12株霉菌菌株,经产酶培养后,加入底物连翘苷,HPLC分析它们转化生成连翘脂素浓度,不同菌株的转化液中连翘脂素的浓度和得率见表1。从表1可以看出,多数菌株转化能力较弱,仅有菌株LB转化连翘苷生成的连翘脂素浓度最高,得率达到73.3%。菌株LB转化连翘苷的样品HPLC分析图谱见图2,可以看出还有部分连翘苷未被转化,底物和产物的总摩尔数基本等于加入底物的摩尔数,说明连翘脂素基本未被水解,菌株LB转化连翘苷生成连翘脂素的专一性良好。

表1 不同菌株转化连翘苷生成连翘脂素的浓度和得率
2.1.2 转化菌株的鉴定
LB菌株在PDA平板培养基上,28 ℃条件下培养2 d,即可长出菌落。菌落初期为白色细绒毛状,之后表面逐渐呈灰绿色,产生大量绿色分生孢子,背
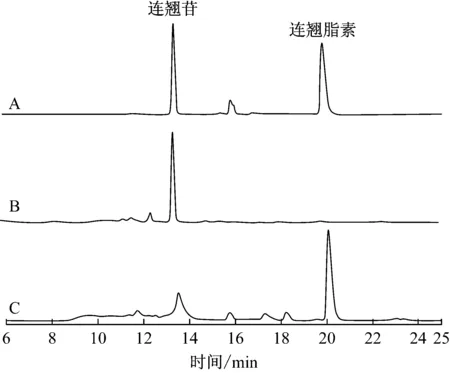
A—连翘苷和连翘脂素标准品;B—转化0 h的对照;C—菌株LB转化18 h的样品
图2 连翘苷生物转化为连翘脂素的HPLC分析图谱
面呈黄色。在显微镜下观察到菌丝有横隔,孢子梗顶端产生成串的青色分生孢子,分生孢子穗呈青霉属菌种特有的帚状。
将菌株LB交由生工生物工程(上海)有限公司进行18S rDNA测序,测得序列大小为1 282 bp。将序列在GenBank上进行BLAST比对,与超过100株青霉属菌株有99%以上的同源性,与6株桔青霉(Penicilliumcitrinum)菌株的18S rDNA序列有100%的同源性。依据18S rDNA序列,绘制的该菌株与青霉属不同种的系统发育树(图3)显示,该菌株与桔青霉亲缘关系较近,与青霉属其他种的亲缘关系相对较远,综合菌株LB的形态特征和18S rDNA的序列分析,可以确定菌株LB为一株桔青霉,已保藏于广东省微生物菌种保藏中心,保藏编号:GDMCC No: 60050。

图3 依据18S rDNA序列同源性比较构建的系统发育树
2.2 产酶培养基组成及pH优化
2.2.1 碳源种类与浓度
分别将初始产酶培养基中的葡萄糖替换成浓度为8 g/L的蔗糖、麦芽糖、乳糖和淀粉,以选出较佳的碳源种类。结果表明碳源为蔗糖时,连翘脂素的转化得率最高,达到了79.1%。二糖结构的蔗糖优于单糖结构的葡萄糖,说明含糖苷键的二糖既能满足菌体生长需要,又可诱导表达水解连翘苷的糖苷酶。实验进而考察了蔗糖浓度对连翘脂素转化得率的影响,结果见图4。
由图4可以看出,当蔗糖浓度为7 g/L时,连翘脂素的转化得率最高,达到了81.4%。如蔗糖浓度继续提高,连翘脂素的转化得率反而迅速下降,但转化体系中并未残留未转化的连翘苷,说明蔗糖浓度过高,虽然菌体生长更加旺盛,但是产生了更多的连翘脂素的水解酶,其得率反而降低。
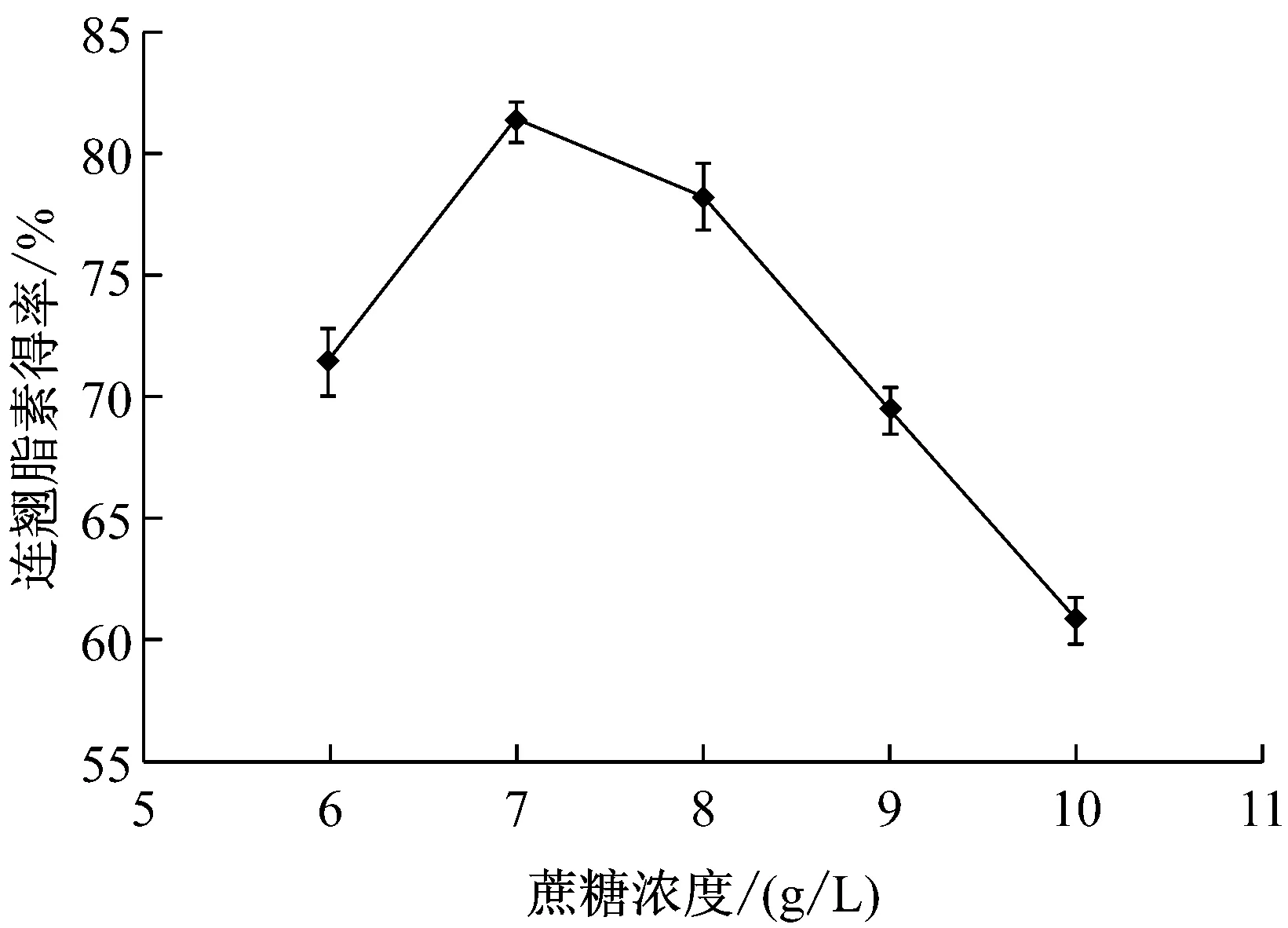
图4 蔗糖浓度对连翘脂素得率的影响
2.2.2 培养基氮源种类与浓度
初始产酶培养中的碳源改为7 g/L的蔗糖,并将其中的蛋白胨替换成浓度为5 g/L的酵母浸出粉或牛肉膏,或替换为浓度为3 g/L的(NH4)2SO4和NH4Cl,以选出较佳的氮源。结果表明氮源为(NH4)2SO4时,连翘脂素的转化得率最高,达到了83.8%。实验进而考察了(NH4)2SO4浓度对连翘脂素得率的影响,结果见图5。

图5 (NH4)2SO4的浓度对连翘脂素得率的影响
由图5可以看出,在(NH4)2SO4浓度从2 g/L增加到5 g/L时,连翘脂素的得率随(NH4)2SO4浓度增加而提高;(NH4)2SO4浓度继续提高,得率则不再增加,所以较佳的(NH4)2SO4浓度为5 g/L,此时连翘脂素的转化得率为86.5%。
2.2.3 培养基初始pH
考察不同培养基初始pH对连翘脂素得率的影响,在转化培养基组成为蔗糖7 g/L,(NH4)2SO45 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO40.5 g/L时,用浓度为2 mol/L的HCl或NaOH调节培养基初始pH。在底物浓度为10 mg/L时,连翘脂素的转化得率见图6。
由图6可以看出,培养基初始pH对连翘脂素得率影响较大,偏低或偏高都不利于菌体产酶转化连翘苷,适宜的pH范围应在5~7之间,最适pH为6。
2.3 转化条件的优化
2.3.1 酶源方式
将产酶培养好的桔青霉LB发酵液分为4种酶源方式转化连翘苷,即发酵液、滤液、菌体重悬于pH 6.0、0.2 mol/L的磷酸盐缓冲液以及菌体悬液经超声破碎,在底物浓度均为10 mg/L的条件下,转化连翘苷生成连翘脂素的得率见图7。

图6 培养基初始pH对连翘脂素得率的影响
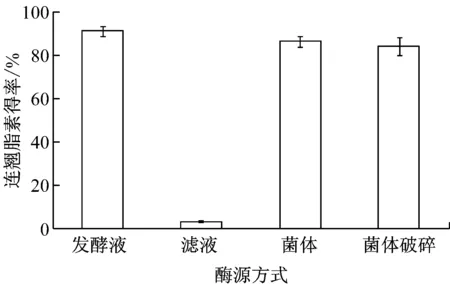
图7 不同酶源方式对连翘脂素得率的影响
由图7可以看出,与发酵液中直接加入底物转化相比,去除菌体的滤液作为酶源进行转化时,连翘脂素的得率仅为3.17%;而菌体重新悬浮于缓冲液转化连翘苷,连翘脂素的得率与发酵液直接转化无显著性差异(P>0.05),说明转化连翘苷的糖苷酶存在于菌体中。菌体悬浮于缓冲液转化,虽然增加了操作步骤,但不含菌体的代谢产物,有利于连翘脂素的分离纯化。此外,菌体悬浮于缓冲液并经超声破碎后转化连翘苷,连翘脂素的得率与未破碎也无显著差异(P>0.05),说明细胞壁和细胞膜没有构成转化过程中的传质障碍。
2.3.2 菌体稀释倍数
菌体培养结束后,发酵液经过滤收集菌体,菌体用原发酵液体积的1~5倍体积的磷酸盐缓冲液悬浮,在底物浓度为10 mg/L时,连翘脂素的得率见图8。
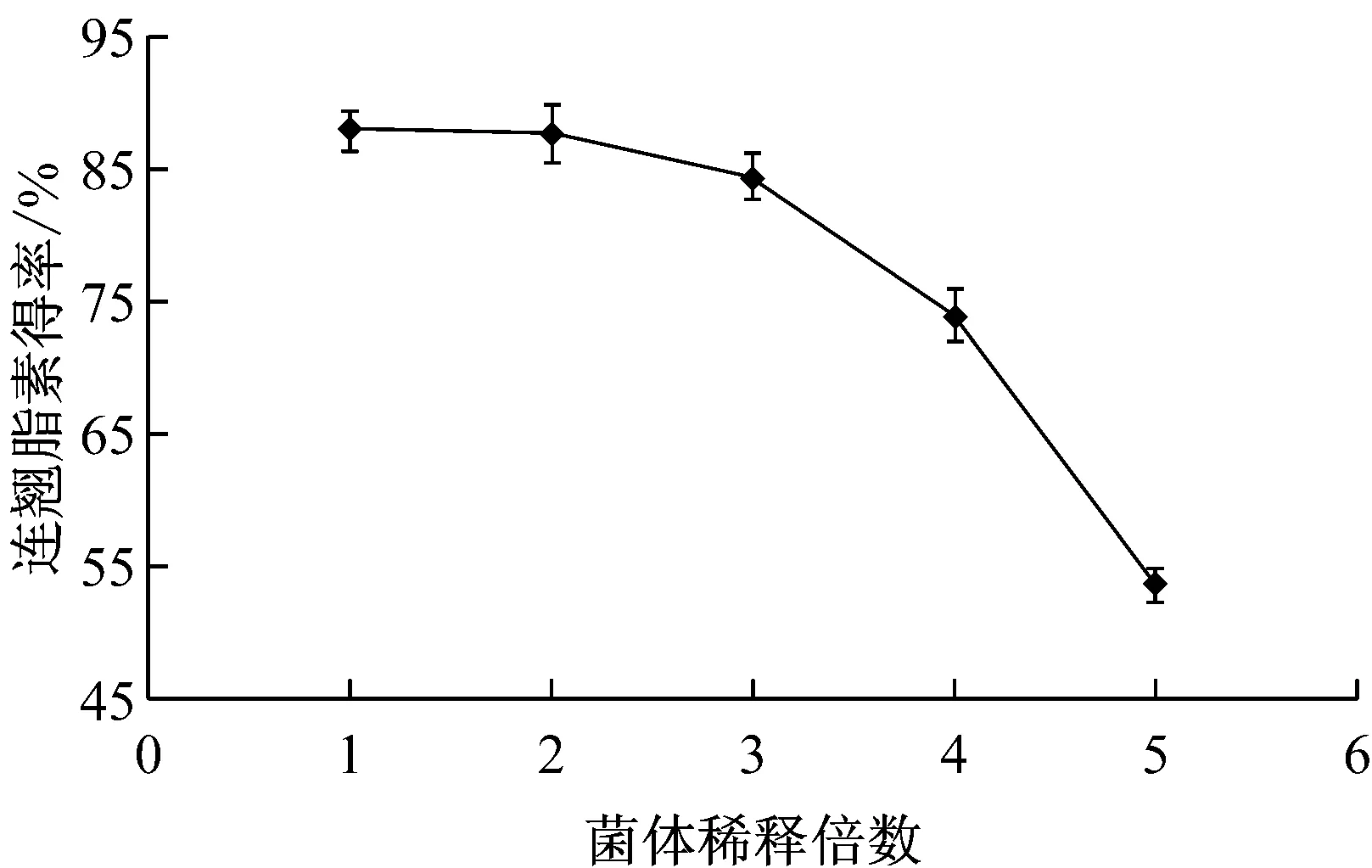
图8 菌体稀释倍数对连翘脂素得率的影响
由图8中可以看出,菌体悬浮于1~3倍发酵液体积的缓冲液中,连翘脂素的得率没有显著差异(P>0.05),将菌体悬浮于大于原发酵液体积的缓冲液,无疑可以降低菌体的使用量,有利于节约菌体发酵的成本。
2.3.3 底物浓度
将发酵液过滤后,菌体用2倍发酵液体积的缓冲液悬浮,加入不同浓度的底物连翘苷,30 ℃转化18 h,连翘脂素的得率见图9。

图9 连翘苷的浓度对根皮素转化的影响
由图9中可以看出,连翘苷的浓度增加到2 g/L,连翘脂素的得率仍然保持在90%以上,继续增加连翘苷浓度,连翘脂素的得率则显著下降,为了保证有较高的转化得率,减少底物的消耗,所以适宜的底物浓度为2 g/L。
2.3.4 转化时间
桔青霉LB的发酵液经过滤后,菌体用2倍发酵液体积的缓冲液悬浮菌体,加入2 g/L的底物连翘苷,30 ℃条件下转化不同时间,连翘脂素的得率见图10。
由图10中可以看出,随着转化时间的延长,连翘脂素的得率不断增加,在20 h时达到最大值,连翘脂素的得率为94.1%,之后则有所下降,说明菌体中也存在一些分解连翘脂素的酶类,所以,在底物浓度为2 g/L时,适宜的转化时间为20 h左右。
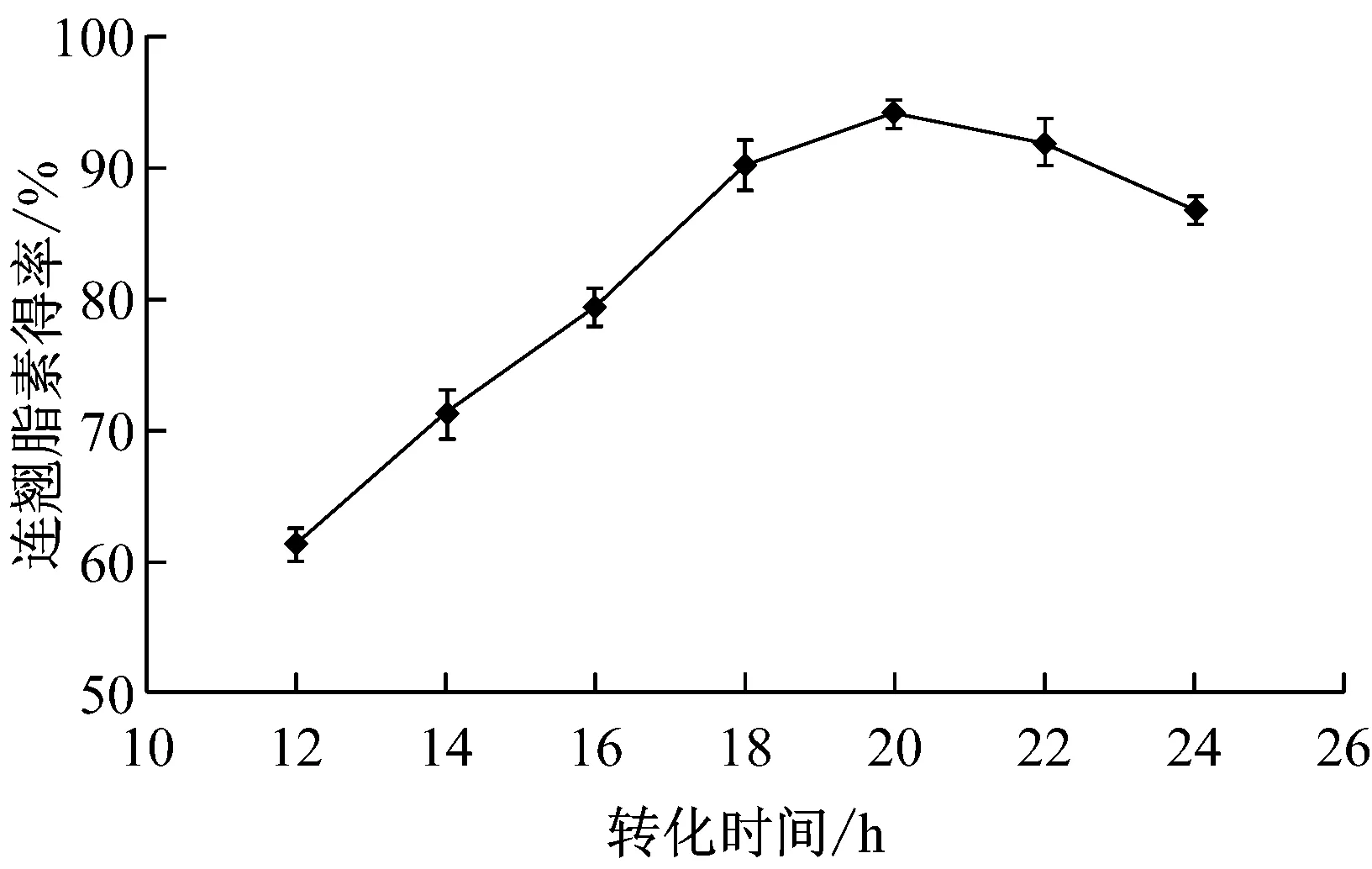
图10 转化时间对连翘脂素得率的影响
3 结论
连翘苷切去葡萄糖残基的苷元—连翘脂素,在抗肿瘤和治疗肝纤维化与肝损伤等方面有更好的药用价值,但由于生产方法不成熟而未被大规模开发利用,微生物转化法具有成本低廉,生产周期短,产物较易分离纯化等优点,目前已被用于多种药物、精细化学品和香精香料的生产[13-15]。中药有效成分经微生物转化后,可以提高药理活性、降低毒副作用或者改善药代特性,对中药现代化有重要作用。本研究从土壤中筛选出一株桔青霉能将连翘苷转化成连翘脂素,且几乎不产生水解酶。经过培养基主要成分及pH和转化条件优化后,在底物浓度为2 g/L时,菌体用2倍发酵液体积的缓冲液悬浮,30 ℃条件下转化20 h,连翘脂素的转化得率高达94.1%,转化液用乙酸乙酯萃取分离,分离物中主要是连翘脂素和少量的连翘苷,几乎不含菌体代谢物质,连翘脂素的纯度可达85%以上,进一步纯化将非常容易。研究结果对连翘和连翘苷的开发利用提供了新的方向,方法具有工艺简单,生产周期短、产物易于纯化的优点,具有一定的工业利用价值。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:159.
[2] 曲欢欢.连翘化学成分和生物活性研究[D].西安:西北大学,2008.
[3] Su W, Xu H, Huang H. Effects of the extract ofForsythiasuspensaon influenza A H1N1 infectioninvitro[J]. Journal of Medicinal Plant Research, 2010, 4(14): 1468-1471.
[4] 刘明.中药连翘药理作用的研究近况[J].现代医药卫生,2007,23(16):2438-2439.
[5] 毛威.连翘化学成分及其杭肿瘤活性的研究[D].湖北:湖北中医学院,2009.
[6] 王恩力,姚景春,刘铮.连翘苷元对大鼠免疫性肝纤维化的影响[J].药物评价研究,2015,38(2):161-164.
[7] 赵志全,姚景春,冯芹等.连翘苷元在制备预防或治疗肝损伤或肝衰竭药物中的应用:中国,201510249870.7 [P].2015-11-25.
[8] 李芸霞,蒋学华,周静.大鼠在体吸收连翘苷的机理研究[J].华西药学杂志,2005,20(5):387-390.
[9] 刘西哲,生宁,霍好利等.大鼠肠内菌转化连翘苷的代谢产物[J].中国医药工业杂志,2012,43(6):455-458.
[10] 樊宏宇,富力.纤维素酶水解连翘苷制备连翘脂素的研究[J].吉林中医药,2014,34(4):403-405.
[11] 樊宏宇,富力.一种制备抗病毒药物连翘脂素的方法:中国,201410387568.3[P].2016-2-17.
[12] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:241.
[13] 杨莉萍,崔志超,高芳等.融粘帚霉对葛根素的生物转化研究[J].工业微生物,2011,41(2):47-50.
[14] 高芳,于丽娟,王兆慧等.一株柚皮苷羟基化真菌的筛选及鉴定[J].工业微生物,2012,42(2):23-27.
[15] 李洋,邱智东,王伟楠.中药生物转化技术研究进展[J].中国酿造,2015,34(7):15-19.
Production of phillygenin from phillyrin by microbial bioconversion
MEI Jian-feng, DONG Zhi-hong, YI Yu, CHEN Jian-shu, ZHANG Yan-lu, YING Guo-qing
College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China
A bioconversion process was developed for production of phillygenin from its glycosidic form—phillyrin. A strain ofPenicilliumcitrinumdesignated as LB was isolated from the soil, which could specifically produce enzyme for bioconversion of phillyrin to phillygenin. After main composition for LB strain producing enzyme and bioconversion conditions were optimized, a high molar yield of phillygenin could be obtained. The optimized medium contained sucrose 7 g/L, (NH4)2SO45 g/L, NaCl 5 g/L, KH2PO45 g/L, MgSO41 g/L, MnSO40.5 g/L, with pH 6.0. After the strain LB was cultivated in enzyme-producing medium for 2 days, the cells were harvested by filtration and suspended in pH 6.0 phosphate buffer at the volume of 2 times of the culture. 2 g/L of phillyrin was added in the cell suspension, and the bioconversion was carried out at 30 ℃, 200 r/min for 20 h. The molar yield of phillygenin could reach 94.1%. The developed process had advantages of simple operation, high productivity, convenience for product purification and less by-products, which might be a potential way for production of phillygenin in the pharmaceutical industry.
phillyrin; phillygenin; bioconversion;Penicilliumcitrinum
10.3969/j.issn.1001-6678.2016.06.002
梅建凤(1973~),男,博士,副教授。电话:0571-88871029,E-mail:mrion@zjut.edu.cn。

