曲美他嗪治疗缺血性心肌病效果的荟萃分析
皮阳 魏宝柱 钱成 吴慧婷 曹建雷 冯鸿 王扬淦
210008 南京大学医学院附属鼓楼医院重症医学科(皮阳);430071 武汉大学中南医院心血管内科(魏宝柱、钱成、曹建雷、冯鸿、王扬淦);435500 武汉,长江航运总医院心血管内科(吴慧婷)
·荟萃分析·
曲美他嗪治疗缺血性心肌病效果的荟萃分析
皮阳 魏宝柱 钱成 吴慧婷 曹建雷 冯鸿 王扬淦
210008 南京大学医学院附属鼓楼医院重症医学科(皮阳);430071 武汉大学中南医院心血管内科(魏宝柱、钱成、曹建雷、冯鸿、王扬淦);435500 武汉,长江航运总医院心血管内科(吴慧婷)
目的 评估曲美他嗪治疗缺血性心肌病患者的疗效。方法在PubMed,EMBASE和Cochrane等数据库中进行系统性文献检索,检索时限为2015年3月以前,并在各纳入文献和相关综述的引文目录中寻找额外的合适的研究。采用固定或随机效应模型计算合并危险比(RR)和加权平均差(WMD)。结果共纳入13项随机对照试验共737例接受曲美他嗪或安慰剂治疗的缺血性心肌病患者。曲美他嗪可以明显改善左心室射血分数(WMD=6.98,95%CI:5.52~8.45,Z=9.35,P<0.001),6 min步行距离(WMD=83.39,95%CI:21.36~145.43,Z=2.63,P=0.008)和纽约心功能分级(NYHA)(WMD=4.28,95%CI:-0.95~-0.35,Z=4.28,P<0.001)。此外,曲美他嗪还显著降低左心室收缩末期内径(WMD=-6.14,95%CI:-7.55~-4.74,Z=8.57,P<0.001),左心室舒张末期内径(WMD=-5.23,95%CI:-6.04~-4.41,Z=12.57,P<0.001),左心室收缩末期容量(WMD=-13.22,95%CI:-21.89~-4.56,Z=2.99,P=0.003),左心室舒张末期容量(WMD=-11.36,95%CI:-14.22~-8.50,Z=7.79,P<0.001),室壁运动评分指数(WMD=-0.22,95%CI: - 0.33~-0.11,Z=3.99,P<0.001),心血管事件和住院率(RR=0.35,95%CI:0.22~0.56,Z=1.74,P<0.001)。然而,在CRP水平和全因死亡率,曲美他嗪和安慰剂比较差异无统计学意义。结论在缺血性心肌病患者中,曲美他嗪可以有效改善临床症状和心功能,并且可以减少心脏原因的住院风险。
曲美他嗪; 缺血性心肌病; 随机对照试验; 系统评价; Meta分析
缺血性心肌病(ischemiccardiomyopathy,ICM)是由冠状动脉粥样硬化引起的心肌长期缺血,导致心肌弥漫性纤维化,产生与原发性扩张型心肌病类似的综合征。随着冠心病发病率的不断上升,ICM对人类健康所造成的危害日渐严重。1995年WHO/ISFC对ICM的定义为:表现为扩张型心肌病,伴收缩功能损害,是由于心肌长期缺血引起的,故其发病与冠心病有着密切联系[1]。
曲美他嗪是作用于心肌代谢的药物,其作用机制是抑制线粒体内长链3-酮酰辅酶A硫解酶(3-ketoacyl coenzyme A thiolase)[2],使能量代谢从脂肪酸氧化转移到葡萄糖氧化,利用有限的氧产生更多的ATP并增加磷脂的合成,从而使心肌细胞的能量产生最优化[3]。通过抑制脂肪酸的β氧化途径,刺激糖代谢,从而增加心肌对缺血损伤的耐受能力[4]。
目前有4项Meta分析评价了曲美他嗪在心衰方面的治疗效果,但在某些结论上仍然存在争议,因为4项Meta分析纳入的研究中,并不是所有的参与者都是缺血原因所致的心功能障碍[5-8]。最近的一项研究认为对于非缺血所致的心功能障碍患者,曲美他嗪并不能明显改善左室射血分数、运动耐量和生活质量[9]。很多随机临床试验已经来评估曲美他嗪在ICM患者临床症状、心功能、运动耐量、生活质量、死亡率、心血管事件和住院率方面的疗效。但到目前为止,尚无Meta分析来评价曲美他嗪在ICM中的治疗效果。因此,我们纳入13项RCT来进行Meta分析,探讨曲美他嗪治疗ICM的有效性。
1 资料和方法
1.1 文献检索方法
在PubMed,Embase和Cochrane图书馆等数据库中检索2015年3月以前的相关文献,英文关键词为“trimetazidine”、“ischemic cardiomyopathy”、“randomized controlled trials”,中文检索词为“曲美他嗪”、“ICM”、“随机对照试验”,并在参考文献目录中的研究和综述中寻找额外的合适的研究。
1.2 文献纳入标准
研究设计:曲美他嗪对ICM的治疗效果的随机对照试验(RCT),无语言、人种和发表状态的限制。治疗的持续时间应不少于两个月。
研究对象:年龄>18岁的ICM患者,符合WHO/ISFC制定的ICM诊断标准。
干预措施:试验组给予40~70 mg/d,口服,其他常规治疗与对照组相同;对照组给予安慰剂及硝酸酯类、抗血小板药物、他汀类药物、β受体阻滞剂等常规药物治疗。
结局指标:(1)全因死亡率,心血管事件和住院治疗率;(2)左心室结构和功能(如左室射血分数,左室收缩末期内径、左室舒张末期内径、左室收缩末期容积、左室舒张末期容积和室壁运动评分指数);(3)心脏功能[如纽约心功能(NYHA)分级和6 min步行距离];(4)血清标记物[如血清C反应蛋白(CRP)水平]。
1.3 文献排除标准
(1)重复文献;(2)综述;(3)非RCT;(4)含有特发性扩张型心肌病,高血压心肌病和瓣膜性心肌病等病例的临床试验;(5)数据不完整且索取未果。
1.4 资料提取
两位研究者独立分析所有可能符合条件的研究并提取各研究的相关数据。在数据提取和分析中的差异通过第三位研究员组织讨论或协商解决。内容包括:研究者、曲美他嗪组合对照组样本量、平均年龄、结局指标相关参数、曲美他嗪剂量等。
1.5 纳入文献质量评价
采用Jadad评分[10],进行评价通过以下5个标准进行:(1)是否分配隐藏;(2)是否生成随机序列;(3)是否盲法;(4)是否随访;(5)是否有对失访或退出描述。
1.6 统计学方法
使用风险比(RR)和95%置信区间(CI)对二分类数据进行分析,并采用加权平均差(WMD)对连续变量进行分析。采用I2统计量行异质性分析,当存在显著异质性(P<0.1,I2>50%)的时候,采用随机效应模型,否则采用固定效应模型。通过敏感性分析(每次排除一项研究)来评估每个功效指标的稳定性。此外,通过Begg检验和Egger回归不对称分析来检验发表偏倚。数据分析通过STATA12.0(StataCorp,College Station,Texas)进行。
2 结果
2.1 检索结果及纳入研究特征
初检共检索到129篇相关文献,通过查看摘要或全文,最终共13项RCT[11-23]满足纳入标准。共纳入737例受试者,其中曲美他嗪组368例,安慰剂组369例。在所有纳入的研究中,曲美他嗪都通过口服给药,剂量在每日40~70 mg之间,时间持续2~48个月。在这13项研究中,11项研究中描述了左室射血分数[11-18,20-22],5项描述了NYHA心功能分级[15-16,18-20,23],5项左室舒张末期容积[12-13,15,18,20],4项左室收缩末期容积[12-13,15,20],4项室壁运动评分指数[14-15,17,20],3项左室舒张末期内径[13-15],3项左室收缩末期内径[13-15],3项6 min步行距离[18-20],3项全因死亡率[16-17,19],2项CRP[16,21]和2项心血管事件及入院风险[15,19]。纳入试验的特征见表1。
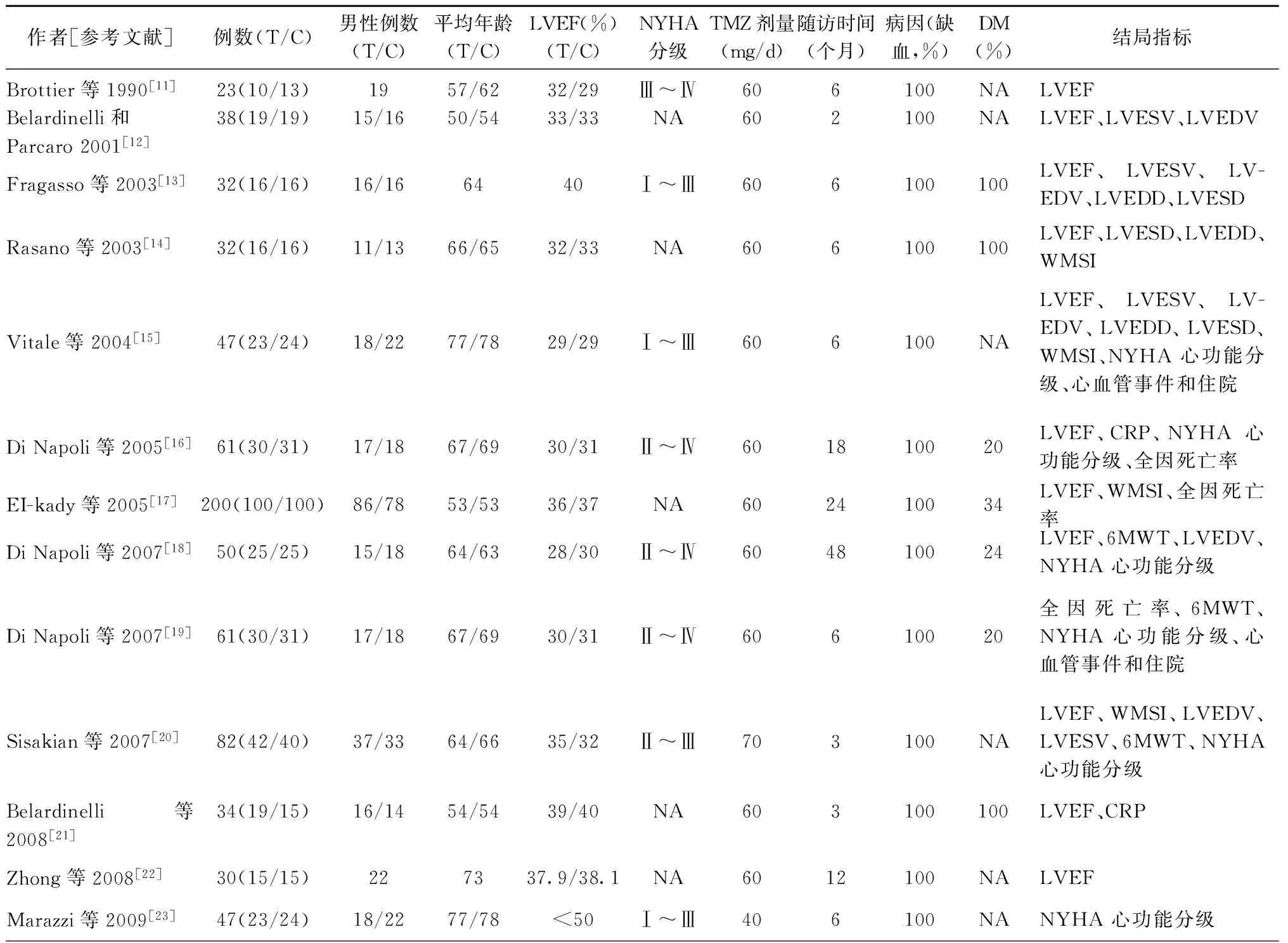
表1 纳入各研究特征

表2 Jadad量表评价纳入RCT的质量
2.2 纳入文献质量评价
Jadad量表是基于随机性描述、随机序列生成、盲法、随访、失访或退出描述的评分,分数从2分到5分(表2)。大部分纳入的研究的Jadad评分都超过3分,表明绝大多数研究是高质量的。
2.3 曲美他嗪治疗效果评价
全因死亡率、心血管事件和住院率的研究结果显示曲美他嗪组全因死亡率并不比安慰剂组低(RR=0.43,95%CI:0.16~1.12,Z=1.73,P=0.083)(图1)。此外,与安慰剂组相比,曲美他嗪可以减少心血管事件和住院治疗(RR= 0.35,95%CI:0.22~0.56,Z=1.74,P<0.001)(图2)。
左心室结构和功能的Meta分析结果显示,加用曲美他嗪治疗在左室射血分数改善上优于标准治疗(WMD=6.98,95%CI:5.52~8.45,Z=9.35,P<0.001)(图3)。此外,曲美他嗪治疗显著降低左室收缩末期内径(WMD=-6.14,95%CI:-7.55~-4.74,Z=8.57,P<0.001),左室舒张末期内径(WMD=-5.23,95%CI:-6.04~-4.41,Z=12.57,P<0.001),左室收缩末期容积(WMD=-13.22,95%CI:-21.89~-4.56,Z=2.99,P=0.003)和左室舒张末期容积(WMD=-11.36,95%CI:-14.22~-8.50,Z=7.79,P<0.001)。此外,曲美他嗪疗法也与室壁运动评分指数下降有明显相关性(WMD=-0.22,95%CI:-0.33~-0.11,Z=3.99,P<0.001),表3。
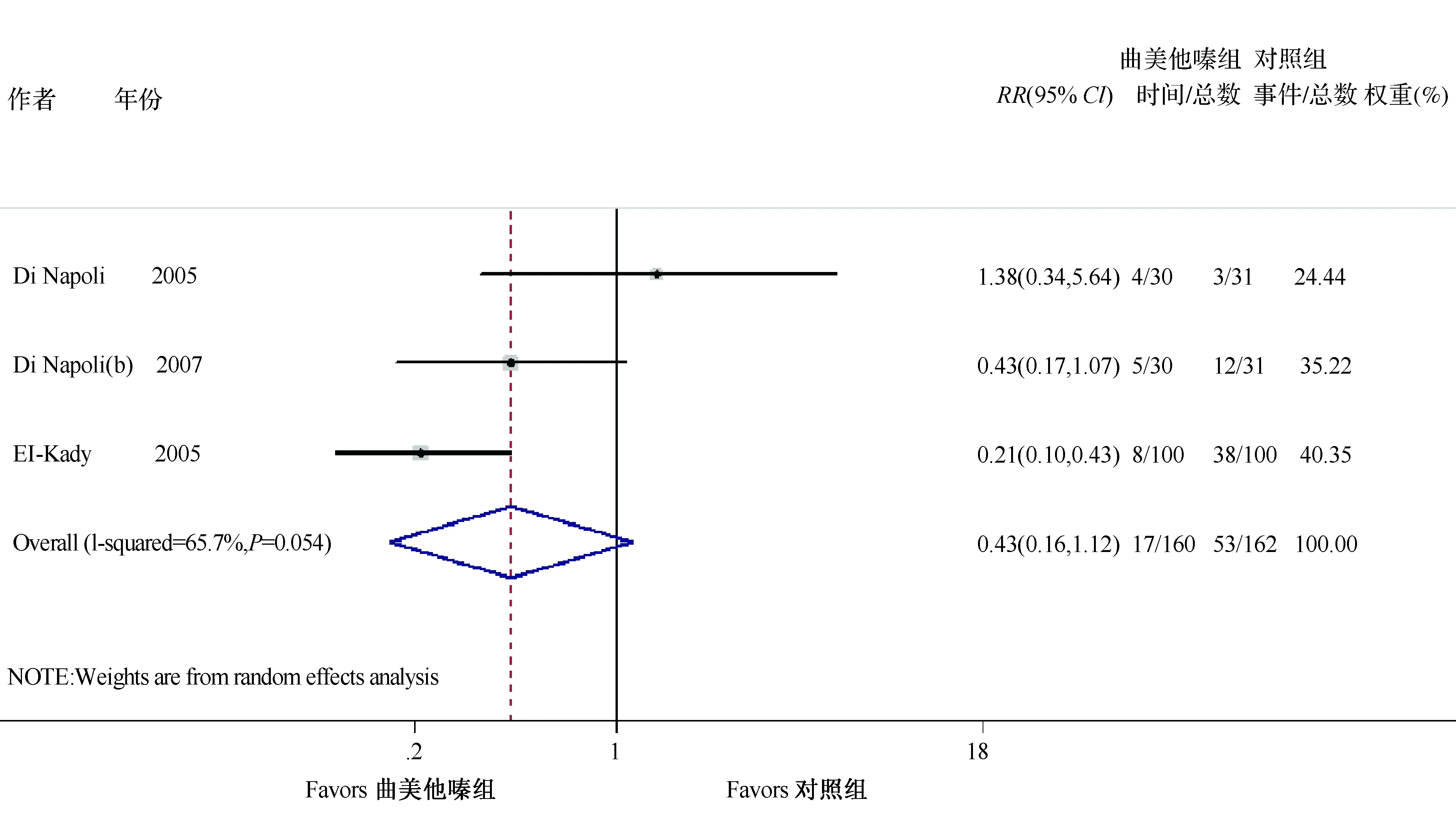
图1 全因死亡率森林图

图2 心血管事件和入院风险森林图

表3 各结局指标的WMD及95%CI
心功能Meta分析显示曲美他嗪组在改善NYHA分级(WMD=4.28,95%CI:-0.95~-0.35,Z=4.28,P<0.001),6 min步行距离(WMD=83.39,95%CI:21.36~145.43,Z=2.63,P= 0.008)较安慰剂组更为有效。
曲美他嗪组与安慰剂组血清标志物相比,血清CRP水平并没有显著减少(WMD=-2.52,95%CI:-5.05~0.00,Z=1.96,P=0.05)(表3)。纳入的13项研究中未提到曲美他嗪引起的不良反应。敏感性分析每次删除一篇文献后,未发现任何效应指标有明显改变。发表偏倚通过Egger检验(P=0.646)和Begg检验(P=0.876),在LVEF方面未发现发表偏倚。
3 讨论
此Meta分析的主要发现是加用曲美他嗪可以使ICM患者在LVEF、6 min步行距离、NYHA分级方面获益。曲美他嗪与安慰剂相比也可以使左室收缩末期内径、左室舒张末期内径、左室收缩末期容积、左室舒张末期容积、室壁运动评分指数和心血管事件和住院风险显著下降。然而在标准疗法基础上增加使用曲美他嗪并不能降低ICM患者全因死亡率和CRP水平。
越来越多的证据表明,左室功能不全伴ICM患者发病的主要原因是底物能量代谢的变化[24]。通过代谢途径起作用的抗缺血药物曲美他嗪已被证实是治疗慢性稳定性心绞痛的有效药物[25-26],它既不影响血压也不影响心率。因此,曲美他嗪可能有巨大的潜力作为辅助治疗来治疗ICM[27]。
曲美他嗪有效的抗缺血效应被认为是通过降低脂肪酸氧化和提高葡萄糖氧化[28]介导的,从而产生更多ATP[27]。此外,值得注意的是曲美他嗪通过还原磷酸化过程,抑制炎症反应,氧化损伤,细胞凋亡[29-30],降低H+产生,降低缺血区域Na+、Ca2+积累,保护缺血区线粒体功能和ATP水平[31],以及改善内皮细胞功能和冠状动脉微循环功能来起到心脏保护作用。
曲美他嗪可能在心肌重构中发挥有益作用,此外,炎性介质参与ICM的发病,而曲美他嗪的抗炎症作用已被证实。此Meta分析未能发现曲美他嗪对CRP有任何有益效果,可能由于纳入的研究样本量较小。
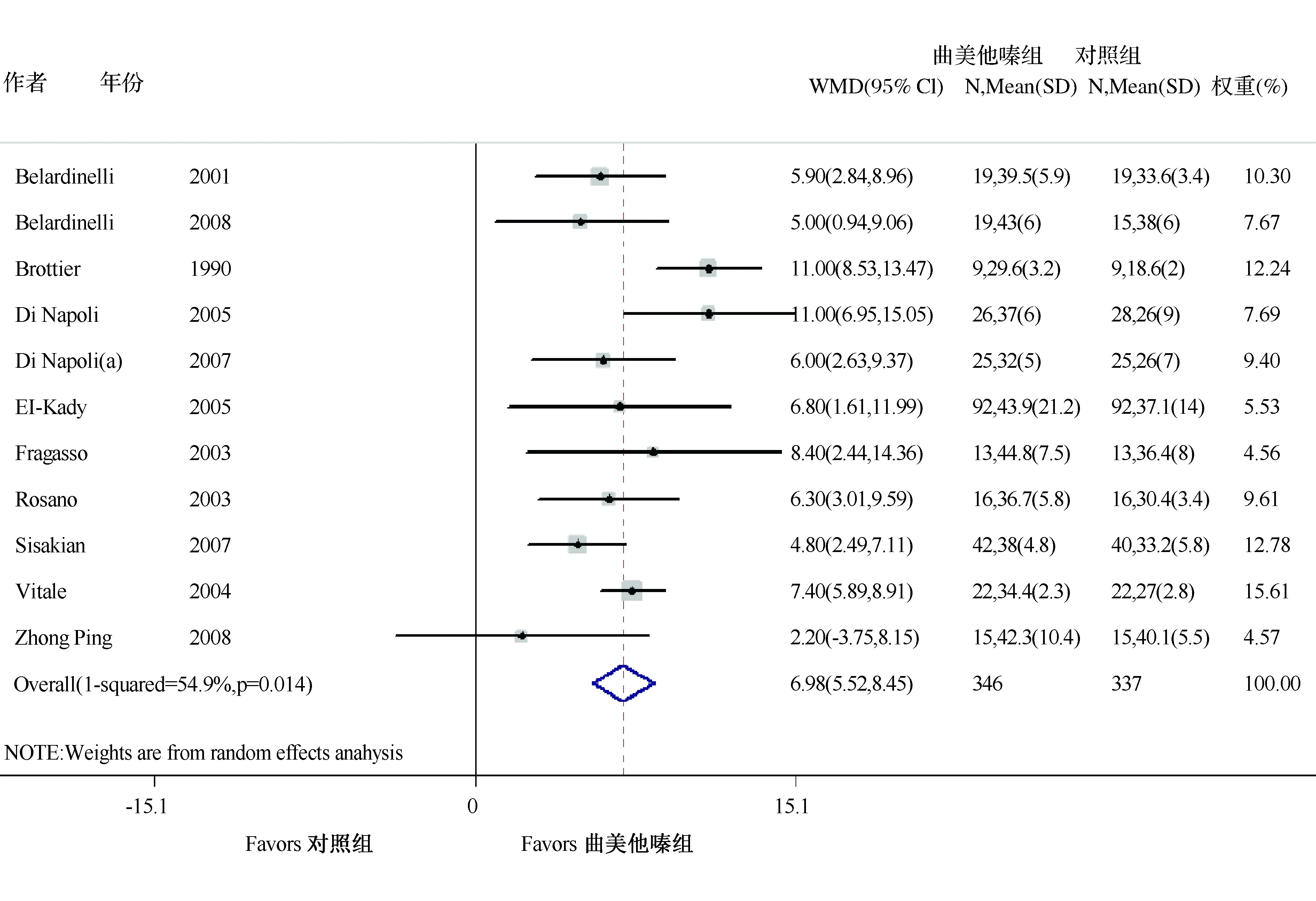
图3 射血分数森林图
在ICM患者中,曲美他嗪对死亡率和其他主要心血管事件的影响仍有争议。只有3项小样本RCT描述了全因死亡率,两项描述了心血管事件和入院风险。此Meta分析合并结果显示曲美他嗪可以明显降低心血管事件和入院风险。由于纳入的研究样本量较小,我们无法评估曲美他嗪对ICM患者死亡率的影响,这需要更大规模的RCT来证实。
此Meta分析也有一定的局限性。首先,纳入研究的方法学质量不理想。两项研究[17,21]是单盲设计,两项试验[20,22]是开放试验,并没有提到盲法。所以潜在的偏倚风险不能完全排除。其次,列入本Meta分析的患者人数规模较小,所以例如全因死亡率、CRP、心血管事件和入院风险等指标的评估只是基于相对少数患者的测量。此Meta分析试图纳入所有相关试验,并且观察到了患者一些获益(心功能、临床症状)与曲美他嗪治疗有关,但是由于样本量较小,我们不能排除高估临床获益的可能性,所以此Meta分析的结果应该谨慎解读。第三,我们没有获得所有患者的个人数据。最后,随访时间介于2个月至48个月,差异较大。治疗的持续时间的差异可能是异质性的主要来源。
总之,此Meta分析表明,曲美他嗪可以改善ICM患者心功能和临床症状,可以从NYHA分级和6 min步行距离的变化来体现。此外,经过长期治疗后,这些与曲美他嗪有关的功能的改善可以进一步减少心血管事件和入院风险。因此,未来需要更严格的多中心双盲大样本和长期随访的RCT来证实这些结论并指导临床治疗ICM。
利益冲突:无
[1] Richardson P,McKenna W,Bristow M,et al.Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies[J].Circulation,1996,93(5):841-842.DOI:10.1161/01.CIR.93.5.841.
[2] Xu X,Zhang W,Zhou Y,et al.Effect of trimetazidine on recurrent angina pectoris and left ventricular structure in elderly multivessel coronary heart disease patients with diabetes mellitus after drug-eluting stent implantation:a single-centre,prospective,randomized,double-blind study at 2-year follow-up[J].Clin Drug Investig,2014,34(4):251-258.DOI:10.1007/s40261-014-0170-9.
[3] Kantor PF,Lucien A,Kozak R,et al.The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-keroacyl coenzyme A thiolase[J].Circ Res,2000,86(5):580-588.DOI:10.1161/01.RES.86.5.580.
[4] Desideri A,Celegon L.Metabolic management of ischemic heart disease:clinical data with trimetazidine[J].Am J Cardiol,1998,82(5):50-53.
[5] Gao D,Ning N,Niu X,et al.Trimetazidine:a meta-analysis of randomized controlled trials in heart failure[J].Heart,2011,97(4):278-286.DOI:10.1136/hrt.2010.208751.
[6] Zhang L,Lu Y,Jiang H,et al.Additional use of trimetazidine in patients with chronic heart failure:a meta analysis[J].J Am Coll Cardiol,2012,59(10):913-922.DOI:10.1016/j.jacc.2011.11.027.
[7] Zhou X,Chen J.Is treatment with trimetazidine beneficial in patients with chronic heart failure[J]? Plos One,2014,9(5):e94660.DOI:10.1371/journal.pone.0094660.
[8] Grajek S,Michalak M.The effect of trimetazidine added to pharmacological treatment on all-cause mortality in patients with systolic heart failure[J].Cardiology,2015,131(1):22-29.DOI:10.1159/000375288.
[9] Winter JL,Castro PF,Quintana JC,et al.Effects of trimetazidine in nonischemic heart failure:a randomized study[J].J Card Fail,2014,20(3):149-154.DOI:10.1016/j.cardfail.2014.01.004.
[10] Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary[J]? Control Clin Trials,1996,17(1):1-12.DOI:10.1016/0197-2456(95)00134-4.
[11] Brottier L,Barat JL,Combe C,et al.Therapeutic value of a cardioprotective agent in patients with severe ischaemic cardiomyopathy[J].Eur Heart J,1990,11(3):207-212.
[12] Belardinelli R,Purcaro A.Effects of trimetazidine on the contractile response of chronically dysfunctional myocardium to low-dose dobutamine in ischaemic cardiomyopathy[J].Eur Heart J,2001,22(23):2164-2170.DOI:10.1053/euhj.2001.2653.
[13] Fragasso G,Piatti Md PM,Monti L,et al.Short and long-term beneficial effects of TMZ in patients with diabetes and ischemic cardiomyopathy[J].Am Heart J,2003,146(5):e18.DOI:10.1016/S0002-8703(03)00415-0.
[14] Rosano GM,Vitale C,Sposato B,et al.Trimetazidine improves left ventricular function in diabetic patients with coronary artery disease:a double-blind placebo-controlled study[J].Cardiovasc Diabetol,2003,28(2):e16.DOI:10.1186/1475-2840-2-16.
[15] Vitale C,Wajngaten M,Sposato B,et al.Trimetazidine improves left ventricular function and quality of life in elderly patients with coronary artery disease[J].Eur Heart J,2004,25(20):1814-1821.DOI:10.1016/j.ehj.2004.06.034.
[16] Di Napoli P,Taccardi AA,Barsotti A.Long term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy[J].Heart,2005,91(2):161-165.DOI:10.1136/hrt.2003.031310.
[17] El-Kady T,El-Sabban K,Gabaly M,et al.Effects of trimetazidine on myocardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy:a 24-month study[J].Am J Cardiovasc Drugs,2005,5(4):271-278.
[18] Di Napoli P,Di Giovanni P,Gaeta MA,et al.Beneficial effects of trimetazidine treatment on exercise tolerance and B-type natriuretic peptide and troponin T plasma levels in patients with stable ischemic cardiomyopathy[J].Am Heart J,2007,153(3):1-5.DOI:10.1016/j.ahj.2007.06.033.
[19] Di Napoli P,Di Giovanni P,Gaeta MA,et al.Trimetazidine and reduction in mortality and hospitalization in patients with ischemic dilated cardiomyopathy:a post hoc analysis of the Villa Pini D′Abruzzo TMZ trial[J].J Cardiovasc Pharmacol,2007,50(5):585-589.DOI:10.1097/FJC.0b013e31814fa9cb.
[20] Sisakian H,Torgomyan A,Barkhudaryan A.The effect of trimetazidine on left ventricular systolic function and physical tolerance in patients with ischaemic cardiomyopathy[J].Acta Cardiol,2007,62(5):493-499.DOI:10.2143/AC.62.5.2023413.
[21] Belardinelli R,Cianci G,Gigli M,et al.Effects of trimetazidine on myocardial perfusion and left ventricular systolic function in type 2 diabetic patients with ischemic cardiomyopathy[J].J Cardiovasc Pharmacol,2008,51(6):611-615.DOI:10.1097/FJC.0b013e31817bdd66.
[22] Zhong P,Wang WY,Song XF,et al.Effects of trimetazidine on myocardial metabolism evaluated by PET-CT in patients with ischemic cardiomyopathy[J].Zhonghua Xin Xue Guan Bing Za Zhi,2008,36(1):36-39.DOI:10.3321/j.issn:0253-3758.2008.01.009.
[23] Marazzi G,Gebara O,Vitale C,et al.Effect of trimetazidine on quality of life in elderly patients with ischemic dilated cardiomyopathy[J].Adv Ther,2009,26(4):455-461.DOI:10.1007/s12325-009-0024-7.
[24] Stanley WC,Recchia FA,Lopaschuk GD.Myocardial substrate metabolism in the normal and failing heart[J].Physiol Rev,2005,85(3):1093-1129.DOI:10.1152/physrev.00006.2004.
[25] Szwed H,Pachocki R,Domzal-Bochenska M,et al.Efficacy and tolerance of trimetazidine,a metabolic antianginal,in combination with a hemodynamic antianginal in stable exertion angina:TRIMPOL Ⅰ,a multicenter study[J].PresseMed,2000,29(10):533-538.
[26] Szwed H,Sadowski Z,Elikowski W,et al.Combination treatment in stable effort angina using trimetazidine and metoprolol:results of a randomized,double-blind,multicentre study(TRIMPOL Ⅱ)[J].Eur Heart J,2001,22(24):2267-2274.DOI:10.1053/euhj.2001.2896.
[27] Bertomeu-Gonzalez V,Bouzas-Mosquera A,Kaski JC.Role of trimetazidine in management of ischemic cardiomyopathy[J].Am J Cardiol,2006,98(5):19-24.DOI:10.1016/j.amjcard.2006.07.005.
[28] Fantini E,Demaison L,Sentex E,et al.Some biochemical aspects of the protective effect of trimetazidine on rat cardiomyocytes during hypoxia and reoxygenation[J].J Mol Cell Cardiol,1994,26(8):949-958.DOI:10.1006/jmcc.1994.1116.
[29] Khan M,Meduru S,Mostafa M,et al.Trimetazidine,administered at the onset of reperfusion,ameliorates myocardial dysfunction and injury by activation of p38 mitogen-activated protein kinase and Akt signaling[J].J Pharmacol Exp Ther,2010,333(2):421-429.DOI:10.1124/jpet.109.165175.
[30] Yin RX,Liang WW,Liu TW,et al.Inhibitory effect of trimetazid-ine on cardiac myocyte apoptosis in rabbit model of ischemia-reperfusion[J].Chin Med Sci J,2004,19(4):242.
[31] Wisel S,Khan M,Kuppusamy ML,et al.Pharmacological preconditioning of mesenchymal stem cells with trimetazidine(1-[2,3,4-trimethoxybenzyl]piperazine)protects hypoxic cells against oxidative stress and enhances recovery of myocardial function in infarcted heart through Bcl-2 expression[J].J Pharmacol Exp Ther,2009,329(2):543-550.DOI:10.1124/jpet.109.150839.
(本文编辑:周白瑜)
Meta-analysis of efficacy of trimetazidine on treatment of ischemic cardiomyopathy
PiYang,WeiBaozhu,QianCheng,WuHuiting,CaoJianlei,FengHong,WangYanggan
IntensiveCareUnit,NanjingDrumTowerHospital,theAffiliatedHospitalofNanjingUniversity,Nanjing210008,China(PiY);DepartmentofCardiology,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China(WeiBZ,QianC,CaoJL,FengH,WangYG);DepartmentofCardiology,YangtzeRiverShippingGeneralHospital,Wuhan435500,China(WuHT)
WangYanggan,Email:ygwang2013@163.com
Objective To assess the treatment effect of trimetazidine (TMZ) in patients with ischemic cardiomyopathy. Methods An extensively systemic search of three computerized databases (PubMed,EMBASE and Cochrane databases) was performed up to March 2015,and additional appropriate studies were searched in the citations of each included literature and related reviews.Pooled risk ratio (RR) and weighted mean differences (WMD) were calculated using fixed or random effects models. Results Thirteen randomized controlled trials (RCTs) involving 737 ischemic cardiomyopathy patients treated with TMZ or placebo were included.TMZ therapy was significantly associated with improvement of left ventricular ejection fraction (WMD=6.98,95%CI:5.52 to 8.45,Z=9.35,P<0.001),6 minute walk distance (WMD=83.39,95%CI:21.36 to 145.43,Z=2.63,P=0.008) and NYHA classification (WMD=4.28,95%CI:-0.95 to -0.35,Z=4.28,P<0.001).Moreover,TMZ treatment also markedly reduced left ventricular end-systolic diameter (WMD=-6.14,95%CI:-7.55 to -4.74,Z=8.57,P<0.001),left ventricular end-diastolic diameter (WMD=-5.23,95%CI:-6.04 to -4.41,Z=12.57,P<0.001),left ventricular end-systolic volume (WMD=-13.22,95%CI:-21.89 to -4.56,Z=2.99,P=0.003),left ventricular end-diastolic volume (WMD=-11.36,95%CI:-14.22 to -8.50,Z=7.79,P<0.001),wall motion score index (WMD=-0.22,95%CI:-0.33 to -0.11,Z=3.99,P<0.001),and cardiovascular events and hospitalization (RR=0.35,95%CI:0.22 to 0.56,Z=1.74,P<0.001).However,there was no significant difference in C-reactive protein levels and all-cause mortality between TMZ and control group. Conclusions In patients with ischemic cardiomyopathy,TMZ treatment could effectively improve clinical symptoms and cardiac function,and reduce the risk of hospitalization for cardiac causes.
Trimetazidine; Ischemic cardiomyopathy; Randomized controlled trial; Systematic review; Meta-analysis
王扬淦,电子信箱:ygwang2013@163.com
10.3969/j.issn.1007-5410.2016.06.012
2016-02- 08)