在线固相萃取-高效液相色谱检测饮料中5种食用合成色素
蒋树新,刘华良,马永建*,阮丽萍
(1.东南大学 公共卫生学院,江苏 南京 210009;2.江苏省疾病预防控制中心,江苏 南京 210009)
在线固相萃取-高效液相色谱检测饮料中5种食用合成色素
蒋树新1,2,刘华良1,2,马永建1,2*,阮丽萍2
(1.东南大学 公共卫生学院,江苏 南京 210009;2.江苏省疾病预防控制中心,江苏 南京 210009)
建立了同时测定饮料中5种食用合成色素的在线固相萃取-高效液相色谱-紫外检测(Online-SPE-HPLC-UV)方法。饮料样品用水稀释并经0.45 μm微孔滤膜过滤后,在线固相萃取柱(Acclaim 120 C18)净化,反相 C18分析柱分离,梯度洗脱,紫外检测器检测。结果表明:5种食用合成色素在0.5~20 mg/L浓度范围内线性关系良好,相关系数(r2)均大于0.999 9,检出限为0.02~0.08 mg/kg,3个水平下的加标回收率为94.5%~103.0%,相对标准偏差为0.4%~2.7%。该研究为快速准确地分离测定饮料中的食用合成色素提供了有效方法。
在线固相萃取;食用合成色素;饮料;高效液相色谱
合成色素,又称合成着色剂,是指用人工化学合成的方法制得的有机化合物,主要以煤焦油中提炼出的苯胺染料为原料制得。与天然色素相比,合成色素具有色泽鲜艳、性质稳定、价格低廉等优势[1],在食品加工过程中常被用来改善食品的感官性质[2]。大量研究表明,过量的合成色素及其分解产物会对人体健康产生潜在危害,包括急性中毒、慢性中毒、致突变性、致畸性、致敏性以及胚胎毒性等,甚至致癌[3]。
已有不少研究建立了合成色素的检测方法。目前合成色素的提取方法大多为离线提取,比如液液萃取法(LLE)[4-5]、固相萃取法(SPE)[6-9]、QuECHERs法[10]、聚酰胺吸附法[11],以及近年发展起来的磁分散固相萃取(M-dSPE)[12]和加速溶剂萃取(ASE)[13]等。但这些方法大多样品前处理过程复杂,需耗费大量时间、人力物力和有机溶剂。本研究首次建立了饮料中5种食用合成色素的在线分析方法,样品经稀释过滤后直接上样,具有简单、快速、准确的特点,且简化了分析步骤,减少了有机溶剂的使用。
1 实验部分
1.1 仪器与试剂
双三元液相色谱系统(美国 Thermo Fisher 公司),配备DGP-3600RS泵、WPS-3000自动进样器、TCC-3X00(RS)柱温箱(配1个六通阀)、VWD-3X00(RS)检测器;Chromeleon 7.0变色龙色谱管理软件;Milli-Q超纯水纯化系统(美国Millipore公司);涡旋混合器(美国 Scientific Industries公司);分析天平(梅特勒-托利多仪器(上海)有限公司);超声波清洗器(德国Elma 公司)。
甲醇(色谱纯,德国默克股份两合公司);乙酸铵(分析纯,南京化学试剂有限公司);实验用水为超纯水;苋菜红、胭脂红、日落黄、亮蓝购自国家标准品物质中心,浓度均为0.5 mg/mL;诱惑红(80%)购自Laboratories of Dr.Ehrenstorfer(德国)。
1.2 样品处理
称取饮料样品5.0 g(含二氧化碳样品需超声振荡去除二氧化碳,精确至0.01 g),用水稀释定容至10 mL,混匀过0.45 μm微孔滤膜,待测。
1.3 在线固相萃取和色谱分离条件
在线萃取柱为Acclaim 120 C18柱(10 mm×4.6 mm,5 μm),分析色谱柱为Agilent Extend-C18柱(250 mm×4.6 mm,5 μm);进样量为10 μL,柱温25 ℃;右泵(online-SPE pump)为净化泵,采用0.2%甲酸溶液(溶剂A)和甲醇(溶剂B)梯度洗脱;左泵(Analytical pump)为分析泵,采用0.02 mol/L乙酸铵溶液(溶剂A)和甲醇(溶剂B)梯度洗脱。分别于5.8 min和16 min处切换六通阀。六通阀切换程序及分析流路梯度洗脱程序见表1,具体切换通路见图1~2。
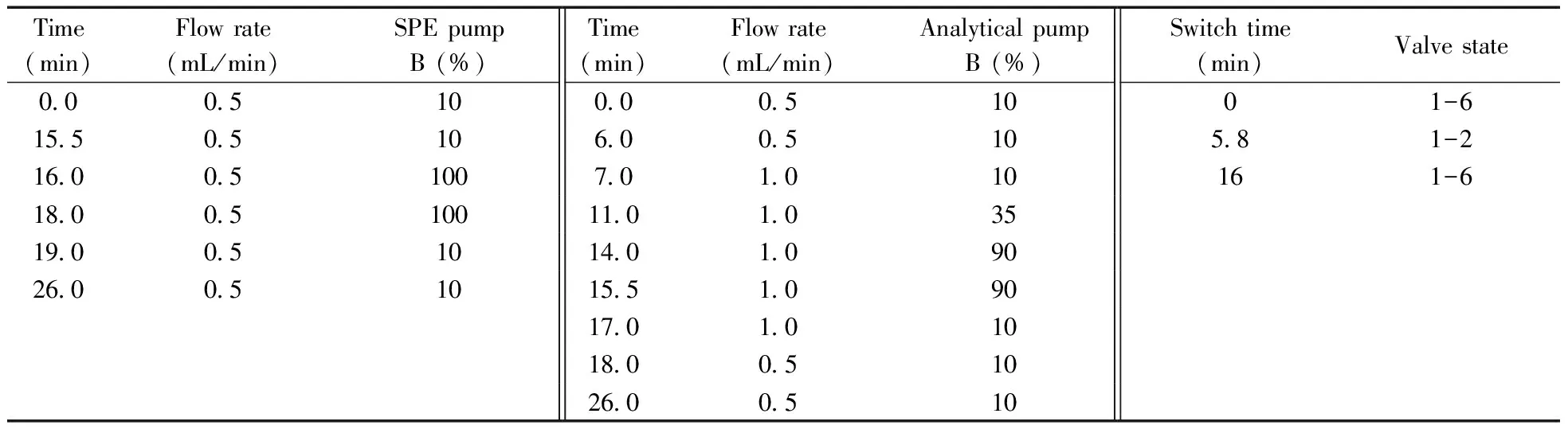
表1 在线净化与色谱分离的梯度洗脱条件
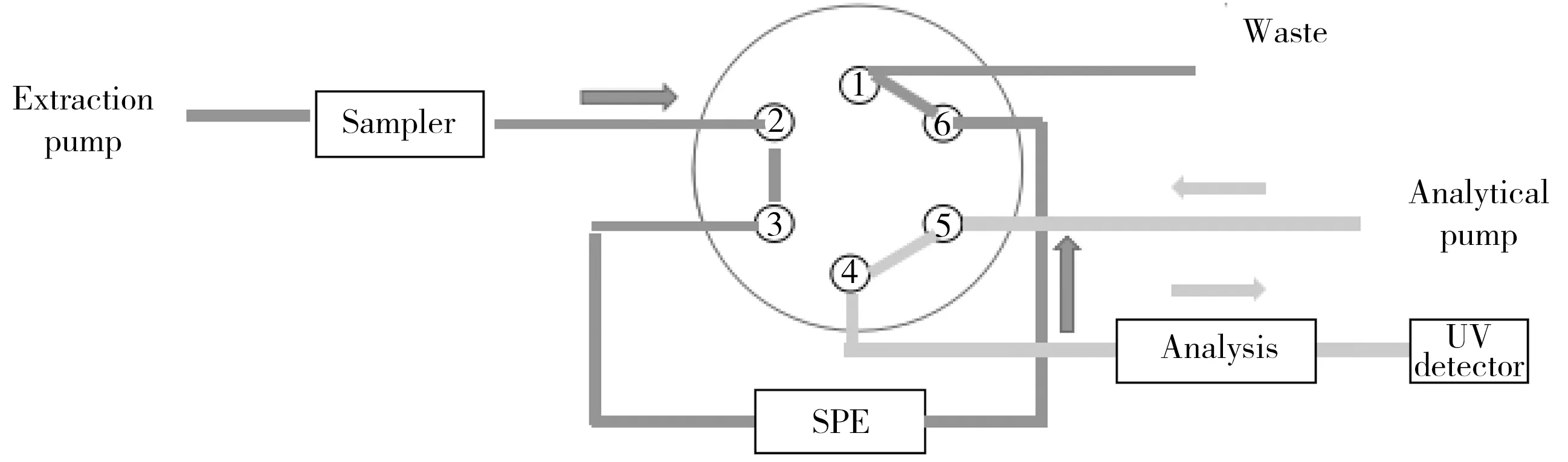
图1 萃取阶段及清洗平衡阶段的阀切换通路Fig.1 Column switching mechanism in extraction and cleaning periods

图2 转移阶段及分离阶段阀的切换通路Fig.2 Column switching mechanism in transfer and analytical periods
2 结果与讨论
2.1 在线固相萃取条件优化
2.1.1 在线萃取柱的选择 比较了TurboFlow MAX,SolEx RSLC HRP,Oasis WAX,Acclaim 120 C184种萃取柱的净化效果。结果表明:TurboFlow MAX柱是混合型强阴离子反相吸附柱,该类型萃取柱对合成色素的保留能力较强,采用各种体积比的甲醇-0.5%甲酸溶液、乙腈-0.5%甲酸溶液、甲醇-0.05 mol/L乙酸铵、乙腈-0.05 mol/L乙酸铵等一系列高有机相、高浓度缓冲盐、低pH值的洗脱溶液均不能将合成色素洗脱下来;SolEx RSLC HRP的填料键合了亲水性膜的二乙烯苯聚合物,5种合成色素均在死时间处被直接洗脱;Oasis WAX柱为混合型弱阴离子反相吸附柱,对酸性化合物具有高的选择性和灵敏度,但实验发现,须用氨水比例达2%以上的氨水-甲醇溶液才能将5种合成色素全部洗脱,而此时洗脱溶液会对目标化合物的分析过程造成严重干扰,无法准确定量。Acclaim 120 C18柱具有极高的表面覆盖率和极低的金属含量,通过优化上样和净化条件可去除大量杂质,有效保留5种合成色素。因此,本研究选择Acclaim 120 C18柱作为最佳在线萃取柱。
2.1.2 萃取流动相的选择 萃取流动相的选择对在线萃取效率有着显著影响。采用甲醇-纯水(10∶90)、纯水作为上样溶液,无法保留苋菜红;通过调节上样溶液pH值,采用甲醇-0.2%甲酸溶液(10∶90)可有效保留5种合成色素。在净化条件优化过程中,比较了不同体积比的甲醇-0.2%甲酸溶液的净化效果,结果表明:以甲醇-0.2%甲酸溶液(10∶90)作为净化溶剂时,可有效分离目标化合物和杂质,保留时间在0~5.8 min范围内的杂质基本清除完毕,目标化合物于6 min开始流出,所以确定第一次阀切换时间为5.8 min。
2.2 分离条件的优化
本研究表明当洗脱溶液中甲醇的体积分数达到60%时才能有效洗脱这5种合成色素,而且5种化合物在C18分析柱上的保留能力相差较大,苋菜红的保留能力较弱,用低比例有机相流动相洗脱时能被洗脱。若采用一般方法以60%甲醇的洗脱溶液集中洗脱后再进行梯度洗脱,苋菜红和胭脂红将无法分离并很快从分析柱流出。因此,本研究将洗脱与分析步骤合并,即在净化过程完成后,通过阀切换串联在线萃取柱与分析柱,将目标化合物洗脱到分析柱上进行分离,直至最后1种目标化合物(亮蓝)分离完毕(15.3 min)后,于16 min处再次切换六通阀,进行在线萃取柱的清洗平衡,以备下次进样。
本文还考察了柱温(20~35 ℃)对分离效果的影响。结果表明:柱温对被测化合物的分离度影响不大,而各被测化合物的保留值随柱温升高有所提前;当柱温达到30 ℃及以上时,日落黄的响应值显著下降。因此,本实验选择25 ℃为最佳检测柱温。
本研究对检测波长进行了优化。国标(GB/T5009.35-2003)[14]采用254 nm作为检测波长测定不同种类的合成色素,该波长下干扰物质多,灵敏度不高,特异性不强。本研究利用二极管阵列检测器扫描获得不同合成色素的紫外-可见吸收光谱,各组分的最大吸收波长为:苋菜红(520 nm)、胭脂红(510 nm)、日落黄(486 nm)、诱惑红(510 nm)、亮蓝(630 nm)。以目标化合物的最大吸收波长为检测波长,可提高灵敏度,减少杂质干扰,同时获得良好峰形。在已优化的萃取、分离和检测条件下,分别对合成色素的混合标准溶液、样品和空白样品进行测定,色谱图见图3。
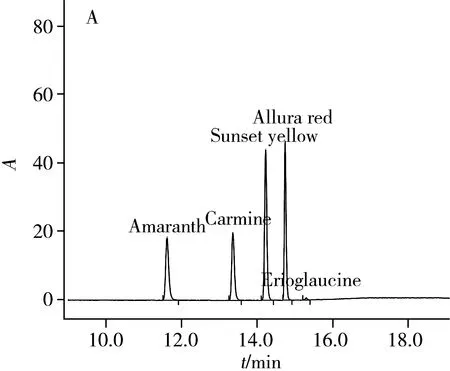


图3 5种合成色素标准混合溶液(10 μg/mL,A)、样品中日落黄(486 nm,B)及空白样品(C)的色谱图
2.3 方法的线性范围与定量下限
用水配制系列浓度5种合成色素的混合标准溶液,按上述优化后的实验方法进行分析。以5种合成色素的峰面积(y)与其浓度(x,mg/L)进行线性回归,得出回归方程和相关系数(r2)。结果表明,5种合成色素在0.5~20 mg/L浓度范围内线性关系良好,r2大于0.999 9。在空白样品中添加一系列低浓度的标准溶液,根据3倍信噪比计算检出限,根据10倍信噪比计算定量下限,得检出限为0.02~0.08 mg/kg,定量下限为0.08~0.44 mg/kg,实验结果见表2。

表2 5种合成色素的线性方程、相关系数、检出限与定量下限
2.4 方法的回收率与精密度
称取适量空白饮料样品进行低、中、高3个浓度水平的加标实验(中水平加标量为GB 2760-2014[15]规定的最大限量值),每个水平重复测定6次,计算回收率和相对标准偏差(RSD)。测得回收率为94.5%~103.0%,RSD为0.4%~2.7%(见表3)。方法显示了良好的准确度和精密度,能够满足实际样品的分析要求。
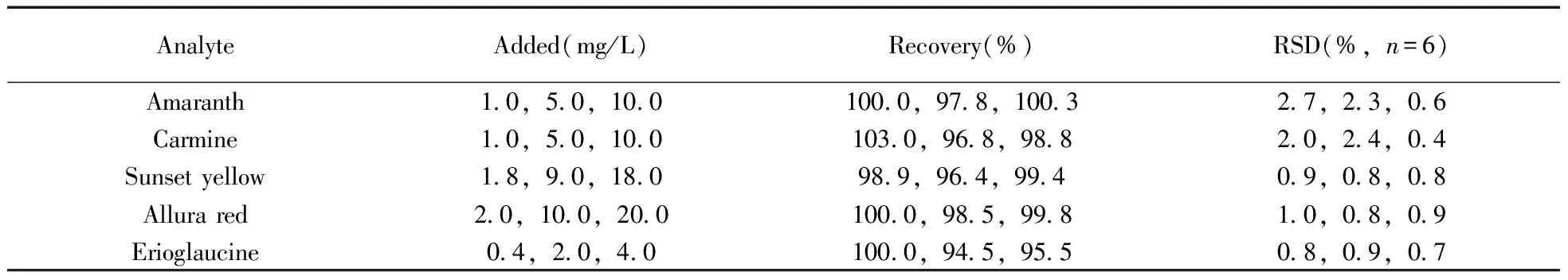
表3 回收率和精密度实验结果
2.5 实际样品的检测
从南京市鼓楼区的超市购买饮料样品共6份,采用本方法进行分析检测。样品1中检出苋菜红2.92 mg/kg,亮蓝0.30 mg/kg;样品2中检出亮蓝0.54 mg/kg;样品3中检出诱惑红0.49 mg/kg;样品4中检出苋菜红0.76 mg/kg,胭脂红1.55 mg/kg;样品5中检出亮蓝0.40 mg/kg;样品6中检出胭脂红0.49 mg/kg,日落黄17.06 mg/kg。数据结果显示,6份样品的色素含量均未超出GB 2760-2014规定的限量要求。
3 结 论
本文建立了在线固相萃取-高效液相色谱检测饮料中5种合成色素的分析方法。饮料样品经稀释过滤后可直接上样,无需其他前处理步骤。通过优化在线萃取条件和分离条件,可以实现5种合成色素的有效分离,并且可以获得较为理想的准确度和精密度。本方法具有操作简单、快速简便、省时、重现性好等优点,能够满足饮料中合成色素的定量分析要求,具有较好的实际应用价值。
[1] Liu W E,Ling Y,Zhang Y,Li S H,Jiang S J,Yao M Y,Li H N,Zheng Y,Zhang F.Chin.FoodAddit.(周伟娥,凌云,张元,李绍辉,蒋受军,姚美伊,李红娜,郑阳,张峰.中国食品添加剂),2015,139(9):150-156.[2] Mapari S,Thrane U,Meyer A.TrendsBiotechnol.,2010,28(6):300-307.
[3] Gao H G,Gong W J,Zhao Y G.Anal.Sci.,2015,31(3):205-210.
[4] Yan B,Hu H S,Zhang Y W,Zhao S E,Lu H.J.Anal.Sci.(鄢兵,胡海山,张云伟,赵淑娥,芦慧.分析科学学报),2014,30(4):525-528.
[5] Zhang Y L,Ma J Y,Wang H.J.NorthwestA&FUniv.:Nat.Sci.Ed.(张予林,马静远,王华.西北农林科技大学学报:自然科学版),2011,39(1):186-192.
[6] Wang Q L,Jiang H L,Zhao Y,Ying L.FoodSci.(王全林,姜海亮,赵颖,应璐.食品科学),2009,30(14):256-260.
[7] Chen Y F,Xiao B M,Sun Y F,Ding X L,Fu Y,Liu X M.Chin.J.FoodHyg.(陈彦凤,肖白曼,孙艳芳,丁笑莉,付宇,刘秀梅.中国食品卫生杂志),2013,25(5):428-430.
[8] Xie J H,Feng H,Fu X L.ChinaFoodSafetyMagazine(谢君红,冯辉,付晓陆.食品安全导刊),2013,(5):29-30.[9] Ding Y,Qiu P L,Huang Q T,Peng C.Chin.J.HealthLab.Technol.(丁怡,邱佩丽,黄秋婷,彭程.中国卫生检验杂志),2009,19(6):1262-1264.
[10] Liu L,Wu Q,Lin F Y,Kuang M H.Sci.Technol.FoodInd.(刘丽,吴青,林凤英,邝敏华.食品工业科技),2013,34(12):81-85.
[11] Ruan L P,Ji W L,Liu H L,Li L,Ma Y J.Chin.J.HealthLab.Technol.(阮丽萍,吉文亮,刘华良,李莉,马永建.中国卫生检验杂志),2011,23(2):151-154.
[12] Chen X H,Zhao Y G,Shen H Y,Zhou L X,Pan S D,Jin M D.J.Chromatogr.A,2013,10(1346):123-128.
[13] Liao Q G,Li W H,Luo L G.Anal.Chim.Acta,2012,716:128-132.
[14] GB/T 5009.35-2003.Determination of Synthetic Pigments in Foods.National Standards of the People's Republic of China(食品中合成色素的测定.中华人民共和国国家标准).
[15] GB2760-2014.Standards of Using Food Additives.National Standards of the People's Republic of China(食品添加剂使用标准.中华人民共和国国家标准).
Determination of 5 Edible Synthetic Pigments in Drinks by Online Solid-phase Extraction Coupled with High Performance Liquid Chromatography
JIANG Shu-xin1,2,LIU Hua-liang1,2,MA Yong-jian1,2*,RUAN Li-ping2
(1.School of Public Health,Southeast University,Nanjing 210009,China;2.Jiangsu Provincial Center for Disease Control and Prevention,Nanjing 210009,China)
A method was developed for the determination of 5 kinds of synthetic pigments in drinks by online solid-phase extraction coupled with high performance liquid chromatography-ultraviolet detection(online-SPE-HPLC-UV).The drinks samples were diluted with water,and filtered with 0.45 μm microporous membrane filter.Then the samples were purified on an Acclaim 120 C18column and separated on a reversed-phase column by gradient elution.The detection was performed by ultraviolet detection.The calibration curves of 5 kinds of synthetic pigments were linear in the concentration range of 0.5-20 mg/L,with correlation coefficients(r2) greater than 0.999 9.The limits of detection(LODs) were in the range of 0.02-0.08 mg/kg.The recoveries of 5 kinds of synthetic pigments at three spiked levels ranged from 94.5% to 103.0%,with relative standard deviations of 0.4%-2.7%.The research provides an effective method for the rapide determination of edible synthetic pigments in drinks.
online solid-phase extraction;edible synthetic pigments;drinks;high performance liquid chromatography(HPLC)
2016-03-10;
2016-07-10
江苏省科技厅科技支撑计划项目(BE2010745)
10.3969/j.issn.1004-4957.2016.12.011
O657.72;TS264.4
A
1004-4957(2016)12-1581-05
*通讯作者:马永建,硕士,主任技师,研究方向:分析化学,Tel:025-83759366,E-mail:mayongjian@jscdc.cn

