UPLC-Q-TOF-MS法测定小鼠大脑中4种单胺类神经递质的含量
区硕俊,罗展远,曾广丰,梁俊发,章海涛,梁卫寰,岑建斌,徐颖愉
(1.广州质量监督检测研究院 国家加工食品质量监督检验中心,广东 广州 511447;2.广东药学院 广东省代谢病中西医结合研究中心,广东 广州 510006;3.广东出入境检验检疫局 检验检疫技术中心,广东 广州 510623;4.广东工业大学 轻工化工学院,广东 广州 510006)
UPLC-Q-TOF-MS法测定小鼠大脑中4种单胺类神经递质的含量
区硕俊1,3*,罗展远2,曾广丰3,梁俊发1,章海涛3,梁卫寰4,岑建斌1,徐颖愉1
(1.广州质量监督检测研究院 国家加工食品质量监督检验中心,广东 广州 511447;2.广东药学院 广东省代谢病中西医结合研究中心,广东 广州 510006;3.广东出入境检验检疫局 检验检疫技术中心,广东 广州 510623;4.广东工业大学 轻工化工学院,广东 广州 510006)
建立了超高效液相色谱-四极杆飞行时间质谱法(UPLC-Q-TOF-MS)对小鼠大脑中的多巴胺(DA)、5-羟色氨(5-HT)、二羟基苯乙酸(DOPAC)和高香草酸(HVA) 4种单胺类神经递质的含量进行同时测定。样品以30%乙醇溶液(甲酸调至pH 5.0)匀浆处理后,冷冻离心,过滤。在优化色谱-质谱条件下,采用ESI和APCI复合源,正/负离子扫描方式进行数据采集。4种单胺类神经递质在0.5~1 000 μg/L范围内呈良好线性关系,相关系数(r)大于0.999 3,方法的检出限为0.5~5.0 μg/L,平均回收率为93.3%~101.8%,相对标准偏差为1.1%~3.3%。该方法具有操作简便、高效快速、回收率良好、灵敏度高、重现性好和准确度高等优点,可用于小鼠脑组织内4种单胺类神经递质的含量测定。
超高效液相色谱-高分辨飞行时间质谱法(UPLC-Q-TOF-MS);单胺类神经递质;小鼠;脑组织
单胺类神经递质(Monoamine neurotransmitters,MNTs)是人体内一种重要的神经递质,在人体内的神经、心血管等组织系统及激素介导的内外分泌活动中有着广泛的调节作用[1]。MNTs及其代谢产物的含量对情绪、认知和应激行为等生理活动均有重要影响[2-4],同时,其含量变化与人类多种精神疾病的临床表现密切相关,如抑郁症[5]、焦虑症[6]、精神分裂症等[7]。因此,准确检测生物体内的MNTs对于人类疾病的诊断、药物治疗及基础研究具有重要意义[8]。
由于MNTs在生物样品中的含量极低,增加MNTs在反相色谱中的憎水性困难较大,以及基质效应等因素的干扰,因此,准确测定MNTs仍具有挑战性。目前,有关MNTs的检测方法主要有液相色谱法(包括高效液相色谱-激光诱导荧光法[9]、高效液相色谱-电化学检测法[10])、液相色谱-质谱联用法[11-12]、荧光法[13]和毛细管电泳法[14]。上述方法中,电化学检测法存在稳定性差、灵敏度低、难度高和检测速度慢等问题,而毛细管电泳法则重现性较差,因此,这2种方法不适用于临床诊断。而高效液相色谱-荧光法虽解决了上述问题,但由于其选择性仍难达到分析要求,对于生物样品来说易受杂峰干扰,从而影响分析结果,并且为了改善目标物在色谱柱中的保留行为,需在流动相中加入离子对试剂,从而大大缩短了色谱柱寿命,因此不适于批量检测。柱前衍生化处理结合液相色谱-质谱/质谱法(HPLC-MS/MS)可以显著提高检测的灵敏度,并降低生物样品的基质效应[15-16]。但柱前衍生化的操作较繁琐,总体的衍生时间较长,而且同一种衍生剂对不同的MNTs衍生时间也不一致(30~120 min)。本文采用乙醇-甲酸作为萃取剂,无需对生物样品进行衍生处理,缩短了样品前处理时间,并结合UPLC-Q-TOF-MS精确测定分子量,建立同时测定生物体内4种单胺类神经递质的UPLC-Q-TOF-MS法,该方法相比于直接测定的LC-MS法提高了定性、定量能力。
1 实验部分
1.1 仪器与设备
Triple TOF®5600+高分辨质谱仪(美国ABsciex公司),UPLC 20AD高效液相色谱仪(日本岛津公司)。T10 basic匀浆机(德国IKA公司);PHS-25CW pH计(上海般特仪器有限公司);TG16B 离心机(湖南凯达科学仪器有限公司);D3024R冷冻高速台式离心机(美国赛洛捷克Scilogex公司);CSR-1-200超纯化水机(北京爱思泰克科技开发有限责任公司)。
1.2 材料与试剂
饲养7 d昆明小鼠,体重范围28~35 g(广州质量监督检测研究院,国家加工食品质量监督检验中心);无水乙醇、甲酸(分析纯,广州试剂厂);甲醇(色谱纯,美国Fisher公司);多巴胺(DA)、5-羟色胺(5-HT)、二羟基苯乙酸(DOPAC)、高香草酸(HVA)标准品(纯度≥ 99%,美国Sigma公司);实验用水为超纯水。
1.3 实验条件
1.3.1 标准溶液的配制 分别准确称取4种神经递质标准品各0.010 0 g于100 mL棕色具塞容量瓶中,用30%甲醇溶液定容配制成100 mg/L储备液,然后吸取上述4种标准储备液用30%甲醇溶液稀释配成混合标准系列溶液,各单标浓度分别为0.5,1.0,5.0,10.0,25.0,50.0,250,500,1 000 μg/L。
1.3.2 样品处理 在低温手术台上取小鼠大脑的不同脑组织部位于-20 ℃保存,称重,置于2 mL离心管中,按脑组织∶组织提取液(30%乙醇,甲酸调至pH 5.0)=1 g∶10 mL的比例加入组织提取液,将离心管置于冰浴中用匀浆机匀浆1 min。取出后冷冻离心20 min(15 000 r/min,2 ℃),上清液过0.22 μm滤膜,待测。
1.3.3 色谱条件 色谱柱:Cortecs C18(100 mm×3.0 mm,2.7 μm,Waters公司);柱温:35 ℃;样品室温度20 ℃;进样量:5 μL;流动相A为甲醇,B为水,采用梯度洗脱方式洗脱分离;流速:0.5 mL /min。正离子模式梯度洗脱程序:0.0~3.0 min,10%~80% A;3.0~5.0 min,80% A;5.0~5.1 min,80%~10% A;5.1~6.0 min,10% A。负离子模式梯度洗脱程序:0.0~3.0 min,40%~95% A;3.0~5.0 min,95% A;5.0~5.1 min,95%~40% A;5.1~6.0 min,40% A。
1.3.4 质谱条件 离子源:ESI和APCI复合源(ESI为化合物测定离子源,APCI为校准离子源);正/负离子扫描方式;APCI源连接ABsciex公司自动校正系统(CDS),每10个样品自动校正1次,APCI正离子校正液流速0.25 mL/min,APCI负离子校正液流速0.5 mL/min,气帘气:40 psi,离子源雾化气:50 psi,离子源加热辅助气:50 psi,离子源温度:550 ℃,离子源电压5 500 V/-4 500 V。一级TOF-MS扫描准确质量范围:100~1 000 Da,数据采集时间100 ms,DP:40 V/-40 V,CE:5 V/-5 V;二级IDA-MS扫描准确质量范围:50~1 000 Da,DP:40 V/-40 V,CE:(15±10) V/(-15±10) V;高灵敏模式,数据采集时间50 ms,信号阈值100 cps,IDA实验每循环采集6次数据,动态背景减法扣除。
1.3.5 数据分析方法 所有质谱数据在ABSciex公司的Analyst TF 1.6软件采集,数据在PeakView 2.0,MasterView 2.0和MultiQuant 3.0等软件上定性定量处理分析。根据TOF-MS和IDA-MS高分辨质谱获得化合物的准确分子量,定性定量分析小鼠大脑中4种单胺类神经递质的含量。
2 结果与讨论
2.1 单胺类神经递质的定性定量分析
采用UPLC-Q-TOF-MS检测小鼠大脑中4种单胺类神经递质的含量,以目标物一级母离子的精确质量数、同位素丰度比、二级碎片离子的精确质量数和色谱保留时间等信息进行定性定量分析,4种目标化合物的定量分析质谱数据见表1。4种化合物中DOPAC和HVA仅在负离子模式下有响应,形成[M-H]-分子离子峰;DA和5-HT在正离子和负离子模式下均有响应,但正离子模式的分子离子峰[M+H]+强度大于[M-H]-。二级精确分子量质谱见图1。

表1 4种单胺类神经递质的定性定量分析质谱数据


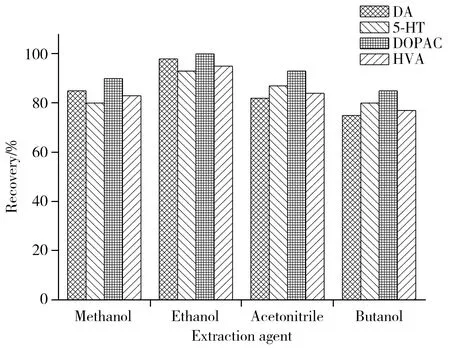
图2 不同提取剂对4种神经递质提取率的影响Fig.2 Effect of different extraction agents on 4 kinds of monoamine neurotransmitters
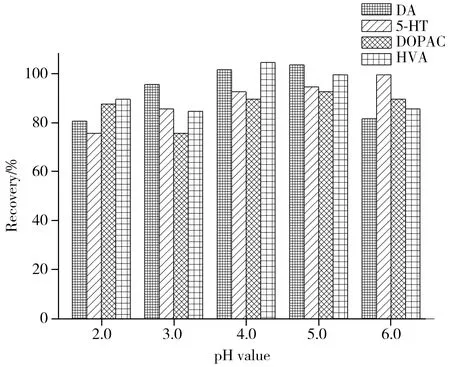
图3 pH值对4种神经递质回收率的影响Fig.3 Effect of pH value on recoveries of four monoamine neurotransmitters
2.2 样品处理条件的优化
2.2.1 提取剂的优化 分别以浓度均为30%的甲醇、乙醇、乙腈、正丁醇作为提取剂,对样品中的4种神经递质进行萃取。结果显示,4种提取剂具有较好的沉淀蛋白效果,其中以30%乙醇为提取剂时,对4种单胺类神经递质的回收率影响最小,提取效果最佳(见图2)。
进一步考察了不同比例的乙醇溶液对4种单胺类神经递质的提取效果。由于4种单胺类神经递质均具有较强的亲水性,尤其是盐酸多巴胺,只能在乙醇等有机溶剂中微溶。因此提取液中乙醇的比例不能过大,否则会导致提取率降低。实验结果显示,乙醇比例为30%时净化效果更佳,因此选取30%的乙醇溶液作为提取液。
2.2.2 沉淀净化条件的优化 使用高氯酸作为蛋白质沉淀剂虽然效果显著,但由于其具有强氧化性,过高浓度的高氯酸会引起神经递质氧化分解,从而影响分析结果,同时也会缩短色谱柱寿命。本实验采用30%乙醇提取液作为蛋白质沉淀剂,并用甲酸将溶液调至大脑蛋白质的等电点附近。同时,考察了不同pH值对4种神经递质回收率的影响。结果表明,pH值在4.0~6.0的范围内,溶液具有良好的净化效果,而在pH值为5.0的条件下,4种神经递质的回收率较高,满足分析要求(见图3)。
2.3 方法的专属性
4种目标物按照表1的精确分子量提取一级母离子,并结合同位素丰度比、二级碎片离子的精确质量数和色谱保留时间进行测定。由于高分辨质谱的高灵敏度,可极大地排除基质干扰,为进一步考察基质效应,取6份同一样本的脑组织纹状体匀浆液各500 μL,1份匀浆液加入500 μL提取液作为对照;另5份加入4种单胺类神经递质的混合标准溶液100 μL,然后加入提取液 400 μL处理后进行分析。以相同浓度的标准溶液进行单点定量,结果见表2。结果表明,4种目标物测定的准确度均大于95.2%,小鼠脑区中的其它内源性物质不影响4种目标物的测定。

表2 小鼠脑匀浆液中4种单胺类神经递质的测定准确度(n=5)
2.4 线性关系与检出限
精确吸取各标准储备液并进行混合稀释,得到一系列质量浓度不同的混合标准溶液,在优化色谱-质谱条件下进样分析,以峰面积(Y)对进样质量浓度(X,μg/L)进行线性回归。结果表明,4种单胺类神经递质的响应值与其浓度在一定范围内呈良好的线性关系,相关系数均不小于0.999 3(见表3)。按3倍信噪比(S/N=3)计算检出限(LOD),10倍信噪比(S/N=3)计算定量下限(LOQ),得到4种单胺类神经递质的LOD为0.5~5.0 μg/L,LOQ为2.0~15.0 μg/L(见表3),表明方法具有较高的灵敏度。

表3 4种单胺类神经递质的线性方程、线性范围、相关系数、检出限及定量下限
2.5 回收率与精密度
在已知各单胺类神经递质浓度的同一纹状体匀浆液样品中,添加3种不同水平的4种混合标准溶液,每个水平日内重复测定6次,样品的平均回收率和相对标准偏差(RSD)见表4。4种单胺类神经递质的平均回收率为93.3%~102%,相对标准偏差(RSD)为1.1%~3.3%,表明该方法的准确度与精密度满足4种单胺类神经递质分析的要求。

表4 小鼠脑匀浆液中4种单胺类神经递质的加标回收率与相对标准偏差(n=6)
2.6 实际样品分析
采用本方法分别对饲养7 d无异常行为的20只小鼠大脑的纹状体进行处理分析,纹状体和下丘脑组织中分别检出DA,5-HT和DOPAC,未检出HVA(结果见表5),实际样品的提取离子流色谱图见图4,说明该方法适用于实际样品的检测。

表5 小鼠大脑纹状体组织中4种单胺类神经递质的含量(μg/g)
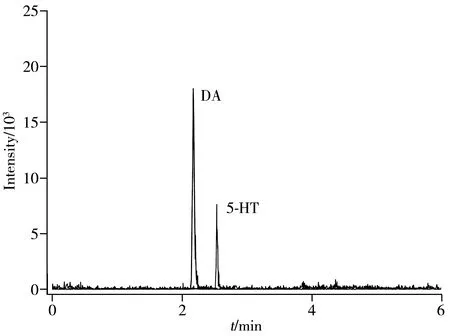
图4 实际样品中4种单胺类神经递质的提取离子流色谱图
Fig.4 Extracted ion chromatograms of four monoamine neurotransmitters in actual samples
3 结 论
本文建立了UPLC-Q-TOF-MS同时测定小鼠大脑组织中4种单胺类神经递质的方法。采用乙醇-甲酸溶液作为提取剂,简化了样品前处理过程;以甲醇-水作为流动相进行梯度洗脱,目标物在3 min内可达到较好的分离,大大缩短了分析时间;利用高分辨质谱的高灵敏度,减少了基质对目标物的干扰,对于目标物的定性定量更为精确。运用本法对20只小鼠大脑纹状体和下丘脑中的4种单胺类神经递质进行测定,结果表明该方法具有灵敏度高、重现性好和准确度高等优点,可用于小鼠脑组织中4种单胺类神经递质含量的测定,从而为疾病的药物治疗及基础研究提供参考依据。
[1] Das D,Phillips C,Hsieh W,Sumanth K,Dang V,Salehi A.Prog.Neuropsychopharmacol.Biol.Psychiatry,2014,54(15):140-148.
[2] Sardella R,Scorzoni S,Conte C,Lisanti A,Ianni F,Natalini B.J.Pharm.Biomed.Anal.,2014,98:253-259.
[3] Huang F,Li J,Shi H L,Wang T T,Muhtar W,Du M,Zhang B B,Wu H,Yang L,Hu Z B,Wu X J.J.Neurosci.Methods,2014,229(5):8-14.
[4] Zhao H Y,Duan C L,Fan C X,Liu Q,Zhang T,Yang H.Chin.J.Anal.Chem.(赵焕英,段春礼,范春香,刘琦,张韬,杨慧.分析化学),2009,3:330-334.
[5] Hamon M,Blier P.Prog.Neuropsychopharmacol.Biol.Psychiatry,2013,45(3):54-63.
[6] Roy V,Merali Z,Poulter M O,Anisman H.Behav.BrainRes.,2008,185(1):49-58.
[7] Cai H L,Fang P F,Li H D,Zhang X H,Hu L,Yang W,Ye H S.J.Psychiat.Res.,2011,188(2):197-202.
[8] Wang Z M,Wang Y W,Yi J,Long S,Yu L S.Chin.J.HealthLab.Technol.(王泽民,王玉文,伊晶,龙森,余露山.中国卫生检验杂志),2015,17:2863-2865.
[9] Zhou L,Wang S M,Tian K,Dong Y M,Hu Z D.J.Sep.Sci.,2007,30(1):110-117.
[10] Parrot S,Neuzeret P C,Denoroy L.J.Chromatogr.B,2011,879(32):3871-3878.
[11] Benedetto G E D,Fico D,Pennetta A,Malitesta C,Nicolardi G,Lofrumento D D,Nuccio F D,Pesa V L.J.Pharm.Biomed.Anal.,2014,98(10):266-270.
[12] Zhang J,Liu Y S,Jaquins-Gerstl A,Shu Z,Michael A C,Weber S G.J.Chromatogr.A,2012,1251(16):54-62.[13] Ji C J,Li W L,Ren X D,EI-Kattan A F,Kozak R,Fountain S,Lepsy C.Anal.Chem.,2009,81(23):9195-9203.
[14] Zhang D P,Wu L,Chow D S L,Tam V H,Rios D R.J.Pharm.Biomed.Anal.,2016,117(5):227-231.
[15] Gao S M,Zhang Z P,Karnes H T.J.Chromatogr.B,2005,825(2):98-110.
[16] Hedman C J,Wiebe D A,Dey S,Plath J,Kemnitz J W,Ziegler T E.J.Chromatogr.B,2014,953/954:62-67.
Determination of Four Monoamine Neurotransmitters in the Mouse Brains by Ultra Performance Liquid Chromatography with High Resolution Quadrupole Time of Flight Mass Spectrometry
OU Shuo-jun1,3*,LUO Zhan-yuan2,ZENG Guang-feng3,LIANG Jun-fa1,ZHANG Hai-tao3,LIANG Wei-huan4,CEN Jian-bin1,XU Ying-yu1
(1.National Centre for Quality Supervison and Testing of Processed Food(Guangzhou),Guangzhou Quality Supervision and Testing Institute,Guangzhou 511447,China;2.Guangdong Province Research Centre for Chinese Integrative Medicine Against Metabolic Disease,Guangdong Pharmaceutical University,Guangzhou 510006,China;3.Inspection & Quarantine Technology Center of Guangdong Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510623,China;4.School of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou 510006,China)
An ultra performance liquid chromatography-high resolution quadrupole time of flight mass spectrometric(UPLC-Q-TOF-MS) method was developed for the determination of four monoamine neurotransmitters including dopamine(DA),serotonin hydrochloride(5-HT),3,4-dihydroxyphenylacetic acid(DOPAC) and homovanillic acid(HVA) in mouse brains.Samples were homogenized with 30% ethanol solution(formic acid pH 5.0),freezingly centrifuged and filtered.Under the optimized chromatographic and mass spectrometric conditions,data were acquisited with electrospray ionization(ESI) and atmospheric pressure chemical ionization(APCI) composite sources in positive ion/negative ion mode.The calibration curves of four monoamine neurotransmitters showed good linearities(r>0.999 3) within the concentration range of 0.5-1 000 μg/L.The limits of detection were in the range of 0.5-5.0 μg/L,and the average recoveries were 93.3%-101.8% with relative standard deviations(RSDs) of 1.1%-3.3%.This method showed the advantages of simplicity,efficiency,high recovery,good sensitivity and high precision,and was suitable for the determination of four monoamine neurotransmitters in brain tissue of mouse.
ultra performance liquid chromatography-high resolution quadrupole time of flight mass spectrometry(UPLC-Q-TOF-MS);monoamine neurotransmitters;mouse;brain tissue
2016-06-18;
2016-07-20
广东省质量技术监督局科技项目(2016PZ17)
10.3969/j.issn.1004-4957.2016.12.009
O657.63;O623.731
A
1004-4957(2016)12-1569-06
*通讯作者:区硕俊,助理工程师,研究方向:气、液相色谱分析及研究,Tel:020-84410935,E-mail:846476388@qq.com

