一种快速测定牦牛皮胶和牛皮胶中18种氨基酸的PITC柱前衍生HPLC法
许梦琪,魏立新,肖远灿,毕宏涛,杨红霞*,杜玉枝*
(1.中国科学院西北高原生物研究所,青海省藏药药理学和安全性评价研究重点实验室,青海 西宁 810008;2.中国科学院藏药重点实验室,青海 西宁 810008;3.中国科学院大学,北京 100049)
一种快速测定牦牛皮胶和牛皮胶中18种氨基酸的PITC柱前衍生HPLC法
许梦琪1,2,3,魏立新1,2,肖远灿1,2,毕宏涛1,2,杨红霞1,2*,杜玉枝1,2*
(1.中国科学院西北高原生物研究所,青海省藏药药理学和安全性评价研究重点实验室,青海 西宁 810008;2.中国科学院藏药重点实验室,青海 西宁 810008;3.中国科学院大学,北京 100049)
建立一种有效测定牦牛皮胶与牛皮明胶中18 种氨基酸含量的异硫氰酸苯酯(PITC)柱前衍生-高效液相色谱法。对PITC衍生方法进行了优化,方法无需干燥和有机溶剂萃取过量PITC的步骤。牦牛皮使用胃蛋白酶在37 ℃下酶解72 h,酶解物冷冻干燥保存。样品用6.0 mol/L盐酸,110 ℃水解后,以PITC为衍生试剂进行衍生处理。采用Shiseido Capcell Pak C18(4.6 mm×250 mm,5 μm)色谱柱,流动相为0.14 mol/L乙酸钠-0.5 mL/L三乙胺水溶液(pH 6.08)和60%乙腈,梯度洗脱,流速为 1 mL/min,检测波长为254 nm。18种氨基酸在 0.2~80 mg/L浓度范围内与峰面积间的线性关系良好(r2≥0.999 2),检出限为0.01~0.39 mg/kg,平均回收率为78.7%~121.0%,相对标准偏差(RSD)为0.05%~12.0%。结果表明,该方法衍生化步骤简单、灵敏度高、前处理时间短,可用于牛科动物皮胶中多种氨基酸成分和含量的测定。
牦牛皮明胶;牛皮明胶;氨基酸;柱前衍生;异硫氰酸苯酯;高效液相色谱法
牦牛(Bosgrunniens)是世界上除了人类之外生活在海拔最高处的哺乳动物,是高原畜牧业最重要的优势畜种[1-3]。牦牛皮胶由牦牛皮经科学方法提炼而成,可益气生血、健脾补肾,主要用于营养性贫血、久病气虚无力等症[4]。新鲜牛皮中蛋白质高达30%~35%,氨基酸是蛋白质的基本组成单位[5]。牦牛皮胶的功效与其含有的氨基酸种类及含量有密切关系[4]。因此,准确测定和分析氨基酸组成及含量对于分析牦牛皮胶的功效具有重要意义。
氨基酸的分析方法主要有氨基酸分析仪测定法、柱前衍生-高效液相色谱法、衍生化毛细管电泳法和离子交换层析法(IEC)等[6]。由于柱前衍生-高效液相色谱法具有灵敏、快速的优点而被广泛应用于氨基酸的测定[7-8]。文献报道的柱前衍生试剂主要有异硫氰酸苯酯(PITC)[9-11]、2,4-二硝基氯苯(DNCB)、邻苯二甲醛(OPA)[12]及6-氨基喹啉-N-羟基琥珀酰亚胺基氨基甲酸酯(AQC)[13]。虽然PITC作为衍生试剂时具有遇水产生结晶、毒性大等缺点[14],但由于其反应条件要求不高,反应迅速,衍生产物稳定等优点而被广泛应用[15],且多用于胶原蛋白和明胶的测定[16]。目前,有关牦牛皮胶的氨基酸组成分析和含量测定仅见张彩旗等[17]采用氨基酸分析仪测定法和朱洪梅等[18]使用DNCB为衍生试剂进行柱前衍生-高效液相色谱法的报道,尚无使用PITC作为衍生试剂的研究。
本文采用PITC为衍生试剂,建立柱前衍生-高效液相色谱法,对衍生化步骤进行优化,改进了PITC作为衍生试剂时的缺点,并比较了牛皮明胶与牦牛皮胶中 18 种游离氨基酸的种类及含量差异,从而为牛科动物皮胶的质量控制提供了参考。
1 实验部分
1.1 仪器与试剂
Agilent 1260 液相色谱仪,配G1322A在线脱气机,G1311C四元泵,G1329B自动进样器,G1316A柱温箱,G1315D 二极管阵列检测器,Agilent Chemstation色谱工作站(美国Agilent公司)。KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司),AL104电子天平(Mettler Toledo公司);PB-10 pH计(德国Sartorius公司);HB-120S金属浴加热器(海门市其林贝尔仪器制造有限公司);恒温干燥箱(上海一恒科学仪器有限公司);3K15离心机(美国Sigma公司);VORTEX-5涡旋振荡器(海门市其林贝尔仪器制造有限公司);Milli-QA-10纯水器(美国Millipore公司)。
衍生试剂异硫氰酸苯酯(纯度>99%,日本TCI公司);牛皮明胶(G9382,美国Sigma公司);胃蛋白酶(活性:3 000~3 500,Wolsen公司);无水乙酸钠(分析纯,天津市凯信化学工业有限公司);乙腈(色谱纯,山东禹王实业有限公司化工分公司);羟脯氨酸标准品(Hyp,美国Sigma公司),天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、苏氨酸(Thr)、精氨酸(Arg)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)和苯丙氨酸(Phe)共17种氨基酸混合标准品溶液(AAS18,美国Sigma公司)。三乙胺、苯酚、冰醋酸、浓盐酸均为分析纯。
1.2 实验材料
牦牛皮明胶为自制,牛皮明胶购于美国Sigma公司。
牦牛皮明胶制备方法:牦牛皮原料购于青海百德食品有限公司。将整张新鲜未处理的牦牛皮浸泡,洗净杂物,分割成大小为30 cm×30 cm块状。用NaOH溶液浸泡48 h后进行脱毛处理。将脱毛后的牦牛皮置于清水中浸泡至pH值呈中性。浸泡脱碱后,分别用丙酮、乙醚、丙酮进行脱脂。脱脂后的牛皮用蒸馏水冲洗至无异味。处理好的牛皮加入0.1 mol/L甘氨酸缓冲液进行匀浆处理,加胃蛋白酶,质量比为酶∶明胶=1∶99,37 ℃下水解72 h后离心,上清液用滤纸过滤后,冷冻干燥待进一步分析。
1.3 实验方法
1.3.1 溶液的配制 标准氨基酸混合液:取氨基酸对照品溶液100 μL,加2 mL 6 mol/L盐酸于110 ℃水解24 h,加入羟脯氨酸粉末25 mg进行衍生后,4 ℃避光保存。
含1%苯酚的6 mol/L HCl:取36.5%的浓盐酸49.5 mL,加入49.5 mL超纯水和1 mL苯酚即得。
衍生试剂 A:甲醇、超纯水和三乙胺按照2∶2∶1的体积比配成。
衍生试剂 B:甲醇、超纯水、三乙胺和PITC按照7∶1∶1∶1的体积比配成。
1.3.2 标准氨基酸混合液和样品的水解 标准氨基酸混合液水解:取17种氨基酸混合标液1 mL于安瓿瓶中,加入2 mL含1%苯酚的6 mol/L盐酸溶液,充氮气密封后置于120 ℃恒温干燥器中24 h。冷却至室温,用pH 7.5 PBS定容至5 mL,待用。
样品水解:取10 mg牦牛皮胶样品置于安瓿瓶中,其余步骤同标准氨基酸混合液水解。
1.3.3 标准氨基酸混合液和样品的衍生 标准氨基酸混合液衍生:取40 μL水解后的氨基酸混合液,于金属浴120 ℃加热15 min使盐酸挥发。再加40 μL衍生试剂A,于涡旋振荡器混合后,再加入120 μL衍生试剂B,置于涡旋振荡器混合1 min。上述溶液在室温下(20~25 ℃)静置20 min后,加入300 mL pH 7.5 PBS缓冲液混匀,用0.45 μm滤膜过滤待用。
样品衍生:取40 μL水解后的样品溶液,其余步骤同标准氨基酸混合液衍生。
1.3.4 色谱条件 色谱柱:Shiseido Capcell Pak C18(4.6 mm×250 mm,5 μm;日本Shiseido公司);柱温:25 ℃;样品室温度:20 ℃。流动相 A:0.14 mol/L乙酸钠-0.5 mL/L三乙胺水溶液(用冰醋酸调至pH 6.08);流动相B:60%乙腈;流速:1 mL/min;检测波长:254 nm;进样量:7 μL。采用梯度洗脱:0.0~10.0 min,90%~50% A;10.0~15.0 min,50%~0% A;15.0~23.0 min,0%A;23.0~24.0 min,0%~90% A;24.0~30.0 min,90%A。
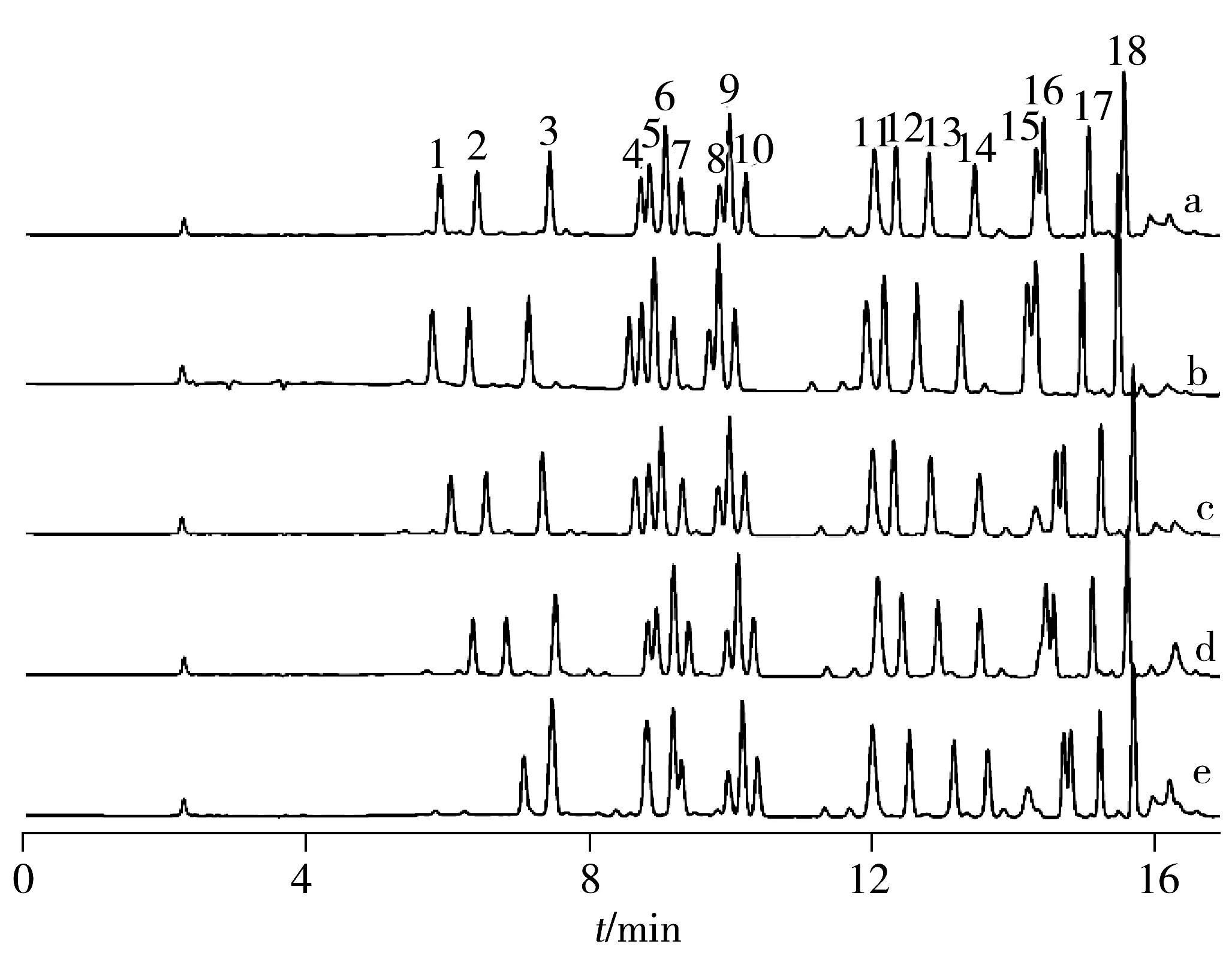
图1 18种氨基酸标准品在不同pH值条件下的HPLC色谱图Fig.1 HPLC chromatograms of 18 kinds of amino acids in different pH values peaks:1.Asp,2.Glu,3.Hyp,4.Ser,5.His,6.Gly,7.Arg,8.Thr,9.Pro,10.Ala,11.Cys,12.Tyr,13.Val,14.Met,15.Ile,16.Leu,17.Phe,18.Lys;pH value(a-e):5.49,6.00,6.08,6.35,6.75

图2 3种干燥方法对氨基酸对照品中18种氨基酸衍生效果的影响(n=3)Fig.2 Effect of three different methods of drying on the derivatives of 18 amino acids(n=3)
2 结果与讨论
2.1 衍生条件和色谱条件的优化

图3 萃取和过滤对氨基酸对照品中18种氨基酸含量的影响(n=3)Fig.3 Effect of filtration and extraction on content of 18 amino acids reference solution (n=3)
2.1.1 pH值的优化 由于氨基酸为两性物质,缓冲液pH值会影响到不同氨基酸的离解程度,从而影响氨基酸的保留值。Bidlingmeyer等[19]在实验中选择pH 6.35的流动相A(0.14 mol/L乙酸钠-0.5 mL/L三乙胺水溶液),而本研究发现在现有实验条件下,pH 6.35并不能很好地分离18种氨基酸。本实验用18种氨基酸标准品考察了流动相A的pH值分别在5.49,6.00,6.08,6.35和6.75 时18种氨基酸的分离效果(见图1)。结果显示,随着流动相A的pH值增大,18种氨基酸的保留值向后漂移,当流动相A的pH值为6.75时不能完全分离出18种氨基酸;当流动相A的pH值为6.08时,18种氨基酸的分离效果最好。故本实验选择流动相A(0.14 mol/L乙酸钠-0.5 mL/L三乙胺水溶液)的pH 值为6.08。2.1.2 干燥方法的优化 Bidlingmeyer等[19]在进行氨基酸衍生时每步均需真空干燥,然而由于样品量极少,进行真空干燥时样品损失较大,故本实验对干燥方法进行了优化,用18种氨基酸对照品考察了加热干燥(金属浴120 ℃,10 min)、冷冻干燥(冷冻干燥机,2 h)和不干燥3种方法对18种氨基酸含量测定的影响。结果见图2。结果显示,加热干燥法测定时亮氨酸和异亮氨酸的色谱峰未能分开,而采用不加热的方法测得的氨基酸含量显著高于其他两种方式(P<0.05)。
2.1.3 样品衍生化过程的优化 考察了衍生完毕后,用有机试剂萃取氨基酸和直接过滤结晶两种方法对氨基酸含量和衍生试剂PITC含量的影响,结果见图3。结果表明,萃取后的氨基酸含量与过滤后的氨基酸含量无显著差异(P>0.05)。衍生后直接过滤方法测出的PITC峰面积值为12 201.93,衍生后萃取方法测出的PITC峰面积为21 334.24。由此可以判断出PITC接触水生成结晶,可以直接降低PITC的浓度,过滤后不会影响氨基酸的含量。并且过滤操作简单、节约试剂和时间。所以,本实验最终采用过滤的方法作为衍生化后处理步骤。
同时对衍生试剂用量、衍生化反应时间和反应温度进行优化,得样品、衍生试剂A与衍生试剂B的最佳体积比为1∶1∶3,反应时间为20 min,且衍生化过程在室温(20~25 ℃)时衍生化效果最好。
2.2 方法学考察
2.2.1 线性关系、检出限与定量下限 对“1.3.1”制备的氨基酸标准衍生溶液用pH 7.5 PBS缓冲液逐级稀释6次,采用峰保留时间比较法定性,外标法定量。以氨基酸溶液的浓度(x,mg/L)为横坐标,峰面积(y,mAU)为纵坐标,得到18种氨基酸的回归方程。由表1可见,在0.2~80 mg/L范围内,氨基酸的峰面积与其浓度的线性关系良好,相关系数为0.999 2~1.000 0。分别以信噪比S/N=3和S/N=10确定各氨基酸的方法检出限(LOD)和定量下限(LOQ),得18种氨基酸的LOD为0.01~0.39 mg/kg,LOQ为0.03~1.29 mg/kg(见表1)。

表1 18种氨基酸的线性方程、相关系数,线性范围,检出限及定量下限
2.2.2 回收率、精密度、重复性与稳定性 取牛皮明胶12份,每份20 mg,其中9份平均分为 3 组,按其中各成分质量分数的高(120%)、中(100%)、低(80%)浓度水平分别加入18种氨基酸对照品储备液,剩余3份样品中加入与混合标准溶液等体积的pH 7.5 PBS缓冲液作为对照;按所建立的方法对样品进行处理及测定,18 种氨基酸的加标回收率见表2。由表2可见,在上述加标水平下,18 种氨基酸的回收率为78.7%~121.0%,相对标准偏差(RSD)为0.05%~12.0% 。按2015版《中国药典》附录HPLC法指导原则考察精密度和重复性,RSD均小于3%;供试品溶液在36 h内基本稳定,RSD均小于5%。可见该方法具有较高的回收率,较好的精密度、重复性及稳定性,可以满足明胶样品中 18 种氨基酸含量的检测需要。在优化条件下,18种氨基酸混合标准溶液、空白衍生化溶液及牦牛皮明胶样品衍生化溶液的色谱图见图4。
表2 牛皮明胶中18种氨基酸的加标回收率及相对标准偏差(n=3)
Table 2 Recoveries and RSDs of 18 amino acids spiked in gelatin from bovine skin(n=3)/%

No.AminoacidLowMiddleHighRecoveryRSDRecoveryRSDRecoveryRSD1Asp8021478816787342Glu9360679470969520483Hyp10800781096411088244Ser109007411190611120145His1007171011381986256Gly10910681112371111227Arg9642896024965168Thr98906399117987369Pro112005411424311393610Ala103106810424010292311Cys98412011203098400512Tyr1091869911910911913Val10220381047062103903914Met9660981002309723915Ile8105089145102506316Leu105105010743910623117Phe788035815148191318Lys1136201173231210085
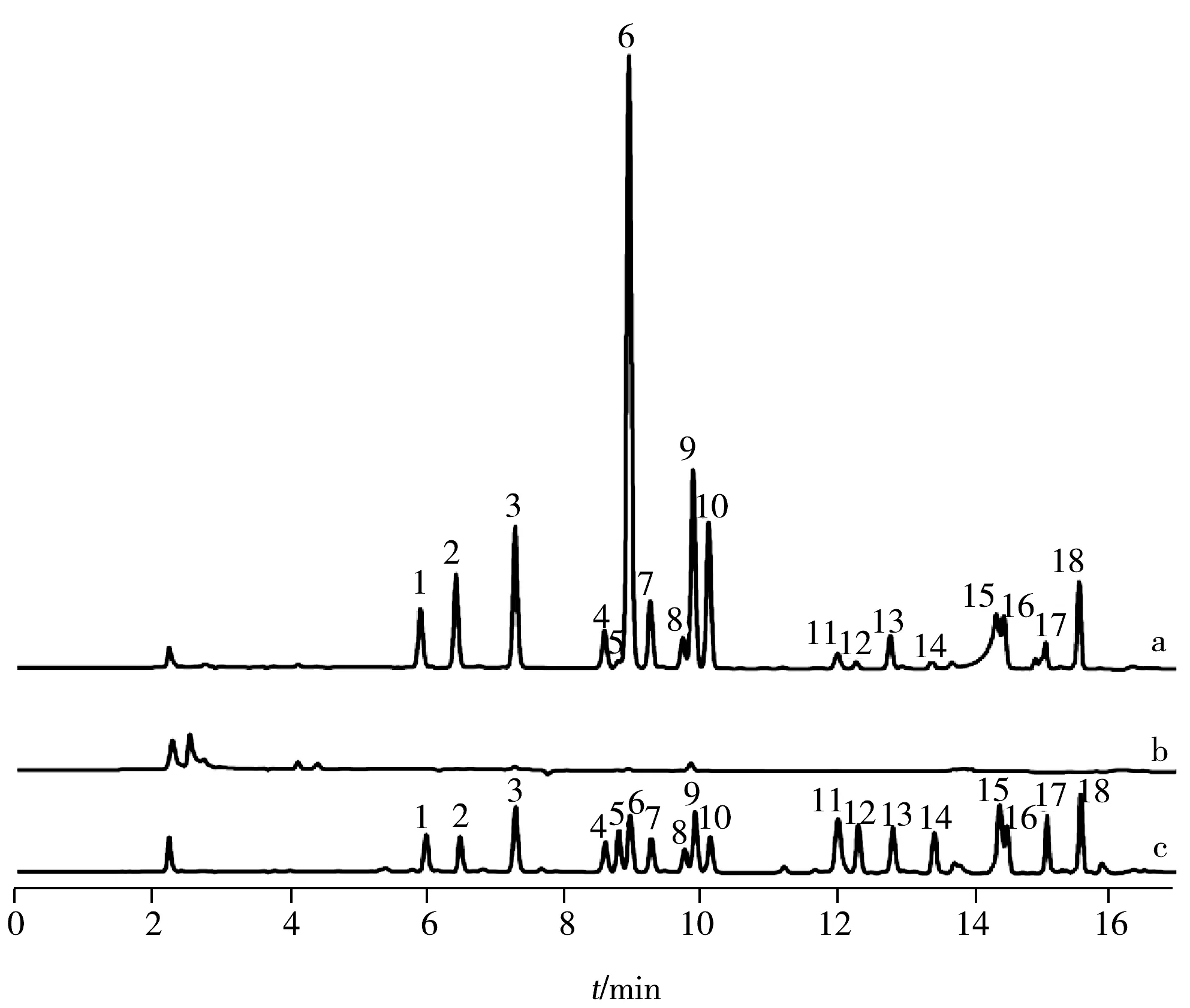
图4 牦牛皮明胶衍生化溶液(a)、空白衍生化溶液(b)及18种氨基酸对照品衍生化溶液(c)的 HPLC色谱图Fig.4 HPLC chromatograms from the test derivative solution of gelatin from Yak(a),blank derivative solution(b) and the reference derivative solution of 18 amino acids(c)the number denoted was the same as that in Fig.1
2.3 实际样品测定
按照本方法检测牦牛皮明胶和牛皮明胶中18种氨基酸的含量,测定结果如表3所示。由检测结果可看出,牛皮明胶和牦牛皮胶内均含有丰富的氨基酸,甘氨酸和酪氨酸含量相差较大,差幅分别为19.04%和38.34%;其余16种氨基酸含量基本相似。牦牛皮明胶在提取时由于在溶液中加入了0.1 mol/L甘氨酸,因此与牛皮明胶中的甘氨酸含量相差较大。同时,牦牛皮明胶和牛皮明胶中的特征氨基酸—脯氨酸和羟脯氨酸的含量均较高。本实验测定的氨基酸含量与张彩旗等[17]用氨基酸分析仪测得牦牛皮胶中的氨基酸含量基本相同(P<0.05)。
3 结 论
本文以PITC作为衍生试剂进行柱前衍生化,建立了柱前衍生-高效液相色谱测定牛和牦牛皮明胶中的氨基酸成分及含量。本文所建立的检测方法在0.2~80 mg/L范围内呈良好的线性关系,相关系数为0.999 2~1.000 0,检出限为0.01~0.39 mg/kg,3个添加水平下的回收率为78.7%~121.0%,RSD为0.05%~12.0%,完成一次测定用时24 min,动物皮明胶中的氨基酸成分在普通C18色谱柱上能实现很好的分离。该方法准确、可靠,可为动物皮胶来源与品质鉴定、营养状况评估和研究动物皮胶的生理意义提供一定的参考。
表3 牛皮明胶和牦牛皮胶中氨基酸的含量(n=3)
Table 3 Contents of amino acids in gelatin from bovine skin and Yak skin(n=3)w/(mg·g-1)

AminoacidGelatinfrombovineskinGelatinfromYakskinAminoacidGelatinfrombovineskinGelatinfromYakskinAsp4370±871∗4389±868Glu7586±12957433±1062Hyp7797±1427107±130Ser2147±3422073±394His689±122713±143Gly15502±47418465±1043Arg5716±10525659±1134Thr2262±0712112±030Pro8761±1947817±119Ala5996±10395705±1021Cys1636±0791753±076Tyr373±004516±025Val1532±2161504±242Met509±177558±104Ile1921±6161989±703Leu4424±2234487±078Phe1321±3141366±211Lys2226±3852190±356
* values are given as mean±SD from triplicate determinations
[1] Bai B Q,Hao L Z,Chai S T,Niu J Z,Wang W B,Liu S J.FoodSci.(拜彬强,郝力壮,柴沙驼,牛建章,王万邦,刘书杰.食品科学),2014,(17):290-296.
[2] Long R J,Dong S K,Hu Z Z,Shi J J,Dong Q M,Han X T.Livest.Prod.Sci.,2004,88(1):27-32.
[3] De Yak A H A.Int.J.Morphol.,2015,33(2):764-776.
[4] Dang H Q,Yang L B,Sun Q H.Med.World(党合群,杨黎彬,孙青惠.医药世界),2005,(10):76-77.
[5] Zhang X J.TheCollagenHydrolysedfromtheCalfSkinandItsAntioxidantActivityAnalyze.Xi’an:Northwestern University(张小娟.牛皮胶原蛋白的水解及其抗氧化性研究.西安:西北大学),2012.
[6] Ding Y S,Mou S F.Chin.J.Chromatogr.(丁永胜,牟世芬.色谱),2004,22(3):210-215.
[7] Chang B Y,Liu H J,Yan H W,Yu F H,Liu X X.Chin.J.Anal.Chem.(常碧影,刘洪基,闫惠文,于风华,刘兴湘.分析化学),1995,23(1):100-103.
[8] Roach M C,Harmony M D.Anal.Chem.,1987,59(3):411-415.
[9] Qin F P,Wang C Z,Ji X F.J.ChangchunUniv.Technol.:Nat.Sci.Ed.(邱芳萍,王长周,季晓枫.长春工业大学学报:自然科学版),2012,33(5):583-587.
[10] Zhang Y,Sun J H,Ye R H,Peng L,Wu D K.J.Instrum.Anal.(张怡,孙晋红,叶汝汉,彭蕾,伍迪科.分析测试学报),2013,32(8):1003-1006.
[11] Zhao D S,Ma X L,Li X X,Zhang H B,Mian Q H,Meng L,Chen J.Chin.J.Pharm.Anal.(赵东升,马晓丽,李新霞,张海波,勉强辉,孟磊,陈坚.药物分析杂志),2013,33(6):963-968.
[12] Dai Z,Wu Z,Jia S,Wu G.J.Chromatogr.B,2014,964:116-127.
[13] Sun Y C,Xu X Z,Xu Y L,Tan Z J,Mou Z B,Du N N.Chin.J.Chromatogr.(孙言春,许宪祝,徐衍岭,谭志军,牟振波,杜宁宁.色谱),2013,31(3):275-280.
[14] Jiang H F,Ma P Y,Jin Y,Feng X D,Wang X H.Mod.Sci.Instrum.(江海风,马品一,金月,冯旭东,王兴华.现代科学仪器),2013,(4):55-61.
[15] Cohen S A,Bidlingmeyer B A,Tarvin T L.Nature,1986,320(6064):769.
[16] Shigemura Y,Akaba S,Kawashima E,Park E Y,Nakamura Y,Sato K.FoodChem.,2011,129(3):1019-1024.[17] Zhang C Q,Xing Y X,Hu F Z.Mod.Sci.Instrum.(张彩旗,星玉秀,胡凤祖.现代科学仪器),2006,(3):50-51.[18] Zhu H M,Wei L X,Du Y Z,Xiao Y C,Yang H X,Li C.Chin.Tradit.PatentMed.(朱洪梅,魏立新,杜玉枝,肖远灿,杨红霞,李岑.中成药),2012,34(2):195-198.
[19] Bidlingmeyer B A,Cohen S A,Tarvin T L.J.Chromatogr.B,1984,336(1):93-104.
Determination of 18 Amino Acids in Gelatin from Bovine and Yak by High Performance Liquid Chromatography Coupled with Precolumn Derivatization
XU Meng-qi1,2,3,WEI Li-xin1,2,XIAO Yuan-can1,2,BI Hong-tao1,2,YANG Hong-xia1,2*,DU Yu-zhi1,2*
(1.Qinghai Key Laboratory of Tibetan Medicine Pharmacology and Safety Evaluation,Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810008,China;2.Key Laboratory of Tibetan Medicine Research,Chinese Academy of Sciences,Xining 810008,China;3.University of Chinese Academic of Sciences,Beijing 100049,China)
A rapid quantitative method of high performance liquid chromatograpy(HPLC) was developed for the analysis of 18 amino acids in gelatin from bovine skin and Yak skin.The steps of sample derivatization with PITC were optimized.The method was no need for drying-down and extraction with organic solvent.The yak leather was enzymatically hydrolyzed at 37 ℃ for 72 h with pepsin,and then was freeze-dried.The sample was then hydrolyzed with 6.0 mol/L HCl at 110 ℃.After the hydrolyzation,the solution was derivatized with phenyl isothiocyanate(PITC).Gradient HPLC separation was performed on a Shiseido Capcell Pak C18column(4.6 mm×250 mm,5 μm) with 0.14 mol/L sodium acetate-0.5 mL/L triethylamine solution(pH 6.08,adjusted with glacial acetic acid) and 60% acetonitrile as mobile phases at a flow rate of 1 mL/min.The detection was carried out with an ultraviolet detector,and the wavelength was set at 254 nm.The calibration curves were linear in the range of 0.2-80 mg/L with correlation coefficients(r2) not less than 0.999 2.The limits of detection for the method were in the range of 0.01-0.39 mg/kg,and the average recoveries were 78.7%-121.0% with RSDs of 0.05%-12.0%.The derivatization steps were simple and sensitive,and the sample pretreatment time was short.The method was suitable for the rapid identification and determination of amino components in gelatin from bovid.
gelatin from Yak;gelatin from bovine;amino acid;precolumn derivatization;phenyl isothiocyanate(PITC);high performance liquid chromatography(HPLC)
2016-06-17;
2016-08-29
青海省自然科学基金青年项目(2015-ZJ-924Q);中国科学院“西部之光”人才培养引进计划
10.3969/j.issn.1004-4957.2016.12.008
O657.72;O629.711
A
1004-4957(2016)12-1563-06
*通讯作者:杜玉枝,研究员,研究方向:藏药药理及新产品开发,Tel:0971-6132480,E-mail:yzdu@nwipb.cas.cn 杨红霞,博士,助理研究员,研究方向:藏药药理,Tel:0971-6132480,E-mail:hxyang@nwipb.cas.cn

