生物酶对五氯联苯降解的初步研究
季蕾,陈贯虹,傅晓文,黄玉杰,王加宁,张强
(山东省科学院生态研究所, 山东省应用微生物重点实验室, 山东 济南 250014)
【环境与生态】
生物酶对五氯联苯降解的初步研究
季蕾,陈贯虹,傅晓文,黄玉杰,王加宁,张强*
(山东省科学院生态研究所, 山东省应用微生物重点实验室, 山东 济南 250014)
多氯联苯(PCBs)是具有代表性的持久性有机污染物(POPs),其氯代数目越多,降解越难。本文以分离筛选的6株PCBs降解细菌为材料,制备了含有NADH辅酶再生系统关键酶甲酸脱氢酶(FDH)的PCBs降解复合酶,研究了其对PCBs的降解效果。结果表明,Pseudomonassp. MGB11胞内酶/FDH复合酶对五氯联苯PCB114的降解率在10 h内可达69.4%,对于高毒性、难降解的高氯PCBs的污染修复具有应用价值。
五氯联苯; 降解复合酶; 甲酸脱氢酶
工业化学品多氯联苯(PCBs)是首批被列入国际持久性有机污染物( persistent organic pollutants, POPs)公约的污染物,具有持久性、半挥发性、长距离迁移性、生物蓄积性和高毒性的污染特性[1],其氯化程度越高,越难分解。五氯联苯作为高氯PCBs,与低氯代物相比,具有更高的毒性和持久性[2]。目前,POPs污染事故仍不断发生,及时、有效地修复污染环境,对人类健康和经济发展至关重要。
微生物降解因其低耗、易于实现原位修复、环境安全和纯生态过程的显著优点[3],是公认的治理PCBs污染的一种环保而有效的手段。好氧微生物能够把低氯PCBs(nCl<5)氧化为氯代苯甲酸,但很难降解高氯PCBs(nCl≥5)[4];厌氧生物过程将高氯PCBs还原成低氯PCBs,但不能破坏苯环结构[5],PCBs好氧开环过程需要联苯双加氧酶等NADH依赖型氧化还原酶[6-8]。NADH的持续供给可通过高效、低成本的甲酸/FDH(甲酸脱氢酶) 辅酶再生系统实现[9]。
本研究针对微生物降解高氯PCBs周期长、效率低的问题,以五氯联苯为降解底物,选用实验室自行分离筛选的6株PCBs降解好氧细菌,制备含有NADH辅酶再生系统关键酶FDH的PCBs降解复合酶,提高高氯PCBs的降解效率,以实现对PCBs污染的快速修复。
1 材料与方法
1.1 实验材料
联苯(国药集团);PCB114(2,3,4,4',5-Pentachlorobiphenyl)(Sigma-Aldrich);正己烷为色谱纯;其他化学试剂为分析纯。
6株PCBs降解菌均由本实验室分离并保存,分别为Burkholderiasp. MGB112、Sphingomonassp. MGB12、Pseudomonassp. MGB11、Rhodococcussp. MGB10、Arthrobactersp. MGB09、Pseudomonassp. VM14。
表达博伊丁假丝酵母fdh基因的基因工程大肠杆菌E.coliBL21-fdh由本实验室构建,用于FDH的制备。
诱导培养基:蛋白胨2 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.1 g/L,NaCl 0.2 g/L,(NH4)2SO41.0 g/L,联苯1.0 g/L,pH=7.0。
ZYP培养基:蛋白胨10 g/L,酵母提取物5 g/L,Na2HPO4·12H2O 9 g/L,KH2PO46.8 g/L,(NH4)2SO43.3 g/L,CaCl20.02 g/L,MgSO40.24 g/L,0.5%甘油,葡萄糖0.5 g/L,乳糖2 g/L。
1.2 实验方法
1.2.1 PCBs降解酶制备
6株PCBs降解菌分别在30 ℃、150 r/min条件下用诱导培养基培养48 h,4 ℃、8 000 r/min离心5 min,分别收集菌体及上清液,菌体用10 mmol/L PBS缓冲液(pH=7.5)稀释至原浓度的1/20,在250 W、3 s/5 s条件下进行细胞破碎20 min,离心,上清为粗酶液。
1.2.2 FDH制备及活性检测
E.coliBL21-fdh在37 ℃、150 r/min条件下经ZYP培养基培养24 h,于4 ℃、8 000 r/min离心5 min,菌体稀释至原浓度的1/20,在200 W、3 s/3 s条件下进行细胞破碎6 min,离心,上清为粗酶液。
FDH活性检测:反应体系中甲酸钠1 670 mmol/L,NAD 16.7 mmol/L,10 mmol/L PBS缓冲液(pH=7.5)2 mL,加入适当稀释的酶液1 mL,蒸馏水补足4 mL,30 ℃反应5 min,测定反应前后340 nm处的吸光值,根据标准曲线计算酶活力。酶活力定义为1 min催化产生1 μmol NADH所需的酶量为1 U。
1.2.3 菌株对PCBs降解
不同菌株分别在诱导培养基中培养至饱和后,各取2 mL菌液8 000 r/min离心5 min,菌体用灭菌蒸馏水清洗2次,重悬后分别接种至50 mL 浓度为1 mg/L 的PCB114溶液中,置于摇床中30 ℃、150 r/min培养。培养7 d后测定PCB114的降解率。
1.2.4 PCBs的酶降解
反应体系为10 mL,其中10 mmol/L PBS缓冲液(pH=7.5)5 mL,PCBs降解酶1 mL,FDH 酶液1 mL,蒸馏水补足至10 mL。PCB114 终浓度1 mg/L,甲酸钠1 670 mmol/L,30 ℃水浴反应8 h后测定降解率。
1.2.5 PCBs萃取及检测
反应体系中加入10 mL正己烷,充分震荡后超声5 min,转移至分液漏斗,静置分层后分离上下相,萃取3次,合并萃取液,经无水硫酸钠脱水,旋蒸后定容至5 mL,GC-MS法测定PCB114含量。
气相色谱条件:HP-5MS色谱柱,进样口温度280 ℃,柱温100 ℃保持1 min后,升至280 ℃保持4 min,载气流速为1 mL/min,不分流进样,进样量1 μL。质谱条件:离子源为电子轰击源(EI),能量70 eV,阱温220 ℃,传输线温度280 ℃,溶剂延迟5 min。定量分析选择SIM模式。
2 结果与分析
2.1 菌株对PCBs的降解
6株PCBs降解菌经1 g/L联苯诱导,可达到的饱和生物量如表1所示。Pseudomonassp. MGB11的菌体密度最大,其OD600值为2.05;Pseudomonassp. VM14生物量达饱和时的OD600值仅为0.57,6株细菌在诱导培养基中所达到的饱和菌体密度均较低。收集菌体转接至PCB114培养基中,7 d后有3株菌的降解率达到20%以上,其中Pseudomonassp. MGB11降解率最大,为29%(表1),其降解能力与生物量保持一致。
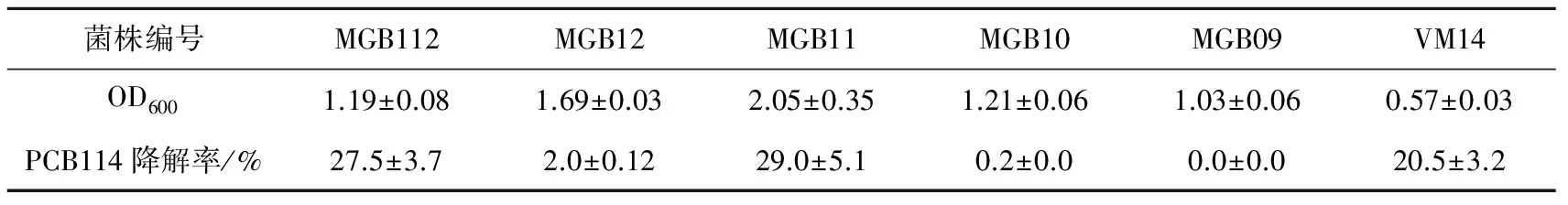
表1 PCBs降解菌在诱导培养基中的饱和生物量和PCB114降解率
2.2 复合酶对PCBs的降解
E.coliBL21-fdh经诱导产酶后,收集细胞并破碎,获得的粗酶液FDH酶活力为0.633 U/mL。分别制备6株PCBs降解菌的粗酶液,与FDH粗酶按照1:1(V/V)的比例进行复配,添加至PCB114浓度为1 mg/L的降解体系,反应8 h后,PCB114降解率结果如表2所示。

表2 不同复合酶对PCB114的降解率
注:CK为MGB112粗酶液(未添加FDH)。
结果显示,8 h后MGB112、MGB11、VM14对PCB114降解率分别为57.1%、65.7%、40%,其中Pseudomonassp. MGB11胞内酶/FDH复合酶对PCB114的降解率最高(65.7%)。Burkholderiasp. MGB112胞内酶/FDH复合酶的PCB114降解率(57.1%)与其胞内酶单独作用8 h相比(7.5%)提高了6.6倍。
2.3 PCBs降解酶在细胞不同部位的分布
菌株Pseudomonassp. MGB11经培养后,对其培养液、菌体破碎液的PCB114降解能力进行比较,结果显示,在8 h内,Pseudomonassp. MGB11胞内酶/FDH对PCB114的降解率达67.5%,而添加胞外上清液/FDH的体系中未检测到降解活性,表明具有PCBs降解活性的酶主要存在于胞内,而不分泌到胞外培养液中。Ruiz-Aguilar等[10]报道,来源于细菌的PCBs降解酶大多为胞内酶,而白腐真菌可分泌胞外过氧化物酶降解

图1 复合酶Pseudomonas sp. MGB11胞内酶/FDH对PCB114的降解曲线Fig.1 Degradation curve of intracellular enzyme of Pseudomonas sp. MGB11 /FDH to PCB114
PCBs,与好氧细菌相似,降解速率与含氯量成反比,降解四氯代以上的PCBs仍比较困难。
2.4 复合酶对PCB114的降解曲线
在短时间内实现PCB114高效降解的复合酶Pseudomonassp. MGB11胞内酶/FDH,对1 mg/L PCB114的降解曲线见图1。结果显示,经8~10 h降解后,复合酶对底物的降解速率趋于稳定,10 h时PCB114降解率达69.4%。
3 讨论
目前关于高氯代PCBs降解的相关研究报道较少,多为低氯PCBs降解的相关研究。胡星等[11]筛选获得的假单胞菌SYC01对四氯联苯PCB77(0.5 mg/L)、PCB52(0.1 mg/L)的降解率分别为34%、68%。Sierra等[12]分离的好氧菌Janibactersp. MS3-02对四氯联苯Aroclor1242在7 d内的降解率为70%。本文中,对更难降解的毒性类二噁英类PCBs[13],降解酶系仅需10 h即可降解69.4%,具有更快的降解速率。此外,微生物降解高氯PCBs的过程,一般需要先经过厌氧脱氯后,更易于好氧开环降解生成小分子。本文所使用的好氧微生物胞内酶,直接通过好氧过程可将高氯PCBs降解,操作工艺简单,适用于原位污染修复。
在PCBs污染修复方面,厌氧脱氯的研究仅局限于菌种的分离和脱氯机理的研究,而在分子生物学及酶学方面仍处于空白阶段,好氧生物降解主要集中在PCBs降解菌株的筛选、降解机理及降解相关的酶和基因方面的研究[14],对于构建具有辅酶再生功能的高氯PCBs降解复合酶的相关研究尚属首次[15]。
利用分离筛选、富集或基因工程构建获得的具有特定降解功能的微生物,通过发酵工程及酶工程手段,提取相关酶或酶系,制备复合酶或经固定化后,用于PCBs污染土壤、水体及有机污染场地的修复,是极具应用潜力的环境治理途径。本研究将辅酶再生系统关键酶FDH引入PCBs降解复合酶的构建,实现好氧条件下对高氯代PCBs的高效降解,周期短、降解能力强、成本低且操作工艺简单,在污染环境治理、生态修复方面具有应用价值。
[1]董玉瑛, 冯霄. 持久性有机污染物分析和处理技术研究进展 [J]. 环境污染治理技术与设备, 2003, 4(6): 49-55.
[2]SAFE S, BANDIERA S, SAWYER T, et al. PCBs: structure-function relationships and mechanism of action [J]. Environmental Health Perspectives, 1985, 60: 47-56.
[3]周际海, 黄荣霞, 樊后保, 等. 污染土壤修复技术研究进展 [J]. 水土保持研究, 2016, 23(3): 366-372.
[4]ABRAMOWICZ D A. Aerobic and anaerobic biodegradation of PCBs: A review [J]. Critical Reviews in Biotechnology, 1990, 10(3): 241-251.
[5]韦朝海, 张小璇, 任源, 等. 持久性有机污染物的水污染控制: 吸附富集、生物降解与过程分析 [J]. 环境化学, 2011, 30(1): 300-309.
[6]刘云兴, 王国梁. 多氯联苯生物降解技术研究进展 [J]. 环境科学与管理, 2012, 37(12): 72-75.
[7]曲媛媛, 许炳雯, 丛培, 等. 两相体系中固定化联苯双加氧酶全细胞产靛蓝特性研究 [J]. 大连理工大学学报, 2013, 53(3): 340-345.
[8]BRENNER V, ARENSDORF J J, FOCHT D D. Genetic construction of PCB degraders [J]. Biodegradation, 1994, 5(3/4): 359-377.
[9]黄志华, 刘铭, 王宝光, 等. 甲酸脱氢酶用于辅酶NADH 再生的研究进展 [J]. 过程工程学报, 2006, 6(6): 1011-1016.
[10]RUIZ-AGUILAR G M L, FERNNDEZ-SNCHEZ J M, RODRGUEZ-VZQUEZ R,et al. Degradation by white-rot fungi of high concentrations of PCB extracted from a contaminated soil [J]. Advances in Environmental Research, 2002, 6(4): 559-568.
[11]胡星, 杜丽婷, 王斐, 等. 一株联苯基质筛选菌的生理及多氯联苯降解特性 [J]. 上海大学学报 (自然科学版), 2016, 22(2): 188-196.
[12]SIERRA I, VALERA J L, MARINA M L, et al. Study of the biodegradation process of polychlorinated biphenyls in liquid medium and soil by a new isolated aerobic bacterium (Janibacter sp.) [J]. Chemosphere, 2003, 53(6): 609-618.
[13]SAFE S. Toxicology, structure-function relationship, and human and environmental health impacts of polychlorinated biphenyls: progress and problems [J]. Environmental health perspectives, 1993, 100(4): 259-268.
[14]PIEPER D H, SEEGER M. Bacterial metabolism of polychlorinated biphenyls [J]. Journal of molecular microbiology and biotechnology, 2008, 15(2/3): 121-138.
[15]FURUKAWA K, FUJIHARA H. Microbial degradation of polychlorinated biphenyls: Biochemical and molecular features [J] . Journal of Bioscience and Bioengineering, 2008, 105(5): 433-449.
Pilot study on bioenzyme degradation to pentachlorodiphenyl
JI Lei, CHEN Guan-hong, FU Xiao-wen, HUAGN Yu-jie, WANG Jia-ning, ZHANG Qiang*
(Shandong Provincial Key Laboratory of Applied Microbiology, Ecology Institute, Shandong Academy of Sciences, Jinan 250014, China)
∶ Polychlorinated biphenyls (PCBs) is a representative of persistent organic pollutants (POPs). More its chlorinated number leads to more difficult its degradation . We prepared PCBs compound degrading enzyme of key enzyme formate dehydrogenase (FDH) of NADH coenzyme regeneration system with isolated 6 PCBs degradation bacteria strains as materials. We address its degrading effect to PCBs. Results indicate that degradation rate of Pseudomonas sp. MGB11/FDH compound enzyme to pentachlorodiphenyl PCB114 is up to 69.4% within 10 h. It therefore has application value in the repair for high chlorine PCBs pollutants with high toxicity and low degradability.
∶ pentachlorodiphenyl; compound degrading enzyme; formate dehydrogenase
10.3976/j.issn.1002-4026.2016.06.015
2016-08-08
国家国际科技合作专项(2014DFE90100);山东省自然科学基金(ZR2015YL008, BS2015HZ011)
季蕾(1985—),女,博士,研究方向为生态修复。
*通信作者。E-mail:zhbuaiji@sina.com。
X53
A
1002-4026(2016)06-094-04

