忍冬叶化学成分的研究进展
朱姮,陈静娴,文蕾,王召平,井凤,王岱杰*
(1.山东中医药大学药学院,山东 济南 250355;2.山东师范大学生命科学学院,山东 济南 250014;3.山东省中药质量控制技术重点实验室,山东省分析测试中心,山东 济南 250014)
【中药与天然活性产物】
忍冬叶化学成分的研究进展
朱姮1,陈静娴2,文蕾1,王召平1,井凤3,王岱杰3*
(1.山东中医药大学药学院,山东 济南 250355;2.山东师范大学生命科学学院,山东 济南 250014;3.山东省中药质量控制技术重点实验室,山东省分析测试中心,山东 济南 250014)
忍冬叶为金银花采摘后的副产物,产量约为花的10倍,且具有较强的药理活性。本文对忍冬叶中挥发油类、有机酸类、黄酮类以及环烯醚萜苷类等化学成分进行综述,发现忍冬叶中的化学成分与金银花相似,在目前药材市场上金银花价格居高不下的情况下,可以考虑作为金银花的替代品。目前对忍冬叶的研究热点主要集中在含量测定、成分分离及提取物药理研究方面,今后应开展对忍冬叶系统的化学分离及基于活性导向的活性部位研究,同时与列入药典的金银花和忍冬藤进行同类药理活性的比较研究。
忍冬;忍冬叶;化学成分
忍冬(LonicerajaponicaThunb.)为忍冬科(Caprifoliaceae)忍冬属(Lonicera)多年生常绿植物,是我国重要的药用植物,其藤、叶、花均可入药。目前,忍冬不同部位在《中国药典》中区分开来,忍冬花又名金银花(Lonicerae japonicae flos)是忍冬的干燥花蕾或带初开的花;忍冬藤(Lonicerae japonicae caulis)是忍冬的干燥茎枝[1]。其中,金银花是目前药材市场上常用的抗病毒大宗药材,但是当前市场上金银花价格居高不下,寻找新的替代品成为未来的发展方向。在我国最早记录忍冬的医书为梁代陶弘景著作的《本草经集注》,书中以“忍冬”之名予以记述,指出忍冬的药用部位为忍冬藤和忍冬叶[2]。忍冬药用部位在历史上经历了茎叶-茎叶花-花的变迁历程。忍冬叶作为金银花药材的一种副产物,产量约为花的10倍,四季皆有,产量较大,资源丰富[3],且与金银花在临床上功效相似,都有清热解毒之功效,有效成分也与花基本相似,甚至比花含量高,但长期以来都被作为非药用部分弃去而未得到利用,造成了药用植物资源的极大浪费[4]。本文对近十几年忍冬叶的化学成分研究进行了归纳和总结,为其化学成分和抗炎、抗病毒以及保肝等药理活性的进一步研究提供参考。
1 挥发油类
肖敏等[5]采用水蒸气蒸馏-乙醚萃取法,用提取挥发油的装置提取出忍冬叶中挥发油成分,共识别出 26种化合物。主要成分包括有机酸和有机酸酯,其他成分主要有酮、 醛和醇类化合物,其中有机酸酯类化合物占 29.44% ,有机酸类化合物占 27.56% ,其他类如烷烃、醇、酮、醛类化合物占22.3%。忍冬叶中主要的挥发油成分包括棕榈酸、9, 12, 15-十八碳三稀酸甲基酯、9, 12-十八碳二稀酸乙基酯、十六烷酸乙基酯、亚油酸以及芳樟醇等。
钟玲等[6]运用超临界CO2流体萃取技术对忍冬叶中的绿原酸和脂溶性成分进行萃取,并用GC-MS对提取物的脂溶性成分进行分析并鉴定出39种化合物,主要成分有邻苯二甲酸单-乙基己酯、反式角鲨烯、十八烷、植物醇和邻苯二甲酸二异丁酯等。
2 有机酸类
忍冬叶中有机酸类化合物主要为绿原酸类,其中包括单咖啡酰基绿原酸类和双咖啡酰基绿原酸类化合物。郭玉等[3]比较研究了同一株忍冬来源的忍冬叶、花中的绿原酸含量,绿原酸在忍冬花、叶中的含量分别为2.72%和2.30%。截止目前已经成功从忍冬叶中分离出10种化合物,名称和结构式如表1所示。
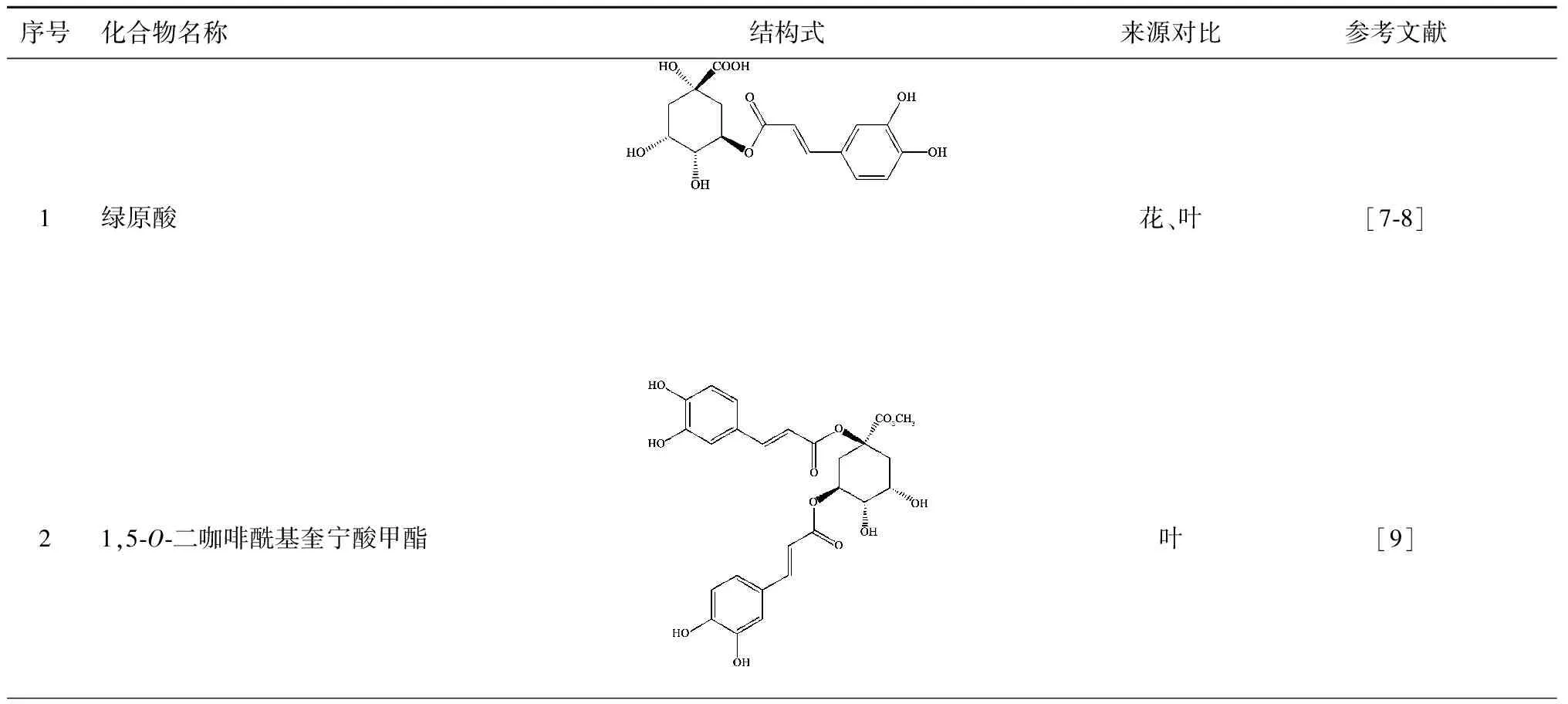
表1 忍冬叶中的有机酸类化合物
续表1
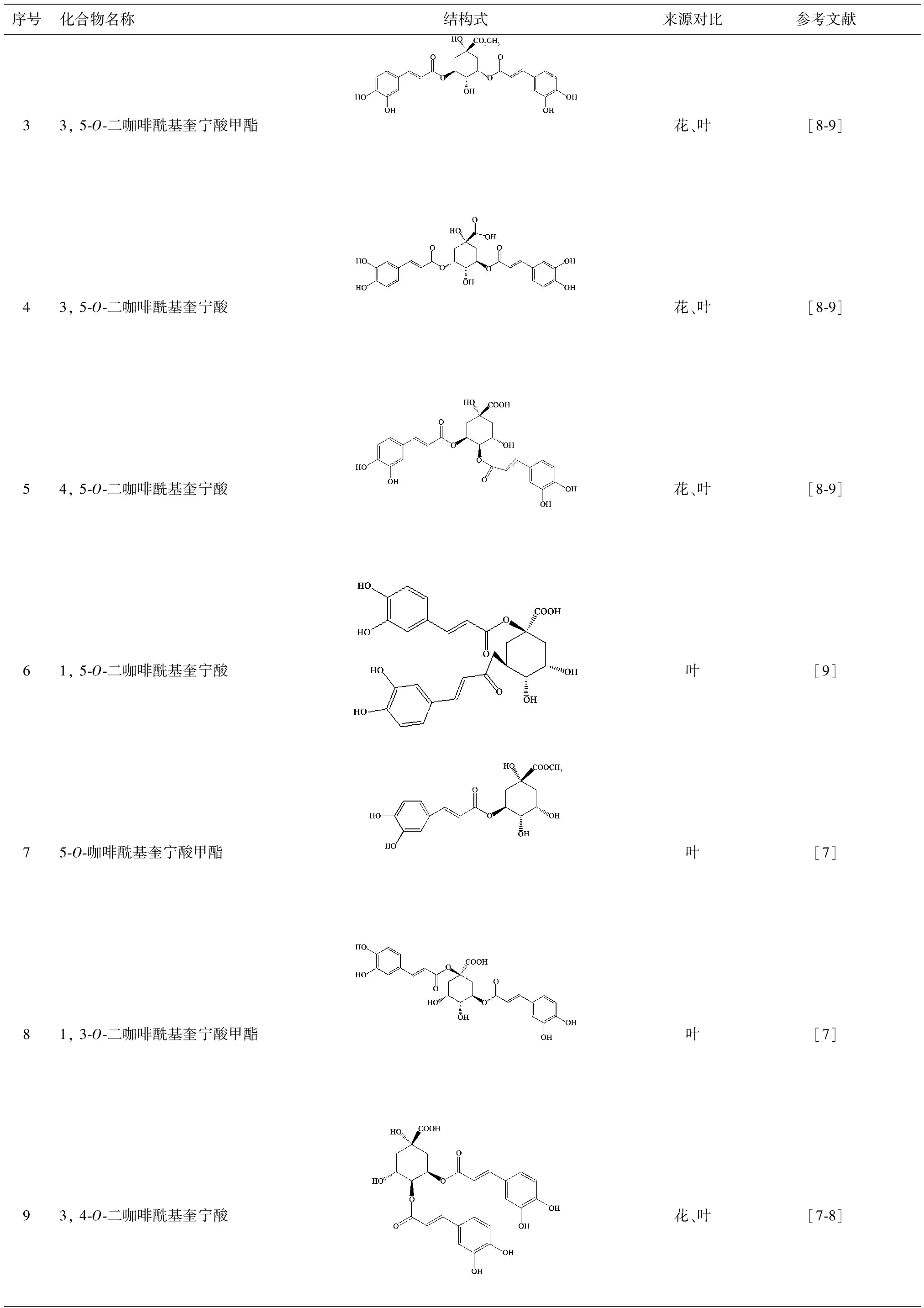
序号化合物名称结构式来源对比参考文献33,5⁃O⁃二咖啡酰基奎宁酸甲酯花、叶[8⁃9]43,5⁃O⁃二咖啡酰基奎宁酸花、叶[8⁃9]54,5⁃O⁃二咖啡酰基奎宁酸花、叶[8⁃9]61,5⁃O⁃二咖啡酰基奎宁酸叶[9]75⁃O⁃咖啡酰基奎宁酸甲酯叶[7]81,3⁃O⁃二咖啡酰基奎宁酸甲酯叶[7]93,4⁃O⁃二咖啡酰基奎宁酸花、叶[7⁃8]
续表1
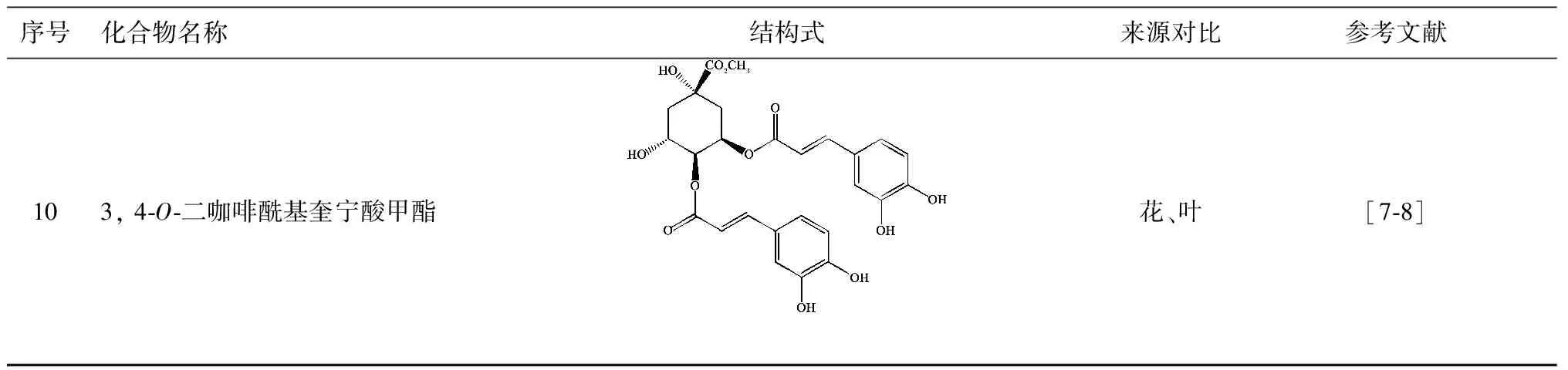
序号化合物名称结构式来源对比参考文献103,4⁃O⁃二咖啡酰基奎宁酸甲酯花、叶[7⁃8]
3 黄酮类
黄酮类化合物具有较好的抗菌、抗病毒、保肝降脂等活性[10-13],忍冬叶中黄酮类成分含量丰富,王丽婷等[14]测定了叶和花中槲皮素和木犀草素的含量,叶中二者的含量分别为27.53 μg/g和147.3 μg/g,优于花中的20.94 μg/g和41.66 μg/g。郭玉等[15]采用高效液相色谱法测定了同一株忍冬来源的花和叶中木犀草苷含量,叶中含量0.326%,为花中含量的3倍。
目前已从叶中分离得到22个黄酮类化合物[16-22],化合物的名称、结构式与来源如表2所示。
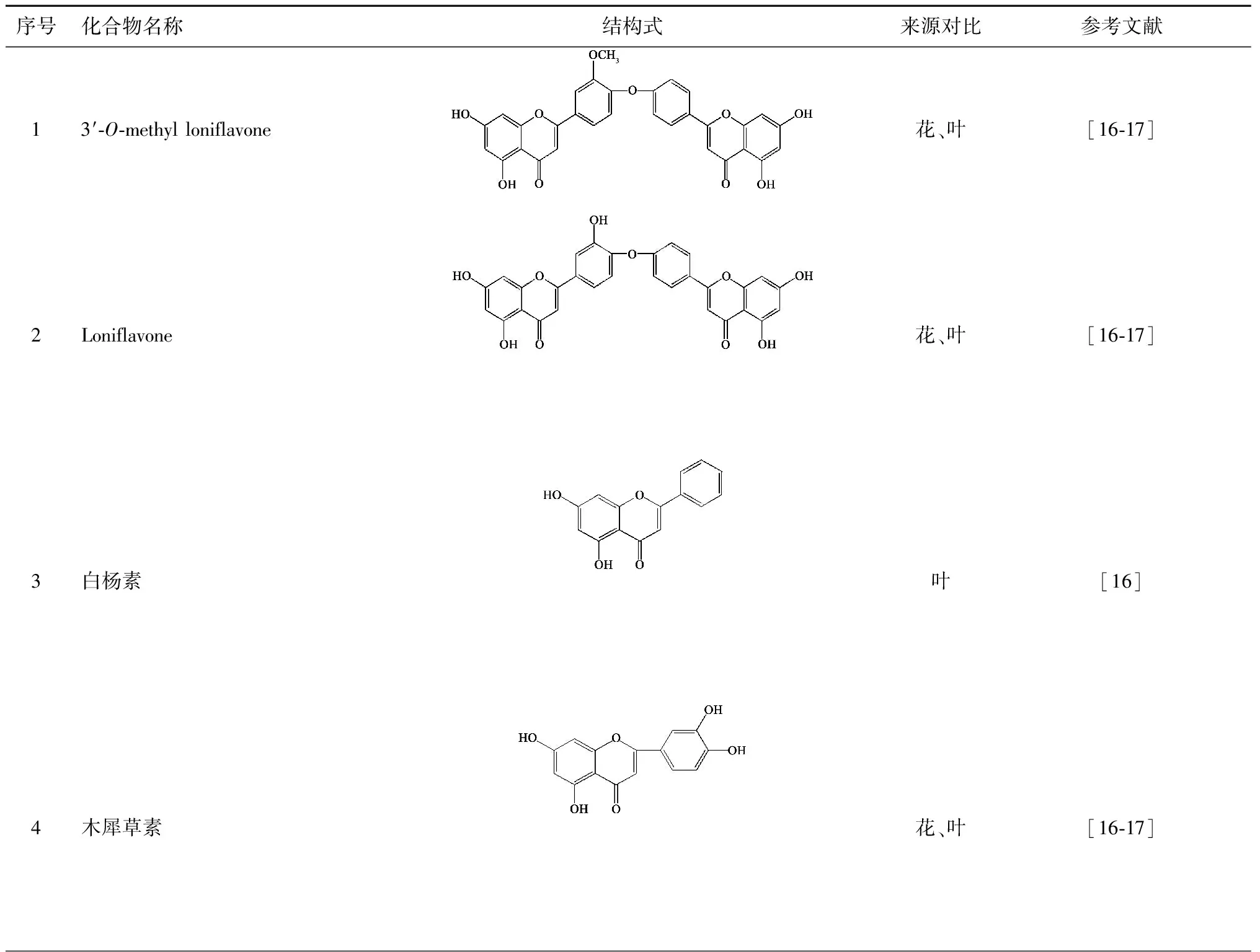
表2 忍冬叶中的黄酮类化合物
续表2
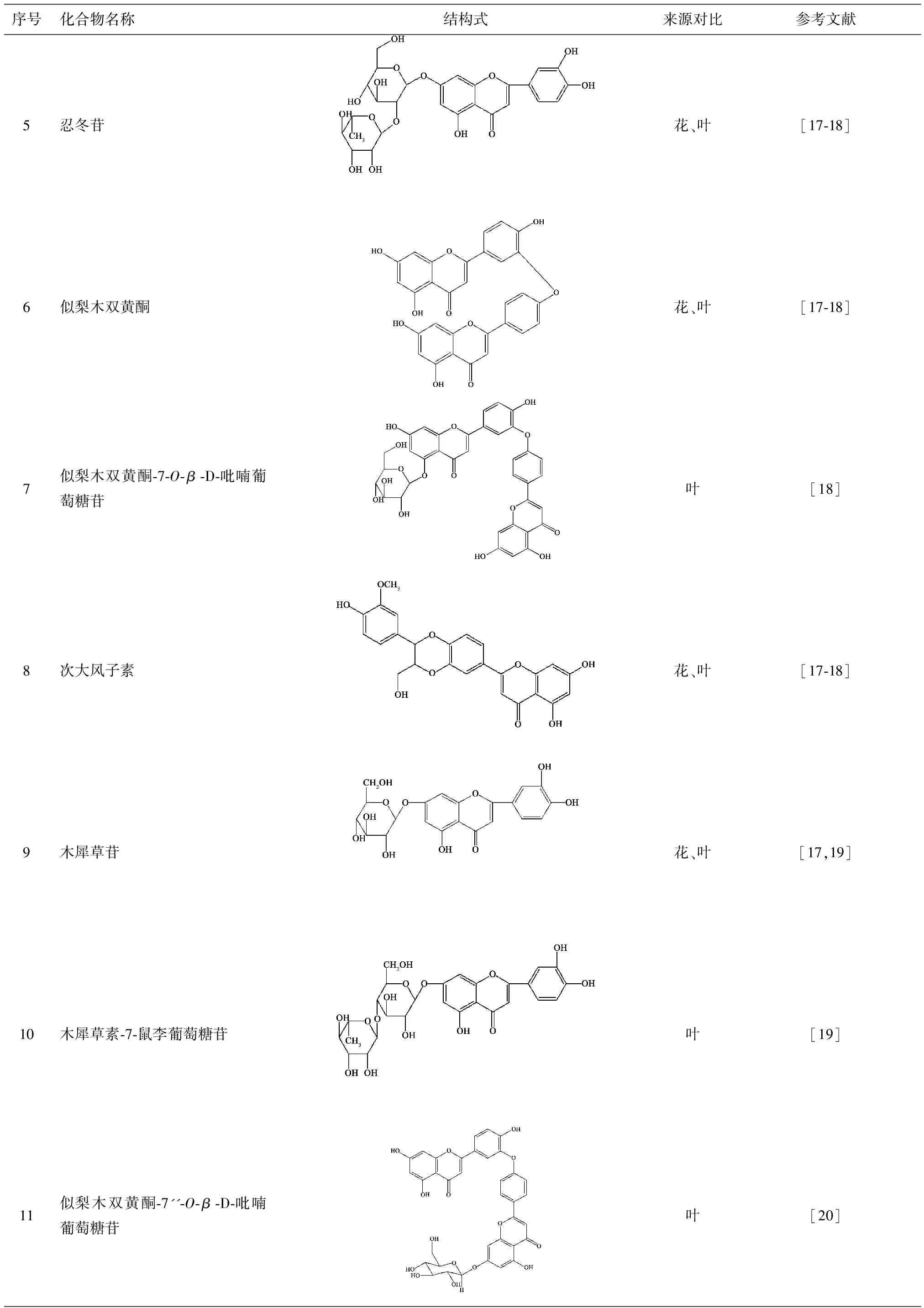
序号化合物名称结构式来源对比参考文献5忍冬苷花、叶[17⁃18]6似梨木双黄酮花、叶[17⁃18]7似梨木双黄酮⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷叶[18]8次大风子素花、叶[17⁃18]9木犀草苷花、叶[17,19]10木犀草素⁃7⁃鼠李葡萄糖苷叶[19]11似梨木双黄酮⁃7''⁃O⁃β⁃D⁃吡喃葡萄糖苷叶[20]
续表2
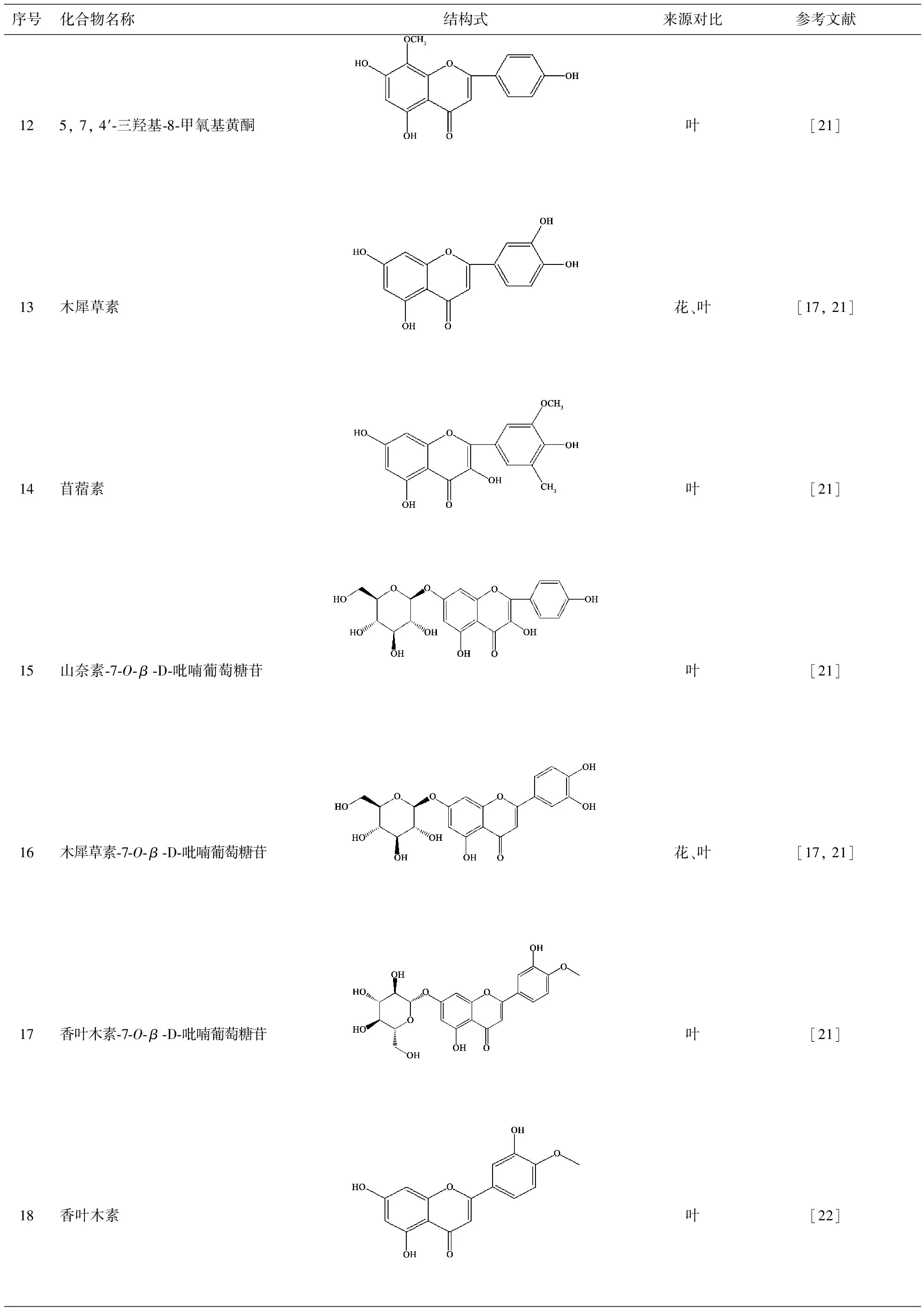
序号化合物名称结构式来源对比参考文献125,7,4′⁃三羟基⁃8⁃甲氧基黄酮叶[21]13木犀草素花、叶[17,21]14苜蓿素叶[21]15山奈素⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷叶[21]16木犀草素⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷花、叶[17,21]17香叶木素⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷叶[21]18香叶木素叶[22]
续表2
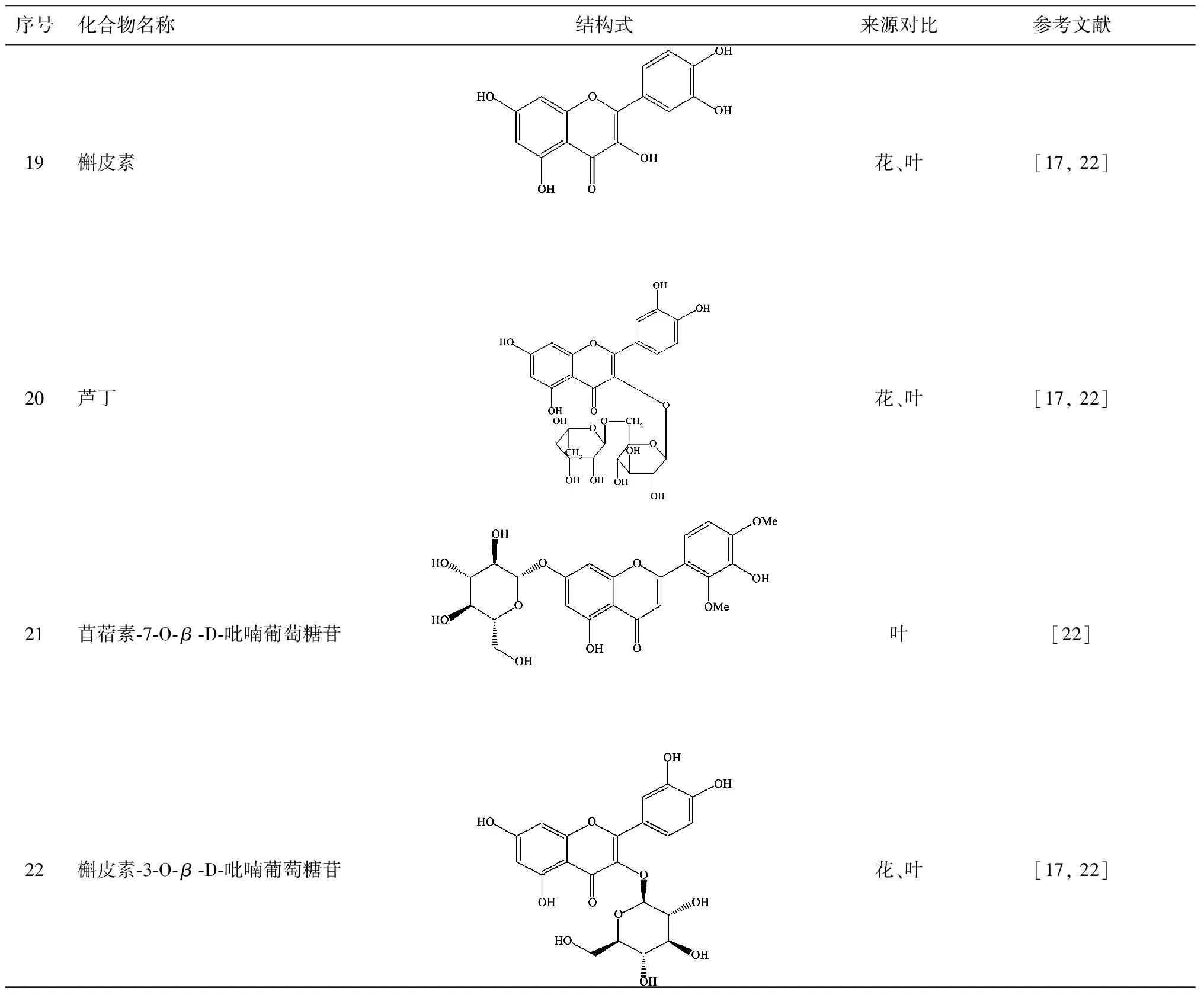
序号化合物名称结构式来源对比参考文献19槲皮素花、叶[17,22]20芦丁花、叶[17,22]21苜蓿素⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷叶[22]22槲皮素⁃3⁃O⁃β⁃D⁃吡喃葡萄糖苷花、叶[17,22]
4 环烯醚萜苷类
现已从忍冬叶、茎叶中分离得到的环烯醚萜苷类成分有10个[23-26],钱正明等[27]研究结果显示,忍冬叶中环烯醚萜苷类成分含量丰富,且具有较高的生物活性,有潜在的开发利用价值。目前主要分离出的环烯醚萜苷类化合物有10种,见表3。
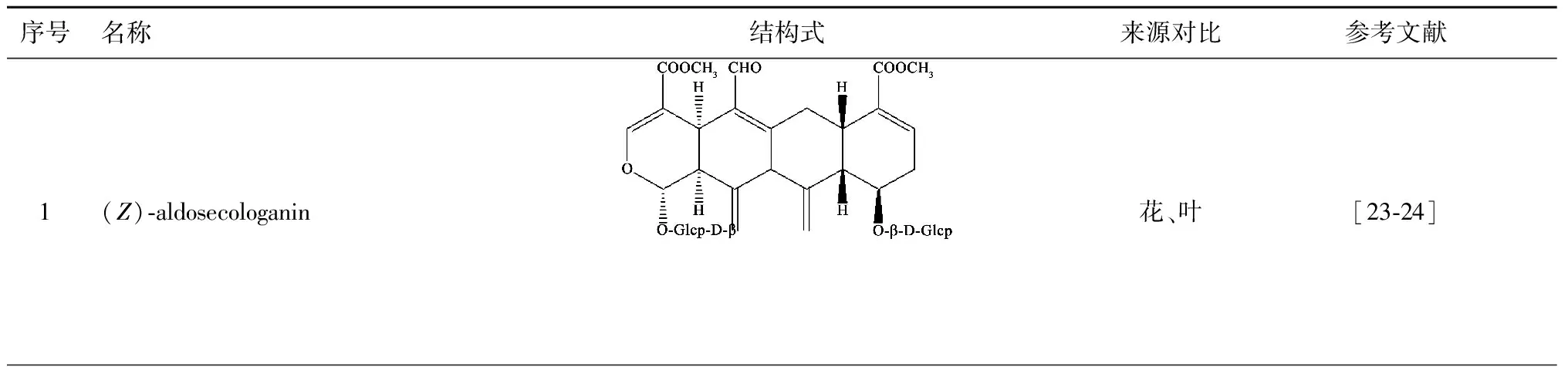
表3 忍冬茎、叶中分离的环烯醚萜苷类化合物
续表3
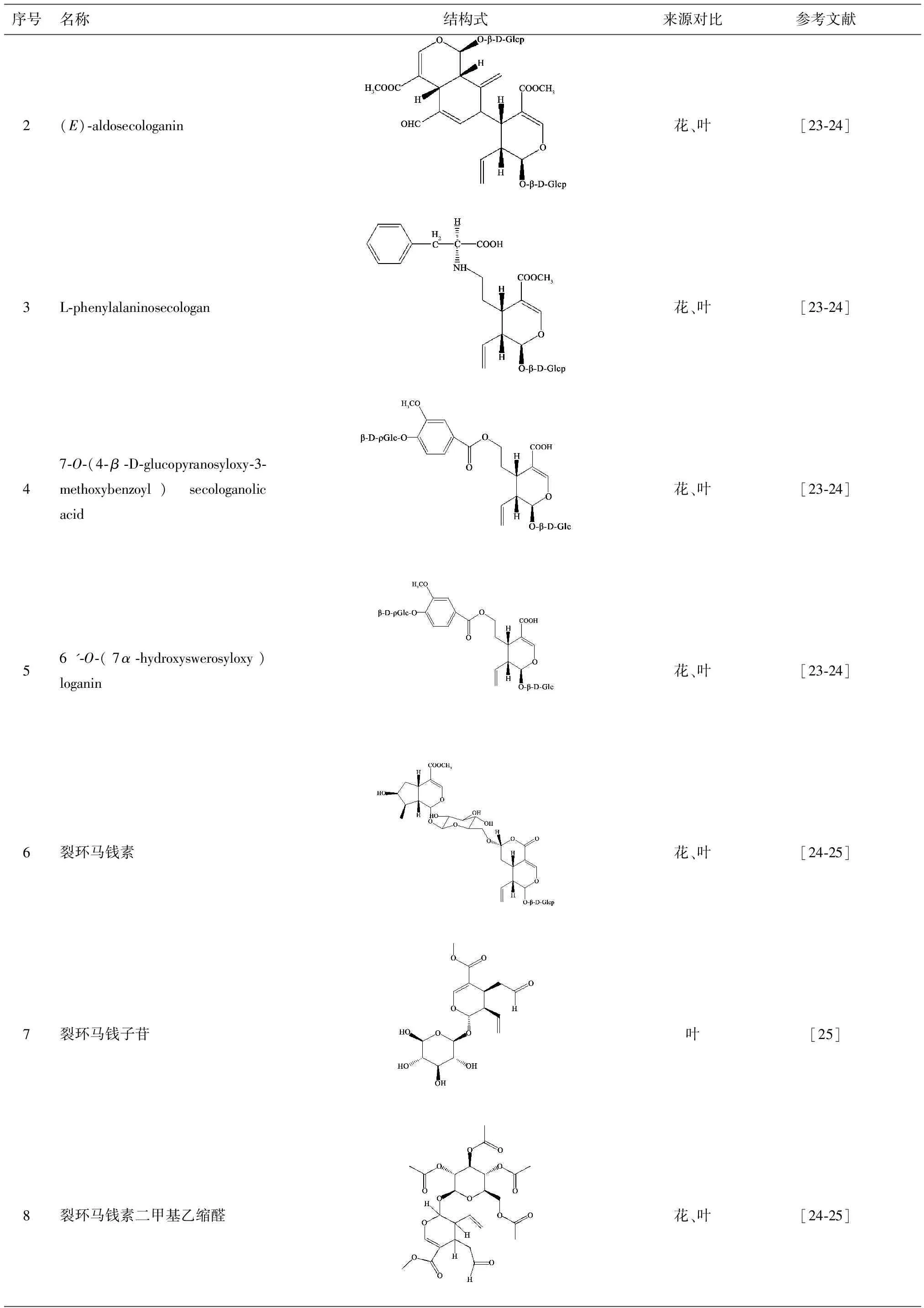
序号名称结构式来源对比参考文献2(E)⁃aldosecologanin花、叶[23⁃24]3L⁃phenylalaninosecologan花、叶[23⁃24]47⁃O⁃(4⁃β⁃D⁃glucopyranosyloxy⁃3⁃methoxybenzoyl)secologanolicacid花、叶[23⁃24]56'⁃O⁃(7α⁃hydroxyswerosyloxy)loganin花、叶[23⁃24]6裂环马钱素花、叶[24⁃25]7裂环马钱子苷叶[25]8裂环马钱素二甲基乙缩醛花、叶[24⁃25]
续表3
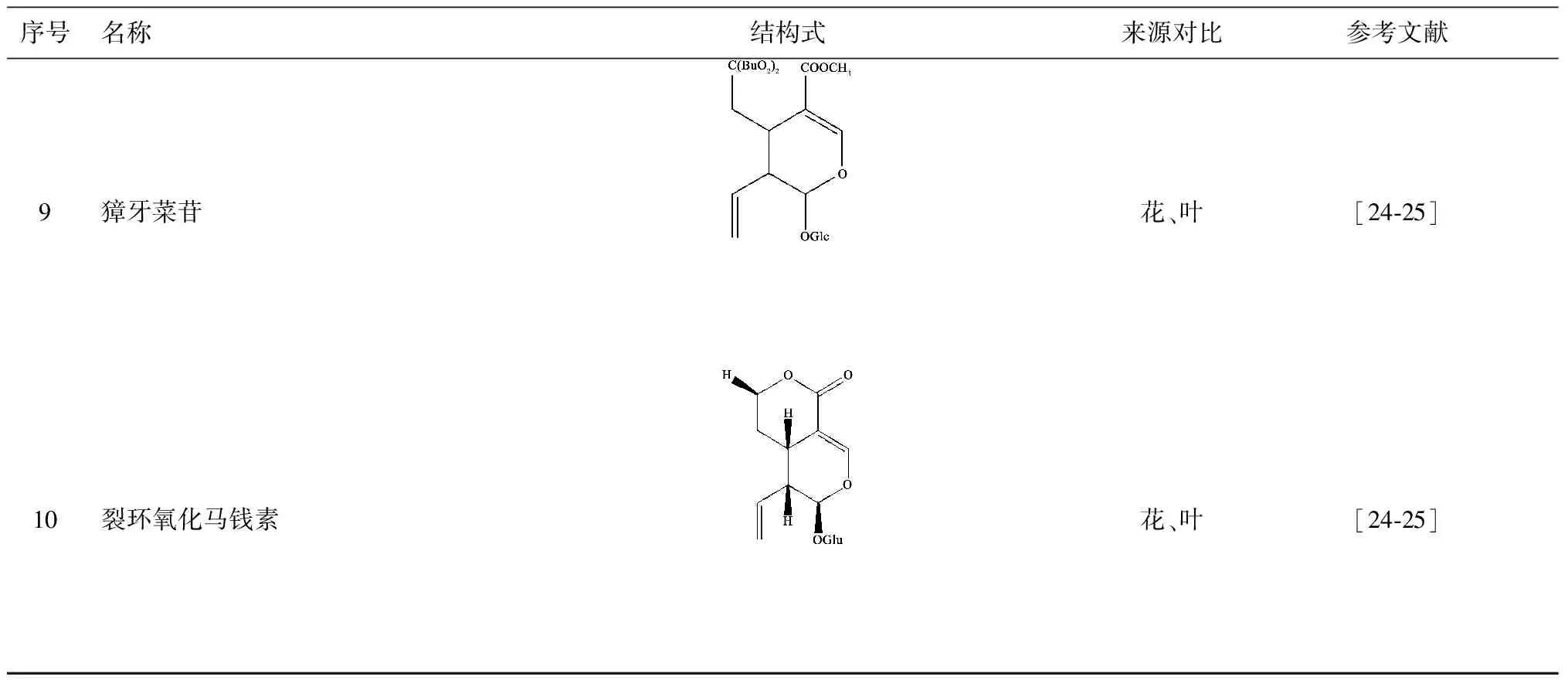
序号名称结构式来源对比参考文献9獐牙菜苷花、叶[24⁃25]10裂环氧化马钱素花、叶[24⁃25]
5 三萜皂苷类
马俊利等[22]采用硅胶柱色谱和制备薄层色谱法从忍冬叶中分离出齐墩果酸、忍冬苦苷A和忍冬苦苷B。
6 其他类
刘婵娟等[9]采用大孔树脂和聚酰胺色谱分离方法结合制备液相,从忍冬叶中分离得到β-谷甾醇和胡萝卜苷。
7 研究现状与展望
7.1 研究现状
目前,国内外研究者虽已对忍冬叶进行了大量研究,但与金银花相比,研究还不够深入,未充分挖掘忍冬叶的化学物质基础。在药理活性方面,虽然已有报道忍冬叶与花的活性相似,但对于叶的药理作用研究范围仍不如金银花广泛,有待于对其活性单体、组分的作用机理深入研究,开发出有活性的特异性成分。同时,忍冬为“药食同源”类药材,对其在制药、食品、保健品、中兽药等领域有待于进行深入开发利用。
7.2 展望
近几年,全国金银花产量一直在一万吨以上,由此产生的忍冬叶废弃物达十几万吨。忍冬叶中主要化学成分与金银花类似,主要为有机酸类、黄酮类和环烯醚萜苷类,含量丰富,采摘简单,不受花期限制,如经相关基础性研究并加以开发,可作为长期的药用来源。因此,未来可以针对忍冬叶中黄酮类、咖啡酰奎宁酸类和环烯醚萜苷类化合物含量丰富的特点,建立特定组分的高效提取富集方法;继续对忍冬叶活性部位进行分离纯化工作,争取发现结构新颖、高效特异的活性先导化合物;建立忍冬叶活性物质的质量控制方法以及进行新产品开发。开展忍冬叶资源化利用,结合忍冬叶的特点,促进金银花资源产业化的转化,逐步建立起金银花资源循环经济发展的模式和体系,以实现节约资源和可持续发展的目的,对本行业和全社会都具有重要的现实价值和长远的战略意义。
[1]国家药典委员会.中华人民共和国药典2015年版一部[S].北京:中国医药科技出版社. 2015.
[2] 王岱杰. 忍冬叶化学成分及其抗H-5亚型禽流感病毒研究[D]. 泰安:山东农业大学, 2013.
[3] 郭玉, 阳育聪, 刘运美, 等. 金银花及其叶中有效成分的比较研究[J]. 南华大学学报医学版, 2008, 36(2): 154-157.
[4] 赵金凤, 周凤琴, 郭庆梅, 等. 忍冬叶研究进展[J]. 中国药房, 2010,21(39):3738-3740.
[5] 肖敏, 谭红军, 李晓华, 等. 金银花叶挥发油的GC-MS分析[J]. 安徽农业科学, 2013, 41(3) : 947.
[6] 钟玲, 徐婷. 超临界CO2萃取金银花叶中绿原酸及挥发油成分研究[J]. 亚太传统医药, 2013, 9(2): 43-46.
[7] 马俊利, 李宁, 李铣. 忍冬叶中咖啡酰奎宁酸类化学成分[J]. 中国中药杂志, 2009, 34(18): 2346-2348.
[8] 宋亚玲, 倪付勇, 赵祎武, 等. 金银花化学成分研究进展[J]. 中草药, 2014, 45(24): 3656-3664.
[9] 刘婵娟, 陈四平. 忍冬叶的化学成分[J]. 中国实验方剂学杂志, 2010, 16(17): 90-92.
[10] 潘秋文. 金银花叶的研究进展[J]. 浙江中医学院学报, 2004, 28(4):90.
[11] 姜洪芳, 石宝俊, 赵伯涛, 等. 忍冬叶黄酮-磷脂复合物的降血脂作用[J]. 中国实验方剂学杂志, 2011, 17(18): 165-168.
[12] 马俊利, 商克勇, 周艳红. 忍冬叶总黄酮对四氯化碳致急性肝损伤小鼠的保护作用[J]. 中国实验方剂学杂志, 2012, 18 (24): 304-307.
[13] RAHMAN A, KANG S C. In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts ofLonicerajaponicaThunb.. Food Chemistry, 2009, 116(3): 670-675.
[14]王丽婷,杨敏丽. 高效液相色谱法同时测定金银花及叶中的黄酮类物质[J].时珍国医国药,2007,18(8):1850-1851.
[15]郭玉,郑兴,曹轩,等. RP-HPLC测定金银花叶中木犀草苷的含量[J].中成药,2009,31(8):1299-1300.
[16] KUMAR N, SINGH B, BHANDARI P,et al. Biflavonoids fromLonicerajaponica[J]. Phytochemistry, 2005, 66 (23): 2740-2744.
[17] 陈玲, 张海艳, 李晓. 忍冬的化学成分研究进展[J]. 现代药物与临床, 2015, 30(1): 108-114.
[18] 马俊利, 李宁, 李铣. 忍冬叶的化学成分[J]. 沈阳药科大学学报, 2009, 26(11): 868-870.
[19] 姜洪芳, 张卫明, 张玖. 忍冬叶黄酮类化合物的提取分离与结构鉴定[J]. 安徽农业科学, 2008, 36(27): 11795-11797.
[20] 马俊利, 李宁, 李铣. 忍冬叶中的一个新双黄酮苷[J]. 中国药物化学杂志, 2009, 19(1): 63-64.
[21] 马俊利, 李宁, 李铣. 忍冬叶中黄酮类成分的分离与鉴定[J]. 沈阳药科大学学报, 2010, 27(1): 37-39.
[22] 马俊利. 忍冬叶化学成分研究[J]. 中国实验方剂学杂志, 2013, 19(8): 95-97.
[23] MACHIDA K, SASAKI H, IIJIMA T ,et al. Studies on the Constituents ofLoniceraSpecies. XVII. New iridoid glycosides of the stems and leaves oflonicerajaponicathunb[J]. Chem Pharm Bull, 2002, 50(8): 1041-1044.
[24] 夏远, 李弟灶, 裴振昭, 等. 金银花化学成分的研究进展[J]. 中国现代中药, 2012, 14(4): 26-32.
[25] 马俊利, 肖楠, 宋琨. 忍冬叶中的环烯醚萜苷类成分[J]. 中国实验方剂学杂志, 2011, 17(9): 121-123.
[26] 杜芳黎, 姚彩云, 宋志军. 忍冬属植物中环烯醚萜苷类化合物的研究进展[J]. 天然产物研究与开发, 2015, 27(7): 1296-1307.
[27] 钱正明, 李会军, 李萍, 等. 高效液相色谱法测定忍冬藤和叶中8种活性成分[J]. 分析化学, 2007, 35(8): 1159-1163.
Research advances on chemical constituents of leaves fromLonicerajaponicaThunb.
ZHU Heng1, CHEN Jing-xian2, WEN Lei1, WANG Zhao-ping1, JING Feng3, WANG Dai-jie3*
(1.School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China; 2. School of Life Sciences, Shandong Normal University, Jinan 250014, China; 3.Shandong Provincial Key Laboratory of Traditional Chinese Medicine Quality Control Technology, Shandong Analysis and Test Center, Jinan 250014, China)
∶Leaves fromLonicerajaponicaThunb. are by-products of Lonicerae japonicae flos, about 10 times yield of flowers, and have stronger pharmacological activity. We review chemical constituents of volatile oil, organic acids, flavonoids and iridoid glycosides in leaves ofLoniceraejaponicaeand discover that these are similar with those of the flowers. Therefore, the leaves can serve as substitutes for Lonicerae japonicae flos for it's existing high prices. Their research focus lies in content determination, component separation and pharmacology of extracts. Their future research should highlight chemical separation and activity oriented active sites, and comparison of pharmacological activity between leaves and flowers fromLonicerajaponicaThunb.
∶LonicerajaponicaThunb.; leaves fromLonicerajaponicaThunb.; chemical constituents
10.3976/j.issn.1002-4026.2016.06.005
2016-02-25
山东省科技发展计划(2014GSF119031)
朱姮(1990—),硕士研究生,研究方向为天然产物分离与纯化。 E-mail:sdzbzdzh@sina.com
*通信作者。E-mail:wangdaijie@126.com
R284.2
A
1002-4026(2016)06-030-10

