晋西北酸粥发酵过程中酵母菌的分离鉴定
李文亚,常健,王琪
(山西大学生命科学学院,山西太原030006)
晋西北酸粥发酵过程中酵母菌的分离鉴定
李文亚,常健,王琪
(山西大学生命科学学院,山西太原030006)
通过个体形态特征观察、生理生化试验,结合分子生物学方法,对晋西北酸粥发酵过程中的酵母菌进行了分类鉴定。结果表明,在晋西北酸粥发酵过程中的6个时间段共分离出41株酵母菌,形态学初步归为5种类型,经生理生化试验和ITS序列分析将其鉴定为3种酵母,分别为:库德毕赤酵母(Pichia kudriavzevii)、东方伊萨酵母(Issatchenkia orientalis)和酿酒酵母(Saccharomyces cerevisiae),其均存在于晋西北酸粥的整个发酵过程中。
晋西北酸粥;发酵;酵母菌;分离鉴定
酸粥是一种主要由糜米、大米、小米等制作而成的传统谷类发酵食品[1],主要食用地区分布在内蒙古西部、山西西北部、陕西北部等地[2]。类似的谷物发酵食品在世界其他地区也有食用,如Sekete,Boza和Champùs等[3-4]。酸粥不但较好地保存了由当地自然环境有益微生物赋予的独特风味[5],还具有消食健胃、生津止渴等保健功效。
本试验中的晋西北酸粥是选用北方地区的优质糜米(Panicum miliaceum L.)作为原料,经过室温自然发酵而成。在发酵过程中酵母菌可以促进微生物间的共生作用,在提高特殊风味和香气方面起着重要的作用[6]。目前,国内对于酸粥的研究主要集中于内蒙古酸粥,并且对酸粥中乳酸菌的研究较多[7],但是对于晋西北酸粥及其中酵母菌的研究还未见报道。
本研究以晋西北酸粥为原料,发酵12 h后分时段取样,研究发酵过程中酵母菌的种类变化。在形态鉴定基础上,结合ITS序列分析,对酵母菌进行鉴定。这既可以对晋西北酸粥中的酵母菌资源进行收集和保存,同时还可以为进一步研究晋西北酸粥的风味特征奠定基础。
1 材料和方法
1.1 试验材料
晋西北酸粥发酵原液和糜米,均从忻州当地获得。
1.2 试剂及仪器
STE(20 mL):NaCl 0.12 g,20 mmol/L Tris-HCl(pH值8.0)10 mL,0.5 mol/L EDTA 40 μL,ddH2O 9.96mL。2×CTAB:2%CTAB,1.4mol/LNaCl,0.1mol/L EDTA(pH值8.0)。TE:10 mmol/L Tris-HCl(pH值8.0),1 mmol/L EDTA(pH值8.0)。1×105Pa灭菌30 min。50×TAE(1 L):准确称取Tris 242 g,EDTA 37.2 g于1 L烧杯中加入800 mL去离子水,充分搅拌溶解,加57.1 mL冰乙酸,充分溶解,最后加去离子水定容至1 L,室温保存。10%SDS(十二烷基硫酸钠):称取1.0gSDS定容至10mL,121℃灭菌20min。蛋白酶-K(10 mg/mL),购自生工生物工程(上海)股份有限公司。
1.3 仪器
试管恒温加热仪(北京来亨科贸有限责任公司);高速冷冻离心机5417R(德国艾本德股份公司);DYY-6C型电泳仪(北京六一仪器厂);电热恒温水浴锅(北京市医疗设备总厂);ALS 1296 PCR仪(美国伯乐公司);Gel Doc 2000 UV凝胶成像系统(美国伯乐公司)。
1.4 培养基
马铃薯葡萄糖琼脂培养基(PDA培养基):其用于酵母菌的分离和菌落观察。
马铃薯葡萄糖培养基:其用于酵母菌的液体富集。
YGC培养基:酵母粉5.0 g/L、葡萄糖20.0 g/L、琼脂15 g/L、链霉素0.1 g/L,pH值6.6±0.2,121℃灭菌20 min。其用于酵母菌的菌落计数。
Wallerstein Laboratory(WL)培养基[8]:葡萄糖5.0 g/L、胰蛋白胨5.0 g/L、酵母浸粉4.0 g/L、磷酸二氢钾0.55 g/L、氯化钾0.425 g/L、氯化铁0.25 mg/L、硫酸镁0.125g/L、氯化钙0.125g/L、硫酸锰0.25mg/L、溴甲酚绿22.0 mg/L、琼脂20 g/L,pH值6.5±0.2,121℃灭菌20 min。其用于对酵母菌的菌落形态进行观察。
生理生化培养基:糖发酵培养基、同化氮源培养基、同化乙醇培养基、无维生素基础培养基和50%葡萄糖液体培养基(检测类淀粉物质生成)。
1.5 采样
将200 g糜米加入600 mL晋西北酸粥原液中进行发酵。自12 h起每隔2 h采样一次,共采6次,即第12,14,16,18,20,22小时,分别编号为1,2,3,4,5,6。
1.6 分离纯化和菌落计数
对每次的样品进行如下梯度稀释:无菌移液管取原液1 mL加入至9 mL无菌水中,得10-1浓度稀释液,取10-1浓度稀释液系列稀释至10-6。取10-4,10-5,10-6等3个浓度梯度的稀释液0.1 mL,分别涂布于PDA平板和YGC平板上,每个稀释度做3个平行,30℃恒温培养24~48 h。以不加菌液为对照。长出明显菌落后进行菌落计数。最大稀释梯度下挑取不同形态的典型菌落,进行观察、编号、划线分离和纯化。
1.7 菌落形态及个体形态观察
根据微生物学试验手册[9],从菌落形状、气味、边缘等方面对分离到的酵母菌菌落形态进行观察记录。同时,以0.1%美蓝溶液为介质制片,显微观察菌株的细胞形态和繁殖方式。以此对分离到的酵母菌株进行初步的形态聚类。将已分类的菌株接种于PDA斜面,4℃保藏。
1.8 菌株的生理生化试验
糖发酵试验:将挑选出的5株代表菌(编号1.4,2.3,3.5,4.2,6.5)用接种环挑取一环,分别接种于11种糖发酵培养基(葡萄糖、D-果糖、蔗糖、D-麦芽糖、乳糖、木糖、菊糖、山梨糖、L-阿拉伯糖、D-树胶醛糖、淀粉)中,每种糖做3个平行,30℃培养2~3 d,观察有无气泡产生和试管颜色变化。
其他生理生化试验:用同样的方法接种酵母菌于同化氮源培养基、同化乙醇培养基、无维生素基础培养基和50%葡萄糖液体培养基中,重复3次,30℃培养24~72 h。观察酵母菌生长情况。
1.9 液体富集和DNA提取
室温下活化保藏菌株,将挑选出的5株代表菌用接种环挑取一环,接种于含5 mL马铃薯葡萄糖培养基的试管中,30℃,160 r/min培养48 h后,用改良CTAB法[10]提取酵母菌DNA。
具体的提取方法为:取液体培养物各4.5 mL,12 000 r/min离心10 min,弃上清,用STE洗菌2次,取沉淀于无菌离心管中,对应标号1~5,分别加入经65℃预热的300 μL 2×CTAB提取缓冲液,加2%β-巯基乙醇(1 mL 2×CTAB提取缓冲液中加2 μL的2%β-巯基乙醇),65℃水浴中轻轻混匀,加400 μL 10%SDS,10 μL 10 mg/mL蛋白酶-K,混匀,置于65℃水浴1 h,每隔10 min上下摇晃混匀,冷却至室温。在离心管中加入等体积Tris-饱和酚、氯仿进行抽提,上下缓慢摇晃,12 000 r/min离心10 min,吸上清至无菌离心管中,取与无菌离心管中液体等体积的氯仿抽提,上下缓慢摇晃多次之后,12000r/min离心10min,将所得上清液吸出置于新的无菌离心管中,加入2倍体积的异丙醇,上下轻轻振荡,可见白色絮状沉淀析出。将沉淀用1 mL 75%乙醇洗涤2次,风干后溶于50 μLTE,60℃水浴1 h,4℃过夜溶解。
1.10 PCR反应
ITS5区域PCR扩增:以提取到的基因组为模板,用真菌通用引物ITS4-ITS5扩增酵母菌的ITS序列,ITS4:5′-TCCTCCGCTTATTGATATGC-3′;ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′。反应体系(50 μL):5 μL 10×Trans Easy Taq Buffer;2 μL dNTP;引物(20 mmol/L)各4 μL;1 μLTrans Easy Taq DNA polymerase;2 μL DNA模板;ddH2O补至50 μL。阴性对照用ddH2O代替模板。反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸60 s,34个循环后;72℃保温10 min[11]。扩增产物经2%的琼脂糖凝胶电泳分离,UV凝胶成像系统检测。
2 结果与分析
2.1 晋西北酸粥酵母菌计数
因YGC平板上10-4,10-5稀释梯度下的菌落密度大不适宜计数,故选取10-6稀释梯度的平板进行计数,其结果列于表1。
由表1可知,酸粥中的酵母菌总数在2.81~ 3.43 lgcfu/mL。酵母菌在发酵过程中的数量呈现“增加—恒定—增加—降低”的变化趋势。

表1 酸粥样品中的酵母菌计数lgcfu/mL
2.2 晋西北酸粥酵母菌的形态特征
分离纯化后共得到41株酵母菌。其中,样品1分离出5株,分别编号为1.1,1.2,1.3,1.4,1.5;样品2分离出8株,分别编号为2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8;样品3分离出6株,分别编号为3.1,3.2,3.3,3.4,3.5,3.6;样品4分离出7株,分别编号为4.1,4.2,4.3,4.4,4.5,4.6,4.7;样品5分离出8株,分别编号为5.1,5.2,5.3,5.4,5.5,5.6,5.7,5.8;样品6分离出7株,分别编号为6.1,6.2,6.3,6.4,6.5,6.6,6.7。
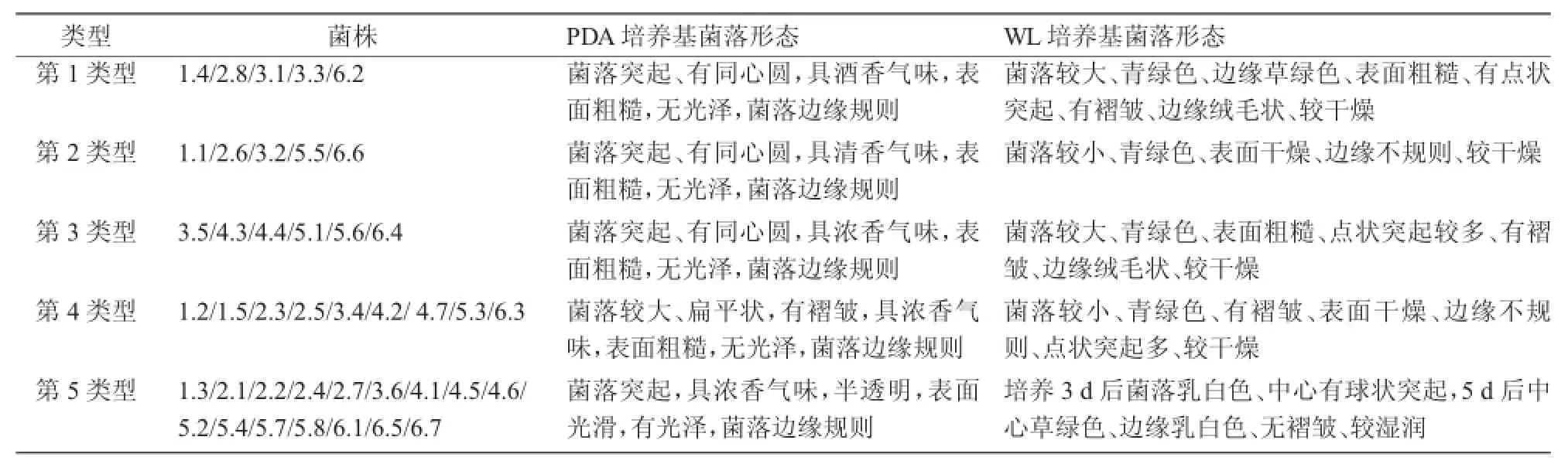
表2 酵母菌菌落形态描述
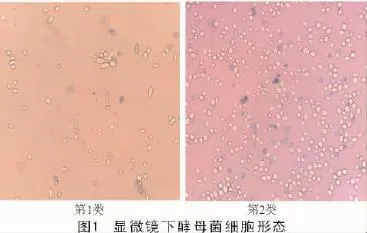
根据41株酵母菌在PDA和WL培养基上的菌落形态特征,将其区分为5种类型(表2)。挑选5株代表菌(编号1.4,2.3,3.5,4.2,6.5,分别用A,B,C,D和E表示)镜检。5株酵母菌在显微镜下可分为2种形态类型(图1),一种为椭圆形,另一种为圆形,繁殖方式均为芽殖。
2.3 酵母菌生理生化试验结果
从表3可以看出,5株菌均可以利用葡萄糖和D-果糖,均不可以利用菊糖、乳糖、L-阿拉伯糖和D-树胶醛糖。菌株A,B,C,D可以利用木糖和山梨糖。菌株E可以利用蔗糖和D-麦芽糖。菌株A,B,C,D不能利用淀粉,而菌株E为可变反应。
由表4可知,5株菌均不能产生类淀粉物质,不可以利用硝酸盐。菌株A,B,C,D都耐高渗透压,可以同化乙醇,能合成自身需要的全部维生素,可以利用硫酸盐,且A,B,C与D相比长势较好。菌株E只能在37℃生长。
2.4 PCR结果
用改良的CTAB法提取5株酵母菌DNA,经ITS序列扩增后凝胶电泳检测,结果发现,在500~800 bp有明亮的特异性条带,与预测的理论值基本相符(图2)。
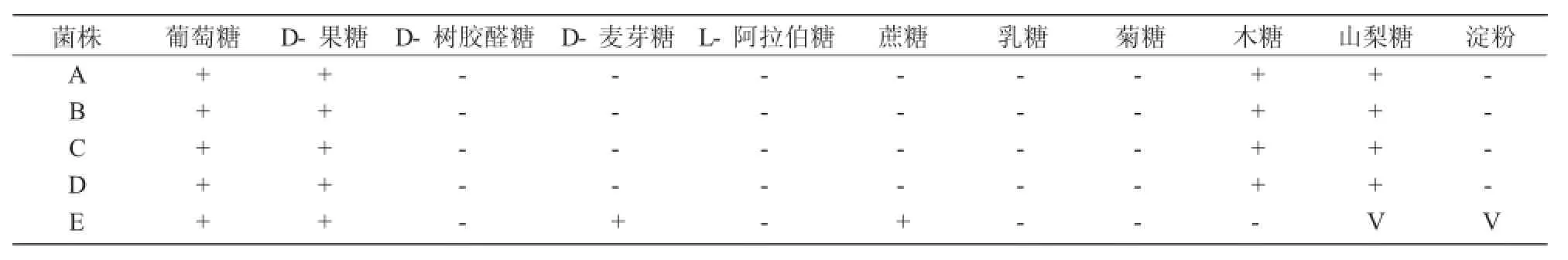
表3 酵母菌糖发酵试验结果

表4 其他生理生化试验结果

2.5 分子鉴定
将5株典型的酵母菌株A,B,C,D和E的ITS序列进行扩增并测序,将获得的序列提交GenBank,经BLAST比对,结果表明,菌株A与库德毕赤酵母(Pichia kudriavzevii)KP674517.1和东方伊萨酵母(Issatchenkia orientalis)EF198000.1的同源性均为99%;菌株B与库德毕赤酵母(P.kudriavzevii)LC014798.1的同源性为99%;菌株C与库德毕赤酵母(P.kudriavzevii)KP674517.1和东方伊萨酵母(I.orientalis)EF198000.1的同源性均为100%;菌株D与东方伊萨酵母(I.orientalis)EF198000.1的同源性为99%;菌株E与酿酒酵母(Saccharomyces cerevisiae)KP723678.1的同源性为99%。综合以上形态特征及生理生化特征,采用《酵母菌特征及鉴定手册》[12]介绍的方法,对5株酵母进行分类,可以将菌株A,B和C鉴定为Pichia kudriavzevii,菌株D鉴定为Issatchenkia orientalis,菌株E鉴定为Saccharomyces cerevisiae。
3 讨论
糜米发酵成酸粥后,因其营养价值提高,储存期延长,深受黄河沿岸老百姓的喜欢。酸粥利用附着在谷物上的微生物自然发酵,在发酵过程中能产生功能性低聚糖、多肽与氨基酸、抗氧化活性物质和降低胆固醇及血压的物质等[13],因而被赋予了特殊的保健功能。
白梅等[14]从内蒙古地区的28份酸粥样品中分离到的酵母菌有Issatchenkia orientalis,Saccharomyces cerevisiae和Candida pararugosa等9种酵母,I.orientalis为优势菌株。陈忠军[15]从内蒙古河套地区酸粥中分离出了裂殖酵母(Schizosaccharomyces spp.)、小椭圆接合酵母(Zygosaccharomyces microellipsoides)和酿酒酵母(Saccharomyces cerevisiae)。而本试验则从晋西北酸粥中共分离出3种酵母,分别为:P.kudriavzevii、S.cerevisiae和I.orientalis。就分离出的酵母种类而言,比内蒙古地区酸粥中酵母菌种类少,这可能是由地域、气候、谷物种类和制作方法所致。
Issatchenkia spp.和Saccharomyces spp.是以植物为底物进行酸发酵时较为常见的菌[16-18]。在乌干达的一种粥中分离出东方伊萨酵母(I.orientalis),它对该食品的发酵和成熟都有重要的作用[19]。毕赤酵母与酿酒酵母混合发酵产生的酯类、酸等对改善发酵谷物食品的口感、风味有着重要的作用[20]。此外,在发酵过程中,乳酸菌和酵母菌存在着共同代谢关系,酵母菌会为乳酸菌提供维生素和其他生长因子,而乳酸菌生长造成的酸性环境也会影响酵母菌的种类[17]。
通过研究晋西北酸粥的6个不同时段酵母菌的种类变化可以发现,在晋西北酸粥发酵的整个过程中酵母菌有3种并且一直存在。酵母菌数量在发酵的第14小时增长后基本保持恒定,直至第20小时数量出现再次明显的增长,之后开始下降。这可能是由发酵液的pH值改变,不再适宜酵母菌的增长所造成的。
本试验是利用传统的研究方法获得纯培养菌株后对其特性进行描述,从而得到微生物的大致类群,然而,自然环境中有相当多的菌种(90%~99%)无法通过传统培养的方法培养得到[21-22]。因此,在传统制作的酸粥中仍可能存在着未知的酵母菌类型,这有待后续的深入研究。
[1]王志伟,陈忠军.乳酸菌谷物发酵食品——酸粥发酵工艺的研究[J].农产品加工,2010(2):27-30.
[2]薛建岗.内蒙古西部地区自然发酵酸粥化学成分及微生物组成分析[J].食品科技,2013,38(7):10-16.
[3]Gotcheva V,Pandiella S S,AngelovA,et al.Microflora identification of the Bulgarian cereal-based fermented beverage Boza[J].Process Biochem,2000,36(4):127-130.
[4]Esteban O C,Clemencia C L,Rosanna T.Detection and identification ofwild yeasts in Champùs,a fermented Colombian maize beverage[J].Food Microbiol,2008,25(6):771-777.
[5]陈忠军,杨晓清,乌尼.内蒙古河套地区酸粥中乳酸菌的分离及其生物学特性的研究[J].内蒙古农业大学学报,2002,23(3):62-65.
[6]李宇辉,王俊钢,刘成江,等.新疆伊犁牧区发酵乳制品中酵母菌的分离和多样性分析[J].食品与发酵工业,2013,39(7):98-103.
[7]王炜宏,杜晓华,张家超,等.内蒙古鄂尔多斯地区酸粥发酵液中乳酸菌的分离鉴定[J].食品与生物技术学报,2010,29(2):266-270.
[8]薛军侠,徐艳文,杨莹,等.WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007(9):36-41.
[9]周德庆.微生物学试验手册[M].上海:上海科学技术出版社,1986.
[10]陈昆松,李方,徐昌杰,等.改良CTAB法用于多年生植物组织基因组DNA的大量提取[J].遗传,2004,26(4):529-531.
[11]郭冬琴.橙汁中酵母菌的分离鉴定及其快速分子检测技术研究[D].重庆:西南大学,2012.
[12]J·A·巴尼特,R·W·佩恩,D.亚罗.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991.
[13]李玉珍,肖怀秋,兰立新.我国大米发酵食品研究进展[J].江苏调味副食品,2008,25(6):33-37.
[14]白梅,王娟,卿蔓君,等.内蒙古西部区酸粥中酵母菌的分离鉴定及优势菌分析[J].微生物学通报,2010,37(9):1300-1304.
[15]陈忠军.内蒙古河套地区酸粥中发酵菌生物学特性研究[D].呼和浩特:内蒙古农业大学,2001.
[16]Giraud E,Champailler A,Raimbault M.Degradation of raw starch bya wild amylolytic strain of Lactobacillus plantarum[J].Appl Environ Microbiol,1994,60(12):4319-4323.
[17]Gobbetti M,Corsetti A,Rossi J.The sourdough microflora.Interactions between lactic acid bacteria and yeasts:metabolismof carbohydrates[J].Appl Microbiol Biotechnol,1994,41(4):456-460.
[18]Nago CM,Hounhouigan DJ,Akissoe N,et al.Characte-rization of the Beninese traditional ogi,a fermented maize slurry:physiological and microbiological aspects[J].Int J Food Sci Technol,1998,60(3):307-315.
[19]Martin P O,Kozo A.Main microorganisms involved in the fermentation of Ugandan ghee[J].Food Microbiol,2009,133(3):286-291.
[20]刘小翠,李云波,赵思明.生米发酵食品的研究进展[J].食品科学,2006,26(10):616-619.
[21]陈邦,范代娣,王琰.土壤微生物DNA提取方法的研究[J].西北大学学报:自然科学版,2009,39(5):785-788.
[22]李红,周友兵,陈炳耀,等.分子生物学技术在微生物多样性研究中的应用[J].河北大学学报:自然科学版,2004,23(4):450-454.
Isolation and Identification of Yeasts in the Fermentation Process of Northwestern Shanxi Acid Gruel
LI Wen-ya,CHANGJian,WANGQi
(College ofLife Sciences,Shanxi University,Taiyuan 030006,China)
The morphological characteristics,physiological and biochemical experiments combined with molecular biology method was used toidentifythe species ofyeasts in the fermentation process ofnorthwestern Shanxi acid gruel.The results showed that 41 strains of yeasts were isolated in the six periods of the fermentation process of northwestern Shanxi acid gruel.These strains were classified into five types bymorphological characteristics,and identified as respectively Pichia kudriavzevii,Issatchenkia orientalis and Saccharomyces cerevisiae byphysiological and biochemical experiments and ITS4 and ITS5 series analysis.The three kinds ofyeasts existed in the entire fermentation process ofnorthwestern Shansi acid gruel.
northwestern Shanxi acid gruel;fermentation;yeasts;isolation and identification
TS201.3
A
1002-2481(2016)03-0323-05
10.3969/j.issn.1002-2481.2016.03.13
2015-11-04
李文亚(1990-),女,山西临汾人,在读硕士,研究方向:资源微生物。王琪为通信作者。

