基于CLSI EP12-A2文件要求的乙型肝炎五项定性检测性能验证
唐恩跃,何增品,崔晓花,杨永平,熊秋霞△
(1.云南省保山市人民医院检验科 678000;2.昆明医科大学第一附属医院检验科,昆明 650032)
·论 著·
基于CLSI EP12-A2文件要求的乙型肝炎五项定性检测性能验证
唐恩跃1,何增品2,崔晓花2,杨永平2,熊秋霞2△
(1.云南省保山市人民医院检验科 678000;2.昆明医科大学第一附属医院检验科,昆明 650032)
目的 对昆明医科大学第一附属医院检验科免疫室酶联免疫吸附试验(ELISA)定性项目乙型肝炎(乙肝)五项进行性能验证。方法 采用ELISA,通过稀释乙肝五项各项目强阳性标本得到临界值浓度(C50)并验证其是否正确;采用各个项目C50 -20%~+20%浓度范围的重复性实验验证其结果是否包含C5~C95区间;用C50 +20%浓度验证检测限;常规手工操作试验和TECAN全自动酶免检测两种方法检测10例阳性和10例阴性标本,对其结果进行方法学比较及分析。结果 5个项目C50验证正确;C50 -20%~+20%浓度范围包含了C5~C95区间;检测限验证通过;5个项目两种方法检测结果一致性检验Kappa系数均为1。结论 本实验室乙肝五项定性检测使用方法及试剂盒相关性能均验证合格,常规手工操作试验方法和TECAN全自动酶免检测方法两种方法学比较结果一致性较好。
乙肝五项定性检测; 性能验证; 酶联免疫吸附试验
近年来,各大医院实验室将通过ISO15189实验室质量和能力的认可纳入到了实验室的发展规划中。在质量体系的构建中,对试验方法进行方法学性能验证是实验室技术要求中非常重要的一环,在2013年4月实施的ISO15189补充文件CNAS-CL39实验室质量和能力的认可准则在免疫学检验领域的应用中,对免疫学定性检验方法的性能验证内容提出了具体的要求[1]。定性项目的性能评价包括重复性评价(分析物浓度接近临界点时的重复性实验、批内重复性、批间重复性)、方法学比较(包括未知临床诊断的方法学比较和已知临床诊断的方法学比较)、检测限验证、特异性验证等。其中最主要的是分析物浓度接近临界点时的重复性实验和方法学比较两项评价。美国临床和实验室标准化协会(CLSI)颁布的EP12-A2文件《定性项目的性能评价》提出定性检测重复性须验证3个浓度值的临床标本,即C50(临界点)、C5(低于C50浓度20%)和C95(高于C50浓度20%)。(1)C50:最佳条件下,处于和接近临界值的分析物浓度,多次重复检测此浓度的单一标本时,将获得50%的阳性结果和50%的阴性结果;(2)C5:检测浓度为C5的分析物时,将产生5%的阳性结果,用浓度
1 材料与方法
1.1 标本选择
1.1.1 质控品 阴性血清(自配)和标准血清质控品:HBsAg临界质控品0.2 IU/mL(201504002),乙肝表面抗原(HBsAg)0.5 IU/mL(201404002),乙肝表面抗体(HBsAb) 10 mIU/mL(201411002),乙肝e抗原(HBeAg) 1 NCU/mL(201404002),乙肝e抗体(HBeAb) 1 NCU/mL(20148001),乙肝核心抗体(HBcAb)2 IU/mL(201409002)均产自康彻斯坦公司。
1.1.2 分析物接近临界点时的重复性实验
1.1.2.1 定性检测重复性须验证3个浓度值的临床标本,即C50(临界点)、C5(C50-20%)和C95(C50+20%)。
1.1.2.2 如何获得系统或试剂的临界点(C50):检测试剂或系统说明书可能会注明分析物的临界浓度。如果临界浓度未知,可将阳性标本进行梯度稀释,然后对他们进行重复检测以确定能够获得50%阳性和50%阴性结果的对应稀释度,这一对应稀释度的分析物浓度即为临界点(C50)。
1.1.3 方法学比较 收集常规检测标本20例,其中阳性标本7例,弱阳性标本3例,阴性标本10例。
1.2 试剂与试剂 HBsAg检测试剂(批号201503081)、HBsAb检测试剂(批号201506081)、HBeAg检测试剂(批号201502021)、HBeAb检测试剂(批号201412411)、HBcAb检测试剂(批号201506081)均产自上海科华。仪器为瑞士Tecan公司生产的Tecan Freedom Evolyzer-2全自动酶免一体机、Thermo Multiskan MK3酶标仪;深圳汇松公司生产的PW-960全自动酶标洗板机,仪器均按ISO15189质量体系技术要求校准。
1.3 方法
1.3.1 室内质控 如性能验证在10 d内完成,每次试验质控品重复检测2次,共提供20次重复检测结果;如果性能验证超过20 d,则每一批次都要对每份质控品进行单次检测,总计提供20次重复结果。
1.3.2 分析物接近临界点时的重复性实验 将每个项目S/CO值在3左右的阳性标本用0.9%的生理盐水进行倍比稀释,将各稀释度进行40次重复检测(每个项目C50浓度OD值接近CUT OFF值),重复检测每个项目的C50-20%、C50+20%浓度标本各40次,确定每一浓度标本结果阳性和阴性的百分比。实验操作和结果判断严格按照说明书进行。
1.3.3 检测限验证 用C95浓度的标本,重复检测40次。
1.3.4 方法学比较 设定手工操作、MK3比色为评价方法,TECAN全自动酶免检测方法为靶方法,验证其符合率,分别用常规手工操作试验方法和TECAN全自动酶免一体机同时检测20例标本,分布于10 d内,按常规方法检测。
1.4 判断标准
1.4.1 室内质控 不合格批次在10 d内不应超过1次或20 d内不超过两次,如若超出,立即停止检测工作并咨询试剂制造商以确定原因并采取纠正措施。
1.4.2 分析物接近临界点时的重复性实验 判断标准见表1,若C50验证合格,则说明C50估计正确,若C50-20%、C50+20%验证合格,则说明(C50-20%)~(C50+20%)浓度包含了C5~C95的区间。

表1 分析物接近临界点时的重复性实验判断标准
1.4.3 检测限验证 C95浓度的标本重复检测40次阳性结果≥36/40则验证通过。
1.4.4 统计学处理 计算Kappa系数评价其一致性,Kappa系数大于等于0.75,说明两种方法一致性较好,Kappa系数在0.40~0.75则两种方法一致性一般,Kappa系数小于0.40两种一致性较差。计算公式为Kappa系数=(Po-Pe)/(1-Pe),其中Po是实际一致比,Pe是期望一致比。
2 结 果
2.1 分析物浓度接近临界点的重复性验证 对各项目C50、C5、C95浓度各进行40次测试,5个项目均验证通过,说明5个项目C50-20%~C50+20%的浓度包含了C5~C95的区间。见表2。
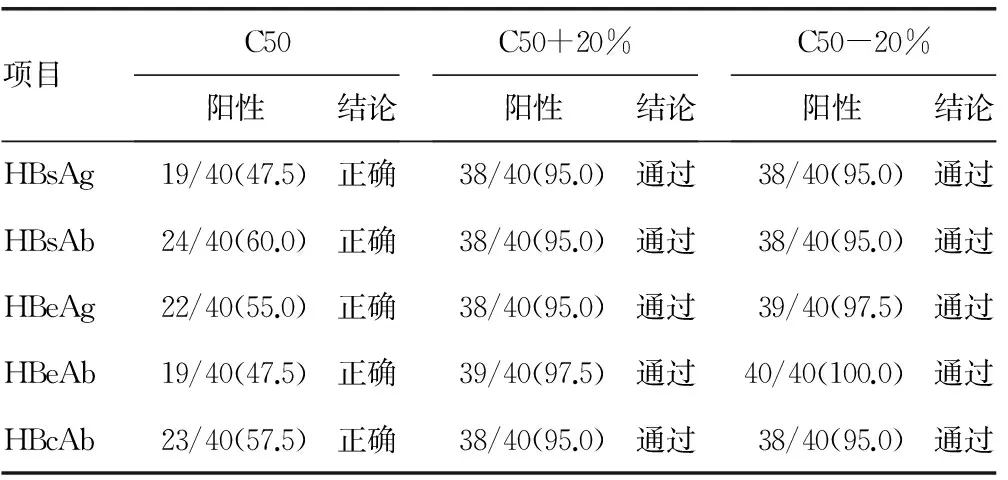
表2 分析物浓度接近临界点的重复性验证结果[n/n(%)]
2.2 检测限验证 5个项目在C95浓度时均验证通过。见表3。
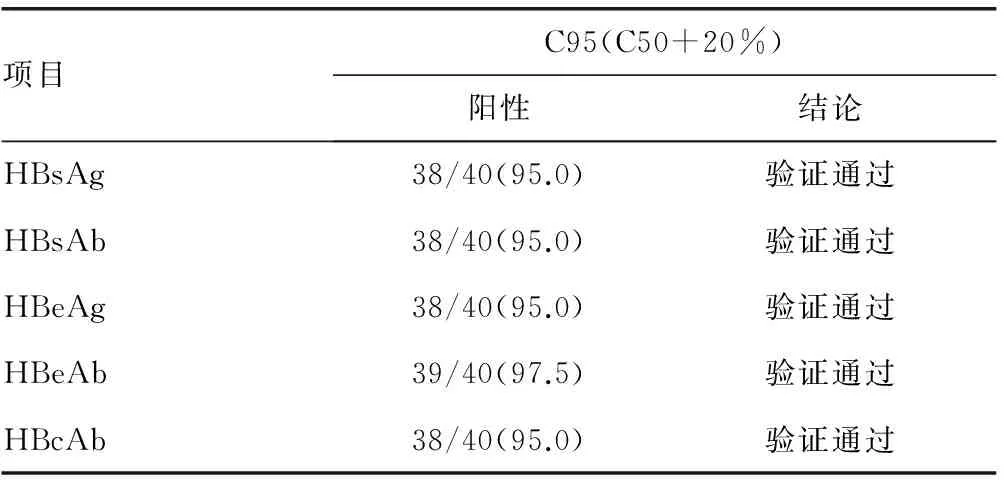
表3 检测限验证结果[n/n(%)]
2.3 方法学比较 5个项目20例标本用常规手工操作试验方法和TECAN全自动酶免一体机检测阳性符合率和阴性符合率全部为100.0%,5个项目Kappa系数全部为1,表明5个项目常规手工操作试验方法和TECAN全自动酶免一体机检测结果一致性较好。
3 讨 论
ISO15189:2007准则作为指导实验室建立质量体系的纲领性文件,其第5.5.2条款指出实验室应评估所选用方法和程序,在用于医学检验之前应证实其可给出满意结果[2]。对定性实验而言,临界值是唯一的医学决定水平,它的高低直接关系试验的成败[3]。用浓度接近临界值的标本作为评价材料比用强阳性或低阴性标本更能发现检测误差[4]。根据EP12-A2文件《定性项目的性能评价》要求,乙肝五项须进行分析物接近临界点时的重复性实验和方法学比较两项性能评价,其他的可以选做,不作强制要求。
由于最佳条件不易获得,实验室准确估计C50比较困难,昆明医科大学第一附属医院检验科免疫室按照EP12-A2文件要求,乙肝五项各个项目的C50通过稀释各个项目的强阳性标本得来,5个项目的C50验证结果在47.5%~60.0%,全部验证正确。在确定了C50后,对5个项目C50+20%的浓度各进行40次检测,阳性率均在95.0%及以上;对5个项目C50-20%的浓度各进行40次检测,阴性率都在95.0%及以上,验证通过,说明5个项目的(C50-20%)~(C50+20%)浓度包含了C5~C95的区间。C5~C95区间的宽度暗示了定性试验的精密度,因为其反映了重复性检测结果不一致的浓度范围,C5~C95的区间越窄,代表方法越好[4]。同时,5个项目在C95验证通过的情况下也说明5个项目检测限也验证通过。
当实验室同时使用2套以上的检测系统检测同一项目时,必须保证两者检测结果的一致性[5]。本室对各项目的10例阳性标本和10例阴性标本用常规手工操作试验方法和TECAN全自动酶免一体机检测来验证两个方法的一致性,各个项目的阳性符合率和阴性符合率均为100.0%,通过计算Kappa系数来评价其一致性,5个项目两种方法检测一致性较好。
本实验室乙肝五项定性检测使用方法及试剂盒相关性能均验证合格,常规手工操作试验方法和TECAN全自动酶免检测两种方法学比较结果一致性较好。
[1]中国合格评定国家认可委员会.医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明[S].北京:中国合格评定国家认可委员会,2012.
[2]ClincalandLaboratoryStandardsInstitute.EP12-A2Userprotocolforevalutionofqualitativetestperformance;approvedguideline[S].PA,USA:CLSI,2009.
[3]中国合格评定国家认可委员会.ISO15189:2007医学实验室质量和能力的专用要求[S].北京:中国合格评定国家认可委员会,2008.
[4]周辉,张治国,杜春英,等.Bact/Alert3D系统与常用检测方法的比较[J].临床肺科杂志,2009,14(7):902-903.
[5]黄妩姣,黄宪章,庄俊华,等.CLSIEP12-A2文件在HBeAb定性检测性能评价中的应用[J].检验医学,2012,27(11):900-903.
Performance validation of 5- item qualitative detection of hepatitis B based on requirements of EP12-A2 CLSI file
TANGEnyue1,HEZengpin2,CUIXiaohua2,YANGYongping2,XIONGQiuxia2△
(1.DepartmentofClinicalLaboratory,BaoshanMunicipalPeople′sHospital,Baoshan,Yunnan678000,China;2.DepartmentofClinicalLaboratory,FirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To perform the performance verification of 5-item qualitative detection of enzyme linked immunosorbent assay(ELISA) in the immunology room of laboratory department of the First Affiliated Hospital of Kunming Medical University.Methods The ELISA method was adopted.The strong positive samples of hepatitis B 5 items were diluted to the critical value concentration (C50) and its correction was verified;the repeated experiments with the C50 -20%-+20% concentration range for the various items were adopted to verify whether the results including the C5-C95 interval;the detection limit was verified by using the C50 +20% concentration;10 positive and 10 negative specimens were detected by the conventional manual operating test and TECAN fully automatic enzyme immunoassay detection,then the obtained results were performed the methodological comparison and analysis.Results The 5-item C50 verification was correct;the C50 -20%-+20% concentration range included the C5-C95 interval;the verification of detection limit was passed;the Kappa coefficient of 5-item consistency test in the results detected by two methods was 1.Conclusion The application method of hepatitis B 5-item qualitative detection and related performance of reagent kit all are qualified by verification.The methodological comparison results of the routine manual operation test and TECAN fully automatic enzyme immunoassay display good consistency.
five qualitative detection of hepatitis B; performance verification; enzyme linked immunosorbent assay
唐恩跃,男,主管技师,主要从事生化检验研究。△
,E-mail:asan_1123@163.com。
10.3969/j.issn.1673-4130.2016.24.022
A
1673-4130(2016)24-3443-03
2016-09-04
2016-10-23)

