不同光谱法用于药物与蛋白相互作用的比较研究
刘保生, 李彤彤, 张秋菊, 崔萌萌, 段韶彤
(河北大学化学与环境科学学院 河北省分析科学技术重点实验室, 河北 保定 071002)
不同光谱法用于药物与蛋白相互作用的比较研究
刘保生*, 李彤彤, 张秋菊, 崔萌萌, 段韶彤
(河北大学化学与环境科学学院 河北省分析科学技术重点实验室, 河北 保定 071002)
在模拟人体生理环境下,利用荧光猝灭法(FQS)、同步荧光法(SYS)、共振光散射法(RLS)及紫外吸收光谱法(UV)分别研究了298 K下牛血清白蛋白与硫酸粘杆菌素、硫酸头孢匹罗、头孢匹胺钠3种药物间的相互作用机理。结果表明:对于相同的体系,利用4种方法计算得到的结合常数在同一数量级,猝灭方式均为生成新物质的静态猝灭,药物与蛋白作用时均以1∶1的比例结合,Hill系数近似。但对4种方法所得实验数据的综合比较表明,FQS、SYS更适合用于研究蛋白与药物的反应机理。
牛血清白蛋白; 荧光猝灭法; 同步荧光法; 共振光散射法; 紫外吸收光谱法
1 引 言
在蛋白质化学层面,药物与血清白蛋白在体外的结合已被当作研究蛋白质结合行为的模型,并在化学、生命科学和临床医学领域备受关注[1-2]。在药物与蛋白质相互作用的研究领域,荧光光谱法和紫外吸收法是相对较为常用的方法。在荧光光谱法中,通过分析荧光参数,能够得到很多有关蛋白质结构变化的信息[3]。荧光光谱包括荧光猝灭光谱、同步荧光光谱和共振光散射光谱,这3种光谱可以通过改变同一台荧光光谱仪的参数值扫描得到。荧光光谱法因其灵敏、快速、简单的优势[4],在检测领域应用普遍。紫外吸收法是探讨蛋白质结构变化和微环境变化简单而有效的方法[5]。利用蛋白质与药物体系的紫外吸收光谱的变化(如位移,峰值变化),不但能预测出体系作用机理,还能计算体系的结合常数[6-7]。
在结构上,牛血清白蛋白(BSA)与人血清白蛋白有很高的同源性[8],而且BSA具有稳定性高、相对廉价、容易获得以及特殊的配体结合性质等特点,所以经常被选作模型蛋白来研究药物与蛋白质的相互作用[9]。硫酸粘杆菌素(Colistin sulfate, CLS) 是一种由多粘芽胞杆菌和其相关的物种的菌株中分离出来的一种多肽抗生素[10]。硫酸头孢匹罗(Cefpirome Sulfate,CFS)和头孢匹胺钠(Cefpiramide Sodium, CFMS)均为头孢菌素类抗生素。本文利用4种方法研究了BSA与上述3种药物的相互作用,并对同一体系4种方法所得的结论进行了比较和分析。3个体系的研究结果也证明了4种方法的可行性。
2 实 验
2.1 药品与仪器
牛血清白蛋白(BSA,Sigma公司)配成浓度为2.0×10-4mol/L的水溶液备用。硫酸粘杆菌素(CLS)、硫酸头孢匹罗(CFS)、头孢匹胺钠(CFMS)的标准品均配制成浓度为1.0×10-4mol/L的水溶液备用。配制内含0.15 mol/L的NaCl的0.05 mol/L的 Tris-HCl缓冲溶液(pH =7.40)。以上水溶液均置于冰箱中4 ℃保存,实验用水均为二次石英蒸馏水。
使用的仪器主要有日本岛津RF-5301PC荧光分光光度计和UV-265紫外可见分光光度计,南京桑力电子设备厂生产的SYC-15B型超级恒温水浴,上海雷磁仪器厂出品的pHS-3C型精密酸度计。
2.2 实验步骤
2.2.1 荧光光谱测试
在一系列10 mL比色管中分别加入1.0 mL Tris-HCl缓冲溶液、1.0 mL BSA(2.0×10-6mol/L)溶液及不同体积的CLS(CFS或CFMS)溶液,用二次蒸馏水定容,静置30 min使体系反应完全。将样品置于1 cm石英比色皿中,设置发射和激发狭缝均为5 nm。
荧光猝灭法:设置仪器激发波长为280 nm,扫描荧光光谱,记录各体系在340 nm处的荧光强度;同步荧光法:使发射波长与激发波长保持固定差值λem-λex=Δλ(15 nm或60 nm)扫描各体系的同步荧光光谱,读取最高峰处的荧光强度;共振光散射法:固定λem-λex= 0 nm,测定 220~700 nm范围内3种药物与BSA的共振光散射光谱并记录290 nm处的共振光散射光强度。
2.2.2 紫外吸收光谱测试
在一系列10 mL比色管中加入1.0 mL Tris-HCl缓冲溶液、1.0 mL BSA(2.0×10-5mol/L)溶液及不同体积的CLS(CFS或CFMS)溶液,用二次蒸馏水定容,静置30 min使体系反应完全。以相应浓度的药物溶液为参比,扫描各体系溶液在190~450 nm范围内的紫外吸收光谱。
3 结果与讨论
3.1 荧光光谱分析
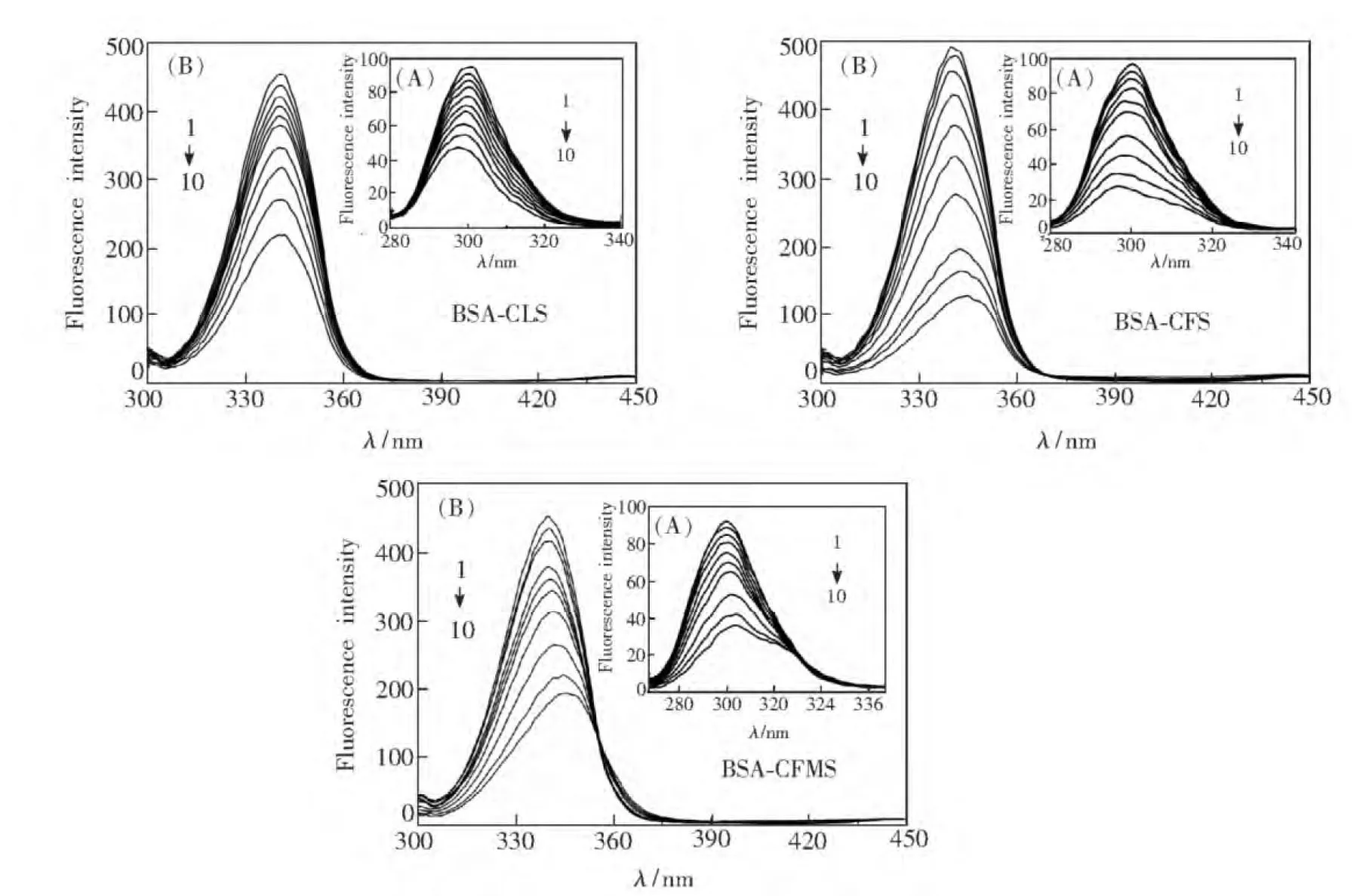
图1所示为3个体系的荧光光谱。由图1可知,增加药物浓度,BSA在340 nm处的荧光强度呈现有规律的下降趋势,说明3种药物均与BSA发生了相互作用,同时伴随有BSA内源荧光的猝灭现象[11]。将测得实验数据按Stern-Volmer方程[12]处理,可以进一步推断猝灭机理:

CBSA= 2.0×10-7mol/L. 1~10:CCLS= (0,0.2,1.0,5.0,8.0,10,15,20,30,40)×10-6mol/L.CCFS=(0,0.4,1.2,4.0,8.0,10,20,30,40,50)×10-6mol/L.CCFMS= (0,0.4,1.2,4.0,8.0,10,20,30,40,50)×10-6mol/L.
图1 BSA-药物体系的荧光光谱(T= 298 K)。A: BSA-CLS; B: BSA-CFS; C: BSA-CFMS。
Fig.1 Fluorescence spectra of BSA-drugs system(T= 298 K). A: BSA-CLS. B: BSA-CFS. C: BSA-CFMS.
(1)
以F0/F-[L] 作图,由拟合直线可得BSA与药物的猝灭常数Ksv以及猝灭速率常数Kq,列于表1。3个体系的Kq值均比2×1010L/(mol·s)大两个数量级,说明BSA-CLS、BSA-CFS、BSA-CFMS 3个体系的结合过程是生成复合物的静态猝灭过程[13],
与图1中加入药物使BSA的最大吸收峰发生红移现象一致[14]。应用方程(2)[15]可以计算3个体系的结合常数Ka和结合位点数n:
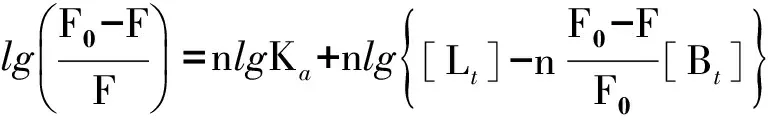
(2)
以 lg{(F0-F)/F}对 lg{[Lt]-n[Bt](F0-F)/F0} 作图,由拟合直线的斜率和截距可得Ka和n值,结果列于表1。结果显示,3个体系的n值均约为1,即药物与蛋白均以1∶1的比例相结合[16]。

表1 荧光法猝灭法测得的3个体系在298 K的猝灭反应参数
r1为方程F0/F-[L]的线性相关系数;r2为方程lg[(F0-F)/F]-lg{[Lt]-n[Bt](F0-F)/F0}的线性相关系数。
3.2 同步荧光光谱分析
图2为3种药物与BSA的同步荧光光谱。BSA-CLS体系:当Δλ=15 nm时,酪氨酸的最大发射波长发生蓝移,说明BSA的构象发生改变,酪氨酸周围极性减小,疏水性增加[17]。当Δλ=60 nm时,同步光谱没有发生位移变化,
CBSA=2.0×10-7mol/L. 1~10:CCLS=(0,0.2,1.0,5.0,8.0,10,15,20,30,40)×10-6mol/L.CCFS=(0,0.4,1.2,4.0,8.0,10,20,30,40,50)×10-6mol/L.CCFMS=(0,0.4,1.2,4.0,8.0,10,20,30,40,50)×10-6mol/L.

图2 BSA-药物体系的同步荧光光谱(T = 298 K)。 (A)Δλ=15 nm;(B)Δλ=60 nm。
r1为方程F0/F-[L]的线性相关系数;r2为方程lg[(F0-F)/F]-lg{[Lt]-n[Bt](F0-F)/F0}的线性相关系数。
说明色氨酸周围极性没有因加入CLS而发生改变。BSA-CFS体系:当Δλ=15 nm时,酪氨酸的最大发射波长向短波长方向发生移动,说明酪氨酸周围极性发生改变。当Δλ=60 nm时,色氨酸最大发射波长向长波长移动,说明色氨酸周围的极性增加,疏水性降低[18]。BSA-CFMS体系:当Δλ=15 nm和Δλ=60 nm时,色氨酸和酪氨酸的光谱图均发生一定红移,说明CFMS的加入使色氨酸和酪氨酸周围环境均发生改变。对于同步荧光法,利用方程(1)、(2)分别对3个体系的同步荧光法所得数据进行处理,结果列于表2。比较表1与表2 的数据可以看出,同步荧光法与荧光猝灭法所得的猝灭机理相同,猝灭参数非常接近,说明同步荧光法应用于计算猝灭参数是可取的。
3.3 共振光散射光谱(RLS)分析
图3为BSA-CLS和BSA-CFS两个体系的RLS光谱,体系BSA-CFMS的RLS谱图因与体系BSA-CFS相似,故没有列出。由图3可知,单独的BSA在290 nm处有较强的RLS信号。当加入药物浓度增加时,BSA的RLS信号发生规律性降低,并有新峰形成。取BSA在290 nm处的最大散射峰变化,按方程(1)、(2)对数据进行处理,求得3个体系的Ksv、Kq、Ka列于表3。由表3可知,RLS法所得的结果与采用荧光猝灭方法所得的结果在同一个数量级。因为共振光散射光谱法也属于荧光光谱的一种,所以,前两种方法的分析公式同样也适用于共振光光谱的分析。通过比较表1、2、3可知,同一体系的3种荧光法所得到的猝灭参数很接近。说明RLS法可以应用于测定药物与蛋白质的相互作用。

CBSA = 2.0×10-7 mol/L. 1~10: CCLS = (0,0.2,1.0,5.0,8.0,10,15,20,30,40)×10-6 mol/L.
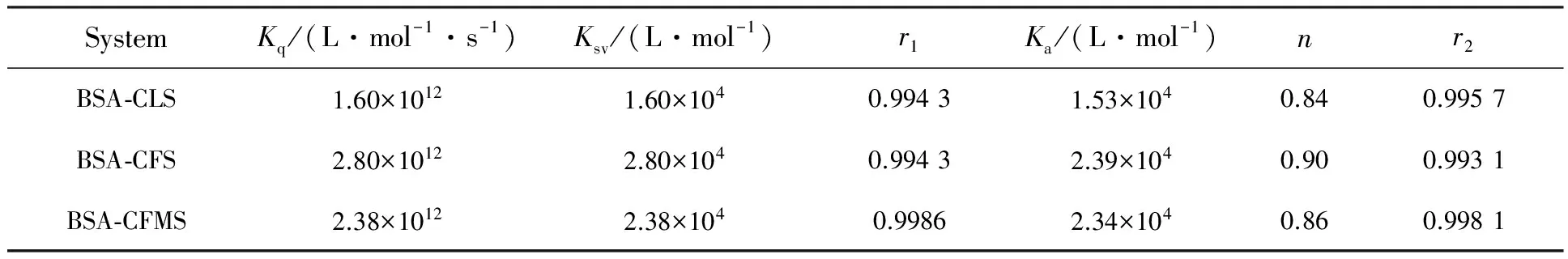
SystemKq/(L·mol-1·s-1)Ksv/(L·mol-1)r1Ka/(L·mol-1)nr2BSA⁃CLS1.60×10121.60×1040.99431.53×1040.840.9957BSA⁃CFS2.80×10122.80×1040.99432.39×1040.900.9931BSA⁃CFMS2.38×10122.38×1040.99862.34×1040.860.9981
r1为方程F0/F-[L]的线性相关系数;r2为方程lg[(F0-F)/F]-lg{[Lt]-n[Bt](F0-F)/F0}的线性相关系数。
3.4 紫外吸收光谱分析
图4为3个体系的紫外吸收谱图。由图4可知,在3个体系中,随着药物浓度的增加,BSA在波长210 nm附近的最大吸收峰强度降低且伴有峰位红移现象,说明3个体系在相互作用时均生成了新的物质,这也再次表明3种药物与蛋白的结合过程为静态猝灭[19]。蛋白与药物小分子的Kb可以通过公式(3)[20]得到:
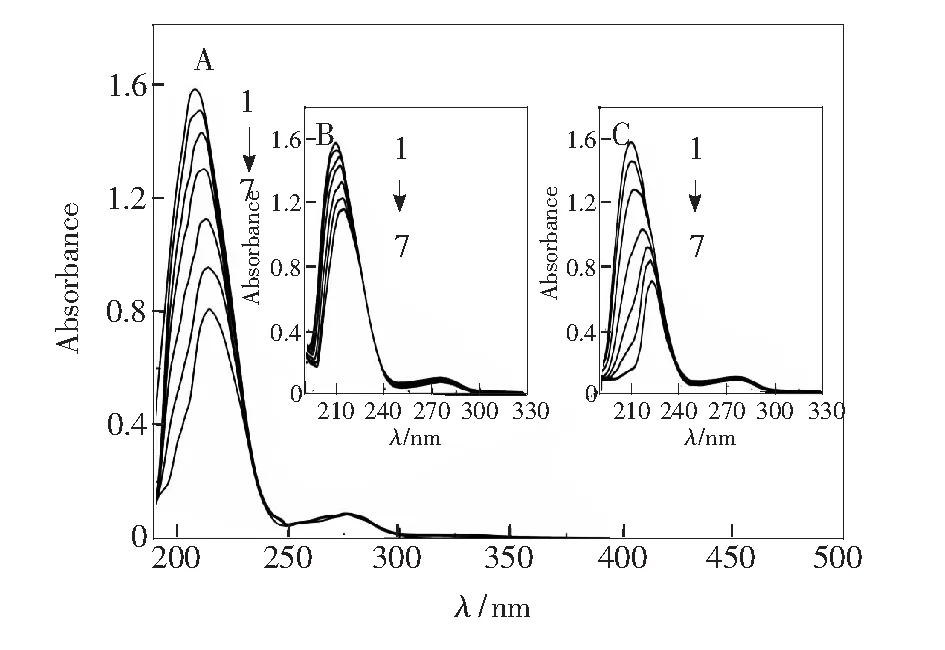
CBSA= 2.0×10-6mol/L. 1~7:CCLS=(0,4,10,20,30,40,50)×10-6mol/L.CCFS=(0,4,10,20,30,40,50)×10-6mol/L.CCFMS=(0,4,10,20,30,40,50)×10-6mol/L.
图4 BSA-药物体系的紫外吸收光谱 (T=298 K)。A: BSA-CLS; B: BSA-CFS; C: BSA-CFMS。
Fig.4 Absorption spectra of BSA-drugs systems (T=298 K). A: BSA-CLS. B: BSA-CFS. C: BSA-CFMS.
(3)
由(A0-A)-1对[L]-1作图计算得到的3个体系的紫外吸收法的结合常数Kb列于表4。比较表1、2、3、4数据可知,利用公式(3)计算得到的紫外吸收法的结合常数与荧光法利用公式 (1)、(2)计算得到的在同一个数量级,说明采用紫外吸收法计算蛋白质-药物体系的结合常数是可取的。数值上微小的差别是因为紫外吸收法与荧光法计算参数时利用的公式不同。
3.5 Hill系数的计算
由Hill方程[21]的系数nH可以判断具有多重配体结合部位的蛋白质与配体相结合时,各结合部位之间的相互影响情况:

表4 紫外吸收光谱法测得的3个体系在298 K的结合常数
r3是方程(A0-A)-1-[L]-1的线性相关系数。

(4)
其中,Y是结合饱和分数,K是结合常数,nH是Hill系数。nH=1表示零协同作用,nH>1表示正协同作用,nH<1表示负协同作用。
(5)
其中,对于荧光光谱法,Q=(F0-F)/F0;对于紫外吸收法,Q=(A0-A)/A0。1/Qm是以1/Q对1/[L]作直线图的截距。各体系各方法得到的数值nH列于表5。由表5可见,各体系的nH均约等于1,表明在药物在与蛋白质结合过程中,3种药物(CLS,CFS,CFMS)对之后的配体再与BSA结合不会产生影响,表现为零协同作用[22]。同一个体系中的4种方法所得的数据相同,也说明在计算Hill系数时4种方法都是可取的。

表5 3个体系的Hill系数
r4为曲线lg[Y/(1-Y)]-lg[L]的相关系数。FQS:荧光猝灭法;SYS同步荧光法;RLS:共振光散射法。
4 结 论
利用4种方法分别研究了BSA-CLS、BSA-CFS、BSA-CFMS 3个体系之间的相互作用,且在每个体系中利用4种方法的数据计算实验参数时,
拟合方程的线性相关系数均在0.99以上。对同一体系,4种方法所得到的药物与蛋白作用机理相同。对于体系结合常数,荧光法、同步荧光法所得相近且数值较高,共振荧光法偏低,紫外吸收法最小。这可能是共振荧光法所受干扰较大而紫外吸收法灵敏度较低所致。因此,荧光法、同步荧光法更适于用于药物与蛋白结合反应的研究。
[1] ZHANG Y Z, ZHOU B, LIU Y X,etal.. Fluorescence study on the interaction of bovine serum albumin with p-Aminoazobenzene [J].J.Fluoresc., 2008, 18(1):109-118.
[2] WEI J R, HE Y X, BEI G X,etal.. Fluorometric investigation of the interaction of (2E)-3-(4′-Halophenyl)-N-{4″-[(5‴, 6‴-dimethoxypyrimidin-4‴-yl)sulfamoyl]phenyl}prop-2-enamides with bovine serum albumin [J].Proc.Natl.Acad.Sci.,IndiaSect. A:Phys.Sci., 2014, 84(4):505-516.
[3] 陆从文,兰秀风,张林,等. 依巴斯汀与牛血清蛋白相互作用的荧光光谱研究 [J]. 光子学报, 2015, 44(10):1030004. LU C W, LAN X F, ZHANG L,etal.. Interaction between ebastine and bovine serum albumin by fluorescence spectroscopy [J].ActaPhoton.Sinica, 2015, 44(10):1030004. (in Chinese)
[4] WU Q, LI S, FU X,etal.. Spectroscopic studies on binding of lotus seedpod oligomeric procyanidins to bovine serum albumin [J].J.Appl.Spectrosc., 2014, 80(6):884-892.
[5] ZHANG H M, WANG Y Q, ZHOU Q H,etal.. Molecular interaction between phosphomolybdate acid and bovine hemoglobin [J].J.Mol.Struct., 2009, 921(1-3):156-162.
[6] 何梅,夏之宁,阴永光,等. 紫外光谱研究中药大黄有效成分与牛血清白蛋白的相互作用 [J]. 中国现代应用药学杂志, 2004, 21(6):429-432. HE M, XIA Z N, YIN Y G,etal.. Research on interactions between effective multicomponents of radix et rhizoma rhei with bovine serum albumin by ultraviolet-visible spectra analysis [J].Chin.J.Mod.Appl.Pharm., 2004, 21(6):429-432. (in Chinese)
[7] 刘媛,谢孟峡,康娟. 三七总皂甙对牛血清白蛋白溶液构象的影响 [J]. 化学学报, 2003, 61(8):1305-1310. LIU Y, XIE M X, KANG J. Influence of total saponins ofPanaxnotoginsengon the conformation of BSA [J].ActaChim.Sinica, 2003, 61(8):1305-1310. (in Chinese)
[8] YANG H X, LIU Q C, ZHAO L,etal.. Fluorescence spectroscopic studies on the interaction of oleanolic acid and its triterpenoid saponins derivatives with two serum albumins [J].J.SolutionChem., 2014, 43(4):774-786.
[9] ZHAO X N, LIU Y, NIU L Y,etal.. Spectroscopic studies on the interaction of bovine serum albumin with surfactants and apigenin [J].Spectrochim.ActaA, 2012, 94:357-364.
[10] YIN F B, WANG D L, LI Z F,etal. Study on anaerobic digestion treatment of hazardous colistin sulphate contained pharmaceutical sludge [J].Bioresour.Technol., 2015, 177:188-193.
[11] GUO X J, JING K, GUO C,etal.. The investigation of the interaction between oxybutynin hydrochloride and bovine serum albumin by spectroscopic methods [J].J.Lumin., 2010, 130(12):2281-2287.
[12] TOPRAK M, ARIK M. The investigation of the interaction between orientin and bovine serum albumin by spectroscopic analysis [J].Luminescence, 2014, 29(7):805-809.
[13] KATHIRAVAN A, CHANDRAMOHAN M, RENGANATHAN R,etal.. Spectroscopic studies on the interaction between phycocyanin and bovine serum albumin [J].J.Mol.Struct., 2009, 919(1-3):210-214.
[14] HU M Y, WANG X, WANG H,etal.. Fluorescence spectroscopic studies on the interaction of Gemini surfactant 14-6-14 with bovine serum albumin [J].Luminescence, 2012, 27(3):204-210.
[15] CAO S N, LIU B S, LI Z Y,etal.. A fluorescence spectroscopic study of the interaction between glipizide and bovine serum albumin and its analytical application [J].J.Lumin., 2014, 145:94-99.
[16] HU Y J, YUE H L, LI X L,etal.. Molecular spectroscopic studies on the interaction of morin with bovine serum albumin [J].J.Photochem.Photobiol. B, 2012, 112:16-22.
[17] SHU Y, XUE W W, XU X Y,etal.. Interaction of erucic acid with bovine serum albumin using a multi-spectroscopic method and molecular docking technique [J].FoodChem., 2015, 173:31-37.
[18] LI J, DUAN H Y, WEI W Z,etal.. Spectrometric investigations on the binding of dopamine to bovine serum albumin [J].Phys.Chem.Liq., 2012, 50(4):453-464.
[19] BOZKURT E, BAYRAKTUTAN T, ACAR M,etal.. Spectroscopic studies on the interaction of fluorescein and safranine T in PC liposomes [J].Spectrochim.ActaA, 2013, 101:31-35.
[20] 常希俊,黄艳,贺群. 铱(IV)离子与人血丙种球蛋白的作用研究 [J]. 化学学报, 2005, 63(3):223-238. CHANG X J, HUANG Y, HE Q. Study on the interaction between Ir(IV) and gamma seroglobulinum humanum [J].ActaChim.Sinica, 2005, 63(3):223-238. (in Chinese)
[21] 张红颖,陈宁生,张文龙,等. 辛伐他汀和格列齐特与牛血清白蛋白协同作用的光谱法研究 [J]. 化学研究与应用, 2014, 26(9):1386-1392. ZHANG H Y, CHEN N S, ZHANG W L,etal.. Spectroscopic investigation of the synergy between simvastatin and gliclazide as well as bovine serum albumin [J].Chem.Res.Appl., 2014, 26(9):1386-1392. (in Chinese)
[22] BOJKO B, SUKOWSKA A, MACIEK-JURCZYK M,etal.. The influence of dietary habits and pathological conditions on the binding of theophylline to serum albumin [J].J.Pharm.Biomed.Anal., 2010, 52(3):384-390.

刘保生(1963-),男,河北保定人,研究员,1992年于河北大学获得硕士学位,主要从事分子发光学理论与应用的研究。
E-mail: lbs@hbu.edu.cn
Multi-spectrophotometric Methods for The Investigation of The Interactions of Bovine Serum Albumin and Drugs
LIU Bao-sheng*, LI Tong-tong, ZHANG Qiu-ju, CUI Meng-meng, DUAN Shao-tong
(KeyLaboratoryofAnalyticalScienceandTechnologyofHebeiProvince,CollegeofChemistry&EnvironmentalScience,HebeiUniversity,Baoding071002,China)
The interactions between colistin sulfate(CLS), cefpirome sulfate(CFS), cefpiramide sodium(CFMS) and bovine serum albumin(BSA) were investigated by fluorescence quenching spectroscopy (FQS), synchronous fluorescence spectroscopy (SYS), resonance light scattering (RLS) and UV absorption spectroscopy at 298 K with the simulated physiological condition of the body. The results show that the binding constants of BSA-CLS, BSA-CFS and BSA-CFMS obtained from four methods are at the same order of magnitude, and the quenching mechanism is a static quenching process. The number of binding site (n) in the three system is approximately equal to 1, and the values of Hill’s coefficients in the three system are approximately consistent. The comparison to the experimental data for four methods indicates that FQS, SYS seem to be more suitable for the studying of the reaction mechanism of protein and drug.
bovine serum albumin; fluorescence quenching spectroscopy; synchronous fluorescence spectroscopy; resonance light scattering spectroscopy; UV-Vis absorption spectroscopy
1000-7032(2016)07-0866-07
2016-01-28;
2016-04-13
国家自然科学基金(21375032)资助项目
O657.3
A
10.3788/fgxb20163707.0866
*CorrespondingAuthor,E-mail:lbs@hbu.edu.cn

