不同养殖盐度对凡纳滨对虾血细胞的影响
■郑佩华 钱 坤 张秀霞 鲁耀鹏 王冬梅 李军涛 王安利 冼健安*
(1.华南师范大学生命科学学院广东省水产健康安全养殖重点实验室,广东广州 510631;2.中国热带农业科学院热带生物技术研究所,海南海口 571101)
凡纳滨对虾(Litopenaeus vannamei)是世界三大主要对虾养殖品种之一,也是我国养殖面积最广、产量最高的养殖虾类。凡纳滨对虾是一种广盐性的甲壳动物,能够存活于1‰~2‰的微咸水与40‰的海水之间[1]。一些报道认为其最适生长盐度为18‰~20‰[2-5]。由于凡纳滨对虾盐度适应性广,其养殖范围不断向内陆扩展,目前甚至在完全淡水的条件下也能养殖成功。但近年来,在低盐度养殖条件下,生长速度慢、蜕壳缓慢、易发病等问题逐渐突出,严重阻碍了凡纳滨对虾养殖业向内陆地区的发展。关于盐度对虾类的生长、酶活力、渗透压影响以及盐度耐受性的报道已较多[4-7],血细胞在虾类生理和免疫过程中发挥重要作用,但盐度对虾类血细胞影响的研究报道甚少。流式细胞术是临床上应用已十分广泛的细胞水平的先进分析技术,本研究通过应用流式细胞术分析凡纳滨对虾在不同养殖盐度下的血细胞生理和免疫状态的变化,以其探讨低盐度对虾类血细胞的影响及其作用机制,为凡纳滨对虾在低盐度环境下的健康养殖提供参考。
1 材料与方法
1.1 材料
凡纳滨对虾(Litopenaeus vannamei)购自广东省广州市番禺区某养殖场,养殖水体盐度为5‰。对虾平均体长为(10.6±1.7)cm,在温度(24±2)℃、pH值7.9~8.0、盐度5‰的室内循环水系统中暂养一周后,选取附肢完整、健康状况良好、处于蜕皮期间的对虾进行试验。
1.2 不同盐度水平的处理
设置两个养殖盐度:5‰和20‰,每组设置三个平行。高盐度水体用日晒海盐进行调节,初始盐度为5‰,每天进行2‰的盐度提升,使对虾逐渐适应,直至提升至20‰为止。每个桶放水约200 L,放养对虾30尾,养殖水体一直保持曝气。在高盐度组驯化至盐度20‰后,在实验室条件下再养殖两周以保证完全适应盐度环境。试验期间每天按3%体重的量投喂某品牌商业饲料(40%粗蛋白质、5%粗脂肪、16%灰分),每天及时吸除粪便和残饵。
1.3 血细胞悬液制备
在相应的盐度下养殖两周后进行取样。用2.5 ml一次性注射器吸取300 μl预冷的抗凝剂(葡萄糖20.5 g/l、柠檬酸钠8 g/l、氯化钠4.2 g/l,pH值7.5),然后从虾的围心腔和腹血窦抽取等量的血淋巴,置于离心管中,取200 μl用于血细胞总数(Total haemocyte count,THC)的测定,余下部分加入4倍预冷的抗凝剂进行稀释,用于其它指标的测定。每尾虾的稀释血淋巴作为单独样品进行检测,每个指标均测定15尾虾。
1.4 流式细胞仪
试验中所用流式细胞仪是美国BD(Becton Dickin⁃son)公司生产的FACS Calibur,激发光波长为488 nm,通过CellQuest软件(Becton Dickinson Immunocytome⁃try Systems,San Jose,CA)来获取和分析试验数据。
1.5 血细胞总数的测定
THC根据之前建立的FCM方法进行测定。取未经稀释的血细胞悬液200 μl,加入10×SYBR Green I(Sigma),室温避光孵育60 min,用200目筛网过滤后上机检测。每个样品上样1 min,根据划定的细胞区域,分析并记录完整细胞的个数,每个样品读取3次。根据以下公式进行计算:THC(个/ml)=1 min上样细胞数(个/min)/上样速度(ml/min)×样品稀释倍数。
1.6 血细胞比例分析
取血细胞悬液200 μl,直接上机检测,每个样品的细胞获得数为10 000个。前向角散射光(Forward light scatter,FSC)和侧向角散射光(Side light scatter,SSC)分别反映细胞的大小和颗粒复杂程度,以FCS为横坐标、SSC为纵坐标作散点图,根据不同类型血细胞的大小和颗粒复杂度的不同,在散点图上设门划定不同的细胞亚群,分析其比例。
1.7 血细胞凋亡率的测定
以Annexin V-FITC/PI凋亡检测试剂盒检测血细胞的凋亡率。试验操作参考说明书稍作修改。取600 μl血细胞悬液进行离心(800×g,4 ℃、5 min),血细胞重悬于200 μl 1×Annexin V结合缓冲液中,加入10 μl Annexin V-FITC 和20 μl PI工作液,室温避光染色 15 min,再加入400 μl 1×Annexin V 结合缓冲液,200目筛网过滤后立即用流式细胞仪检测。用FL1和第二荧光通道(FL2)分别获取Annexin V-FITC和PI的荧光数据,在Cell Quest软件上建立以Annex⁃in V-FITC荧光强度(FL1)为横坐标,PI荧光强度(FL2)为纵坐标的散点图,用十字门划分各类细胞的区域。细胞总凋亡率为前期凋亡、后期凋亡和死亡细胞所占的比例。
1.8 活性氧(Reactive oxygen species,ROS)含量的测定
以DCFH-DA(Sigma)为荧光标记探针检测血细胞ROS含量的变化。取血细胞悬液200 μl,加入终浓度为10 μmol/l的DCFH-DA,混匀后室温避光孵育30 min,用200目筛网过滤后上机检测,每个样品的细胞获得数为10 000个。用第一荧光通道(FL1)获取胞内DCF的荧光数据,在Cell Quest软件上建立以DCF荧光量(FL1)为横坐标,细胞数量为纵坐标的单参数直方图,分析样品的DCF平均荧光量,胞内的DCF平均荧光量与ROS含量成正比。
1.9 一氧化氮(NO)含量的测定
以DAF-FM DA(Sigma)为标记探针检测NO含量的变化。取血细胞悬液200 μl,加入终浓度为10 μmol/l DAF-FM DA,混匀后室温避光孵育60 min,用200目筛网过滤后上机检测,每个样品的细胞获得数为10 000个。用FL1获取胞内DAF的荧光数据,在Cell Quest软件上建立以DAF荧光量(FL1)为横坐标,细胞数量为纵坐标的单参数直方图,分析样品的DAF平均荧光量,胞内的DAF荧光量与NO含量成正比。
1.10 非特异性酯酶活力的测定
以二乙酸荧光素(Fluorescein diacetate,FDA)为标记探针检测非特异性酯酶活力的变化。取血细胞悬液200 μl,加入终浓度为 5 μmol/l FDA 避光孵育30 min,用200目筛网过滤后上机检测,每个样品的细胞获得数为10 000个。用FL1获取胞内FDA的荧光数据,在Cell Quest软件上建立以FDA荧光量(FL1)为横坐标,细胞数量为纵坐标的单参数直方图显示,分析样品的FDA平均荧光量,细胞的FDA平均荧光量与非特异性酯酶活力成正比。
1.11 游离Ca2+含量的测定
以Fluo3-AM(Sigma)为标记探针检测胞浆游离Ca2+含量的变化。取血细胞悬液200 μl,加入5 μmol/l Fluo3-AM室温避光孵育30 min,用200目筛网过滤后上机检测,每个样品的细胞获得数为10 000个。用FL1获取胞内Fluo3的荧光数据,在Cell Quest软件上建立以Fluo3荧光量(FL1)为横坐标,细胞数量为纵坐标的单参数直方图,分析样品的Fluo3平均荧光量,细胞的Fluo3荧光量与游离Ca2+含量成正比。
1.12 血清酚氧化酶(PO)活力的测定
按上述方法,每尾虾抽取200 μl血淋巴,800×g、4℃离心10 min,上清为血清,用于PO活力的测定。PO活力依据Huang等[8]的方法进行测定。取20 μl血清,加到880 μl的L-dopa溶液(L-dopa溶于pH值6.6的磷酸钾缓冲液中,终浓度为3 mg/ml)中,立即用分光光度计测定490 nm下的吸光值,每隔10 s读取一次,一共读取120 s。每分钟OD490增加0.001定义为一个酶活力单位。
1.13 统计分析
结果用“平均值±标准差”(Mean±SD)表示,试验数据通过SPSS 19.0对数据进行t检验分析,P<0.05确认为显著性差异,P<0.01确认为极显著性差异。
2 结果(见表1~表2)
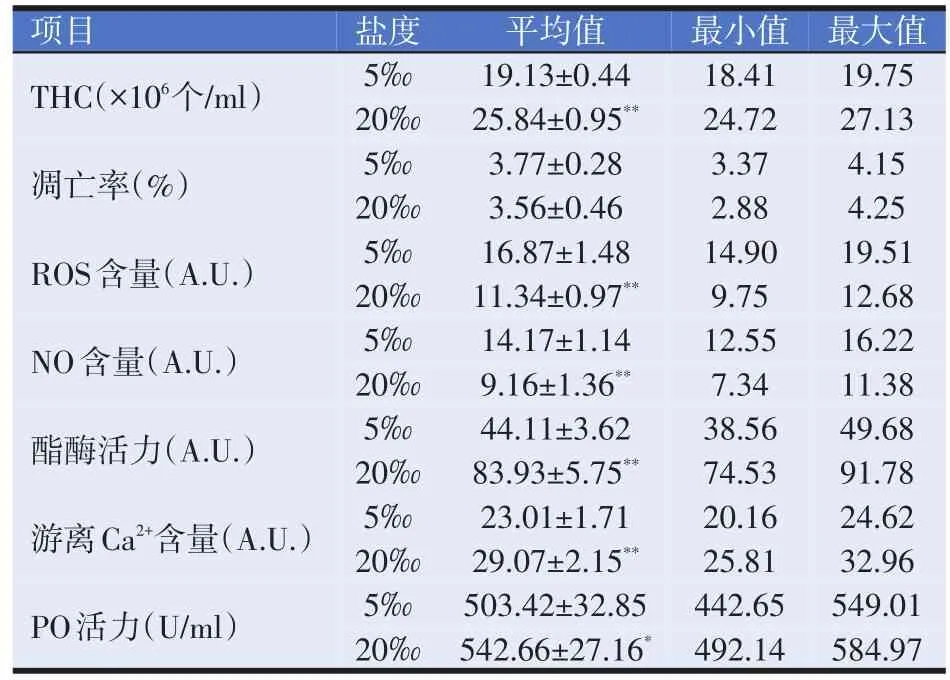
表1 两个养殖盐度下凡纳滨对虾的血细胞状态
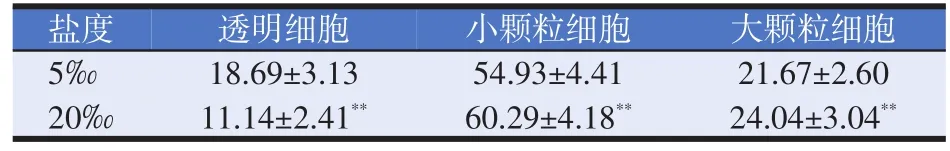
表2 两个养殖盐度下凡纳滨对虾的不同类型血细胞比例(%)
如表1所示,在20‰盐度下养殖的对虾的THC、酯酶活力和游离Ca2+含量极显著高于5‰盐度下的对虾(P<0.01),分别是5‰盐度下对虾的1.35、1.90倍和1.26倍;两个盐度下养殖对虾的血细胞凋亡率没有显著差异(P>0.05);在5‰盐度下养殖的对虾的ROS和NO含量极显著高于20‰盐度下的对虾(P<0.01),分别是20‰盐度下对虾的1.49倍和1.55倍;20‰盐度下养殖的对虾的血清PO活力显著高于5‰盐度下养殖的对虾(P<0.05)。
血细胞组成比例如表2所示,在5‰盐度下,凡纳滨对虾的小颗粒细胞比例最高,占54.93%,大颗粒细胞次之,透明细胞最少;在20‰盐度下,凡纳滨对虾的血细胞组成比例也表现为:小颗粒细胞>大颗粒细胞>透明细胞,与5‰盐度下的对虾相比,大颗粒细胞和小颗粒的比例分别提高了2.37个百分点(P<0.01)和5.36%(P<0.01),透明细胞的比例减少了7.55个百分点(P<0.01)。
3 讨论
3.1 盐度对血细胞总数和凋亡率的影响
THC是衡量虾类免疫状态的重要指标,在正常状态下,虾类的血细胞数量会保持在一定的范围内;而在遭受胁迫或病原体感染的状态下,THC则往往呈现出下降的趋势[9-13]。本研究结果发现,在20‰盐度下,凡纳滨对虾的THC极显著高于5‰盐度,约为1.35倍。Gilles等[14]研究显示圣保罗对虾(Farfantepenaeus paulensis)血淋巴中血细胞数量随着盐度的降低而减少。沈丽琼等[15]研究显示15‰~25‰盐度下养殖的凡纳滨对虾的THC高于5‰~10‰盐度下养殖的对虾。这些研究结果与本研究结果基本一致。虽然经过盐度驯化后,凡纳滨对虾可以在较低盐度下生存和生长,甚至可以进行全淡水的养殖,但一些研究发现盐度对凡纳滨对虾的生长性能有显著影响,认为其最适生长盐度为20‰[1,4]。由于血细胞在免疫过程中发挥着重要作用,所以THC的下降被认为是免疫力下降的重要体现,导致机体对病原体易感性的增强。本研究结果显示,5‰盐度下,对虾THC较低,表明低盐度下对虾的免疫力较差;而在被认为最适生长盐度20‰的盐度下,对虾呈现出较高的血细胞数量,表明适宜的盐度对虾的免疫力有正面的调节作用。
研究已发现虾类在正常生理状态下,血细胞中存在一定比例的凋亡细胞,这被认为是机体为维持血细胞整体功能,进行新陈代谢的正常表现[16]。当虾体受到环境急性胁迫或病原体感染时,血细胞的凋亡率会呈现显著上升。在亚硝酸盐胁迫下,斑节对虾血细胞凋亡率上升,从而导致THC的下降[12]。斑节对虾在受到白斑病毒感染后,血细胞凋亡率显著上升,虾体的免疫防御能力受到抑制,对虾的生存受到威胁[17]。这些研究均表明血细胞凋亡率是体现虾类免疫状态的一个重要指标。在本研究中,虽然低盐度下,对虾的THC较低,但低盐度并未显著影响血细胞的凋亡率,可能是由于对虾经过长期驯化后,在一定程度上适应低盐度,使血细胞凋亡率处于正常范围内。
3.2 盐度对血细胞组成比例和PO活力的影响
根据大小和颗粒情况,虾类的血细胞可分为三类:透明细胞、小颗粒细胞和大颗粒细胞[18-19]。不同类型的血细胞有不同的功能,就吞噬功能而言,一些研究认为透明细胞是承担吞噬作用的主要血细胞类型[20],但另一些研究则显示小颗粒细胞和大颗粒细胞的吞噬能力较强[21-23],目前仍没用统一的定论;小颗粒细胞和大颗粒细胞负责储存和释放酚氧化酶原系统,并有较强的细胞毒活性[18]。笔者以往的研究表明大颗粒细胞拥有很强的ROS和NO产生能力,小颗粒细胞次之,透明细胞产生能力极弱[24-25];大颗粒细胞的酯酶活力强于小颗粒细胞和透明细胞[24]。由于不同类型血细胞的功能不同,它们的比例或数量可能在一定程度上反映了虾体的免疫状态,因此一些研究将不同类型血细胞数量(Ddifferential haemocyte count,DHC)作为虾类的免疫状态指标[26]。研究表明环境胁迫或病原体感染均会对虾类不同血细胞的比例或数量产生影响[26-28]。在本研究中,结果显示养殖盐度也对不同血细胞的比例产生影响,与低盐度相比,在高盐度下对虾的小颗粒细胞和大颗粒细胞的比例极显著提高,尤其是小颗粒细胞,提高了5.36百分点;透明细胞的比例则极显著减少。根据以往的研究,小颗粒细胞和大颗粒细胞可能在虾类免疫过程中发挥更为重要的作用[16,24-25,27]。20‰盐度下,两类颗粒细胞比例提高可能暗示在此养殖盐度下虾类的免疫状态较好。
酚氧化酶原(proPO)系统是甲壳动物重要的免疫防御系统,储存于两类颗粒细胞的颗粒中。颗粒细胞经免疫刺激后,会进行脱颗粒释放proPO系统相关免疫因子,其中包括了被激活的PO。PO可以将酚转化为醌,醌再进一步形成黑色素而发挥抗菌杀菌、伤口愈合等作用[29]。本试验结果显示,在20‰盐度下的对虾的血清PO活力显著高于5‰盐度下的对虾。李华等[7]也研究了三个盐度对凡纳滨对虾血清PO活力的影响,结果显示在不同盐度下适应15 d以后,凡纳滨对虾在18‰盐度时,血清PO活力最强,4‰盐度时次之,32‰盐度时最低,与本研究的结果一致。两类颗粒细胞是储存与释放proPO系统的血细胞类型,在20‰盐度下,两类颗粒细胞比例的显著提高可能是促使血清PO活力升高的原因。
3.3 盐度对ROS和NO含量的影响
ROS,包括超氧阴离子(·O2-)、过氧化氢(H2O2)和羟自由基(·OH)等,是一类具有强氧化性的物质,在杀灭和清除病原体的过程中发挥十分重要的作用,是机体起免疫和防御作用的重要物质之一。NO与ROS相似,在病原体等的刺激下,NOS通路会被激活,产生大量的NO,从而抑制或杀灭病原体[30-32]。然而,ROS具有两面性,在正常状态下,抗氧化系统的调控使体内ROS的产生和清除能够很好地调节,达到稳定的动态平衡状态;当受到机体胁迫作用时,ROS产物和抗氧化防御系统之间的平衡便会被破坏[33],过量的ROS会对机体自身造成氧化损伤,诱导细胞发生凋亡[26,34]。大量产生的NO也会对机体自身造成损伤,是细胞凋亡的重要诱导因素之一[28]。
本研究结果显示,5‰低盐度下对虾的血细胞ROS含量极显著高于20‰盐度,为20‰盐度下的1.49倍。NO对养殖盐度的响应与ROS相似,在低盐度下NO含量较高。低盐度下产生较多的ROS和NO,推测有两种可能性:被动产生和主动产生。环境胁迫是诱导机体产生ROS和NO的重要原因[11-12],低盐度下较多的ROS和NO可能是由于长期的慢性低盐度胁迫而被动产生的。虽然较高含量的ROS和NO在抗菌杀菌能力上可发挥更强的作用,在一定程度上弥补血细胞数量不足以及酯酶活性下降所造成的免疫力下降,但较高含量的ROS和NO需要机体调动更多的抗氧化活力,以维持氧化和抗氧化的动态平衡,免于对机体自身造成氧化损伤,因此在低盐度下,对虾对抗氧化活力相关的营养素,如VC、VE、铜、锌、锰、硒等的需求量可能也较高。与适宜盐度相比,机体需要消耗较多的营养素和能量用于提高抗氧化活力,可能是导致低盐度下生长较缓慢的原因之一。
3.4 盐度对酯酶活力的影响
酯酶是溶酶体酶的一种,在血细胞吞噬异物和病原体后的杀菌溶菌以及分解被吞噬物等过程中起重要的作用,是重要的免疫指标之一。另外,一些研究表明,酯酶活力对外界环境的变化较为敏感,因此酯酶活力也可用作分析环境胁迫和环境毒理的重要指标[35]。研究显示,一些杀虫剂会抑制牡蛎(Crassostrea gigas)的酯酶活力[36]。Cd2+胁迫会导致斑节对虾(Penaeus monodon)血细胞酯酶活力下降[13]。本研究发现,与ROS和NO情况相反,对虾在低盐度下的血细胞酯酶活力较低,仅为20‰盐度下的52.6%,表明与适宜盐度相比,低盐度下对虾血细胞的免疫活力有所下降。李华等[7]比较了盐度为4‰、18‰和32‰条件下凡纳滨对虾血浆多种免疫酶活力,结果显示,盐度18‰时免疫酶活力最强。虽然对虾经过驯化后,能够在低盐度下生存和生长,但从上述指标来看,低盐度可能产生了长期的慢性盐度胁迫作用,对虾体产生了一定的不良影响,尤其体现在免疫力上,因此低盐度环境可能会增加对虾对某些疾病的易敏感。
3.5 盐度对胞内游离钙离子含量的影响
钙除了构成有机体的骨骼、甲壳等以外,少量Ca2+会存在于软组织中,发挥各种生理功用,包括参与肌肉收缩、血液凝固、神经传导、酶的激活、调控细胞凋亡以及膜的通透性等[37-38]。本研究结果显示,外界盐度的差异导致了虾血细胞内游离Ca2+含量发生显著的变化,高盐度养殖对虾的胞内游离Ca2+含量极显著高于低盐度养殖对虾。胞内游离Ca2+含量是细胞凋亡的一个重要指标,在细胞凋亡前期,储存在内质网内的Ca2+会被大量释放到细胞质中,胞质内的游离Ca2+含量迅速持续升高,进一步促进凋亡的发生[11]。然而,结合THC、细胞凋亡率等指标来看,可以推测高盐度下游离Ca2+含量的上升与细胞凋亡无直接关系。已有研究显示,环境盐度对水生动物血液的渗透压会产生显著影响[39-40],高盐度下较高的游离Ca2+含量可能是为了机体维持血细胞胞内渗透压的平衡。
4 结论
本研究结果显示,在两个不同盐度下(5‰和20‰)养殖的凡纳滨对虾,其血细胞指标存在显著的差异性。20‰盐度组的对虾的血细胞总数(THC)、酯酶活力、小颗粒细胞和大颗粒细胞的比例以及血清酚氧化酶(PO)活力均较高,表明对虾在20‰盐度下血细胞免疫力较高。20‰盐度组对虾的血细胞胞内游离Ca2+含量较高,表明对虾血细胞可以通过调节胞内游离Ca2+的含量来维持内外的渗透压平衡。5‰盐度组对虾的血细胞活性氧(ROS)和一氧化氮(NO)含量均较高,暗示对虾可能长期遭受慢性低盐度胁迫,但两盐度组对虾的血细胞凋亡率没有显著差异,5‰盐度下对虾可能调动了更多的抗氧化活力,以清除过多的ROS和NO。综上,本研究结果表明,养殖盐度会显著影响对虾血细胞的生理和免疫状态,在20‰适宜盐度下,对虾的血细胞免疫力较强;5‰低盐度下,对虾可能遭受慢性低盐度胁迫,血细胞免疫力较低。

