氟苯尼考在花鲈体内的代谢及残留消除规律
黄聚杰,林茂,2*,鄢庆枇,李忠琴,2,李江森
(1.集美大学水产学院;2.鳗鲡现代产业技术教育部工程研究中心:福建 厦门 361021)
氟苯尼考在花鲈体内的代谢及残留消除规律
黄聚杰1,林茂1,2*,鄢庆枇1,李忠琴1,2,李江森1
(1.集美大学水产学院;2.鳗鲡现代产业技术教育部工程研究中心:福建 厦门 361021)
为了解氟苯尼考在花鲈(Lateolabraxjaponicus)体内的代谢动力学特征和残留消除规律,利用高效液相色谱法检测氟苯尼考混饲口灌给药后在花鲈血浆、肌肉、肝和肾等样品中的时间-浓度变化。在代谢动力学研究中,将20 mg/kg 氟苯尼考单次混饲口灌给药于花鲈后,获得48 h内的药时数据,利用DAS和WinNonlin软件进行比较分析。结果表明,不同药代动力学分析软件或者不同权重系数所获得的房室参数值有较大差异,特别是消除相半衰期(T1/2β);而非房室参数值则比较接近。其中DAS软件非房室模型分析氟苯尼考在花鲈血浆中的药代动力学参数显示,药时曲线下面积(AUC0—∞)为257.591 mg/(L·h),表观分布容积(Vz/F)为1.401 L/kg,平均滞留时间(MRT0—∞)和消除半衰期(T1/2z)分别为18.505和12.508 h,达峰浓度(Cmax)和达峰时间(Tmax)分别为18.356 μg/mL和3 h。在残留消除研究中,氟苯尼考以60 mg/kg的高剂量单次给药后,采集30 d内的药时数据,利用WT程序计算的结果显示,氟苯尼考在花鲈肌肉、肝、肾和血浆中的理论休药期分别为6.54、8.69 、8.30和5.89 d。研究结果为氟苯尼考在花鲈养殖中的用药方案和休药期的制定提供理论依据。[中国渔业质量与标准,2016,6(3):6-13]
氟苯尼考;花鲈;药代动力学;残留;休药期
氟苯尼考(florfenicol,FFL)是甲砜霉素的氟化物,又称为氟甲砜霉素,于20世纪80年代被研制出来。作为一种新型的动物用药,由于其具有抗菌谱广、吸收良好、体内分布广泛、安全高效且无潜在的致再生障碍性贫血等优点,被广泛地应用于水产养殖[1]。中国农业部1435号公告第一批《兽药试行标准转正标准目录》公布了水产用的氟苯尼考粉制剂(10%)[2],此外《兽药典-兽药使用指南化学药品卷(2010版)》指出,可以用于水产动物的氟苯尼考制剂还有氟苯尼考预混剂(50%)和氟苯尼考注射液[3]。作为氯霉素的替代品,研究显示氟苯尼考对杀鲑气单胞菌(Aeromonassalmonicidas)、鳗弧菌(Vibrioanguillarum)、迟缓爱德华菌(Edwardsiellatarda)等水产动物病原菌具有较强的抑制及杀灭作用[4]。
花鲈(Lateolabraxjaponicus),又称鲈、海鲈、七星鲈,隶属鲈形目、鮨科、花鲈属,是水产养殖的主要种类,其肉质细嫩,营养丰富,为广温、广盐性的肉食性经济鱼类[5]。氟苯尼考在相关水产动物体内的药代动力学研究较多,实验品种涉及鲫(Carassiusauratus)[6]、西伯利亚鲟(Acipenserbaerii)[7]、罗非鱼(OreochromisniloticusxO.aureus)[8]、日本鳗鲡(Anguillajaponica)、欧洲鳗鲡(A.anguilla)[9]、中华鳖(Trionyxsinensis)[10]、中国明对虾(Penaeusorientalis)[11]、大黄鱼(Larimichthyscrocea)[12]、九孔鲍(Haliotisdiversicolor)[13]、斑点叉尾鮰(Ictaluruspunctatus)[14]等,但在花鲈体内的代谢研究未见报道。因此,本研究模拟实际养殖条件,采用混饲口灌给药方式,研究氟苯尼考在花鲈体内的药代动力学和残留消除规律,并提出给药方案和休药期建议,以期为该药物的安全使用提供理论依据。
1 材料与方法
1.1 实验动物
实验前花鲈暂养于200 L养殖缸中,使用循环水养殖系统,水温(22±1)℃,盐度17.8。期间花鲈经抽样检测体内无氟苯尼考残留,暂养7 d后开始实验,实验用鱼平均体重为(505.3±70.5)g。
1.2 主要试剂
氟苯尼考标准品(99.7%,Dr. Ehrenstorfer);氟苯尼考原料药(99.0%,张家港市恒盛药用化学有限公司,批号FB20130452);正己烷,乙腈(色谱纯,Tedia)。
1.3 给药及样品采集
代谢动力学研究采用20 mg/kg的常规治疗剂量以导管单次混饲口灌给药,于给药后0.25、0.5、1、2、3、4、6、9、15、24、36、48 h,分别采集血液、肝、肾和肌肉等样品。残留消除研究则采用60 mg/kg的高剂量单次混饲口灌给药[15-18],采样时间点为给药后1、2、3、4、6、9、15、24、30 d。给药前花鲈以150 mg/L的MS-222麻醉剂浸浴3 min以减少捕捞的应激反应。
血液的采集是用2 mL注射器进行尾柄抽血,并置于5 mL离心管中,注射器和离心管使用前用 0.1% 肝素钠润洗后风干。血样于4 000 r/min条件下离心10 min,取上清液,同其他组织样品置于-20 ℃ 保存待测。
1.4 样品处理
组织(肌肉、肝、肾)和血浆自然解冻后,组织剪碎并用研磨仪匀浆。肌肉、肝样品各取1 g,肾取0.2 g,血浆1 mL,样品分别放入10 mL离心管中。加入2 mL乙酸乙酯,漩涡振荡5 min后,于10 000 r/min离心10 min,取其上清液于广口瓶中。重复上述提取步骤2次,合并上清液。将广口瓶放入通风柜内的水浴锅中,70 ℃水浴加热风干后,加入2 mL流动相溶液,放入摇床振荡直至残留物完全溶解。加入饱和正己烷2 mL,振荡5 min。所有液体移至10 mL离心管中,于10 000 r/min离心10 min,下层液体经0.45 μm 微孔滤膜过滤后,存于进样瓶中待测。
1.5 色谱条件
样品处理后利用高效液相色谱仪Agilent1100进行检测分析;色谱柱是Agilent HC-C18(4.6 mm × 250 mm,5 μm);进样量10 μL;流动相为乙腈-水(30 ∶70,V/V);流速1 mL/min;流速柱温40 ℃;检测波长223 nm。
1.6 标准曲线和检测限
将配置的100 μg/mL氟苯尼考标准储备液,用定容液配成0.01、0.05、0.1、0.5、1、5、10、20 μg/mL的标准溶液,进行测定。以质量浓度为纵坐标、峰面积为横坐标绘制标准曲线,求出回归方程和相关系数。按信噪比S/N=3计算最低检测限。
1.7 回收率和精密度
在空白血浆、肌肉、肝、肾样品中,分别添加标准液,配置成氟苯尼考质量浓度分别为0.1、1、10 μg/mL的样品,按1.4进行样品前处理,各个浓度样品分别于一日和一周内重复测定3次,计算回收率和日内、日间精密度[9]。
1.8 代谢和残留消除数据分析
代谢动力学的药时数据采用DAS3.0软件进行药动学分析,并与WinNonlin5.2软件分析结果进行比较。残留消除的药时数据以SPSS11.0软件进行曲线拟合,并以WT1.4软件计算休药期。
2 结果与分析
2.1 色谱特征
在本研究的色谱条件下,氟苯尼考的保留时间在7.6 min左右,峰型尖锐对称,分离效果好(图1)。以3倍信噪比(S/N)计算氟苯尼考的最低检测限为0.05 μg/mL。
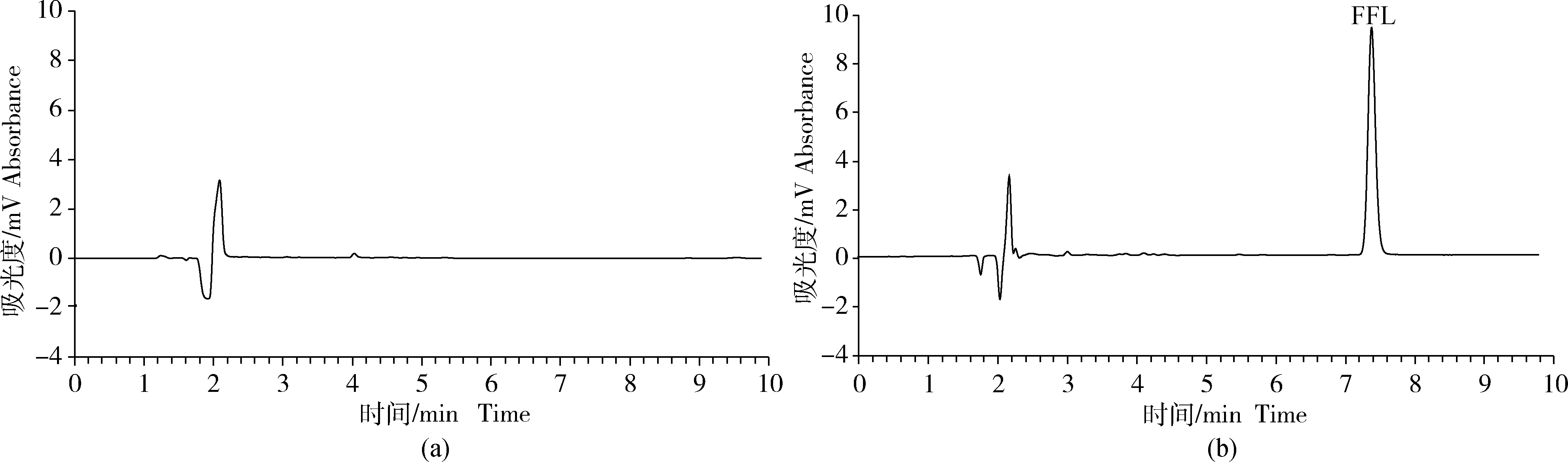
图1 空白血浆样品(a)及其添加氟苯尼考标准品后(b)的色谱图Fig.1 Chromatogram of control plasma sample (a) and the sample added with florfenicol standard(b)
2.2 分析方法验证
以氟苯尼考的色谱峰面积值(S)为横坐标,氟苯尼考质量浓度(C)为纵坐标,随检测批次绘制标准曲线,并计算当批样品中药物的质量浓度,各批次标准曲线高度近似,且相关系数(R2)均大于0.998。添加0.1、1和10 μg/mL氟苯尼考的加标空白样品,经检测,平均回收率为(94.6±5.2)%,日内变异系数为(3.7±0.5)%,日间变异系数为(5.4±1.2)%。
2.3 氟苯尼考在花鲈血浆中的药动学特征
花鲈以20 mg/kg的剂量采取混饲口灌方式给药,给药后的时间-浓度数据(图2)显示,在0~3 h内,氟苯尼考在血浆中的浓度逐渐升高,在3 h时达到峰浓度(Cmax)18.356 μg/mL。之后进入消除相,以较快的速度下降到15 h时的6.731 μg/mL,在48 h时氟苯尼考残留为1.727 μg/mL。
药时数据以DAS软件(可选5种权重系数1、1/C、1/C/C、1/C′/C′或 1/C′)和WinNonlin软件的房室模型进行分析,可获得拟合良好(R>0.93)的药动学曲线(图2)。这6条拟合线较为相近,但并不完全吻合,模型参数(表1)显示这6种计算方式所获得的参数值有较大的差异,特别是重要的药动学参数消除相半衰期(T1/2β,h)以DAS软件不同权重系数计算,其值从8.564到6 931.472,以WinNonlin计算
则为18.636。而以非房室模型进行分析(表2),DAS和WinNonlin软件所获得的主要药动学参数比较接近,甚至AUC(0—t)、MRT(0—t)、Tmax和Cmax等参数值相等。
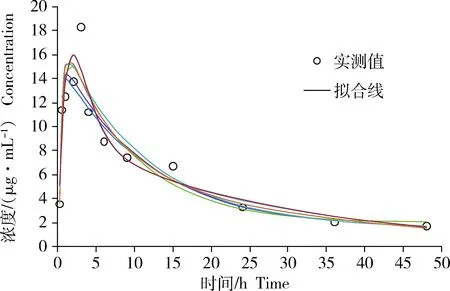
图2 单次口灌氟苯尼考后花鲈血浆中的药时数据点及其拟合曲线6条拟合线分别采用药动学软件DAS(可选5种权重系数1、1/C、1/C/C、1/C′/C′或1 1/C′)和Win-Nonlin的二室模型进行运算和绘制。Fig.2 The concentration-time data and fitted curve offlorfenicol in plasma of Lateolabrax japonicus after single oral administrationThe six lines were fitted by DAS software operated with five kinds of weigh factors and WinNonlin software, respectively.
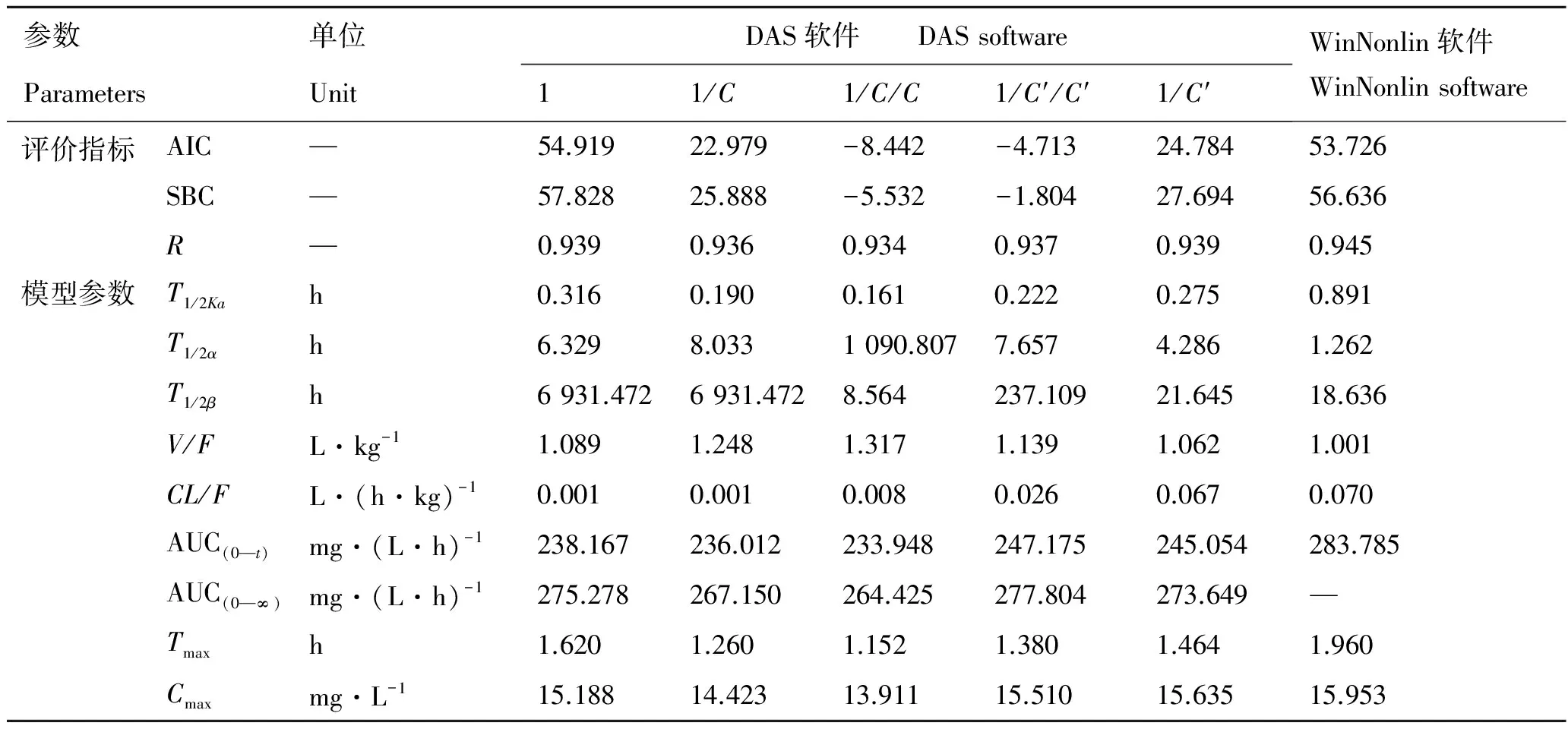
参数单位DAS软件 DASsoftwareParametersUnit11/C1/C/C1/C′/C′1/C′WinNonlin软件WinNonlinsoftware评价指标AIC—54.91922.979-8.442-4.71324.78453.726SBC—57.82825.888-5.532-1.80427.69456.636R—0.9390.9360.9340.9370.9390.945模型参数T1/2Kah0.3160.1900.1610.2220.2750.891T1/2αh6.3298.0331090.8077.6574.2861.262T1/2βh6931.4726931.4728.564237.10921.64518.636V/FL·kg-11.0891.2481.3171.1391.0621.001CL/FL·(h·kg)-10.0010.0010.0080.0260.0670.070AUC(0—t)mg·(L·h)-1238.167236.012233.948247.175245.054283.785AUC(0—∞)mg·(L·h)-1275.278267.150264.425277.804273.649—Tmaxh1.6201.2601.1521.3801.4641.960Cmaxmg·L-115.18814.42313.91115.51015.63515.953
注:“—”表示无。1、1/C、1/C/C、1/C′/C′、1/C′为拟合的权重系数,AIC为赤田判据,SBC为许贝氏判据,R为相关系数。T1/2Ka为吸收相半衰期;T1/2α为分布相半衰期;T1/2β为消除相半衰期;V/F为表观分布容积;CL/F为清除率;AUC为曲线下面积;Tmax为达峰时间;Cmax为达峰浓度。下同。

表2 采用非房室模型计算氟苯尼考在花鲈血浆中的药动学参数
注:MRT为平均滞留时间;T1/2z为消除半衰期;Vz/F为表观分布容积,下标“z”表示统计矩原理计算。下同。
2.4 氟苯尼考在花鲈组织中的代谢特征
氟苯尼考在花鲈肌肉、肝和肾中的药时曲线(图3)显示,氟苯尼考在这3种组织中广泛分布,达峰浓度(Cmax)分别可至11.150、17.702和14.944 μg/g。在肝和肾中3 h即达峰值,而在肌肉中的达峰时间(Tmax)较慢(9 h)。
3种组织中的药时数据以DAS软件非房室模型进行分析(表3),结果显示,氟苯尼考在肌肉中的平均滞留时间(MRT0—t)最长,为16.263 h;清除率(CLz/F)最小,为0.073 L/(h·kg);药时曲线下面积(AUC0—t)最大,为251.259 mg/(L·h),表明48 h内氟苯尼考在肌肉中有较多分布,滞留较长。而氟苯尼考在肌肉中的半衰期(T1/2z= 12.653 h)却相对较短,这表明氟苯尼考在药时曲线的尾端消除加快。

图3 单次口灌氟苯尼考后花鲈肌肉和肝、肾中的药时曲线(n=5)Fig.3 The time-concentration curve of florfenicol in muscle, liver and kidney ofLateolabrax japonicus after single oral dose
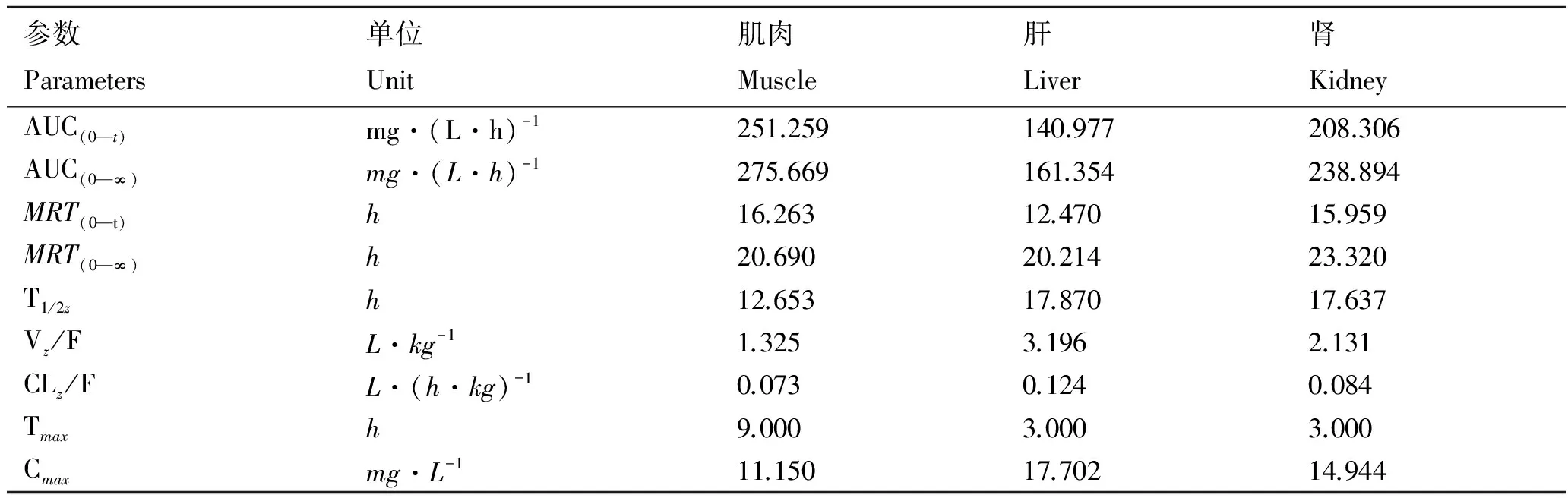
参数Parameters单位Unit肌肉Muscle肝Liver肾KidneyAUC(0—t)mg·(L·h)-1251.259140.977208.306AUC(0—∞)mg·(L·h)-1275.669161.354238.894MRT(0—t)h16.26312.47015.959MRT(0—∞)h20.69020.21423.320T1/2zh12.65317.87017.637Vz/FL·kg-11.3253.1962.131CLz/FL·(h·kg)-10.0730.1240.084Tmaxh9.0003.0003.000Cmaxmg·L-111.15017.70214.944
2.5 氟苯尼考的残留消除与休药期
将60 mg/kg氟苯尼考单次口灌花鲈后,检测其残留消除情况。第1天时肌肉、肝、肾和血浆中的药物含量分别为19.194、19.499、25.564和17.601 μg/mL,从第2天开始血浆和组织中药物含量迅速下降,第9天时分别为0.098、0.345、0.234和0.088 μg/mL,第15天时只有肾组织中仍可检测到0.051 μg/mL的药物残留,其后各样品中均未检出残留。药时数据以SPSS软件拟合获得残留消除方程(表4),结果显示氟苯尼考在肌肉、肝、肾和血浆中的消除速率常数(1/d)分别为0.583、0.439、0.524和0.642。根据氟苯尼考在鱼体中的最高残留限量值(MRL=1 μg/g)[34],以WT软件的回归法计算理论休药期(图4),结果表明,22 ℃水温条件下,氟苯尼考以60 mg/kg的剂量单次口灌后,在花鲈肌肉、肝、肾和血浆中的理论休药期(WDT)分别为6.54、8.69、8.30和5.89 d。
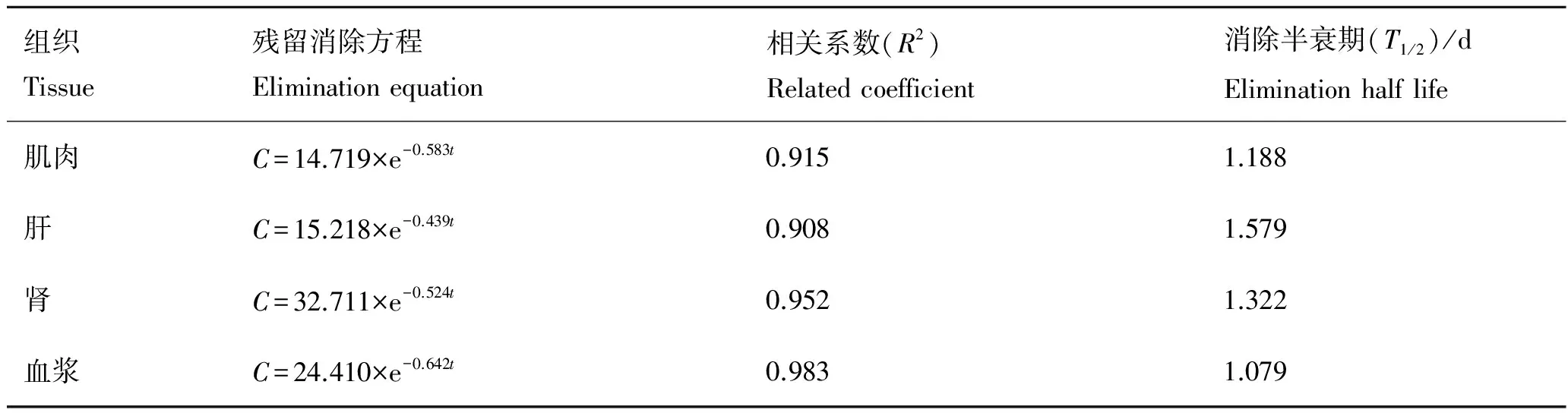
表4 氟苯尼考在花鲈各组织的消除曲线方程和参数
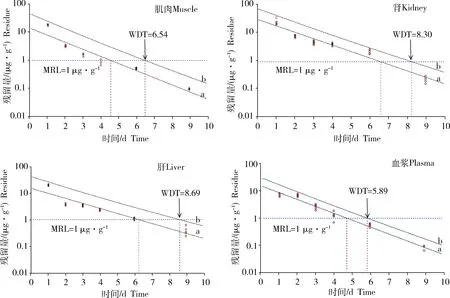
图4 氟苯尼考在花鲈各组织中的理论休药期a:拟合回归线;b:95%置信区间的上限。Fig.4 Plot of the withdrawal time calculated for florfenicol in Lateolabrax japonicusa:Linear regression line; b:Tolerance limit with 95% confidence.
3 讨论
3.1 房室模型与非房室模型
国内外药动学研究中,房室模型(compartmental analysis,CA)和非房室模型 (noncompartmental analysis,NCA)常用于药动学参数的计算[6,8,13,18-19,21,23,26-30]。CA的优点在于通过对药时数据的回归分析获得拟合曲线的方程,以此可以进行药残浓度的模拟和预测,但其缺点是非典型数据有可能出现异常参数,甚至无法成功拟合。如本研究中,氟苯尼考在肝、肾组织中的药时曲线(图3)存在二次吸收或者“双峰”的现象,这种离群数据点与房室模型拟合曲线的趋势不一致,导致拟合模型的相关系数较低。此外,使用不同的软件或者权重系数所得到的房室模型的药动学参数有时会存在极大的差异(表1),这也造成不同学者之间的研究结果在比较或互证时,部分药动学参数值(如T1/2β)可比性太差。NCA的缺点在于参数少,无法提供拟合方程进行药残预测,而实际上对于药物的评价,NCA提供的一些参数足够了,如参数V/F反映了药物在体内的分布特性,T1/2和MRT分别评价药物的消除半衰期和体内滞留时间,AUC则很好地说明了药物的暴露程度和生物利用度。NCA最大的优点还在于对非典型数据也能提供变异较小的参数值,不同软件(如DAS和WinNolin)中NCA的计算结果比较接近或基本一致(表2)。目前,在新药注册的药动学试验中,一般推荐以NCA计算药动学参数,而在研究报道中也越来越多被采用[13,20,27-30]。
3.2 氟苯尼考在花鲈体内的药动学特征
Cmax和Tmax是评价药物在动物体内吸收程度和吸收速率最直观的指标。本研究中,花鲈在22 ℃水温下,以20 mg/kg的剂量单次口灌氟苯尼考后,Cmax和Tmax分别为18.356 μg/mL和3 h(表2)。唐雪莲等[18]的研究显示氯霉素在鲈体内的Cmax和Tmax分别是21.093 μg/mL和3.961 h(24 ℃,口灌剂量为80 mg/kg);而胡琳琳等[19]的研究则表明氟甲喹在鲈体内的这两个参数值为1.809 μg/mL和4 h(25℃,口灌剂量为20 mg/kg)。研究显示花鲈对氟苯尼考和氯霉素有较好的吸收,而对氟甲喹的吸收利用程度低,这也说明了不同的药物由于化学结构和理化性质不同,在同种水产动物中的吸收存在一定的差异[25]。诸多报道中,氟苯尼考以20 mg/kg的剂量给药后,牙鲆的达峰浓度为12.18 μg/mL[20],说明花鲈对氟苯尼考的吸收相对于牙鲆更好。氟苯尼考以10~30 mg/kg的剂量给药后在水产动物中的达峰时间各不相同,如花鲈(3 h)、鲫(3.59 h)[6]、牙鲆(4 h)[20]、中华鳖(3.5 h)[10]、大西洋鳕鱼(0.5 h)[22]、西伯利亚鲟(3.59 h)[7]、罗非鱼(12 h)[23]、日本鳗鲡(12 h)和欧洲鳗鲡(12 h)[9]等动物中,在大西洋鳕鱼中吸收较快,而在罗非鱼和鳗鲡中吸收较慢;其中,花鲈、牙鲆和鳗鲡等对氟苯尼考的吸收利用程度较高。
药动学参数中的表观分布容积(V/F)反映药物在动物体内的分布情况[25]。氟苯尼考在西伯利亚鲟[7]、鲫[6]、锦鲤[24]和日本鳗鲡[9]等动物体内的V/F在2.1~3.3 L/kg之间,远大于1 L/kg,表明氟苯尼考在这些水产动物组织中的分布多于血液。而相对而言,在花鲈(1.401 L/kg)和大西洋鲑(1.12 L/kg)[21]体内的V/F则显示氟苯尼考在二者组织和血液中的分布更为均匀。
半衰期(T1/2)是个重要的药动学参数,它反映药物在动物机体中的消除速率。氟苯尼考在花鲈(表2)、罗非鱼[23]、中华鳖[10]、中国明对虾[11]、鲫[6]、日本鳗鲡和欧洲鳗鲡[9]等动物体内的T1/2在3.6~12.5 h之间,这表明氟苯尼考在大多数水产动物体内的消除较快。
3.3 给药方案和休药期建议
花鲈在养殖过程中,常见的细菌性疾病主要有皮肤溃疡病、烂尾病、烂鳃病、肠炎病和类结节病等,它们是由哈维氏弧菌(Vibrioharveyi)、点状气单胞菌(Aeromonaspunctata)、嗜水气单胞菌(A.hydrophila)或杀鱼巴斯德菌(Pasteurellapiscicda)等病原菌引起[31],氟苯尼考对常见病原菌的最小抑菌浓度(MIC)多报道为0.3~1.6 μg/mL[32-33]。抗菌药物的给药剂量是否有效取决于Cmax/MIC能否达到10[33],而本研究中氟苯尼考在花鲈血液中的Cmax为18.356 μg/mL,据此计算Cmax/MIC值在11.5~61.2之间,表明20 mg/kg的剂量对于常见的病原菌是有效的。结合半衰期T1/2z(12.508 h),建议给药方案为以20 mg/kg体重的剂量混饲口服,给药间隔为12 h,即每天2次,连续3~5 d。
药物残留消除规律的研究对于水产动物食品安全具有重要的理论参考价值。为了最大程度地保障水产品的食用安全,在残留消除研究中通常会采用常规用药剂量、多次(3~5次)给药的方式[14,18],但由于部分水产动物应激性强,在多次捕捞给药后难以健康存活至15 d或更长时间,因此有些学者也采用单次、高倍(3~5倍)剂量的给药方式[15-16],既可以避免多次应激,又充分考虑了药物的累积效应,本研究采取了第二种给药方式考察氟苯尼考在花鲈中的代谢消除规律。根据中华人民共和国农业部颁布的第235号公告中关于动物性食品中兽药最高残留限量的规定,氟苯尼考在鱼体各组织中的MRL为1 000 μg/kg[34],据此计算,22 ℃水温条件下,如果仅考虑肌肉为主要食用组织,建议休药期为7 d;如果考虑所有组织,则以消除最慢的肾为靶组织,建议休药期为9 d。
[1] Graham R, Palmer D, Pratt B C, et al.Invitroactivity of florphenicol [J]. Eur J Clin Microbiol, 1988, 7(5): 691-694.
[2] 中华人民共和国农业部.中华人民共和国农业部第1435号公告:兽药试行标准转正标准目录[S]. http://www.moa.gov.cn/zwllm/tzgg/gg/201008/t20100823_1622639.htm.
[3] 中国兽药典委员会. 中华人民共和国兽药典-兽药使用指南-化学药品卷[M]. 北京:中国农业出版社,2010.
[4] Ho S P, Hsu T Y, Chen M H, et al. Antibacterial effect of chloramphenicol, thiamphenicol and florfenicol against aquatic animal bacteria [J]. J Vet Med Sci, 2000, 62(5): 479-485.
[5] 刘海燕, 张伟, 薛敏, 等. 三聚氰胺对花鲈的急性毒性实验研究[J]. 水生生物学报, 2009,33(2):157-163.
[6] 张收元, 操继跃, 罗宇良. 氟苯尼考在鲫鱼体内的药动学力学研究[J]. 水利渔业, 2007,27(3):97-99.
[7] 王瑞雪, 王荻, 李绍戊, 等. 氟苯尼考及氟苯尼考胺在西伯利亚鲟体内的药动学及组织分布[J]. 上海海洋大学学报, 2012,21(4):568-574.
[8] 冯敬宾, 贾晓平. 2种水温条件下罗非鱼体内氟苯尼考的药物动力学比较[J]. 南方水产, 2008,4(4):49-54.
[9] 林茂, 纪荣兴, 陈政强, 等. 氟苯尼考在日本鳗鲡和欧洲鳗鲡体内的药代动力学[J]. 安徽农业科学, 2011,39(36):22341-22343.
[10] 朱丽敏, 杨先乐, 林启存, 等. 肌注和口服氟苯尼考在中华鳖体内残留分析及药代动力学[J]. 水产学报, 2006,30(4):515-519.
[11] 李静云, 李建, 王群, 等. 氟苯尼考3种不同给药方式在中国明对虾体内的药代动力学研究[J]. 福建水产, 2005,12(4):52-57.
[12] 秦方锦, 金珊, 邢晨光, 等. 氟苯尼考在大黄鱼体内的药动学及组织分布研究[J]. 水生态学杂志, 2010,3(1):102-106.
[13] 徐力文, 廖昌容, 王瑞旋, 等. 氟苯尼考在九孔鲍体内的药代动力学初步研究[J]. 台湾海峡, 2006,25(2):216-220.
[14] 刘永涛. 氟甲砜霉素体外药效及在斑点叉尾鮰体内药动学和残留研究[D]. 武汉:华中农业大学, 2007.
[15] 田丽粉. 氟苯尼考在牙鲆体内的药代动力学及残留消除规律研究[D]. 青岛:中国海洋大学, 2009.
[16] 刘秀红. 氯霉素和诺氟沙星在牙鲆体内的药代动力学及残留消除规律研究[D]. 青岛:中国海洋大学, 2003.
[17] 廖碧钗, 樊海平, 林丽聪, 等.硫酸新霉素咋奥尼罗非鱼体内的药代动力学及残留研究[J]. 福建农林大学学报, 2011,40(1):64-68.
[18] 唐雪莲, 王群,李健. 氯霉素在鲈鱼体内的药代动力学及残留的研究[J]. 海洋水产研究, 2003,24(2):45-50.
[19] 胡琳琳. 氟甲喹在眼斑拟石首鱼和鲈鱼体内的药代动力学[D]. 成都:四川农业大学, 2008.
[20] Lim J H, Kim M S, Hwang Y H, et al. Plasma and tissue depletion of florfenicol in olive flounder (Paralichthysolivaceus) after oral administration[J]. Aquaculture, 2010, 307(1):71-74.
[21] Horsberg T E, Hoff K A, Nordmo R. Pharmacokinetics of florfenicol and its metabolite florfenicol amine inAtlanticsalmon[J]. J Aquat Anim Health, 1996, 8(4): 292-301.
[22] Roiha I S, Otterlei E, Litlabo A, et al. Uptake and elimination of florfenicol in Atlantic cod (Gadusmorhua) larvae delivered orally through bioencapsulation in the brine shrimpArtemiafranciscana[J]. Aquaculture, 2010, 310(1):27-31.
[23] 冯敬宾, 贾晓平. 2种水温下罗非鱼体内氟苯尼考的药动力学比较[J]. 南方水产, 2008,4(4):49-54.
[24] Yanong R P E, Curtis E W. Pharmacokinetic studies of florfenicol in koi carp and three spot gouramiTrichogastertrichopterusafter oral and intramuscular treatment[J]. J Aquat Anim Health, 2005, 17(2):129-137.
[25] 湛嘉, 李佐卿, 康继韬, 等. 影响水产动物药代谢动力学的因素[J]. 中国兽药杂志, 2003,37(12):38-41.
[26] 陈玲珍, 杨洪生, 吴光红, 等. 给药剂量对氟苯尼考在中华绒螯蟹体内的药物代谢动力学影响[J]. 动物学杂志, 2010, 45(4):102-109.
[27] 聂晶, 高小峰, 杨立业, 等. 氟甲喹对映体在真鲷体内的药代动力学研究[J]. 浙江海洋学院学报, 2015,34(1):40-44.
[28] 邹荣婕, 徐英江, 刘京熙, 等. 乙酰甲喹在鲤鱼肌肉组织中的残留消除规律研究[J]. 中国农学通报, 2012,28(29):137-141.
[29] 林茂, 陈政强, 纪荣兴, 等. 不同温度下氟苯尼考在鳗鲡体内药代动力学的比较[J]. 上海海洋大学学报, 2013, 22(2): 225-231.
[30] Pentecost R L, Niehaus A J, Werle N A, et al. Pharmacokinetics of florfenicol after intravenous and intramuscular dosing in llamas [J]. Res Vet Sci, 2013,95(2):594-599.
[31] 张璐, 李静. 海水网箱养殖花鲈的主要病害与防治[J]. 水产养殖, 2004,25(2):28-30.
[32] 徐力文, 廖昌容, 刘广锋. 氟苯尼考用于水产养殖的安全性[J].中国水产科学, 2005,12(4):512-518.
[33] Walker R D. The use of fluoroquinolones for companion animal antimicrobial therapy [J]. Aust Vet J, 2000,78(2): 84-90.
[34] 中华人民共和国农业部. 中华人民共和国农业部第235号公告:动物性食品中兽药最高残留限量[S]. http://www.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm.
Pharmacokinetics and rules of residue elimination of florfenicol in Lateolabrax janponicus
HUANG Jujie1, LIN Mao1,2*,YAN Qingpi1, LI Zhongqin1,2, LI Jiangsen1
(1. Fisheries College, Jimei University; 2. Engineering Research Center of the Modern Technology for Eel Industry,Ministry of Education: Xiamen 361021, China)
To study pharmacokinetic of florfenicol in sea bassLateolabraxjaponicus, the concentration of florfenicol in the sample of blood, muscle, liver and kidney collected at different time following oral administration was detected by high performance liquid chromatography. For pharmacokinetics analysis, the dose was 20 mg/kg body weight and the time-concentration data in 48 h were analyzed using DAS and WinNonlin software. There were great differences in the values of compartmental pharmacokinetic parameters between the operations by different softwares or different weigh factors, especially half-life of elimination (T1/2β). Meanwhile, the values of non-compartmental parameters processed by the different software were similar. Non-compartmental parameters in plasma were offered by DAS software, such as area under the curve (AUC0—∞) of 257.591 mg/(L·h), apparent volume of distribution (Vz/F) of 1.401 L/kg, mean residence time (MRT0-∞) of 18.505 h, half-life (T1/2z) of 12.508 h, maximum concentrations (Cmax) of 18.356 μg/mL, and time toCmax(Tmax) of 3 h. For the research of residue elimination, the dose was 60 mg/kg and the data in 30 d were regressed by WT program. In theory, the calculated withdrawal time of florfenicol in muscle, liver, kidney and plasma of sea bass was 6.54, 8.69, 8.30 and 5.89 d, respectively.The result provided a scientific reference for practical applications of florfenicol in aquatic animals. [Chinese Fishery Quality and Standards, 2016, 6(3):6-13]
florfenicol;Lateolabraxjaponicus; pharmacokinetics; residue; withdrawal time
LIN Mao, linmao@jmu.edu.cn
2016-03-05;接收日期:2016-04-11
公益性行业(农业)科研专项(201203085);海洋经济发展区域示范项目(14PYY050SF03);福建省自然科学基金(2014J01131);福建省教育厅科技项目(JA15292)
黄聚杰(1988-),男,硕士,研究方向为水产动物药动学与残留检测技术,594366545@qq.com 通信作者:林茂,副教授,研究方向为水产动物病害控制,linmao@jmu.edu.cn
S948
A
文章编号:2095-1833(2016)03-0006-08

