高效液相色谱法检测乳制品的酪蛋白磷酸肽
梁艳,石丹,王艳萍
(1.内蒙古乳业技术研究院有限责任公司,呼和浩特 010110;2.内蒙古伊利集团液态奶事业部研发部,呼和浩特010110)
高效液相色谱法检测乳制品的酪蛋白磷酸肽
梁艳1,石丹1,王艳萍2
(1.内蒙古乳业技术研究院有限责任公司,呼和浩特 010110;2.内蒙古伊利集团液态奶事业部研发部,呼和浩特010110)
采用高效液相色谱法对乳制品中的酪蛋白磷酸肽(casein phosphopeptide,CPP)质量分数进行检测。样品通过提取、净化和上机测定,可以完全定性和定量分析CPP。结果表明,采用该方法可以使乳制品中的CPP得到很好的分离,且方法简单、安全,结果准确可靠,检验数据重现性好。
高效液相色谱;乳制品;酪蛋白磷酸肽
0 引言
酪蛋白磷酸肽(CPP)是以牛奶酪蛋白为原料经蛋白酶水解、分离纯化而得到的生理活性肽[1],具有结合钙和促进钙吸收的功能[2-3]。
目前国内外对原料中CPP质量分数的检测方法一般采用BaCl2—乙醇法,且乳制品中CPP的质量分数完全靠诚信添加。国内报道的乳制品中CPP的检测方法主要有毛细管区带电泳法[4-5]、液—质联用法[6]和高效液相色谱法[7]。但毛细管区带电泳法的干扰因素多、液—质联用法的检测成本高、高效液相色谱法没有CPP标准品[9]。
目前检测成品中的CPP质量分数时,要先用BaCl2—乙醇法检测原料CPP的质量分数,再以原料的添加量来推算成品中的CPP质量分数,操作步骤繁琐,耗时较长,不适于现代化生产的要求。鉴于此,本研究开发了一种操作简单,省时,结果准确的检测方法。
1 材料与方法
1.1材料与设备
酪蛋白磷酸肽。
BaCl2(分析纯),无水乙醇(色谱纯),盐酸(分析纯),硫酸(分析纯),三氯乙酸(色谱纯),甲醇(色谱纯),乙酸(色谱纯),乙腈(色谱纯)。
高效液相色谱仪。
1.2方法
1.2.1 色谱条件
色谱柱为Diamonsil C18 250×4.6 mm,5 μm;
柱温为25℃;
流动相A为质量浓度为10 g/L的乙腈甲醇溶液,流动相B为质量浓度10 g/L的乙酸水溶液;
梯度洗脱的条件为:0~25 min流动相A由0%→100%;
流速为1.00 mL/min;
进样量为20 μL,紫外检测器波长为280 nm。
1.2.2 CPP原料的纯化
(1)将CPP原料溶解后,调整pH值为4.6,定容为0.2 g/mL的CPP原料溶液,静置30 min;
(2)将上述溶液在4℃、5 000 r/min离心15 min,取上清液,加入BaCl2使其浓度为0.05 mol/L,混匀后,得到一含有BaCl2的CPP原料溶液;
(3)以上述含有BaCl2的CPP原料溶液:无水乙醇=1∶2的体积比,在上述含有BaCl2的CPP原料溶液中加入无水乙醇,混匀后,在4℃静置12~16 h;
(4)将上述静置后的溶液在4℃、5 000 r/min离心15 min,弃去上清液,以上述含有BaCl2的CPP原料溶液∶H2SO4=1∶0.4的体积比,在沉淀中浓度为0.125 M的H2SO4,用滤纸过滤;
(5)取上清液在60~70℃烘干60 min,之后在105℃烘干至恒重,得到纯化的CPP原料。
1.2.3 标准曲线的绘制
将上述纯化的CPP原料用超纯水制备质量浓度为0.1,0.5,1,5,10,20 mg(每100 mL中)的系列标准工作液,采用高效液相色谱仪对该系列标准工作液进行检测分析,绘制标准曲线。
1.2.4 样品前处理
(1)提取。当样品为液态乳制品时:称取20 g样品,用质量浓度为10 g/L的三氯乙酸(质量浓度10 g/L的三氯乙酸水溶液)定容至50 mL,超声10 min,静置过滤得待净化液。
当样品为固态乳制品时:称取5 g样品,用质量浓度为10 g/L的三氯乙酸溶解后定容至50 mL,超声10 min,静置过滤得待净化液。
(2)净化。将固相萃取柱依次用3 mL甲醇、3 mL水活化,取适当体积的待净化液转移至固相萃取柱中,依次用3 mL水和3 mL甲醇洗涤,弃去淋洗液后用6 mL氨化甲醇洗脱至10 mL具塞试管中,整个固相萃取过程流速不超过1 mL/min,将洗脱液于50℃下用氮气吹干,得到残留物;将吹干后得到的残留物用适当体积流动相A定容,过微孔滤膜后,将得到的上清液采用高效液相色谱仪进行检测。
1.3样品中CPP质量分数的计算
样品中CPP质量分数(mg/100g)=[CPP上机质量浓度(mg/100 mL)×50 mL]/样品质量(g)。
2 结果与分析
2.1样品纯化方法的确定
采用不同的样品纯化方法进行了实验,结果如图1所示。由图1可以看出,在没有经过固相萃取纯化的样品的高效液相色谱图(a)上在标志峰附近也有峰出现,而经过固相萃取纯化的样品的高效液相色谱图(b)上则少了很多干扰峰,尤其在标志峰不明显的情况下,干扰峰对测试结果存在极为严重的影响,因此,采用固相萃取对待测样品进行纯化可以有效减少样品中的其他物质对检测造成的干扰,进而提高检测的准确度。
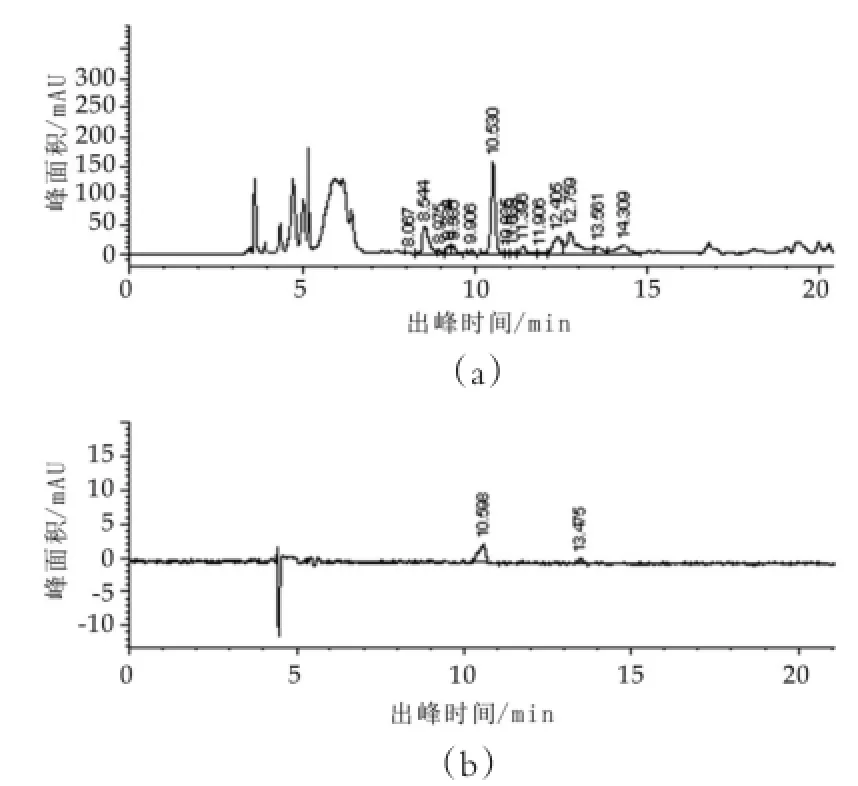
图1 不同前处理得到的样品的色谱
2.2方法的精密度
本研究共进行了10次精密度实验。分别在液奶和奶粉中添加了质量分数为0.50 mg/100 g和120.0 mg/100 g的CPP,检测的平均值分别为0.49 mg/100 g和119.6 mg/100 g,相对偏差分别为3.68%和1.89%。由表1可知,采用这种方法测定乳制品中的CPP质量分数具有很好的稳定性。方法的回收率如表2所示。
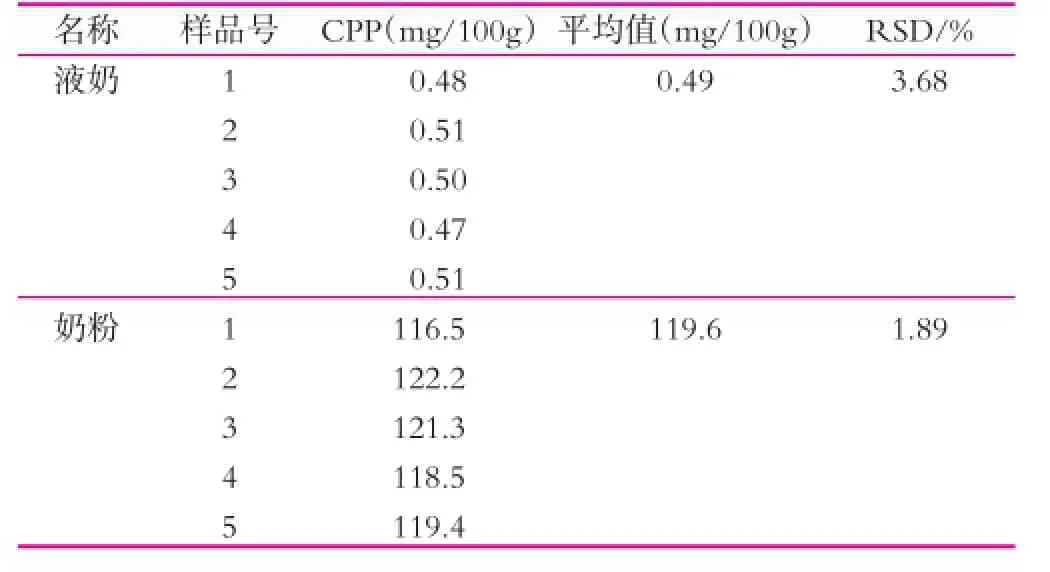
表1 乳制品的精密度试验结果

表2 乳制品的回收率实验结果
本研究对液奶和奶粉中的CPP的回收率进行了测定。在液奶和奶粉样品中分别加入一定量的CPP,按1.3.4的方法进行样品前处理,1.3.1所述的色谱条件进行测定,测得液奶中CPP的加标回收率为96%,奶粉中CPP的加标回收率为97.1%,均有较好的结果。
3 结论
本方法将纯化后的CPP原料作为标准品,以保留时间定性,外标法定量,进行了乳制品中CPP质量分数的高效液相色谱测定法。采用该方法使乳制品中的CPP得到很好地分离,且能够准确定量测定强化了CPP的乳制品中CPP的质量分数。该方法前处理简单,实验条件准确可靠,不仅可以用来测定乳制品的CPP质量分数,而且对分析乳制品中所含的其他蛋白类物质的分析测定也具有一定的指导意义。
[1]冯凤琴,王博诚,倪莉,等.酪蛋白磷酸肽(CPP)分离纯化及分子结构的鉴定[J].无锡轻工大学学报,1999,18(4):33-37.
[2]冯凤琴,王博诚,许时婴,等.酪蛋白磷酸肽对切除卵巢后老龄雌性大鼠骨密度的影响[J].营养学报,2003,25(1):98-100.
[3]陈亚非,陈金星,朱韶娟,等.酪蛋白磷酸肽促进人体钙吸收的作用研究[J].食品科学,2002,23(4):130-132.
[4]牟光庆,张丽萍,王立民,等.毛细管区带电泳测定酪蛋白磷酸肽方法的研究[J].中国食品学报,2002,2(2):21-24.
[5]林嵘,周杏琴.毛细管电泳在HPLV制备分离酪蛋白磷酸肽中的应用。国外分析仪器,2000,(3):41-43.
[6]赖奕坚,陈闽军,刘玉敏,等.LC-MS法测定钙片中酪蛋白磷酸肽含量[J].食品科学,2006,27(12):672-674.
[7]冯凤琴,陈闽军,杜永盛,等.高效液相色谱法测定奶粉中酪蛋白磷酸肽(CPP)含量[J].中国食品学报,2006,6(3):128-131.
[8]庞广昌,朱文欣,陈庆森.酪蛋白磷酸肽(CPPs)测定方法的研究[J].食品科学,2001,22(5):49-52.
[9]王玉莹,陈锡威,冯风琴,等.酪蛋白磷酸肽的研究进展[J].食品工业,2014,35(5):204-208.
Determination of casein phosphopeptide in dairy products by high performance liquid chromatography
LIANG Yan1,SHI Dan1,WANG Yan-ping2
(1.Inner Mongolia Research Institute of dairy technology C.,Ltd,Hohhot 010100,China;2.Inner Mongolia Yili Industri⁃al Group Co.,Ltd.liquid milk Business Unit research&development department,Hohhot 010100,China)
A high performance liquid chromatography(HPLC)method was developed and applied to determine casein phosphopeptide(CPP)in dairy products.Extraction and purification from samples were made before HPLC analysis.Excellent separation of CPP was achieved.The developed method proved to be simple,safe,accurate,reliable and reproducible.
high performance liquid chromatography(HPLC);dairy products;casein phosphopeptide(CPP)
TS252.7
A
1001-2230(2016)09-0056-02
2016-01-12
梁艳(1982-),女,工程师,研究方向为乳品开发。

