分枝杆菌在疾病防治中应用的研究进展①
管清华 刘文贤 钱爱东
(吉林农业大学动物科学技术学院,长春130118)
分枝杆菌在疾病防治中应用的研究进展①
管清华 刘文贤 钱爱东
(吉林农业大学动物科学技术学院,长春130118)
分枝杆菌归于古老的放线菌目,含分枝菌酸,分布于包括水和土壤在内的各种生境,大多数成员可独立生活,一般为无害的腐生菌,但也有一部分种类是病原菌。目前将已报道的分枝杆菌分为结核分枝杆菌复合群(M.tuberculosiscomplex,MTC)、非结核分枝杆菌(Nontuberculosis mycobacteria,NTM)和麻风分枝杆菌。因为分枝杆菌含有糖脂、N-羟乙酰基胞壁酰二肽(N-glycolyl muramyl dipeptide,N-glycolyl MDP)[1]、未甲基化寡聚脱氧核苷酸等能调节哺乳动物免疫的活性成分,一些研究者将卡介苗和几种非结核分枝杆菌用于结核病或癌症等疾病的治疗中,并取得了良好的效果。
1 卡介苗
世界范围内已接种卡介苗(Bacillus calmette-Guérin,BCG) 的人超过十亿,此疫苗预防婴儿和儿童的结核性脑膜炎和粟粒性结核病效果显著[2];同时,作为免疫调节剂被应用于膀胱癌、肺癌、乳腺癌等多种疾病的治疗已有40年的历史,最近研究也发现针对非肌肉侵袭性膀胱癌(Non-muscle-invasive bladder cancer,NMIBC),三周的持续治疗效果更好[3]。但由于卡介苗是减毒的牛结核分枝杆菌活疫苗,会产生高热、关节炎、全身不适等症状,大约8%的病人不得不停止治疗[4,5];同时,BCG还能引起HIV阳性婴儿严重的播散性感染,进一步限制了其在肺结核患病率较高地区的应用[6],所以人们将研究重点逐渐转向其有效成分及非结核分枝杆菌的开发应用。
卡介苗多糖核酸(Polysaccharide nucleic acid fraction of BCG,BCG-PSN)是主要的卡介苗衍生制剂,该物质是将培养的BCG用热酚法提取而制备。Li等[7]用BCG-PSN刺激分离自慢性荨麻疹(CIU)病人的淋巴细胞,以健康捐赠者的细胞做对照,免疫组化和ELISA检测IL-2 和 IL-10的分泌量,结果发现CIU病人IL-2的分泌明显低于健康对照者,但随着 BCG-PSN应用浓度的增加,IL-2的分泌逐渐增多;CIU病人IL-10的产量较对照组高,随着BCG-PSN应用浓度的增加,IL-10的分泌逐渐减少,说明BCG-PSN可促进CIU病人的康复。Xu等[8]应用DEAE-52和Sephadex G-200从BCG-PSN中获得了分子量为2.10×104Da的水溶性葡聚糖 BCG-PASW,用气相色谱、红外光谱、1D 和 2D核磁共振光谱技术检测,发现BCG-PASW是一种α-D-葡聚糖,可能的结构见图1。经MTS法分析,它的抗肿瘤活性被硫化物替代率为0.59,可明显抑制C666-1鼻咽癌细胞生长,推测硫化物成分在其生物活性中扮演决定性角色。
2 母牛分枝杆菌
母牛分枝杆菌(M.Vaccae)是一种见光产色素的快生长腐生无致病性NTM。热灭活母牛分枝杆菌的商品名为微卡,是双向免疫调节制剂,国内某公司的该产品已于2012年获得国家药监局“药物临床试验批件”;Butov等[9]的研究也表明,热灭活的母牛分枝杆菌是安全的,可以缩短结核病化学药物治疗的进程,提高治疗效率。Dlugovitzky等[10]应用微卡治疗结核病患者,发现其可通过增强Th1免疫并下调造成组织损伤的Th2免疫而发挥治疗作用,加快临床症状改善,尤其是治疗6个月以上时,痰菌阴转率与对照组差异显著;Yang等[11]的meta分析也证明了这一点。另外,有研究表明,母牛分枝杆菌细胞壁的骨架成分较完整的热灭活菌体有更好的免疫效果[12,13]。Stanford等[14]的研究表明,用母牛分枝杆菌(SRL172)辅助治疗腺瘤可使患者的存活时间平均延长135天,而对鳞状上皮癌患者治疗作用不明显。
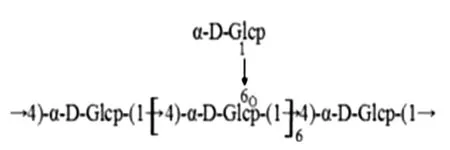
图1 BCG-PASW的可能结构Fig.1 Possible structure of BCG-PSAW
3 草分枝杆菌
草分枝杆菌(M.phlei)是快生长的腐生罕见致病性NTM。灭活该菌制备的制剂,商品名为乌体林斯。Ming等[15]对患有中度、持续性哮喘的儿童吸入灭活草分枝杆菌治疗,结果发现其改善了肺功能,降低支气管高反应性和血清的总IgE,与平喘药舒利迭的作用相近。Morales等[16]的研究表明,对于那些拒绝或不适宜进行膀胱切除术的膀胱癌患者尤其是仅为乳头瘤感染及BCG治疗后复发的患者,草分枝杆菌细胞壁核酸复合物(Mycobacteriumphleicell wall-nucleic acid complex,MCNA)治疗后的1、2年无病生存率分别为35.1%和 32.2%。
草分枝杆菌制剂不仅在防治人类相关疾病中有很好的效果,也引起了动物医学研究者的关注。刘安石等[17]在猪日粮中添加0.1%、0.2%和0.5%的草分枝杆菌,血清抗体检测结果显示与未添加草分枝杆菌的对照组相比,添加0.2%及以上草分枝杆菌组猪繁殖与呼吸综合征抗体水平更高,说明其可调节动物的体液免疫应答。
4 耻垢分枝杆菌
Borrero等[18]用含有耻垢分枝杆菌(M.Smegm-atis)糖脂成分的脂质体免疫BALB/c小鼠,诱导鼠产生特异性的IgG抗体能识别MTB的表面抗原,证实了耻垢分枝杆菌有免疫原性糖脂的存在,推测其可能会提高抗结核亚单位疫苗的保护作用。Maria等[19]制备了耻垢分枝杆菌的脂类制剂,评价了其保护BALB/c鼠抗结核杆菌H37Rv感染的能力,结果,加入明矾佐剂或不加佐剂的该制剂均能明显降低荷菌量,肺炎区域也比对照PBS组小,与BCG有同样的保护效果,推测其可以作为抗结核的疫苗候选者。
重组耻垢分枝杆菌活疫苗用于治疗结核病主要是促进T细胞分泌细胞因子,增加单核巨噬细胞产生H2O2和NO的能力;激活局部NK细胞的活性,诱导Th1优势应答,同时抑制Th2类细胞因子,增强机体免疫能力从而有助于机体快速杀灭病原菌[20]。Ana等[21]将含有结核杆菌Ag85c、MPT51、HspX (CMX)基因的部分序列的质粒转化入耻垢分枝杆菌中,构建了重组菌mc2-CMX,用小鼠感染模型检测了mc2-CMX的效果,结果,该菌诱导机体产生了针对CMX的特异性IgG1或IgG2a,能使体外培养的肺和脾来源的CD4+和CD8+T细胞产生IFN-γ、IL-17、TNF-α、IL-2,在鼠体内也产生了有效的免疫应答,接种mc2-CMX菌的小鼠产生了针对结核杆菌的良好保护作用,效果好于野生耻垢分枝杆菌和BCG。为了增加CMX抗原的安全性和免疫原性,作者对重组菌株进行免疫杀伤逃避(Immune killing evasion,IKE)处理,结果发现,处理后的重组菌株 IKE-CMX较mc2-CMX能诱导更好的保护性应答。另外,耻垢分枝杆菌还为研究分枝杆菌的生物学特点和致病机制以及发展新的诊断和治疗制剂提供了有效的表达平台[22],也广泛用于分枝杆菌感染模型[23]。
5 大府分枝杆菌
近几年大府分枝杆菌(M.Obuense)作为抗癌的免疫治疗剂而被关注,在治疗黑色素瘤中表现出了安全性和良好的耐受性[24],该功能由1型髓样DCs释放细胞因子提高γδT细胞的活性而实现[25]。最近的研究表明,3 μg/ml热灭活的大府分枝杆菌刺激的健康志愿者外周血细胞有明显的特异性增殖应答;300 μg/L的大府分枝杆菌刺激3 h的单核细胞分泌的CD18、CD54、CD45、CD80、HLA-DP,DQ,DR、CD206、CD11b、CD11c、CD35、CD132以及中性粒细胞的CD45、CD11b、CD35等表面受体的表达均明显上调[26]。
6 Mycobacterium indicus pranii
Mycobacteriumindicuspranii(MIP)曾被称为Mycobacterium w (M.w),Jaya 等[27]在2011年发现,皮下注射1×107CFU的M.w能辅助化学治疗药物显著降低实验用BALB/c鼠的肺、脾中结核杆菌的载量。2012年,Gupta等[28]用MIP经气溶胶途径免疫豚鼠,检测豚鼠肺部的免疫应答,发现与BCG免疫组相比,MIP免疫组荷菌量更少,病理学和组织肉芽肿反应得以改善,说明MIP免疫的豚鼠获得了更高的Th1型免疫应答,MIP免疫豚鼠的肉芽肿和肺部细胞悬液也表现出了更高的抗原递呈细胞的功能;研究同时表明,MIP也会快速从体内被清除而不引起不良反应。Pawan等[29]的进一步研究表明,与BCG相比,MIP刺激的巨噬细胞能产生更多的TNF-α和IL-12p40、IL-6和NO,共刺激分子CD40、CD80和CD86的表达量也明显上调;而对于MyD88缺陷型的巨噬细胞,MIP和BCG刺激均缺少这种应答。MIP刺激过的巨噬细胞MyD88信号通路中NF-κB/AP-1的活性也更高。此外,MIP作为激活剂激活HEK293细胞表达的以同型二聚体或异型二聚体形式存在的TLR2 的活性也高于BCG;进一步的试验表明,MIP暴露TLR2配体的能力也较BCG更强,表明MIP较BCG有更高的激活巨噬细胞的潜能。
7 Mycobacterium habana
Mycobacteriumhabana(M.habana)于1971年分离自古巴地区,之后被证明在分枝杆菌感染中具有保护能力。2012年Valdés[30]发现,给BALB/c小鼠皮下接种M.habanaTMC-5135株,用Ag85b或培养滤液抗原(CFA)刺激肺、脾、淋巴结细胞,发现该组小鼠细胞悬液中产生的IFN-γ多于BCG接种组。2014年Valdés等[31]又研究了3株M.habana菌的毒力、免疫原性和效力。经气管给BALB/c小鼠接种高剂量的 TMC 5135 或 IPK-337时,实验鼠100%存活,但有一定的组织损伤,而 IPK-220株的毒力略高于二者。然后作者将2株菌经皮下接种裸鼠,并与BCG比较,发现TMC5135株免疫的裸鼠较BCG组存活时间更长,用H37Rv株攻毒后4个月,TMC5135株和BCG接种组全部小鼠存活,IPK-337接种小鼠有60%存活。说明M.habana虽然不能阻止小鼠感染结核菌,但可以避免实验性疾病的进程,而菌株TMC5135对机体保护水平与BCG相近。
8 结语
结核病已困扰人类上千年,现今依然是严重的公共卫生问题,耐多药结核病的出现又增加了该病的治疗难度;同时,一些非结核分枝杆菌感染人、动物的报道也日渐增多;癌症更是人类健康的杀手。本文所述几种分枝杆菌的研究与开发应用为人类通过生物手段防控分枝杆菌病和癌症提供了非常好的借鉴和思路。针对分枝杆菌双向调节的免疫机制,有研究者提出训练的(先天性)免疫[Trained (innate) immunity,TI)]这一术语,此免疫可以被各种刺激诱导,分枝杆菌接种试验使机体获得的非特异性保护作用也许是由于TI,使先天性免疫细胞中的单核细胞和巨噬细胞被训练;该文作者还发现BCG经过NOD2传递信号诱导遗传外重新编程,尤其是组蛋白H3K4的三甲基化,这些表观遗传变异导致细胞激活,促进细胞因子的产生,使细胞代谢从氧化磷酸化向有氧酵解状态转变[32]。分枝杆菌的N-羟乙酰基MDP可通过NOD2 活化激酶RIP2,然后由泛素(Ub)激活NF-κB 和IRF-5,以引起编码炎症和Ⅰ型干扰素的基因表达,介导先天性和获得性免疫,而NOD2对N-羟乙酰基MDP极敏感,此作用较其他细菌,如单核细胞增生性李斯特菌含有的N-乙酰基 MDP对机体的保护作用更有效。可见随着对此类问题的深入研究,其作用机制也会越来越明了,给其应用提供更好的依据,使分枝杆菌更多地应用于疾病的防治中。
[1] Behr MA,Divangahi M.Freund′s adjuvant,NOD2 and mycobacteria[J].Curr Opin Microbiol,2015,23(2):126-132.
[2] Taniguchi K,Takii T,Yamamoto S,etal.Reactivation of immune responses against Mycobacterium tuberculosis by boosting with the CpG oligomer in aged mice primarily vaccinated with Mycobacterium bovis BCG[J].Immun Ageing,2013,25(10):1-6.
[3] Kamat AM,Flaig TW,Grossman HB,etal.Expert consensus document:Consensus statement on best practice management regarding the use of intravesical immunotherapy with BCG for bladder cancer[J].Nat Rev Urol,2015,12(4):225-235.
[4] Bernini L,Manzini CU,Giuggioli D,etal.Reactive arthritis induced by intravesical BCG therapy for bladder cancer:our clinical experience and systematic review of the literature[J].Autoimmun Rev,2013,12(12):1150-1159.
[5] Decaestecker K,Oosterlinck W.Managing the adverse events of intravesical bacillus Calmette-Guérin therapy[J].Res Rep Urol,2015,7:157-163.
[6] Hesseling AC,Marais BJ,Gie RP,etal.The risk of disseminated bacille Calmette-Guerin (BCG) disease in HIV infected children[J].Vaccine,2007,25:14-18.
[7] Li N,Cao N,Niu YD,etal.Effects of the polysaccharide nucleic acid fraction of bacillus Calmette-Guérin on the production of interleukin-2 and interleukin-10 in the peripheral blood lymphocytes of patients with chronic idiopathic urticaria[J].Biomed Rep,2013,1(5):713-718.
[8] Xu X, Gu Z, Liu S,etal.Purification and characterization of a glucan from Bacillus Calmette Guerin and the antitumor activity of its sulfated derivative[J].Carbohydr Polym,2015, 128(9):138-146.
[9] Butov DA,Efremenko YV,Prihoda ND,etal.Randomized,placebo-controlled Phase II trial of heat-killed Mycobacterium vaccae (Immodulon batch) formulated as an oral pill (V7)[J].Immunotherapy,2013,5(10):1047-1054.
[10] Dlugovitzky D,Stanford C,Stanford J.Immunological basis for the introduction of immunotherapy with Mycobacterium vaccae into the routine treatment of TB[J].Immunotherapy,2011,3(4):557-568.
[11] Yang XY,Chen QF,Li YP,etal.Mycobacterium vaccae as adjuvant therapy to anti-tuberculosis chemotherapy in never-treated tuberculosis patients:a meta-analysis[J].PLoS One,2011,6(9):e23826.
[12] Stanford JL,Stanford CA,O′Brien ME,etal.Successful immunotherapy with Mycobacterium vaccae in the treatment of adenocarcinoma of the lung [J].Eur J Cancer,2008,44(2):224-227.
[13] Rodriguez-Guell E,Agusti G,Corominas M,etal.Mice with pulmonary tuberculosis treated with Mycobacterium vaccae develop strikingly enhanced recall gamma interferon responses to M.vaccae cell wall skeleton[J].Clin Vaccine Immunol,2008,15:893-896.
[14] Rodriguez-Guell E,Agusti G,Corominas M,etal.Impaired gamma interferon response to Mycobacterium vaccae antigens in patients with cavitary pulmonary tuberculosis[J].Clin Vaccine Immunol,2008,15(9):1485-1488.
[15] Ming M,Li C,Luo Z,etal.Effect of inhaled inactivated Mycobacterium phlei in children with moderate asthma[J].Immunotherapy,2013,5(2):191-197.
[16] Morales A,Herr H,Steinberg G,etal.Efficacy and safety of MCNA in patients with nonmuscle invasive bladder cancer at high risk for recurrence and progression after failed treatment with bacillus Calmette-Guérin[J].J Urol,2015,193(4):1135-1143.
[17] 刘安石,钟兰兰,杨 亚,等.草分枝杆菌对猪繁殖与呼吸综合征免疫抗体水平的影响[J].中国兽医杂志,2013,49(5):42-44.
[18] Borrero R,García ML,Canet L,etal.Evaluation of the humoral immune response and cross reactivity against Mycobacterium tuberculosis of mice immunized with liposomes containing glycolipids of Mycobacterium smegmatis[J].BMC Immunol,2013,14(1):S13.
[19] García Mde L,Borrero R,Lanio ME,etal.Protective effect of a lipid-based preparation from mycobacterium smegmatis in a murine model of progressive pulmonary tuberculosis[J].Biomed Res Int,2014,273129:1-6.
[20] Faludi I,Szabo AM,Burian K,etal.Recombinant Mycobacterium smegmatis vaccine candidates[J].Acta Microbiol Immunol Hung,2011,58(1):13-22.
[21] Junqueira-Kipnis AP,de Oliveira FM,Trentini MM,etal.Prime-boost with mycobacterium smegmatis recombinant vaccine improves protection in mice infected with mycobacterium tuberculosis[J].PLoS One,2013,8(11):e78639.
[22] Bashiri G,Baker EN.Production of recombinant proteins in Mycobacterium smegmatis for structural and functional studies[J].Protein Sci,2015,24(1):1-10.
[23] Fujiwara N,Ohara N,Ogawa M,etal.Glycopeptidolipid of Mycobacterium smegmatis J15cs affects morphology and survival in host cells[J].PLoS One,2015,10(5):e0126813.
[24] Stebbing J,Dalgleish A,Gifford-Moore A,etal.An intra-patient placebo-controlled phase I trial to evaluate the safety and tolerability of intradermal IMM-101 in melanoma[J].Ann Oncol,2012,23(5):1314-1319.
[25] Fowler DW,Copier J,Wilson N,etal.Mycobacteria activate gammadelta T-cell anti-tumour responses via cytokines from type 1 myeloid dendritic cells:a mechanism of action for cancerimmunotherapy[J].Cancer Immunol,2012,61(4):535-547.
[26] Samer B,Helmout M,Satvinder M,etal.Analysis of the immunomodulatory properties of two heat-killed mycobacterial preparations in a human whole blood model[J].Immunobiology,2015,220(12):1293-1304.
[27] Jaya F,Pushpa G,Mohan N,etal.Mycobacterium indicus pranii as stand-alone or adjunct immunotherapeutic in treatment of experimental animal tuberculosis[J].Indian J Med Res,2011,134(5):696-703.
[28] Gupta A,Ahmad FJ,Ahmad F,etal.Protective efficacy of Mycobacterium indicus pranii against tuberculosis and underlying local lung immune responses in guinea pig model[J].Vaccine,2012,30(43):6198-6209.
[29] Pawan K,Rohit T,Gobardhan D,etal.Mycobacterium indicus pranii and Mycobacterium bovis BCG lead to differential macrophage activation in Toll-like receptor-dependent manner[J].Immunology,2014,143(2):258-268.
[30] Valdés HI,Montoro Cardoso CE,Hernández-Pando R.In vitro interferon gamma production in mice vaccinated with′Mycob-acterium habana′ against Mycobacterium tuberculosis antigens[J].Rev Cubana Med Trop,2012,64(3):279-289.
[31] Valdés HI,Montoro E,Mata-Espinoza D,etal.Immunogenicity and protection conferred by Mycobacterium habana in a murine model of pulmonary tuberculosis[J].Tuberculosis,2014, 94(1):65-72.
[32] van der Meer JW,Joosten LA,Riksen N,etal.Trained immunity:A smart way to enhance innate immune defence[J].Mol Immunol,2015,68(1):40-44.
[收稿2015-12-24 修回2016-01-17]
(编辑 许四平)
10.3969/j.issn.1000-484X.2016.12.027
①本文受国家自然科学基金(No. 31272566)和吉林省科技发展计划项目(20140204069NY)资助。
管清华(1970年-),男,硕士,副教授,主要从事非结核分枝杆菌相关研究,E-mail:guanqinghua2000@126.com。
及指导教师:钱爱东(1960年-),男,博士,教授,博士生导师,主要从事动物微生物与分子、免疫学的研究,E-mail:qianaidong0115@163.com。
Q939.93
A
1000-484X(2016)12-1846-04

