γ-促分泌酶抑制剂对毛细支气管炎模型大鼠体内Th17细胞分化的影响①
王海英 刘良宵 吴福玲 高 萌
(滨州医学院,烟台264003)
γ-促分泌酶抑制剂对毛细支气管炎模型大鼠体内Th17细胞分化的影响①
王海英 刘良宵 吴福玲 高 萌
(滨州医学院,烟台264003)
目的:研究γ-促分泌酶抑制剂阻断Notch信号对毛细支气管炎(简称毛支)模型大鼠Th17细胞发育和分化的影响,为毛支治疗寻找新的药物提供理论基础。方法:按随机对照原则将SD大鼠分为正常组、毛支组和γ-促分泌酶抑制剂组,滴鼻法成功建立毛支模型,而后尾静脉注射γ-促分泌酶抑制剂MW167,通过HE染色观察肺组织病理改变,ELISA检测血浆中白介素17(IL-17)的水平,实时荧光定量PCR检测肺组织和外周血单个核细胞中RORγt mRNA的表达,Western blot检测肺组织中Notch信号、RORγt的蛋白表达。结果:与毛支组相比,MW167组肺组织病理学改变减轻;血浆IL-17水平也较毛支组降低;肺组织及外周血单个核细胞RORγt mRNA在MW167注射组表达均减弱;MW167组肺组织Notch信号和RORγt蛋白的表达也显著降低。结论:静脉注射γ-促分泌酶抑制剂能够通过阻断Notch信号通路抑制Th17细胞的分化,缓解毛支模型大鼠的气道炎症,对毛支有潜在的治疗价值。
毛细支气管炎;Notch;γ-促分泌酶抑制剂;Th17细胞
毛细支气管炎是一种常见于婴幼儿的下呼吸道感染性疾病,多发于冬季,其最主要病原体为呼吸道合胞病毒(Respiratory syncytial virus,RSV),病毒侵入人体后会诱发T细胞性免疫应答,大量实验证明在毛支炎症过程中除了Th1/Th2细胞应答失衡外,Th17细胞反应在其发病过程中也占有重要地位[1,2]。Notch信号通路是普遍存在于从无脊椎动物到哺乳动物的高度保守的信号序列,能够调节T细胞的分化及发育[3]。有研究证明Notch信号通路阻断剂不仅可以调节Th1和Th2免疫应答减轻肺部炎症反应,还可能通过调节Th17反应影响炎症过程[4]。本实验通过向毛支模型大鼠体内注射γ-分泌酶抑制剂(γ-secretase inhibitor,GSI)阻断Notch信号,研究Notch信号对Th17细胞分化及发育的影响,探讨改善毛支症状的新方法,为毛支治疗寻找新的药物提供理论基础。
1 材料与方法
1.1 材料 健康雄性SD大鼠24只,7周龄,购自青岛派特福德白鼠养殖专业合作社;RSV病毒,由山东省病毒研究所馈赠;γ-促分泌酶抑制剂Ⅱ(MW167)为德国默克密理博公司产品;白细胞介素17(Interleukin,IL-17)ELISA试剂盒购自朗顿公司;TRIzol、cDNA试剂盒及SYBR Green荧光试剂盒为TaKaRa公司产品,引物购自上海生工公司;兔抗大鼠RORγt多克隆抗体购自Abcam公司。
1.2 方法
1.2.1 制备RSV悬液 将RSV病毒滴入长满单层Hela细胞的培养瓶,吸附1 h,然后加入含2%胎牛血清的细胞维持液,放入培养箱。显微镜下观察细胞的病变情况,待病变达100%时收获病毒,用力震荡培养瓶,使细胞从瓶壁脱落,而后反复冻融3次,离心,收集含RSV的上清液。计算半数组织培养感染量(50% tissue culture infective dose,TICD50),并稀释至5×104TICD50/0.1 ml。
1.2.2 动物分组和模型制备 将24只大鼠随机分为3组,分别为正常对照组、毛支组、γ-分泌酶抑制剂组,每组8只。毛支动物模型制备,将病毒按照0.4 μl/g滴入毛支组和γ-分泌酶抑制剂组大鼠两侧鼻孔,正常组以相同的量滴入细胞培养液。毛支模型制备完成后,将MW167按1 mg/kg的体质量尾静脉注射到γ-分泌酶抑制剂组大鼠体内,间隔48 h至1周,即分别于第1、3、5、7天注射,剩余两组用PBS代替MW167进行尾静脉注射。
1.2.3 外周血单个核细胞(Peripheral blood mono-nuclear cell,PBMC)的收集 于末次药物注射2 d后,麻醉大鼠,暴露腹腔,轻轻分离出腹主动脉,抗凝取血。将收集的血液按照大鼠外周血淋巴细胞分离液试剂盒所提供方法提取PBMC。
1.2.4 肺组织病理观察 暴露大鼠胸腔,用PBS灌洗肺组织,然后将一叶肺置于40 g/L多聚甲醛中固定,制成石蜡切片,行HE染色,观察肺组织病理学变化。
1.2.5 实时定量PCR检测肺组织中RORγt mRNA的水平 用Trizol法提取肺组织中总RNA。按照TaKaRa反转录试剂盒方法进行逆转录。采用SYB Green实时荧光定量PCR检测基因表达,大鼠的GAPDH作为内参基因,大鼠RORγt上游引物为5′-CCTCCTGCCACCTTGAGTAT-3′,下游引物为5′-TCTGAGCCCTGTTCT-3′,产物长度130 bp,按照TaKaRa的SYBR Green 荧光PCR试剂盒说明进行扩增,反应体系如下:2×SYBR Premix Ex Taq聚合酶10 μl、上游引物0.4 μl、下游引物0.4 μl、cDNA 2 μl、50×ROX Reference Dye 0.4 μl、无核酸酶水6.8 μl。反应条件:95℃ 30 s,95℃ 5 s,60℃ 20 s,50个循环。反应结束设定最佳阈值线,设正常对照组基因表达为1,获得其他各组基因表达的相对值。
1.2.6 ELISA检测血浆中IL-17的水平 大鼠腹主动脉取血,抗凝处理后离心,取上血浆层,采用酶联免疫吸附法检测血浆中IL-17的水平。
1.2.7 Western blot法检测肺组织中RORγt的表达 将肺组织用蛋白裂解液裂解,提取总蛋白,用BCA法测定蛋白浓度,上样量为60 μg。SDS-聚丙烯酰胺凝胶电泳分离蛋白并转移到PVDF膜上;然后脱脂奶粉封闭2 h;兔抗大鼠RORγt多克隆抗体(1∶500),4℃封闭过夜;辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000),室温孵育1 h;DAB法显色。用电泳凝胶成像分析仪采集结果。
1.3 统计学分析 采用SPSS17.0对数据进行统计分析,多组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠症状、体征观察 毛支组大鼠在接种病毒后出现轻微卡他性鼻炎,口唇发绀,活动度减弱等表现。MW167组大鼠的上述表现减轻。正常对照组大鼠无异常表现。
2.2 肺组织形态学分析 比较3组大鼠肺组织HE病理切片。与正常组相比,毛支组大鼠肺组织炎症明显,炎细胞在支气管及血管周围广泛浸润,支气管黏膜增厚,管腔狭窄,说明毛支模型制备成功。与毛支组相比,MW167组的炎症表现显著减轻,炎细胞浸润程度显著减少,黏膜增厚不明显,肺泡腔内偶有炎细胞,说明MW167有缓解毛支病理变化的作用。见图1。
2.3 大鼠肺组织和PBMC中RORγt mRNA的表达 与正常组相比,毛支组和 MW167 组大鼠的肺组织和PBMC中RORγt mRNA表达均增高,差异有统计学意义,P<0.01;MW167组较毛支组表达降低,差异有统计学意义,P<0.01。见图2。
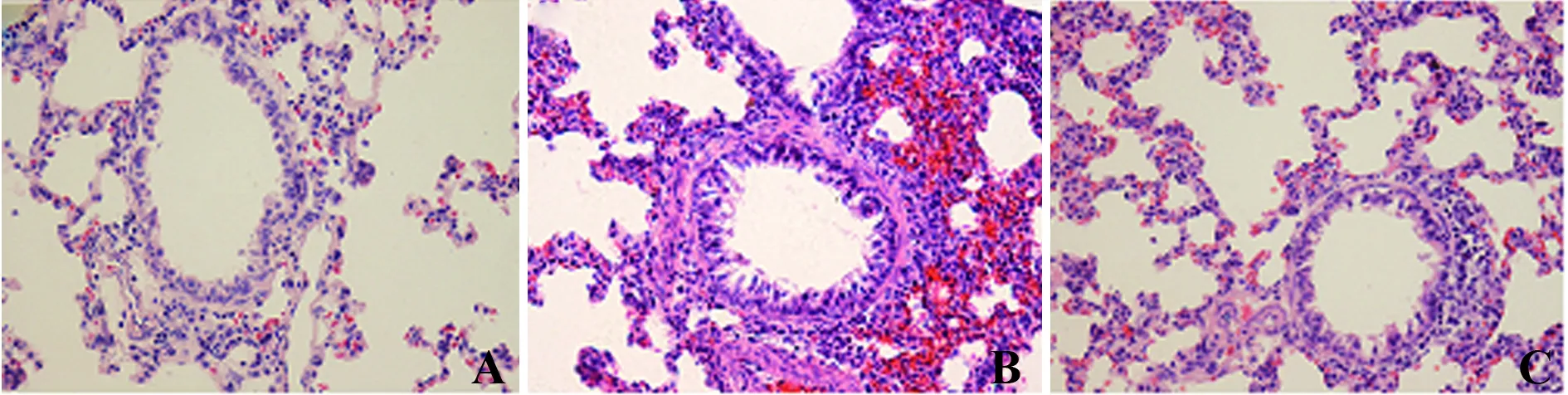
图1 肺组织病理改变(HE,×400)Fig.1 Observation of lung tissue(HE,×400)Note:A.Normal group;B.Bronchiolitis group;C.γ-secretase inhibitor group.

图2 各组大鼠肺组织及外周血中RORγt mRNA的表达Fig.2 Expression of RORγt mRNA in lung tissue and PBMCNote:Compared with RSV group,**.P<0.01.

图3 各组大鼠血浆IL-17的水平Fig.3 Expression of IL-17 in plasmaNote:Compared with RSV group;**.P<0.01.

图4 Western blot检测各组大鼠肺组织相关蛋白表达Fig.4 Western blot detect associated protein expression in lung tissueNote:1.Normal group;2.Bronchiolitis group;3.MW167 group;compared with RSV group,**.P<0.01.
2.4 大鼠血浆IL-17的水平 毛支组大鼠血浆IL-17水平显著高于正常组,差异有统计学意义,P<0.01;MW167组IL-17较毛支组表达降低,差异有统计学意义,P<0.01。见图3。
2.5 大鼠肺组织中蛋白表达水平 毛支组大鼠肺组织中NICD和RORγt蛋白表达较正常组增高,差异有统计学意义(P<0.01);MW167组这两种蛋白表达较毛支组降低,差异有统计学意义(P<0.01),见图4。
3 讨论
毛细支气管炎是造成婴幼儿住院的最常见原因,与哮喘的发生密切相关,严重影响着婴幼儿的身体健康[5]。毛支患儿的主要病理特点除了Th1和Th2失衡外,Th17细胞的功能状态也发生了相应变化。
Th17细胞被认为是区别于Th1和Th2细胞的第三类来自效应CD4+T细胞的细胞群,可特异性表达转录因子视黄酸受体相关孤核受体γt(Retinoid-related orphan nuclear receptor,RORγt)[6]。Th17细胞是一种重要的促炎细胞,过强的Th17应答会造成炎症和其他病理改变[7]。IL-17是Th17细胞分泌的最重要的炎症因子,IL-17有招募和活化中性粒细胞及淋巴细胞到气道的功能,刺激它们及其他类型细胞分泌炎症介质,IL-17还能够阻断CD8+淋巴细胞清除病毒颗粒的能力,协同体内的固有免疫系统加剧炎症反应[8-10]。有研究发现在分化成熟的Th17细胞内RORγt的表达呈现特异性的增高[11]。我们的前期研究也表明在毛支大鼠中Th17细胞分泌的细胞因子IL-17、IL-23及其转录因子RORγt浓度较正常组大鼠显著增高,这些细胞因子会造成炎细胞浸润,导致黏液分泌并降低肺功能[12]。
在哺乳动物中,有4种Notch受体和5种Notch配体。一个完整的Notch信号通路包括其受体、配体及细胞内效应分子(CSL-DNA结合蛋白)三部分组成。Notch信号起始于其相邻受体和配体的结合,然后通过一系列的酶促反应引起Notch受体胞内段(Notch receptor intracellular domain,NICD)的释放并转移到细胞核内,诱导下游基因转录激活[13]。Amsen[14]研究证明Notch信号通路在T细胞的增殖、分化及细胞功能调节方面都具有重要作用。
研究证明Notch信号能够调节Th17细胞的分化,阻断Notch信号将抑制Th17细胞应答[3,15]。Notch信号通路还能够直接促进Th17相关的细胞因子及其转录因子的表达。细胞实验显示,与对照组相比,经GSI处理过的Th17细胞分泌的IL-17及RORγt的表达均明显降低。体内试验中,Keerthivasan等[16]用GSI阻断多发性脑脊髓炎模型小鼠Notch信号通路后,Th17细胞分泌的细胞因子IL-17及其转录因子RORγt亦显著降低。本实验中,毛支大鼠注射GSI后,IL-17和RORγt表达减少,与上述结论相一致。另有研究证明用GSI阻断哮喘大鼠模型的Notch信号通路后,肺组织NICD表达降低,血浆IL-17分泌减少,气道炎症缓解,临床症状改善,说明GSI能够抑制Th17细胞分化,减少IL-17的产生,缓解哮喘大鼠的气道炎症,是治疗哮喘的有效措施[4]。本实验中,阻断毛支模型大鼠Notch信号通路后,肺组织NICD、RORγt表达降低,另外肺组织及PBMC中RORγt mRNA表达亦降低,IL-17分泌减少,同时HE染色也可观察到气道炎症的缓解,以上结果均说明阻断Notch信号通路能够缓解毛支大鼠症状。
综上所述,Notch信号通路能够通过调节Th17细胞的功能和状态影响毛支病情及预后。本实验通过注射GSI阻断毛支大鼠Notch信号通路,抑制了Th17细胞应答,减弱了其促炎作用,缓解了毛支炎症,为毛支的治疗提供了新的思路。
[1] φymar K,Skjerven HO,Mikalsen IB.Acute bronchiolitis in infants,a review[J].Scand J Trauma Resusc Emerg Med,2014,22:23.
[2] 李 宾,吴福玲,冯学斌,等.呼吸道合胞病毒毛细支气管炎患儿外周血CD4+CD25+调节性T细胞与Th17细胞功能变化及意义[J].细胞与分子免疫学杂志,2012,28(4):426-428.
[3] Amsen D,Helbig C,Backer RA.Notchin T cell differentiation:all things considered[J].Trends Immunol,2015,36(12):802-814.
[4] Zhang W,Zhang X,Sheng A,etal.γ-secretase inhibitor alleviates acute airway inflammation of allergic asthma in mice by downregulating Th17 cell differentiation[J].Mediators Inflamm,2015,2015:258168.
[5] Pickles RJ,DeVincenzo JP.Respiratory syncytial virus (RSV) and its propensity for causing bronchiolitis[J].J Pathol,2015,235(2):266-276.
[6] Betteli E,Oukka M,Kuchroo VK.Th-17 cells in the circle of immunity and autoimmunity[J].Nat Immunol,2007,8(4):345-350.
[7] Lan F,Liu K,Zhang J,etal.Th17 response is augmented in OVA induced asthmatic mice exposed to HDM[J].Med Sci Monit,2011,17(5):132-138.
[8] Wei Y,Liu B,Sun J,etal.Regulation of Th17/Treg function contributes to the attenuation of chronic airway inflammation by icariin in ovalbumin-induced murineasthma model[J].Immunobiology,2015,220(6):789-797.
[9] Iwakura Y,Ishigame H,Saijo S,etal.Functional specialization of interleukin-17 family members[J].Immunity,2011,34(2):149-162.
[10] Bystrom J,Al-Adhoubi N,Al-Bogami M,etal.Th17 lymphocytes in respiratory syncytial virus infection[J].Viruses,2013,5(3):777-791.
[11] Ohkura N,Kitagawa Y,Sakaguchi S.Development and maintenance of regulatory T cells[J].Immunity,2013,38(3):414-423.
[12] 高 萌,吴福玲,李营营,等.呼吸道合胞病毒毛细支气管炎大鼠肺组织视黄酸受体相关孤核受体γt 水平增加[J].细胞与分子免疫学杂志,2015,31(11):1492-1496.
[13] Wang Y,Xing F,Ye S,etal.Jagged-1 signaling suppresses the IL-6 and TGF-β treatment-induced Th17 cell differentiation via the reduction of RORct/IL-17A/IL-17F/IL-23a/IL-12rb1[J].Sci Rep,2015,5:8234.
[14] Amsen D,Antov A,Flavell RA.The different faces of Notch in T helper cell differentiation[J].Nat Rev Immunol,2009,9(2):116-124.
[15] Yu S,Liu C,Li L,etal.Inactivation of Notch signaling reverses the Th17/Treg imbalance in cells from patients with immune thrombocytopenia[J].Lab Invest,2015,95(2):157-167.
[16] Keerthivasan S,Suleiman R,Lawlor R,etal.Notch signaling regulates mouse and human Th17 differentiation[J].J Immunol,2011,187(2):692-701.
[收稿2016-05-16 修回2016-06-12]
(编辑 倪 鹏)
Affection to differentiation of Th17 cell in bronchiolitis rat models after injecting γ-secretase inhibitor
WANG Hai-Ying,LIU Liang-Xiao,WU Fu-Ling,GAO Meng.
Binzhou Medical University,Yantai 264003,China
Objective:To investigate the affection to the differentiation of Th17 cell in rat models of bronchiolitis after blocking Notch signaling by γ-secretase inhibitor and provide rationale to seek new target for bronchiolitis drug treatment.Methods:The rats were randomly divided into normal group,bronchiolitis group and γ-secretase inhibitor group.The model of bronchiolitis was established successfully by nasal dripping,and γ-secretase inhibitor(MW167) was injected into the vena caudalis.The pathological changes of the airway were observed by HE staining;the plasma level of interleukin17(IL-17) was detected by ELISA;the level of RORγt mRNA in lung tissues and peripheral blood mononuclear cells(PBMCs) was tested by real-time quantitative PCR;the levels of Notch signaling and RORγt protein in lung tissues were examined by Western blot.Results:Compared to the bronchiolitis group,the histopathologic change in MW167 intravenous injection group was significantly alleviated;the plasma level of IL-17 was decreased;the level of RORγt mRNA in lung tissues and PBMCs was lower in MW167-treated group than bronchiolitis group;the levels of Notch signaling and RORγt were decreased.Conclusion:γ-secretase inhibitor through intravenous injection suppresses the differentiation of Th17 cell and relieves the airway inflammation of bronchiolitis in rat models after blocking Notch signaling and has potential therapeutic value for treating bronchiolitis.
Bronchiolitis;Notch;γ-secretase inhibitor;Th17 cell
10.3969/j.issn.1000-484X.2016.12.008
①本文受山东省自然科学基金(ZR2014HL001)和山东省医药卫生科技发展计划项目(2013WS0312)资助。
王海英(1990年-),女,在读硕士,主要从事毛细支气管炎与Notch信号通路方面的研究, E-mail:13276382516@163.com。
及指导教师:吴福玲(1966年-),女,硕士,主任医师,教授,主要从事小儿呼吸与免疫方面的研究,E-mail:wufuling000@163.com。
R392-33
A
1000-484X(2016)12-1765-04

