AML1-ETO阳性急性髓系白血病CD19的表达及其预后的意义①
边 程 何 平 王 畅 刘晓亮 刘杉珊 林 海 谭业辉 高素君
(吉林大学白求恩第一医院肿瘤中心血液科,长春130021)
AML1-ETO阳性急性髓系白血病CD19的表达及其预后的意义①
边 程 何 平②王 畅 刘晓亮 刘杉珊 林 海 谭业辉 高素君
(吉林大学白求恩第一医院肿瘤中心血液科,长春130021)
目的:探讨CD19在AML1-ETO阳性急性髓系白血病(Acute myelogenous leukemia with AML1-ETO positive ,AML with AML1-ETO positive)患者中的表达及对预后的影响。方法:收集我中心2010年1月至2015年12月共66例初治AML1-ETO阳性AML患者资料,回顾性分析CD19表达与一般临床特征的关系及对生存期的影响。结果:AML1-ETO阳性AML患者初诊时CD19的表达率为50.0%。CD19阳性与阴性患者在年龄、性别、初诊时血红蛋白、血小板、骨髓原始细胞比例、染色体核型、基因突变无统计学差异(P>0.05)。CD19 阳性患者初诊时白细胞计数低于阴性患者,有统计学差异(P=0.027)。CD19阳性患者总体生存率明显优于CD19阴性患者(P=0.030),CD19阳性患者无复发生存率较阴性患者高,但差异无统计学意义(P=0.105)。多因素分析结果提示CD19阳性是AML1-ETO阳性AML患者OS的独立预后良好因素。结论:CD19阳性可能是AML1-ETO阳性AML患者预后良好的标志。
急性髓系白血病;AML1-ETO阳性; CD19;预后
急性髓系白血病(Acute myelogenous leukemia ,AML)是一种常见的血液系统恶性肿瘤,AML1-ETO阳性[伴t(8;21)]AML发病率占急性髓系白血病的12%~15%[1]。AML1-ETO融合基因是21号染色体上的急性白血病因子1(Acute myelogenous leukemia factor 1,AML1 or RUNX1)基因易位到8号染色体上的白血病易位基因(Myeloid translocation gene,ETO or MTG8)易位形成,该类型通常被认为是预后良好组,长期生存率可达50%,进一步研究表明C-Kit突变使此类型复发率提高,生存率降低。同时C-Kit突变阴性患者亦表现出异质性,部分患者在治疗中复发,生存率显著下降。因此,广大学者一直致力于寻找AML1-ETO阳性AML进一步分层标志。Zhu等[2]发现AML1-ETO阳性AML患者诱导缓解后,经2个疗程的巩固治疗AML1-ETO融合基因定量下降3个对数级是预后的良好标志,单纯化疗无病生存率可达94.7%。但该评估时间多为初诊后3~4个月,不能完全满足临床需求。目前尚缺少治疗前相关预后分层标志。AML有淋系抗原表达的现象,t(8;21)AML淋系抗原表达更为常见。潘湘涛等[3]通过对274例AML患者分析得出CD19阳性t(8;21)AML患者完全缓解(CR)率高于CD19阴性t(8;21)AML患者。提示CD19阳性可能是AML1-ETO阳性AML疗效及预后良好的标志。但目前尚无CD19阳性对AML1-ETO阳性AML OS及RFS影响的相关报道。因此,本研究纳入我中心66例AML1-ETO阳性AML患者,观察CD19表达与其临床特征、疗效及预后的关系。
1 材料与方法
1.1 研究对象 回顾性分析2010年1月~2015年12月于吉林大学第一医院肿瘤中心收治的初诊AML1-ETO阳性AML患者,均经骨髓形态学(FAB分型)、流式细胞仪检测免疫分型、染色体核型分析、基因突变、融合基因确诊。CD19抗原表达≥20%定义为阳性,如图1。
1.2 研究方法
1.2.1 患者初诊时临床特征分析 收集患者发病时年龄、性别、初诊时白细胞计数、血红蛋白计数、血小板计数、骨髓原始细胞比例等临床资料。对比CD19阳性与阴性患者在以上方面是否存在差异。
1.2.2 治疗方案 患者接受DA(柔红霉素、阿糖胞苷)、IA(去甲氧柔红霉素、阿糖胞苷)或D-CAG(地西他滨、阿克拉霉素、阿糖胞苷、粒细胞集落刺激因子)等方案诱导治疗,达完全缓解后原方案巩固1疗程,再行中/大剂量阿糖胞苷(阿糖胞苷1~3 g/m2每12 h一次,第1、3、5天)巩固治疗3~4疗程。应用腰穿+三联鞘注(甲氨蝶呤、阿糖胞苷、地塞米松)预防中枢神经系统白血病。根据患者治疗后缓解情况、AML1-ETO融合基因定量水平、患者意愿及是否有合适供者,部分患者接受异基因造血干细胞移植。
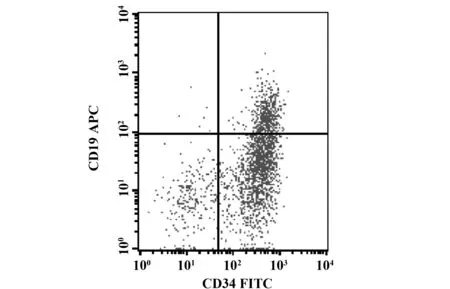
图1 AML1-ETO阳性AML患者CD19表达Fig.1 CD19 expression of AML with AML1-ETO positive
1.2.3 CD19阳性对患者预后的影响 对比CD19阳性和阴性患者的1疗程缓解率、总体生存率和无病生存率,同时对AML1-ETO阳性AML患者的性别、初诊白细胞计数、细胞表面CD19及CD56表达、是否伴有性别染色体改变、C-Kit表达、诱导治疗方案、是否行异基因造血干细胞移植(HSCT)等因素对生存的影响进行单因素和多因素分析。
1.2.4 疗效判定及随访 参照文献[4]分为完全缓解(CR)、部分缓解(PR)、未缓解(NR)及复发。总生存(OS)时间定义为自确诊日至患者死亡或随访截止日期(2015年12月31日)。无复发生存(RFS)时间定义为CR至白血病复发或至在CR期内死亡的时间。

2 结果
2.1 患者一般情况 本研究共纳入66例患者,其中男性36例,女性30例,中位年龄31.5岁(7~62岁)。CD19表达阳性33例(50.0%),CD19表达阴性33例(50.0%),通过对CD19阳性组与CD19阴性组患者初诊时临床特征对比,结果显示初诊时除CD19阳性患者白细胞计数水平低于CD19阴性患者(P=0.027)外,两组患者在年龄、性别、初诊时血红蛋白、血小板计数、骨髓原始细胞比例、其他细胞表面标志物、染色体核型、基因突变、造血干细胞移植比例均无明显统计学差异(P>0.05),见表1。
2.2 CD19阳性患者与CD19阴性患者缓解率比较 66例AML1-ETO阳性AML患者总体1疗程CR患者 47例(71.2%),其中CD19阳性组1疗程CR患者25例(75.8%),PR患者3例(9.1%),CD19阴性组1疗程CR患者22例(66.7%),PR患者3例(9.1%),两组间患者CR率无统计学差异(P=0.361)。
2.3 CD19阳性患者与CD19阴性患者生存率比较 随访时间截止至2015年12月31日,中位随访时间18.75个月(4~70个月)。CD19阳性组复发10例(30.3%),CD19阴性组复发15例(45.5%)。CD19阳性组死亡5例(15.2%),CD19阴性组死亡13例(39.4%)。绘制生存曲线可看出,CD19阳性患者无复发生存率要优于CD19阴性者,但无统计学差异(P=0.105),CD19阳性患者总生存(OS)率要明显优于CD19阴性者,具有显著统计学差异(P=0.030)。见图2、3。
表1 AML1-ETO阳性急性髓系白血病CD19阳性与阴性临床特征
Tab.1 Clinical features comparison of CD19 positive and negative in AML with AML1-ETO positive

CD19positive(n=33)CD19negative(n=33)StatisticPvalueAge(years)3385±12772985±1433t=-11970236Male/Female18/1518/151000WBC(×109/L)840±8281491±1425t=-22670027HB(g/L)8045±24907567±2557t=07700444PLT(×109/L)3987±40153240±2926t=08550396BlastinBM(%)5162±19155358±2142t=-03910697Surfaceantigenexpression(%)CD56positive636(21/33)788(26/33)0277CD34positive970(23/33)970(32/33)1000Karyotype46,XXor46,XY152(5/33)121(4/33)0742t(8;21)alone333(11/33)424(14/33)t(8;21)additional515(17/33)455(15/33)GenemutationsNPM1mutation(%)00(0/33)63(2/32)0145FLT3⁃ITDmutation(%)30(1/33)00(0/32)0321C⁃Kitmutation(%)121(4/33)250(8/32)0181CEBPAmutation(%)32(1/33)00(0/32)0313HSCT(%)152(5/33)91(3/33)0708
2.4 对AML1-ETO阳性AML患者生存影响的单因素分析 结果显示,CD19表达阳性、诱导治疗方案选择IA对总生存(OS)是预后良好的因素,男性、染色体伴-X/-Y、C-Kit突变阳性对OS是预后不良的因素,见表2。只有诱导治疗方案选择IA对无复发生存率(RFS)是预后良好的因素,见表3。

图2 CD19表达对无复发生存率的影响Fig.2 Kaplan-Meier curves indicating relapse-free survival
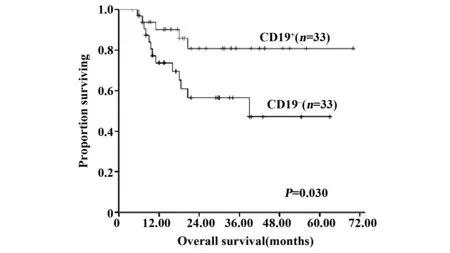
图3 CD19表达对总生存率的影响Fig.3 Kaplan-Meier curves indicating overall survival
表2 影响AML1-ETO阳性AML患者总生存(OS)的单因素及多因素分析
Tab.2 Analysis of prognostic factors for overall survival
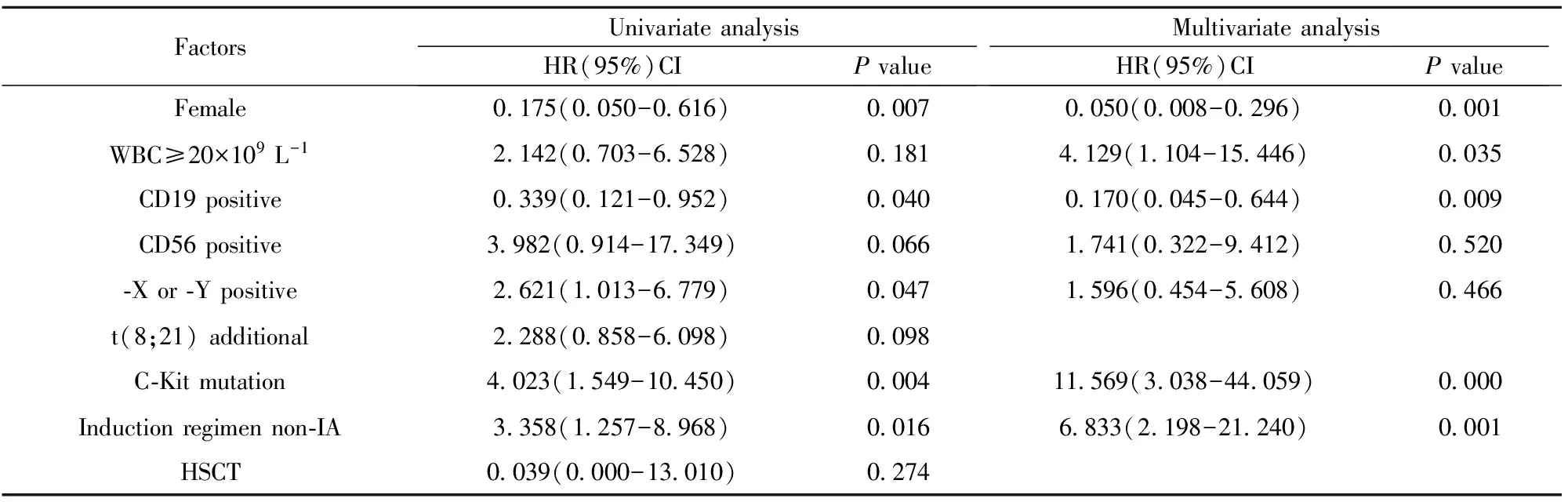
FactorsUnivariateanalysisHR(95%)CIPvalueMultivariateanalysisHR(95%)CIPvalueFemale0175(0050-0616)00070050(0008-0296)0001WBC≥20×109L-12142(0703-6528)01814129(1104-15446)0035CD19positive0339(0121-0952)00400170(0045-0644)0009CD56positive3982(0914-17349)00661741(0322-9412)0520⁃Xor⁃Ypositive2621(1013-6779)00471596(0454-5608)0466t(8;21)additional2288(0858-6098)0098C⁃Kitmutation4023(1549-10450)000411569(3038-44059)0000Inductionregimennon⁃IA3358(1257-8968)00166833(2198-21240)0001HSCT0039(0000-13010)0274
表3 影响AML1-ETO阳性AML患者无复发生存(RFS)的单因素及多因素分析
Tab.3 Analysis of prognostic factors for relapse-free survival
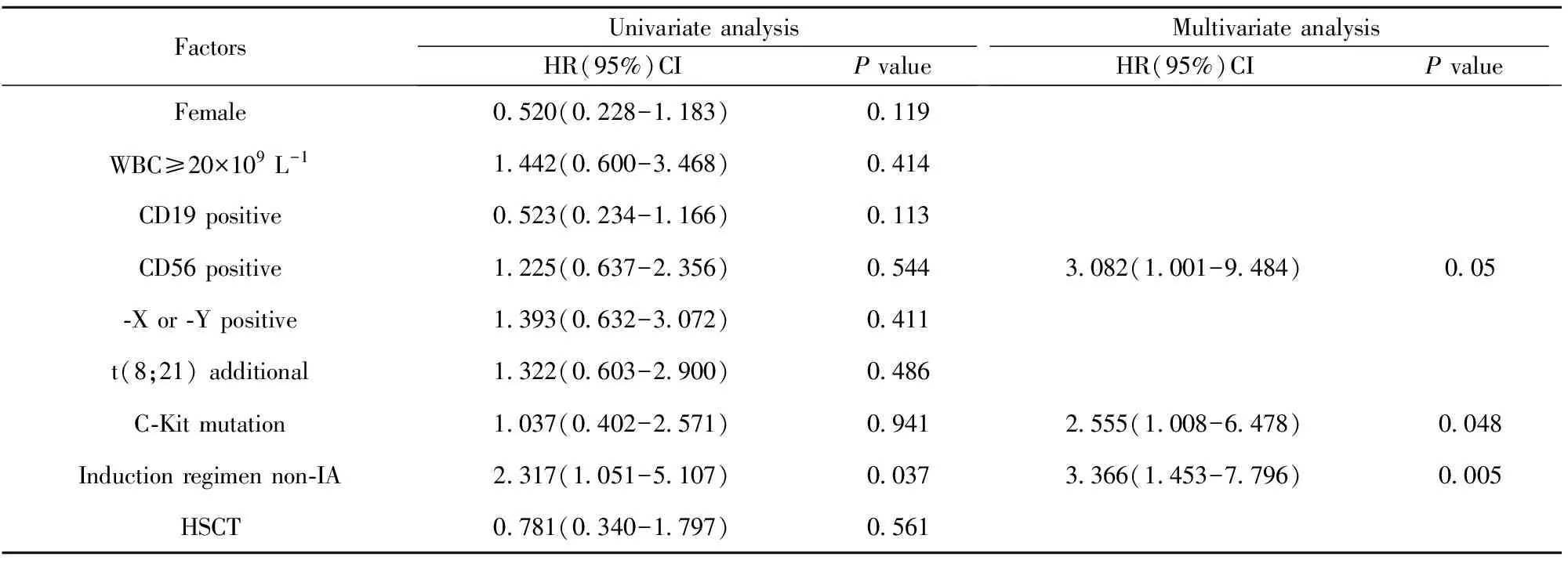
FactorsUnivariateanalysisHR(95%)CIPvalueMultivariateanalysisHR(95%)CIPvalueFemale0520(0228-1183)0119WBC≥20×109L-11442(0600-3468)0414CD19positive0523(0234-1166)0113CD56positive1225(0637-2356)05443082(1001-9484)005⁃Xor⁃Ypositive1393(0632-3072)0411t(8;21)additional1322(0603-2900)0486C⁃Kitmutation1037(0402-2571)09412555(1008-6478)0048Inductionregimennon⁃IA2317(1051-5107)00373366(1453-7796)0005HSCT0781(0340-1797)0561
2.5 对AML1-ETO阳性AML患者生存影响的多因素分析 将单因素分析中对于OS有意义的5个因素纳入多因素分析;因患者一般特征分析中白细胞计数对CD19阳性与CD19阴性组有统计学差异(P=0.027),将初诊白细胞数≥20×109L-1纳入多因素分析;有文献报道[5]对于t(8;21)AML,CD56阴性患者总生存明显优于CD56阳性患者,将CD56表达强行纳入OS的多因素分析,可以看出,CD19表达阳性、诱导治疗选择IA是OS的独立预后良好因素,男性、C-Kit突变阳性、初诊白细胞数≥20×109L-1是OS的独立预后不良因素,见表2。
将单因素分析中对RFS有意义的诱导方案选择IA纳入多因素分析,多项研究报道C-Kit突变阳性是t(8;21)AML RFS的独立预后不良因素[6,7],CD56表达亦有报道是t(8;21)AML的RFS独立的预后不良因素[8]。将C-Kit突变、CD56表达强行纳入RFS的多因素分析,结果发现诱导治疗选择IA是独立的预后良好因素,C-Kit突变阳性、CD56表达阳性是独立的预后不良因素,见表3。
3 讨论
CD19分子是最早发现的B淋巴细胞表面标记之一,其化学性质为跨膜糖蛋白,从骨髓B祖细胞即开始表达,持续整个B细胞成熟期,直至分化为浆细胞时消失,其主要调节B细胞活化和发育,并广泛分布在B淋巴细胞表面,是一种功能受体分子。Gomyo报道[9], CD19在正常造血干细胞、浆细胞、T细胞及其他组织中没有表达,而在B-ALL及非霍奇金淋巴瘤中高表达,是B-ALL和B系淋巴瘤理想治疗靶点。此外,CD19还表达在恶性B细胞肿瘤细胞上和滤泡状树突状细胞上,在急性髓系白血病细胞上发现也有表达。CD19与伴t(8;21)的AML相关性早已报道,近年来研究提示,B细胞特异的激活蛋白PAX5在AML1-ETO基因阳性的AML病例中表达。这可以解释作为PAX5靶基因的CD19为什么在伴t(8;21)AML中表达[10,11]。根据国内外报道,在AML中CD19阳性率为13.3%~14.7%[12,13],主要出现在AML1-ETO阳性AML中。Kita等[14]和 Hurwitz等[15]发现CD19在AML1-ETO阳性AML中阳性率可达78%和81%。国内报道CD19在AML1-ETO阳性AML阳性率为50.0%[13]。我中心研究结果显示CD19阳性率为50.0% ,与国内外基本一致。
本研究首先对CD19阳性和阴性患者初诊时年龄、性别、白细胞、血红蛋白、血小板计数、骨髓原始细胞比例、形态学分型、染色体核型、伴发基因突变等因素进行比较,以期发现CD19阳性AML是否具有不同的临床特征。结果显示,包括染色体核型及基因突变在内的多项因素均无差异,但CD19阳性患者白细胞计数水平低于CD19阴性患者。为进一步明确CD19表达对AML1-ETO阳性AML患者疗效和预后的影响,本文对比了CD19阳性和阴性AML1-ETO阳性AML患者的1疗程完全缓解率和生存率。可以看出,两组患者的缓解率无区别,无复发生存(RFS)率两组比较无统计学差异,但CD19阳性患者表现出RFS延长趋势。CD19阳性患者总生存率要明显优于CD19阴性者,具有显著统计学差异(P=0.030),见图2、3。
文献中关于CD19对于AML1-ETO阳性AML患者预后的影响尚无定论。Felicetto等[16]应用FCM检测发现t(8;21)AML高表达CD19和CD34,CD19联合CD34 表达预测t(8;21) AML预后正确率可达98.9%。Iriyama等[17]对144例t(8;21)AML 患者研究发现,CD19表达阴性且 CD56表达阳性、初诊时WBC≥20×109/L提示预后不良。刘莎等[18]的研究发现CD19阳性患者RFS高于阴性患者(P=0.014),认为CD19阳性对预后的影响可能与伴CD56阴性相关。本研究中CD19阳性患者在CD56及CD34表达上与阴性患者均无差异,提示CD19对预后的影响可能不完全依赖于CD34及CD56的表达。CD19阳性组患者初诊时WBC计数明显低于CD19阴性患者(P=0.027),需注意CD19对预后的影响是否与白细胞数有关。
为进一步明确CD19表达对AML1-ETO阳性AML预后的影响,本文将CD19表达与文献报道中影响预后的一些指标进行了单因素和多因素分析。如多项研究表明,C-Kit阳性t(8;21) AML1-ETO阳性 AML患者复发率高,OS降低[7,19];Schlenk等[20]在对392例成年AML进行Mate分析得出,在男性患者中Y染色体缺失预示较短的总生存期;也有研究表明,IA 方案能缩短AML治疗完全缓解率所需要的时间,并对延长存活时间也有一定的作用[21]。
对性别、初诊白细胞计数、细胞表面CD19及CD56表达、是否伴有性别染色体改变、C-Kit表达、诱导治疗方案、是否行异基因造血干细胞移植(HSCT)等因素对生存的影响的单因素分析,结果显示CD19表达阳性、诱导治疗方案选择IA对总生存(OS)率是预后良好的因素,男性、染色体伴-X/-Y、C-Kit突变阳性对OS是预后不良的因素。只有诱导治疗方案选择IA对无复发生存(RFS)率是预后良好的因素。进一步的多因素分析显示,CD19表达阳性、诱导治疗选择IA是OS的独立预后良好因素,男性、C-Kit突变阳性、初诊白细胞数≥20×109L-1是OS的独立预后不良因素。诱导治疗选择IA 是RFS独立的预后良好因素,C-Kit突变阳性、CD56表达阳性是RFS独立的预后不良因素。
从单因素和多因素分析结果来看,本研究关于性别、治疗方案选择、C-Kit突变、CD56表达和初诊白细胞数对预后影响的结果与文献报道基本一致。CD19阳性无论单因素还是多因素分析,均显示是预后良好的独立危险因素,初诊白细胞数≥20×109L-1是OS的独立预后不良因素。因此提示CD19阳性表达对于AML1-ETO阳性AML患者预后的影响与CD34、CD56无关。CD19阳性作为独立预后良好因素影响AML1-ETO阳性AML患者的预后同时,还可能通过降低初诊时白细胞计数影响此类患者的预后。
综上所述,AML1-ETO阳性AML的缓解及预后与多因素有关。CD19 表达阳性可能是AML1-ETO阳性AML患者预后良好的标志,但其机制还须进一步研究。AML1-ETO阳性AML因其异质性,在预后方面广受争议。通过监测AML1-ETO定量、基因突变类型及特征性免疫表达等,明确预后分层,可达到精准治疗的目的。
[1] Lieht JD.AML1 and the AML1-ETO fusion protein in the pathogene-sis of t(8;21)AML[J].Oncogene,2001,20(40):5660-5679.
[2] Zhu HH,Zhang XH,Qin YZ,etal.MRD-directed risk stratification treatment may improve outcomes of t(8;21) AML in the first complete remission:results from the AML05 multicenter trial[J].Blood,2013,121(20):4056-4062.
[3] 潘湘涛,李建勇,夏学鸣,等.MIC分型评价成人急性髓系白血病中的淋系抗原表达[J].肿瘤,2006,26(10):944-946.
[4] 张之南,沈 悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007:131-133.
[5] 王瑞芳,苏 龙,刘晓亮,等.伴有t(8;21)的急性髓系白血病CD56表达及其预后意义[J].中国实验血液学,2016,20(3):399-401.
[6] Cairoli R,Beghini A,Grillo G,etal.Prognostic impact of C-KIT mutations in core binding factor leukemias:an Italian retrospective study[J].Blood,2006,107(9):3463-3468.
[7] Paschka P,Marcueci G,Ruppert AS,etal.Adverse prognostic significance of KIT mutations itl adult acute myeloid leukemia with inv (16)and t(8;21):a Cancer and Leukemia Group B Study[J].J Clin Oncol,2006,24(24):3904-3911.
[8] Baer MR,Stewart CC,Lawrence D,etal.Expression of the neural cell adhesion molecule CD56 is associated with short remission duration and survival in acute myeloid leukemia with t(8;21)(q22;q22)[J].Blood,1997,90(4):1643-1648.
[9] Gomyo H,Shimoyama M,Minagawa K,etal.Morphologic flow cytometric and cytogenetic evaluation of bone marrow involve-ment in B-cell lymphoma[J].Haematologiea,2003,88(12):1358.
[10] Tiacci E,Pileri S,Orleth A,etal.PAX5 expression in acute leukemias:higher B-lineage specificity than CD79a and selective association with t(8;21)-acute myelogenous leukemia[J].Cancer Res,2004,64:7399-7404.
[11] Valbuena JR,Medeiros LJ,Rassidakis GZ,etal.Expression of B cell-specific activator protein/PAX5 in acute myeloid leukemia with t(8;21)(q22;q22)[J].Am J Clin Pathol,2006,126(2):235-240.
[12] Ball ED,Davit RB,Griffm JD,etal.Prognostic value of lymphocytic surface market in acute myeloid leukemia[J].Blood,1991,77:7242-2250.
[13] 潘湘涛,李建勇,夏学鸣,等.t(8;21)急性髓系白血病的免疫表型特点[J].中华血液学杂志,2001,22(6):313-315.
[14] Kita K,Nalase K,Miwa H,etal.Phenotypical characteristic of acute myelocytic leukemia associated with the t(8;21)(q22;q22) chromosome abnormality :frequent expression of immature B-cell antigen CD19 together with stem cell antigen CD34[J].Blood,1992,80:470-477.
[15] Hurwitz CA,Raimodi SC,Head D,etal.Distinctive immunophenoyypic feature of t(8;21)(q22;q22) acute myeloblastic leukemia in children[J].Blood,1992,80:3182-3188.
[16] Felicetto F,Di Noto R,Annunziata M,etal.Immunophenotypic analysis enables the correct prediction of t(8;2 1)in acute myeloid leukemia[J].Br J Haematol,1998,102(2):444-448.
[17] Iriyama N,Hatta Y,Takeuchi J,etal.CD56 expression is an independent prognostic factor for relapse in acute myeloidleukemia with t(8;21)[J].Leukemia Research ,2013,37:1021-1026.
[18] 刘 莎,魏旭东,米 瑞,等.CD56在t(8;2 1)成人急性髓系白血病患者中的表达及其与预后的相关性分析[J].中华血液学杂志,2015,36(8):676-681.
[19] Cairoli R,Beghini A,Grillo G,etal.Prognostic impact of C-KIT mutations in core binding factor leukemias:an Italian retrospective study[J].Blood,2006,107(9):3463-3468.
[20] Schlenk RF,Benner A,Krauter J,etal.Individual patient databased meta-analysis of patients aged 16 to 60 years with core binding factor acute myeloid leukemia:a survey of the German Acute Myeloid Leukemia Intergroup [J] .J Clin Oncol,2004,22(18):3741-3750.
[21] Shi P,Zha J,Guo X,etal.Idarubicin is superior to daunorubicin in remission induction of de novo acute myeloid leukemia patients with high MDR1 expression[J].Pharmacogenomics,2013,14(1):17-23.
[收稿2016-09-27 修回2016-11-17]
(编辑 倪 鹏)
Expression and prognostic significance of CD19 in patients with acute myelogenous leukemia with AML1-ETO positive
BIAN Cheng,HE Ping,WANG Chang,LIU Xiao-Liang,LIU Shan-Shan,LIN Hai,TAN Ye-Hui,GAO Su-Jun.
Hematology Department Cancer Center,the First Bethune Hospital of Jilin University,Changchun 130021,China
Objective:To investigate the expression and prognostic significance of CD19 in patients with Acute myelogenous leukemia with AML1-ETO positive.Methods: Clinical data of 66 patients AML with AML1-ETO positive who were newly diagnosed from Jan 2010 to Dec 2015 were collected.To retrospectively analyze the relationship between clinical characteristics and expression of CD19,so dose the prognosis.Results: The positive rate of CD19 expressing in AML with AML1-ETO positive was 50.0%.There were no statistically significant differences in terms of age,gender,hemoglobin,platelet,percentage of bone marrow blasts,accompanied with chromosome ,gene mutations between patients with and without CD19 expression(P>0.05).The white blood cell count(WBC) of the CD19 negative group was higher than CD19 positive group,while showed significant difference(P=0.027).Although the relapse-free survival (RFS) of patients with CD19 expression was higher than those without,no significant difference was calculated (P=0.105).Patients with CD19 expression had superior overall survival (OS) compared to those without CD19 expression (P=0.030).Multivariable analysis for OS identified CD19 positivity as an independent predictor associated with better prognosis.Conclusion: The expression of CD19 in AML with AML1-ETO positive may be an indicator associated with better prognosis.
Acute myelogenous leukemia; AML1-ETO positive;CD19;Prognosis
10.3969/j.issn.1000-484X.2016.12.019
①本文受吉林省科技发展计划(20070729-22)资助。
边 程(1990年-),女,硕士,主要从事白血病发病机制及造血干细胞移植方面研究,E-mail:424072736@qq.com。
及指导教师:谭业辉(1973年-),男,博士,主任医师,副教授,硕士生导师,主要从事白血病发病机制及造血干细胞移植方面的研究, E-mail: 276769165@qq.com。
R733.71
A
1000-484X(2016)12-1809-06
②长春医学高等专科学校临床医学部内科教研室,长春130000。

