过敏性紫癜患儿Th17、Treg细胞及IL-17、IL-23水平的测定①
张婷婷 吉晓菲 李少遊 赵 波 段 江 熊晶晶 刘 梅 黄永坤
(昆明医科大学第一附属医院儿科,昆明650032)
过敏性紫癜患儿Th17、Treg细胞及IL-17、IL-23水平的测定①
张婷婷 吉晓菲②李少遊 赵 波③段 江 熊晶晶 刘 梅 黄永坤
(昆明医科大学第一附属医院儿科,昆明650032)
目的:观察过敏性紫癜(Henoch-Schonlein purpura,HSP)患儿急性期及恢复期Th17、Treg细胞及IL-17、IL-23水平变化,以便更好地认识HSP的免疫学发病机制,为HSP的治疗提供帮助。方法:采用流式细胞术(Flow cytometry,FCM)检测HSP患儿65例和健康对照组儿童30例外周血中Th17细胞和Treg细胞比例;采用双抗体夹心酶联免疫吸附(ELISA)法测定其血浆中IL-17、IL-23水平。结果:HSP急性期组Th17、Th17/Treg细胞及IL-17、IL-23水平高于正常对照组(P<0.05),恢复期组较急性期组降低(P<0.05),但仍高于正常对照组(P<0.05)。HSP急性期组Treg水平低于正常对照组(P<0.01),恢复期组较急性期组升高(P<0.01),但是仍低于正常对照组(P<0.01)。单纯型、腹型和其他类型HSP患儿Th17、Treg、Th17/Treg及IL-17、IL-23水平相同(P>0.05)。HSP急性期患儿Th17细胞比例与IL-17水平呈正相关(r=0.880,P<0.01);HSP急性期患儿IL-23水平与Th17细胞比例、IL-17水平呈正相关(r=0.838或r=0.877,P<0.01)。结论:Th17、Treg、Th17/Treg、IL-17和IL-23共同参与HSP的发病,但在单纯型、腹型和其他类型中的水平无明显差异,值得深入研究。
过敏性紫癜;儿童;Th17细胞;Treg细胞;IL-17;IL-23
过敏性紫癜又称亨-舒综合征(Henoch-Schonlein purpura,HSP),是儿童时期较常见的一种自身免疫性血管炎性疾病。好发于春秋季节,常伴有上呼吸道感染病史,预后一般良好但易复发,其发病率呈逐年上升的趋势[1,2]。目前大量研究证实,HSP的发病与免疫紊乱有关。Th17细胞是近年发现的一种新的不同于Th1、Th2细胞的效应性CD4+T细胞亚群,主要通过分泌大量的IL-17和IL-22促进炎症反应的发生发展[3],在自身免疫性疾病和炎症性疾病中发挥重要调节作用。Treg细胞是体内一类具有免疫调节功能的特殊T细胞亚群,对维持机体免疫平衡状态起重要作用[4]。近来研究发现,Th17/Treg细胞失衡与自身免疫性疾病、感染性疾病、肿瘤等关系密切[5-8]。Th17细胞特征的稳定和维持主要通过IL-23来实现[9,10]。有学者研究发现,IL-23/IL-17轴在类风湿关节炎、多发性硬化及炎症性肠病等多种自身免疫性疾病的发病中具有重要作用[11]。本研究通过观察HSP患儿Th17、Treg、Th17/Treg以及IL-17、IL-23水平变化,以便更好地认识HSP的免疫学发病机制,为HSP的治疗提供帮助。
1 材料与方法
1.1 材料
1.1.1 一般资料 HSP急性期组35例,为2014年4~7月在昆明医科大学第一附属医院儿科及昆明市儿童医院风湿免疫科诊断为HSP的住院患儿,年龄3~13岁,平均8.31岁,男22例,女13例,其中,单纯型:以皮肤紫癜为主要表现者13例;腹型:以消化道症状腹痛、血便或粪便检查潜血阳性为主要表现者8例;其他型:除单纯型和腹型外,共14例。HSP恢复期组30例,为急性期患儿经治疗后临床症状缓解,皮肤紫癜明显减少或无新出紫癜,腹痛、关节肿痛等症状消失,血尿、蛋白尿减轻或消失,粪便检查潜血阴性,年龄4~13岁,平均8.65岁,男19例,女11例。诊断均符合1990年美国风湿病学会制定的HSP的诊断标准[12],均为初次发病,住院前未使用过肾上腺皮质激素、免疫调节剂及细胞毒性药物等。正常对照组30例,同期体检的健康儿童,年龄4.5~13岁,平均8.56岁,男17例,女13例。既往无肾脏疾病、变态反应性疾病史,近期无明确感染征象。所有受试对象均知情同意并经医院学术伦理委员会讨论通过。三组性别、年龄比较差异无统计学意义(χ2=0.356、F=0.132,P> 0.05)。
1.1.2 试剂与仪器 鼠抗人CD3-APC-H7、鼠抗人CD8-FITC、鼠抗人IL-17A-Alexa Fluor® 647、鼠抗人FoxP3-PE、流式细胞仪FACSCantoTMⅡ均购自美国BD公司。IL-17 ELISA试剂盒、IL-17 ELISA试剂盒均购自欣博盛生物科技有限公司,Multiskan MK3酶标仪购自芬兰Thermo公司。
1.2 方法
1.2.1 外周血Th17细胞检测 取300 μl肝素钠抗凝血加入含10%胎牛血清的RPMI1640培养基900 μl的培养瓶中,加入刺激剂和蛋白转运抑制剂混合液2 μl,移至37℃、5%CO2培养箱中培养6 h。将刺激培养后的全血细胞移至离心管中,加入鼠抗人CD3-APC-H7 5 μl、鼠抗人CD8-FITC 20 μl,室温避光孵育30 min。加2 ml PBS冲洗,室温3 000 r/min离心7 min,尽量移去上清液。加1 ml 1×Fix/Perm液,室温避光孵育40~50 min,加2 ml 1×Perm/Wash液,离心洗涤2次,尽量移去上清液后平均分为两管,并标记为试验管和对照管,试验管加入鼠抗人IL-17A-Alexa Fluor® 64 720 μl,对照管加入同型对照抗体20 μl,室温避光孵育40~50 min。加2 ml 1×Perm/Wash液,离心洗涤2次,去上清液后加350 μl PBS,重悬沉淀,24 h内上机检测。
1.2.2 外周血Treg细胞检测 Treg细胞的检测采用未经刺激培养的全血细胞,步骤及方法同上。
1.2.3 血浆IL-17、IL-23测定 采集肘静脉血约2~3 ml至肝素钠抗凝管中,留取标本30 min内分离血浆,1 500 r/min离心8 min,用移液枪将血浆移至EP管中,编号置-70℃冰箱保存备用。按照试剂盒说明书,采用双抗体夹心酶联免疫吸附(ELISA)法测定血浆中IL-17、IL-23浓度。
2 结果
2.1 各组儿童Th17、Treg、Th17/Treg及IL-17、IL-23的测定 HSP急性期组Th17、Th17/Treg及IL-17、IL-23水平高于正常对照组(P<0.05),恢复期组较急性期组降低(P<0.05),但是仍高于正常对照组(P<0.05),HSP急性期组Treg水平低于正常对照组(P<0.01),恢复期组较急性期组升高(P<0.01),但是仍低于正常对照组(P<0.01)。见表1,Th17、Treg流式细胞术检测结果见图1、2。
2.2 各型HSP患儿Th17、Treg、 Th17/Treg及IL-17、IL-23的测定 单纯型、腹型和其他类型HSP 患儿Th17、Treg、Th17/Treg及IL-17、IL-23水平相同(P>0.05)。见表2。

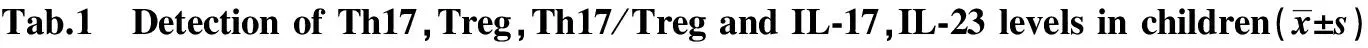

GroupsNormal(n=30)Acute(n=35)Recovery(n=30)Th17(%)066±026135±0461)103±0351)3)Treg(%)315±067181±0462)234±0532)4)Th17/Treg021±007075±0221)046±0171)3)IL⁃17(pg/ml)1686±6223458±9011)2737±9781)3)IL⁃23(pg/ml)1835±8133540±13001)2813±12271)3)
Note:Compared with normal children,1)P<0.05,2)P<0.01;compared with acute phase,3)P<0.05,4)P<0.01.
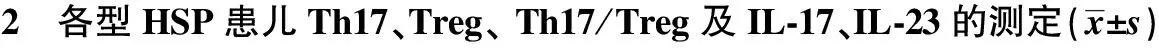

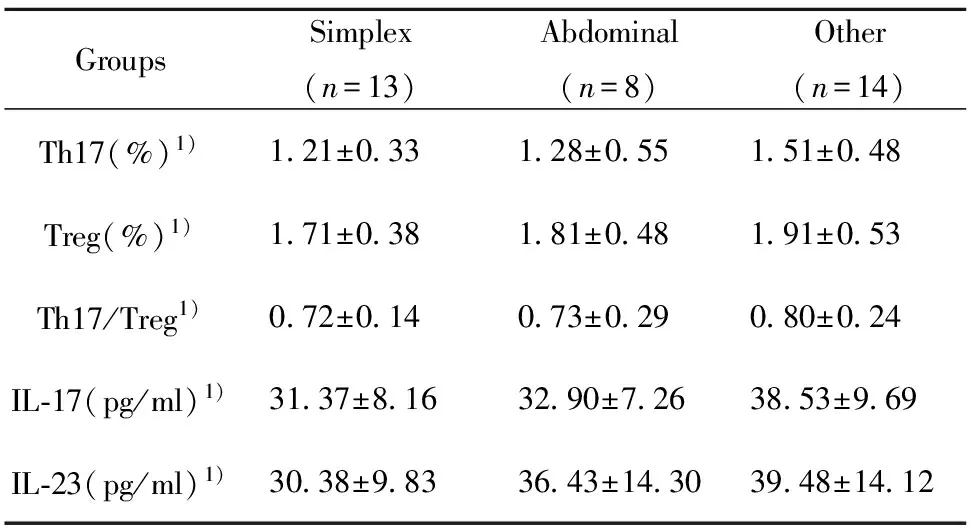
GroupsSimplex(n=13)Abdominal(n=8)Other(n=14)Th17(%)1)121±033128±055151±048Treg(%)1)171±038181±048191±053Th17/Treg1)072±014073±029080±024IL⁃17(pg/ml)1)3137±8163290±7263853±969IL⁃23(pg/ml)1)3038±9833643±14303948±1412
Note:One-way ANOVA,1)P>0.05.

图1 Th17细胞流式细胞术检查结果示意图Fig.1 Flow cytometry examination result diagrams of Th17 cell
2.3 相关性分析结果 HSP急性期患儿Th17细胞比例与IL-17水平呈显著正相关关系(r=0.880,P<0.01)。HSP急性期患儿IL-23水平与Th17细胞比例或IL-17水平呈显著正相关关系(r=0.838或r=0.877,P<0.01)。

图2 Treg细胞流式细胞术检查结果示意图Fig.2 Flow cytometry examination result diagrams of Treg cell
3 讨论
Th17细胞和Treg细胞是近年新发现的CD4+T细胞亚群,它们在维持机体免疫平衡中具有十分重要的作用。HSP被认为是一种全身性炎症疾病。然而,具体的炎性发病机制仍不清楚。目前,大量文献报道过敏性疾病及自身免疫性疾病中Th17细胞及IL-17水平异常升高[13-15]。本研究发现,HSP急性期患儿Th17细胞比例、IL-17水平与正常儿童相比明显升高,且Th17细胞比例与IL-17水平呈正相关,与范秋霞、Jen等研究一致[16-19],由此推测Th17细胞及其特异性细胞因子IL-17参与了HSP的发病,但具体作用机制尚不十分明确,Th17细胞比例及IL-17水平的升高可能是HSP免疫紊乱的主要因素之一。本研究还发现,HSP恢复期患儿Th17细胞比例、IL-17水平较急性期有所下降,但仍未恢复至正常儿童水平。提示恢复期患儿虽临床症状已明显缓解,但仍需继续临床治疗,同时注意休息及饮食,以免症状反复。
Treg细胞的两大功能为免疫抑制和免疫调节,是机体维持自身免疫耐受的重要组成部分[20,21]。本研究发现,HSP急性期患儿Treg细胞比例与正常儿童相比明显降低,与Chen[22]和Yang[23]等研究结果一致,然而Li等[24]发现,HSP急性期患儿Treg细胞与正常对照组相比无明显降低。由此推测,Treg细胞同样也参与了HSP的发病,而且Treg细胞数量减少导致的免疫抑制效应不足可能是HSP免疫紊乱的重要原因之一,恢复期患儿Treg细胞比例回升,可能是Treg细胞对机体的免疫补偿反应。虽然不同研究数据间存在差异,但所有数据均提示HSP患儿急性期存在Th17、Treg细胞紊乱,只是Th17细胞可能在Th17/Treg细胞所致的免疫紊乱中起主导作用。本研究结果显示,HSP急性期患儿Th17/Treg细胞比值较正常儿童升高,恢复期患儿Th17/Treg细胞比值较急性期明显降低,但未降至正常儿童水平,与Chen等[22]研究者一致,说明HSP患儿存在Th17/Treg细胞失衡。Th17/Treg细胞失衡可能是HSP免疫失衡的重要原因之一。另外,在疾病的不同时期Th17/Treg细胞比值不同,或许我们可以通过Th17/Treg细胞比值来推测HSP患儿所处疾病阶段以及治疗效果的评估,以指导临床用药。
IL-23/IL-17轴作为一种炎性通路并介导异常炎性反应在多种炎性疾病和自身免疫性疾病中发挥重要作用[25-28]。IL-23通过诱导Th17细胞分化并促进IL-17产生和释放,介导机体炎症反应,在自身免疫性疾病中发挥重要作用。本研究结果显示,HSP急性期患儿IL-23水平较正常儿童明显升高, IL-23的水平与Th17细胞比例、IL-17水平呈正相关。由此提示,IL-23也参与HSP的发病,且作用机制与Th17细胞、IL-17密切相关,IL-23作为IL-23/IL-17轴的上游细胞因子且水平明显升高,进一步说明IL-23/IL-17轴可能参与HSP的发病。
近来,肠黏膜屏障逐渐成为人们关注研究的热点。大量研究表明肠黏膜屏障在多种疾病(如烧伤、休克、重症胰腺炎等)的发生发展过程中发挥着重要作用[29-31]。Mazmanian等[32]发现,肠道共生菌影响肠黏膜免疫系统的发育和功能。有研究发现,HSP急性期患儿发生肠道菌群失调,而且腹型HSP患儿肠道菌群失调及肠黏膜通透程度相比其他类型更显著。我们发现,单纯型、腹型和其他类型HSP患儿Th17、Treg、Th17/Treg、IL-17、IL-23的均值虽有依次递增或递减的趋势,但差异无统计学意义。由此推测,Th17、Treg、Th17/Treg、IL-17、IL-23虽参与HSP的发病,但在不同类型HSP中所起作用无明显差异,HSP患儿之所以有不同脏器受累以及多种临床表现,各类型HSP可能存在其特殊的发病机制,比如,腹型HSP患儿可能还存在显著肠道菌群紊乱以及肠黏膜屏障功能的破坏。因此,在HSP的治疗过程中特别是腹型HSP的治疗,除了调节免疫平衡外,还应注重促进肠道菌群的调节和肠黏膜屏障功能的恢复。
[1] Kawasaki Y.The pathogenesis and treatment of pediatric Henoch-Schonlein purpura nephritis[J].Clin Exp Nephrol,2011,15(5):648-657.
[2] 陈蓉燕,于 力.儿童过敏性紫癜和紫癜性肾炎的治疗新进展[J].医学综述,2008,14:2124-2127.
[3] Korn T,Bettelli E,Oukka M,etal.IL-17 and Th17 cells[J].Annu Rev Immunol,2009,27:485-517.
[4] Dasgupta A,Saxena R.Regulatory T cells:a review[J].Natl Med J India,2012,25 (6):341-351.
[5] Noack M,Miossec P.Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J].Autoimmun Rev,2014,13(6):668-677.
[6] Zhang W,Hou F,Zhang Y,etal.Changes of Th17/Tc17 and Th17/Treg cells in endometrial carcinoma[J].Gynecol Oncol,2014,132(3):599-605.
[7] Dong L,Wang X,Tan J,etal.Decreased expression of microRNA-21 correlates with the imbalance of Th17 and Treg cells in patients with rheumatoid arthritis[J].J Cell Mol Med,2014,18(11):2213-2224.
[8] 林振忠,余雪平,苏智军,等.慢性乙型肝炎患者外周血Treg/Th17比率的检测及其与肝功能的相关性研究[J].中国免疫学杂志,2012,28(11):1036-1040.
[9] 郑钰涵,吴晓东,孙 兵.Th17细胞分化和功能的研究进展[J].生命科学,2010,22(6):534-538.
[10] 张婷婷,黄永坤.Th17/Treg细胞与过敏性紫癜的免疫发病机制[J].中国小儿急救医学,2015,22(1):41-43.
[11] 杨 帆,伍伟锋.IL-23/Th17轴与自身免疫性疾病[J].国际免疫学杂志,2012,35(1):61-63.
[12] Mills JA,Michel BA,Bloch DA,etal.The American College of Rheumatology 1990 criteria for the classification of Henoch-Schonlein purpura[J].Arthritis Rheum,1990,33(8):1114-1121.
[13] 孔庆飞,穆莉莉,孙 博,等.Th17及IL-17与实验性自身免疫性重症肌无力发病过程的相关性[J].中国生物制品学杂志,2008,12:1039-1042.
[14] Liu ZJ,Yadav PK,Su JL,etal.Potential role of Th17 cells in the pathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2009,15(46):5784-5788.
[15] Doe C,Bafadhel M,Siddiqui S,etal.Expression of the T helper 17-associated cytokines IL-17A and IL-17F in asthma and COPD[J].Chest,2010,138(5):1140-1147.
[16] 范秋霞,王春美,盛光耀.Th17细胞和白细胞介素-17在儿童过敏性紫癜发病中作用[J].中华实用诊断与治疗杂志,2010,26(11):1089-1090.
[17] Jen HY,Chuang YH,Lin SC,etal.Increased serum interleukin-17 and peripheral Th17 cells in children with acute Henoch-Schonlein purpura[J].Pediatr Allergy Immunol,2011,22(8):862-868.
[18] 杨 军,李成荣,王国兵,等.Th17细胞与CD4+CD25+调节性T细胞在儿童过敏性紫癜发病机制中的作用[J].临床儿科杂志,2009,27(7):645-648.
[19] 苗 静,周俊霖,彭晓杰,等.辅助性T细胞17及白介素-17在儿童过敏性紫癜的表达及意义[J].江西医药,2014,49(2):102-104.
[20] Shevach EM.Certified professionals:CD4(+)CD25(+) suppressor T cells[J].J Exp Med,2001,193(11):F41-46.
[21] Ziegler SF.FOXP3:not just for regulatory T cells anymore[J].Eur J Immunol,2007,37(1):21-23.
[22] Chen O,Zhu XB,Ren H,etal.The imbalance of Th17/Treg in Chinese children with Henoch-Schonlein purpura[J].Int Immunopharmacol,2013,16(1):67-71.
[23] 杨 军,李成荣,祖 荣,等.调节性T细胞在儿童过敏性紫癜发病机制中的作用初探[J].中华儿科杂志,2006,44(6):411-414.
[24] Hirahara K,Ghoreschi K,Laurence A,etal.Signal transduction pathways and transcriptional regulation in Th17 cell differentiation[J].Cytokine Growth Factor Rev,2010,21(6):425-434.
[25] Yen D,Cheung J,Scheerens H,etal.IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6[J].J Clin Invest,2006,116(5):1310-1316.
[26] Caruso R,Pallone F,Monteleone G.Emerging role of IL-23/IL-17 axis in H pylori-associated pathology[J].World J Gastroenterol,2007,13(42):5547-5551.
[27] 王新卫,林智明,廖泽涛,等.IL-23与IL-17在强直性脊柱炎患者中表达的初步研究[J].中国免疫学杂志,2009,25(3):266-270.
[28] 罗家明,秦新月,陈黎燕,等.甲基强的松龙抑制实验性自身免疫性脑脊髓炎IL-23/IL-17轴机制研究[J].中国神经精神疾病杂志,2008,34(6):345-348.
[29] 王忠堂,姚咏明,肖光夏,等.烫伤大鼠肠源性细菌移位危险性多因素分析[J].解放军医学杂志,2002,27(9):770-773.
[30] 陈德昌,景炳文,张翔宇,等.大黄对肠黏膜屏障的保护作用[J].中国危重病急救医学,1994,6(6):329-331.
[31] 王兴鹏,王冰娴,吴建新,等.急性坏死性胰腺炎肠黏膜屏障功能障碍及生长激素的作用[J].中华消化杂志,2000,20(1):30-33.
[32] Mazmanian SK,Liu CH,Tzianabos AO,etal.An immunomo-dulatory molecule of symbiotic bacteria directs maturation of the host immune system[J].Cell,2005,122 (1):107-118.
[收稿2016-03-16 修回2016-04-21]
(编辑 许四平)
Detection of Th17,Treg cells and IL-17,IL-23 levels in children with Henoch-Schonlein purpura
ZHANG Ting-Ting,JI Xiao-Fei,LI Shao-You,ZHAO Bo,DUAN Jiang,XIONG Jing-Jing,LIU Mei,HUANG Yong-Kun.
Department of Pediatrics,the First Affiliated Hospital of Kunming Medical University,Kunming 650032,China
Objective:To study the changes of Th17,regulatory T(Treg) cells and IL-17,IL-23 levels at acute phase and recovery phase in children with Henoch-Schonlein purpura(HSP) in order to further understand the immunological pathogenesis and provide help for treating HSP.Methods:The vein blood samples were collected from 65 children with HSP and 30 normal children.The proportion of Th17 cells and regulatory T cells were tested by FCM and concentration of IL-17 and IL-23 in plasma were tested by ELISA.Results:Compared with normal children,the levels of Th17,Th17/Treg and IL-17,IL-23 were in increase at acute phase in children with HSP(P<0.05).At recovery phase,that were in decrease compared with the acute phase(P<0.05),but still higher than the normal children(P<0.05).Compared with normal children,the level of Treg was in decrease at acute phase in children with HSP(P<0.01).At recovery phase,that was in increase compared with the acute phase(P<0.01),but still lower than the normal children(P<0.01).Among the simplex,abdominal and other type of children with HSP,the levels of Th17,Treg,Th17/Treg and IL-17,IL-23 were same(P>0.05).At acute phase in children with HSP,Th17 cells percentage had positively correlated with IL-17 levels (r=0.880,P<0.01),IL-23 levels had positively correlated with Th17 cells percentage and IL-17 levels (r=0.838 or 0.877,P<0.01).Conclusion:Th17,Treg,Th17/Treg,IL-17 and IL-23 are involved in the course of the immunological pathogenesis in children with HSP,but the levels of that have no significant difference among simplex,abdominal and other types,further researches need to be done.
Henoch-Schonlein Purpura;Children;Th17 cell;Regulatory T cell;Interleukin-17;Interleukin-23
10.3969/j.issn.1000-484X.2016.12.017
①本文为国家自然科学基金(No.81360068)和云南省自然科学基金面上项目(No.2013FB137)。
张婷婷(1986年-),女,硕士,主要从事小儿消化系统疾病的诊治和研究。
R725
A
1000-484X(2016)12-1801-05
及指导教师:黄永坤(1961年-),男,硕士,教授,博士生导师,主要从事小儿消化系统与营养、感染与免疫疾病的诊治和研究,E-mail:13577097854@163.com。
②并列第一作者。
③昆明医科大学附属儿童医院风湿免疫科,昆明650000。

