经尿道双极等离子电切治疗肾移植后膀胱肿瘤的疗效及预后分析
刘余庆 卢 剑 肖春雷 侯小飞 黄 毅 马潞林
(北京大学第三医院泌尿外科,北京 100083)
·临床研究·
经尿道双极等离子电切治疗肾移植后膀胱肿瘤的疗效及预后分析
刘余庆 卢 剑 肖春雷 侯小飞 黄 毅 马潞林*
(北京大学第三医院泌尿外科,北京 100083)
目的 探讨经尿道双极等离子电切治疗肾移植后膀胱肿瘤的疗效和安全性,评价术后肿瘤复发的危险因素。方法 2009年9月~2014年6月采用经尿道双极等离子电切术治疗肾移植术后膀胱肿瘤16例,术中汽化切割肿瘤直达深肌层,术后定期膀胱灌注化疗。术后患者定期随访,观察肿瘤复发情况。采用Cox比例风险回归模型分析影响肿瘤复发的危险因素。 结果 16例均成功完成经尿道双极等离子电切术,平均手术时间34.1 min(15~60 min)。术后随访时间14~62个月,中位随访时间45个月,肿瘤复发率50.0%(8/16),其中87.5%(7/8)术后2年内复发。多因素分析表明,原肾马兜铃酸肾病(HR=7.040,95%CI:1.411~35.121,P=0.017)与肿瘤直径≥3 cm(HR=8.230,95%CI:1.055~59.834,P=0.046)是术后复发的危险因素。 结论 经尿道双极等离子电切术是治疗肾移植术后非肌层浸润膀胱肿瘤的有效方法,切除效率高,安全性较好。术后仍有较高的复发率,大多数病例术后2年内复发,原肾马兜铃酸肾病、肿瘤直径≥3 cm的患者,术后复发风险较高。
经尿道双极等离子电切术; 移行细胞癌; 膀胱; 复发; 肾移植
我国肾移植术后恶性肿瘤多见于泌尿系统,尤以尿路上皮癌最为常见[1]。肾移植受者的膀胱癌发生风险显著高于普通人群,而且由于免疫抑制继发的肿瘤易感状态,移植术后膀胱癌的生物学表现更具侵袭性,有较高的复发率,严重影响患者预后[2]。该类患者在选择治疗方法时,须充分考虑治疗操作及其并发症可能对移植肾的影响,治疗肿瘤的同时应尽可能保护移植肾功能,达到治疗的最优化。近年来,经尿道双极等离子电切术(transurethral bipolar plasmakinetic resection of the bladder tumor,PK-TURBT)治疗浅表性膀胱肿瘤获得很好的疗效,与传统单极电切相比具有高效安全的特点,逐渐成为治疗非肌层浸润性膀胱尿路上皮癌的标准术式[3]。PK-TURBT治疗肾移植术后膀胱肿瘤的报道较少,对肾移植受者的疗效和安全性以及术后肿瘤复发的危险因素,尚待进一步阐明。我科2009年9月~2014年6月采用PK-TURBT治疗肾移植术后膀胱肿瘤16例,现报道如下,旨在评价其疗效和安全性,探讨预后风险因素。
1 临床资料与方法
1.1 一般资料
本组16例,男2例,女14例。年龄37~72岁,平均56.7岁。肉眼血尿10例,尿频尿痛2例,移植后随访超声检查发现膀胱肿物2例,2例因发现上尿路积水,膀胱镜检查发现膀胱肿物。既往均因终末期肾病接受同种异体肾移植术,原发肾病包括4例马兜铃酸肾病(aristolochic acid nephropathy,AAN),其余12例为慢性肾小球肾炎。9例应用环孢素为免疫抑制剂,7例应用他克莫司(FK506)。膀胱肿瘤发病与肾移植术间隔为23~132个月,中位时间71个月。既往均无膀胱肿瘤病史,7例因上尿路病变行单侧或双侧肾输尿管切除术,其中4例病理为上尿路尿路上皮癌,术后接受膀胱灌注化疗;5例发现膀胱肿瘤同时合并上尿路病变。膀胱镜检查提示膀胱肿瘤单发6例,多发10例。肿瘤数目1~5个,共40个,平均2.5个。肿瘤直径1.0~4.0 cm,(2.0±0.8)cm。位于膀胱侧壁24个,三角区或底部8个,顶部8个,其中包括1例肿瘤邻近移植肾输尿管口。膀胱镜病理活检均证实为尿路上皮癌。
病例选择标准:①临床诊断均为非肌层浸润性膀胱肿瘤;②膀胱肿瘤发病时间与肾移植术间隔不小于1年;③能够接受经尿道手术;④无严重内科系统疾病;⑤能够完成随访。
1.2 方法
常规术前评估包括完整的病史、体格检查、实验室检查、泌尿系CT或泌尿系核磁共振,膀胱镜检查评价肿瘤位置、直径、数目等,必要时行逆行上尿路造影。完善术前检查,排除手术禁忌,择期行PK-TURBT,5例合并上尿路病变者,同期接受后腹腔镜肾输尿管切除术。连续硬膜外腔阻滞麻醉,取截石位。采用英国Gyrus公司经尿道双极等离子电切系统,冲洗液为生理盐水。监视器下经尿道直视入镜,全面观察膀胱及膀胱肿瘤情况。考虑到肾移植后膀胱肿瘤具有高侵袭、高复发的特点,术中应尽可能切净肿瘤及可疑病变,尤其是膀胱壁可疑原位癌病变,切除送检。由于移植后患者免疫功能受抑制,合并慢性下尿路感染较为常见,术中应仔细分辨肿瘤位置,对于较大肿瘤,要避免遗漏周围卫星病灶。对基底较窄(直径<1.5 cm)的肿瘤,可直接由基底部切割,深达深肌层,直至肿瘤全部切除,然后环形切除肿瘤基底周围1 cm相对正常组织。对于基底部较宽(>1.5 cm)或体积较大的肿瘤(冠部直径>2.5 cm),可以先由肿瘤冠部开始切割,如果切割时出血较明显,用电切襻从肿瘤基底部电凝以控制肿瘤血供,待肿瘤大部分切除后,再对肿瘤基底部进行电切,直达深肌层,并扩大电切周围1 cm范围的相对正常组织。由于移植肾输尿管开口位于膀胱顶底部,术中应仔细分辨输尿管开口位置,顶部及底部肿瘤时应注意保护输尿管开口。1例肿瘤邻近移植肾输尿管口,切割基底部时尽可能采用高频切割,避免凝闭输尿管口,切除肿瘤后,导丝引导下逆行留置双J输尿管支架管。用冲洗器将切除的组织标本冲出体外,送检病理。术中静脉滴注甲泼尼龙80~ 120 mg。留置F20~F22三腔气囊导尿管。术后根据引流尿色确定是否膀胱冲洗,6例术后接受持续膀胱冲洗2~6 h。术后3 d每日静脉滴注甲泼尼龙80 mg。术后观察尿色变化,监测尿量及移植肾功能。同期上尿路手术患者术后14 d拔除尿管,其他患者术后5~6 d拔除尿管。术后1~2周后开始规律膀胱灌注化疗,14例采用吡柔比星40 mg,2例采用表柔比星50 mg。术后患者定期随访,2年内每3个月复查膀胱镜及影像学检查,记录随访期间内肿瘤复发、治疗及转归情况。
1.3 统计学处理

2 结果
16例PK-TURBT均成功完成。PK-TURBT手术时间15~60 min,(34.1±12.3)min。术中未出现经尿道电切综合征,未出现膀胱穿孔,2例出现明显闭孔神经反射,其肿瘤均位于侧壁。术后无持续性出血,无显著感染(体温>38.5 ℃)。术后患者尿量及肾功能稳定,未见急性移植肾排斥。术后病理结果均为膀胱尿路上皮癌;病理分级:低级别5例,高级别11例;病理分期:T113例,T2a2例,T2b1例。术后病理检查发现肿瘤周围存在原位癌5例,其原发膀胱肿瘤均为高级别。
16例术后随访时间14~62个月,中位随访时间45个月。1例术中留置输尿管支架管,术后3个月拔除支架管,随访期间未见移植肾积水,移植肾功能良好。8例肿瘤复发,初始复发部位均在膀胱,其中1例同时发现肺转移,1例同时右侧输尿管肿瘤复发。复发时间为术后5~45个月,中位复发时间8.5月,其中5例术后1年内复发,7例术后2年内复发。8例复发均再次接受手术治疗:4例TURBT治疗(包括1例同期接受右侧上尿路切除);2例膀胱根治性切除,术后随访期间无复发生存;1例再次TURBT,术后分别出现双侧上尿路肿瘤复发,全身化疗后带瘤生存;1例再次TURBT后接受全身化疗,因心功能衰竭死亡。
根据是否合并上尿路尿路上皮癌、术前是否接受膀胱灌注化疗、原肾疾病类型、免疫抑制剂类型、肿瘤直径(是否≥3 cm)、肿瘤病灶(单发、多发)、病理分期、肿瘤分级分组,比较术后肿瘤复发率(表1)。单因素分析显示肿瘤直径和原肾疾病有显著性差异。多因素Cox回归分析表明,肿瘤直径≥3 cm(HR=8.230,95%CI:1.055~59.834,P=0.046)与原肾疾病为AAN(HR=7.040,95%CI:1.411~35.121,P=0.017)是PK-TURBT术后复发的危险因素,见表2。
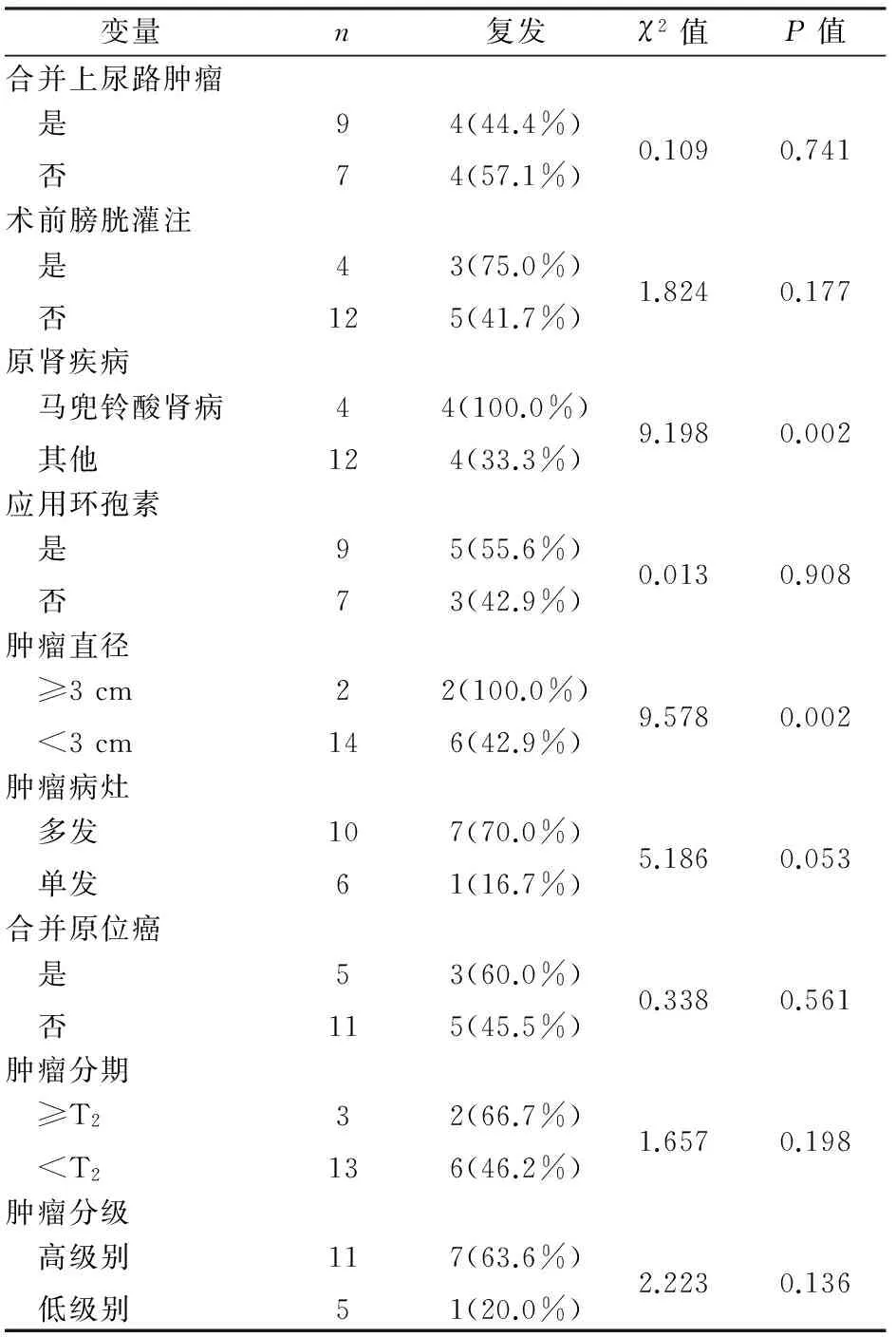
表1 影响PK-TURBT术后复发的单因素分析

表2 影响PK-TURBT术后复发的多因素Cox生存分析
3 讨论
在我国,肾移植后恶性肿瘤以尿路上皮癌最为常见(发生率1.89%~4.1%[4]),肾移植受者发生膀胱癌的相对风险度,是普通人群的2~3倍[5],而且由于免疫抑制状态、病毒感染等原因,膀胱肿瘤往往呈现多源性和高侵袭性的特点[6],高级别T1期肿瘤在移植后非肌层浸润性膀胱肿瘤中最为常见[7]。由于手术本身可能诱发排斥反应,泌尿系感染等手术并发症可能影响移植肾长期存活[8],因此,在选择治疗膀胱肿瘤的方法时,必须考虑手术安全性,最大程度保护移植肾功能。目前,PK-TURBT已成为治疗膀胱肿瘤的主要术式之一,不仅有效应用于非肌层浸润性肿瘤的治疗,而且对于部分局限浸润性肿瘤,也可作为一种选择性手术方案[9]。国内关于肾移植后膀胱癌的治疗多见于散发报道,由于病例数有限,对于手术的疗效及安全性研究较少,对术后肿瘤复发的影响因素尚待研究。
本组16例肾移植术后膀胱尿路上皮癌均成功采用PK-TURBT切除膀胱肿瘤。考虑到肾移植术后患者的特殊性,本组术中、术后3 d预防性静脉滴注甲泼尼龙,未出现围手术期移植肾急性排斥。对于肾移植术后的患者,PK-TURBT治疗膀胱肿瘤具有以下优势。①有效控制手术时间:本组膀胱多发肿瘤病例占62.5%(10/16),平均肿瘤2.5个,平均肿瘤大小2.0 cm,但手术时间控制在15~60 min。Matulewicz等[10]通过多中心研究表明,TURBT手术时间与严重并发症的发生率呈正相关,并认为对于绝大部分病例手术时间控制在60 min内是非常安全的,有助于将大多数并发症的发生率减低至1%以下。PK-TURBT具有较高的肿瘤切除效率,得益于双极等离子电切系统良好的切割效果,切割同时具有止血作用,术中视野清晰,有助于降低经尿道电切综合征的风险[9,11]。②减少膀胱穿孔等副损伤:肾移植后膀胱肿瘤病灶易呈多灶性,常累及膀胱侧壁,本组60.0%(24/40)的肿瘤位于膀胱侧壁,PK-TURBT术中闭孔神经反射发生率较低(12.5%,2/16),且无膀胱穿孔病例。双极等离子电切系统使用时,高频电流不通过人体,只在切割组织局部形成高频电流回路,汽化切割组织,热效应穿透组织表浅,可显著减少闭孔反射的发生,有效避免膀胱穿孔等术中并发症[11,12]。③降低围手术期感染风险:免疫抑制状态使感染易感性增加,长期肾移植受者泌尿系感染率可达19.21%,显著感染可诱发移植肾排斥反应,同时也是影响移植肾存活率的独立危险因素[8],因此,术中术后控制感染尤其重要。本组无显著感染(体温>38.5 ℃),与双极等离子电切系统的切割特点有关。Sugihara等[13]研究证实双极TURBT在术中切割肿瘤的同时,可以封闭创面,降低膀胱内病原体进入体内的风险,而且可以减少术后创面渗血,缩短留置尿管时间,与单极TURBT相比,可以显著降低围手术期感染发生率。
肾移植后膀胱肿瘤侵袭性较强,本组虽临床诊断为非肌层浸润性膀胱肿瘤,但术后病理分期均高于T1,而且高级别肿瘤占68.8%(11/16)。对于高危非肌层浸润膀胱肿瘤,经尿道切除术不仅要最大限度切除潜在病灶,而且应尽可能保证术后病理诊断的真实性。TURBT切除的标本,可能由于组织烧灼导致病理诊断困难,尤其是对于肾移植后的膀胱肿瘤,由于受到移植输尿管再植、膀胱慢性感染等因素的影响,常规TURBT可能会造成一部分患者的病理诊断分期被降低[2]。对于基底较窄(<1.5 cm)的肿瘤,我们在术中尽可能沿肿瘤基底部完整切除;对较大肿瘤,切除肿瘤冠部的同时对肿瘤基底部电凝,这种切除方法可以有效地封闭肌层毛细血管和淋巴管,减少术中肿瘤细胞脱落引起的种植播散,有助于降低术后复发率[14]。为更好地对肿瘤进行病理分期,我们在术中对肿瘤基底部分层切割送检,可以更好地评价肿瘤肌层浸润情况。由于双极电流的电物理学特点,在组织局部产生的热效应显著低于单极电流,因此,可以减少对切割层面细胞结构的破坏[9,12]。Venkatramani等[15]比较双极和单极电切获得的病理标本,双极电切系统可以保留95%的膀胱固有肌层,镜下创面焦灼的比例显著低于单极电切,这对于高危膀胱肿瘤的病理学分析具有重要意义。
本组PK-TURBT术后中位随访时间45个月,复发率50.0%(8/16),87.5%(7/8)术后2年内复发。尿路上皮肿瘤的复发的病理机制尚存在争议,肾移植后患者长期免疫监测功能减退,膀胱黏膜可能对致癌因素更具易感性,肾移植后免疫抑制药物可直接造成膀胱黏膜细胞DNA损害,以及潜在的慢性下尿路感染,降低膀胱黏膜的屏障功能,可能是导致复发率较高的原因[16]。Cox回归模型多因素分析结果显示原肾AAN是PK-TURBT术后复发的危险因素(HR=7.040,P=0.017),其机制为马兜铃酸在体内代谢后形成马兜铃内酰胺(aristolactam)-DNA加合物(AL-DNA adducts),后者进一步诱导p53基因突变,最终导致原癌基因激活而诱发肿瘤[17]。值得注意的是,本组8例复发中,4例原肾AAN均存在上尿路尿路上皮癌,这一结果提示原肾AAN造成膀胱复发风险提高的原因可能是由于原上尿路肿瘤的生物侵袭性较强,易于在膀胱播散种植,而并非缘于整体尿路的致癌易感性[18]。此外,肿瘤多发病灶组术后复发率虽有显著提高,但Cox因素分析显示肿瘤多发病灶不是复发的危险因素。Cox多因素分析显示肿瘤>3 cm是术后复发的危险因素(HR=8.230,P=0.046)。原发肿瘤体积较大提示肿瘤负荷较高,经尿道完全清除肿瘤的难度增加[19]。此外,本组>3 cm的肿瘤术后病理均为T2期,其中1例为低级别,提示原发肿瘤体积可能与诊断较晚有关。膀胱肿瘤主要表现为无痛性血尿,肾移植受者由于慢性泌尿系感染、原肾疾病等原因,这一症状易被忽略或漏诊,导致诊断时膀胱肿瘤已有局部进展[6]。因此,对于原肾AAN、原发病灶较大的膀胱肿瘤患者,PK-TURBT术后应更加严密地随访,必要时再次行PK-TURBT,以期降低术后复发率。
本研究由于样本量限制,一些可能影响膀胱复发的因素,如性别、肾功能情况、上尿路手术病理切缘、上尿路肿瘤的位置及病理等,在现有样本量分组下对比悬殊,无法充分体现这些因素对预后的影响,暂未做分析。Zhang等[4]研究认为免疫抑制药物本身可能对肿瘤的发生有重要意义,但尚无确切证据表明免疫抑制剂对尿路上皮肿瘤的预后造成影响,本研究未做探讨。
总之,我们认为PK-TURBT是治疗肾移植术后非肌层浸润膀胱肿瘤的有效方法,但术后仍有较高的复发率,大多数病例于术后2年内复发,原肾AAN、膀胱原发肿瘤大于3 cm的患者,术后复发风险较高。
1 张 健, 马麟麟, 解泽林, 等.我国肾移植术后新发恶性肿瘤总结分析.中华器官移植杂志, 2014, 35(12):705-710.
2 Prabharasuth D, Moses KA, Bernstein M, et al. Management of bladder cancer after renal transplantation. Urology, 2013, 81(4): 813-819.
3 姜 帅, 王国民, 孙立安, 等. 钬激光与等离子电切治疗非肌层浸润性膀胱尿路上皮癌的前瞻性随机对照研究.中国微创外科杂志, 2012, 12(11):1017-1019.
4 Zhang B, Shen C, Han WK, et al. Comparison of clinicopathologic characteristics of urothelial carcinoma between patients after renal transplantation and on dialysis. Transplantation,2014,98(5): 552-556.
5 Liu GM, Fang Q, Ma HS, et al. Distinguishing characteristics of urothelial carcinoma in kidney transplant recipients between China and Western countries. Transplant Proc, 2013, 45(6):2197-2202.
6 Medani S, O’Kelly P, O’Brien KM, et al. Bladder cancer in renal allograft recipients: risk factors and outcomes. Transplant Proc, 2014, 46(10):3466-3473.
7 Wallerand H, Ravaud A, Ferrière JM. Bladder cancer in patients after organ transplantation. Curr Opin Urol, 2010, 20(5):432-436.
8 田普训, 薛武军, 丁小明, 等.影响肾移植受者长期存活的多因素分析——单中心989例经验总结. 中华器官移植杂志, 2012, 33(12):706-709.
9 张国飞, 吴 越, 汪 清, 等.短周期多次经尿道深度电切联合膀胱灌注化疗治疗高龄T2期高危浸润性膀胱癌45例. 中国微创外科杂志, 2014, 14(8):711-712, 728.
10 Matulewicz RS, Sharma V, McGuire BB, et al. The effect of surgical duration of transurethral resection of bladder tumors on postoperative complications: An analysis of ACS NSQIP data. Urol Oncol, 2015, 33(8):338.e19-e24.
11 刘定益, 王名伟, 王 健, 等.经尿道双极等离子电切系统治疗膀胱癌85例报告. 中国微创外科杂志, 2010, 10(10):870-872.
12 Del Rosso A, Pace G, Masciovecchio S, et al. Plasmakinetic bipolar versus monopolar transurethral resection of non-muscle invasive bladder cancer: a single center randomized controlled trial. Int J Urol, 2013, 20(4):399-403.
13 Sugihara T, Yasunaga H, Horiguchi H, et al. Comparison of perioperative outcomes including severe bladder injury between monopolar and bipolar transurethral resection of bladder tumors: a population based comparison. J Urol, 2014,192(5):1355-1359.
14 Kramer MW, Rassweiler JJ, Klein J, et al. En bloc resection of urothelium carcinoma of the bladder (EBRUC): a European multicenter study to compare safety, efficacy, and outcome of laser and electrical en bloc transurethral resection of bladder tumor. World J Urol, 2015,33(12):1937-1943.
15 Venkatramani V, Panda A, Manojkumar R, et al. Monopolar versus bipolar transurethral resection of bladder tumors: a single center, parallel arm, randomized, controlled trial. J Urol, 2014, 191(6): 1703-1707.
16 Liu Y, Lu J, Hong K, et al. Independent prognostic factors for initial intravesical recurrence after laparoscopic nephroureterectomy for upper urinary tract urothelial carcinoma. Urol Oncol, 2014, 32(2):146-152.
17 Yang HY, Chen PC, Wang JD. Chinese herbs containing aristolochic acid associated with renal failure and urothelial carcinoma: a review from epidemiologic observations to causal inference. Biomed Res Int, 2014, 2014:569325.
18 Chen CH, Dickman KG, Huang CY, et al. Aristolochic acid-induced upper tract urothelial carcinoma in Taiwan: clinical characteristics and outcomes. Int J Cancer, 2013, 133(1):14-20.
19 Liu S, Hou J, Zhang H, et al. The evaluation of the risk factors for non-muscle invasive bladder cancer (NMIBC) recurrence after transurethral resection (TURBt) in Chinese population. PLoS One, 2015, 10(4):e0123617.
(修回日期:2015-10-31)
(责任编辑:李贺琼)
Outcomes and Prognostic Factors of Transurethral Bipolar Plasmakinetic Resection of the Bladder Tumor in Renal Transplant Recipients
LiuYuqing,LuJian,XiaoChunlei,etal.
DepartmentofUrology,PekingUniversityThirdHospital,Beijing100083,China
MaLulin,E-mail:malulin@medmail.com.cn
Objective To investigate the efficiency and safety of transurethral bipolar plasmakinetic resection of the bladder tumor (PK-TURBT) in renal transplant recipients, and to evaluate the risk factors of postoperative recurrence of tumor. MethodsThis retrospective study included 16 cases of clinically diagnosed superficial bladder tumors after renal transplantation. They were treated by PK-TURBT and followed by intravasical instillation from September 2009 to June 2014. In procedures, we vapo-resected and removed bladder tumors, reaching the deep muscle layer of the bladder. Risk factors of tumor recurrence were evaluated with Cox’s proportional hazards regression model analysis. Results The procedures of PK-TURBT were performed successfully with a mean operation time of 34.1 min (range, 15-60 min). Of the cases, 8 cases (8/16, 50.0%) developed recurrence during a median follow-up period of 45 months (range, 14-62 months). Among them, 7 cases (7/8,87.5%) developed recurrence within 2 years after PK-TURBT. By multivariate analyses, native aristolochic acid nephropathy (HR= 7.040, 95%CI: 1.411-35.121,P=0.017) and tumor size ≥ 3 cm (HR= 8.230, 95%CI: 1.055-59.834,P=0.046) were identified as independent predictors for the development of recurrence after PK-TURBT for bladder cancer in renal transplant recipients. Conclusions Transurethral bipolar plasmakinetic resection of the bladder tumor is effective for superficial bladder carcinoma after renal transplantation, with low risk of complications. The incidence of postoperative recurrence is high, and most subsequent cancers recur within 2 years after surgery. The recurrence risk is higher in cases with native aristolochic acid nephropathy and tumor size ≥ 3 cm.
Transurethral bipolar plasmakinetic resection of the bladder tumor; Transitional cell carcinoma; Bladder; Recurrence; Kidney transplantation
A
1009-6604(2016)04-0321-05
10.3969/j.issn.1009-6604.2016.04.009
2015-08-31)
*通讯作者,E-mail:malulin@medmail.com.cn

