PTPN22 C1858T与自身免疫性疾病相关性的研究进展
孔晓彤 王丽华 王健健 单雪 李千 张荟雪
PTPN22 C1858T与自身免疫性疾病相关性的研究进展
孔晓彤 王丽华 王健健 单雪 李千 张荟雪
蛋白酪氨酸磷酸酶非受体型22(the protein tyrosine phosphatase nonreceptor 22,PTPN22)基因的单核苷酸多态性在自身免疫性疾病中发挥着重要的作用。PTPN22 C1858T通过影响免疫细胞产生、活化及抑制T细胞受体信号系统,从而维持着机体免疫系统的动态平衡。该基因一旦发生突变,很可能导致机体自身免疫系统平衡紊乱而发生疾病。现有研究表明,PTPN22 C1858T主要与重症肌无力、系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病相关。本文就PTPN22 C1858T在自身免疫疾病发生、发展中的作用及其可能机制进行综述。
PTPN22 C1858T;单核苷酸多肽性;自身免疫疾病
自身免疫性疾病(autoimmune diseases)是指机体对自身抗原发生自身免疫反应从而导致自身组织损害所引起的疾病。近年来大量研究显示,蛋白酪氨酸磷酸酶非受体型22(the protein tyrosine phosphatase nonreceptor 22,PTPN22)基因单核苷酸多态性在自身免疫性疾病中发挥着重要的作用。目前认为,PTPN22作为多种自身免疫性疾病的易感基因,通过编码淋巴酪氨酸磷酸酶,在T细胞信号转导中起负性调节作用,对维持免疫系统平衡具有重要意义。PTPN22的基因多态性,可能导致T细胞表面受体的信号减弱和调节性T细胞出现功能缺陷,从而导致自身免疫疾病的产生。其中,PTPN22 C1858T这一位点突变已被证实与多种自身免疫疾病,如重症肌无力(myasthenia gravis,MG)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、1型糖尿病(type 1 diabetes,T1D)、类风湿性关节炎(rheumatoid arthritis,RA)及自身免疫甲状腺疾病(AITD)等自身免疫性疾病有关。本文就PTPN22 C1858T在自身免疫疾病发生中的作用及机制进行综述。
1 PTPN22概述
PTPN22基因位于1号染色体短壁上(1p13.2),编码由807个氨基酸残基组成的淋巴特异性蛋白酪氨酸磷酸酶(LYP)。LYP包含1个催化中心及4个SH3结合位点。LYP作为抑制T细胞活化家族成员之一,在自身免疫稳态中发挥重要作用。LYP羧基端中包含4个富含脯氨酸序列的基序,其中第一段基序称为P1,富含脯氨酸基序。在T细胞受体(TCR)信号转导过程中,LYP结合蛋白酪氨酸激酶(Csk)协同下调信号转导,并且通过靶向结合Csk的磷酸蛋白,对Zap70蛋白等蛋白酪氨酸激酶家族成员发挥去磷酸化作用,进而调节淋巴细胞的活性,LYP通过P1基序抑制Csk 的SH3 区域,从而抑制TCR信号系统。PTPN22 C1858T突变可以引起结合SH3 区域的密码子620 位(R620W)的精氨酸(Arg)变为色氨酸(Trp),该等位基因突变通过下调TCR 信号系统降低Csk 与T细胞的亲和力。因此,该突变基因编码的LYP在T 淋巴细胞活化的负性调控中发挥重要作用。
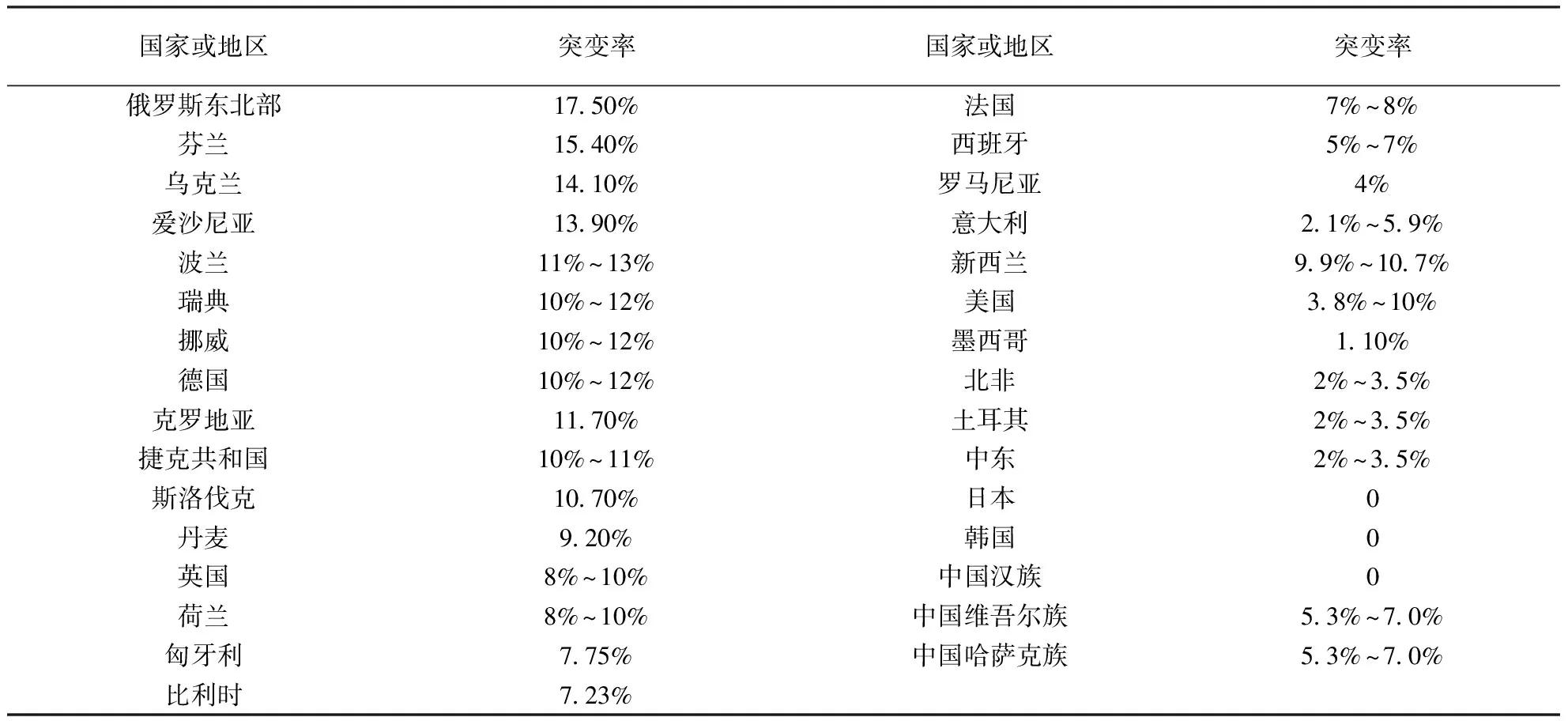
表1 不同国家和地区PTPN22 C1858T等位基因突变率
R620W位于SH3 LYP第一结合区域。有实验研究表明R620W 突变后,LYP的正常作用不能发挥,从而导致该分子不能与Csk结合,致使自身免疫性疾病发病几率增大。Csk抑制T 细胞活化是通过磷酸化Lck和Fyn(均为蛋白酪氨酸家族中的激酶)C-末端具有负性调节作用的酪氨酸而导致的,而LYP的去磷酸化发生于Lck和Fyn中的酪氨酸抑制信号转导通路过程中,因此LYP去磷酸化后,T 细胞活化的信号转导途径受到抑制。因此,当R620W 发生突变后,LYP功能失常,T细胞过度活化,从而引起疾病的发生。有关研究表明,与正常小鼠相比,LYPW619(相当于人类R620W)突变的小鼠由于钙调蛋白酶的迅速降解,导致小鼠中枢免疫器官中大量T 细胞聚集,而T 细胞大量聚集则具有促进B 细胞和树突状细胞等细胞活化的作用,从而引起了自身免疫性疾病的发生[1]。此外,LYP也可以对其他的免疫细胞,如骨髓样细胞、单核细胞、树突状细胞等产生类似影响。Zheng等[2]的研究显示,不同国家和地区PTPN22 C1858T等位基因突变率存在很大差异(表1)。
2 PTPN22 C1858T与自身免疫疾病的相关性
2.1 MG MG是乙酰胆碱受体抗体(AChR-Ab)介导的、细胞免疫依赖的和补体参与的神经-肌肉接头(NMJ)处传递障碍的自身免疫性疾病,病变主要累及NMJ突触后膜上乙酰胆碱受体(acetylcholinergic receptor,AChR)。Gregersen等[3]的大样本研究纳入了649例早发型MG患者,发现PTPN22 C1858T多态性与欧洲人中的早发型MG关系密切。Kaya等[4]的研究发现,在土耳其人群及意大利等地中海地区人群中,PTPN22C1858T单核苷酸多态性与抗乙酰胆碱受体抗体阳性重症肌无力(anti-AChR antibody positive MG,AChR-MG)密切相关,而与胸腺瘤型MG无明显相关性。虽然这一结果与有关欧洲人群研究结果不同,却与关于意大利等地中海地区人群的研究结果相符。上述现象的发生可能是由于种族遗传差异性导致的。上述研究均发现PTPN22C1858T多态性与AChR-Ab的存在密不可分,由此可以推测,PTPN22 C1858T多态性可能通过影响自身免疫细胞的调节而导致自身免疫系统紊乱,从而导致MG的发生。
2.2 SLE SLE是一种自身免疫复合物介导的累及多系统多器官、以炎性反应为特征的自身免疫性疾病。SLE是多因素疾病,环境及遗传因素均能导致该病的产生。Orozco等[5]、Kyogoku等[6]及Reddy等[7]均提出PTPN22 C1858T多态性与SLE具有相关性,而WU[8]等对北美、英国及芬兰等白种人群的研究中发现,PTPN22 C1858T多态性与单纯SLE无关,但与伴有甲状腺疾病的SLE患者有关。Hamza等[9]在针对埃及人群的研究中发现,60例SLE患者中22例(31.67%)同时患有甲状腺疾病,甲状腺过氧化物酶抗体(TPO-Ab)及甲状腺抗体(ATG-Ab)的阳性率分别为8例(13.33%)及10例(16.67%),二者均阳性者为4例(6.67%),SLE组及健康对照组中T等位基因频率差异无统计学意义(P=1.19),但R620W与并存甲状腺疾病的患有SLE的埃及人群与健康对照组差异有统计学意义(P=0.002)。Piotrowski等[10]在对波兰的人口研究中,纳入SLE患者150例、健康对照300位,通过实验得出与上述研究相似的结论(OR=2.552,95%CI=0.6748~9.6400,P=0.1675),并对T等位基因分型加以分析,进而推测环境因素及遗传异质性共同促进了PTPN22 C1858T与SLE发病中的作用。
2.3 T1D T1D又名胰岛素依赖型糖尿病(IDDM)或青少年糖尿病,主要发生于儿童及青少年,是由胰岛素分泌绝对不足导致并依赖胰岛素治疗的一种疾病。T1D中胰岛β细胞破坏所引起的自身免疫反应主要是由CD4+和CD8+T淋巴细胞介导的。除T淋巴细胞外,巨噬细胞及B细胞分别在胰岛炎性反应的早期及晚期与胰岛β细胞的破坏过程中发挥作用。对于有T1D遗传素质的个体而言,环境因素在T1D的发病中也起了重要作用,不同的环境危险因素(如病毒感染等)可能作用于其免疫应答及免疫调节的不同环节,如抗原激活、抗原呈递细胞的递呈作用、抗体产生以及T细胞的调节等,诱发或加剧T1D的发生和发展。现有研究表明,在意大利和撒丁等人群中,PTPN22 C1858T的T等位基因频率较低(2%~3 %),而在北欧及芬兰人群中,该基因频率较高(12%~15%)。Lee[11]等对欧洲11个实验研究结果进行meta分析(该分析共涉及3946个家庭),主要研究T等位基因由父代向子代的遗传率对T1D发病的影响,最终发现PTPN22 C1858T与T1D发病风险升高密切相关(OR=1.611, 95%CI:1.421~1.827,P<1×10-8)。王晓峰等[12]进行的meta分析结果也显示,在白种人群中PTPN22 C1858T与TID二者关系密切。而Thompson等[13]在研究B细胞表现改变与T1D相关性的实验中,评估了PTPN2、BACH2、PTPN22、SH2B3等4个与B细胞功能相关的T1D基因座的作用,其中PTPN22突变对B细胞表型表达并未产生明显影响,表明PTPN22基因突变与T1D发病可能并无明显的相关性,该作者认为仍需进一步扩充样本量来充分证实这一结果。
2.4 类风湿性关节炎(rheumatoid arthritis,RA) RA是一种以关节滑膜炎为特征,以慢性多发性关节炎为主要临床表现的一种自身免疫病,其病理特征是CD4+T细胞、B细胞和巨噬细胞浸润为主的关节滑膜炎性病变。RA发病机制复杂,涉及多个不同易感基因以及环境因素。国外学者在针对欧洲和北美白种RA人群的研究中发现,PTPN22 C1858T 与RA有关,而且可能是RA的易感基因之一。Begovich等[14]2004年首次提出PTPN22 C1858T与类风湿因子(RF)阳性RA有关,而与RF阴性RA无关。Salama[15]等进一步研究发现CT及TT基因型患者疾病的严重性及活动性均显著高于CC基因型,在该实验结果中,抗瓜氨酸肽抗体(anti-CCP)在绝大多数实验组样本中均升高,由此推测,anti-CCP可能与疾病的严重性及活动性有一定关系,但仍需扩大样本量来验证。近年来,抗瓜氨酸合成蛋白抗体(ACPA)逐渐得到关注,多项研究结果显示其可能与重症RA关系密切[16-18]。Taylor等[19]在实验中,选取既往有吸烟史及携带PTPN22基因作为危险因素,选取ACPA升高及骨质侵蚀破坏作为评估RA严重程度的指标,结果发现两种危险因素共同存在时,ACPA水平明显升高,而骨质侵蚀破坏的程度并未升高。该作者指出,在一些研究中,既往有吸烟史者ACPA升高风险并未增加,这可能是由于吸烟年限、数量、共同抗原簇及病程长短等混杂变量导致的,需要进一步研究分析来缩小由上述因素所带来的差异。然而,在对白俄罗斯、日本、土耳其、希腊、哥伦比亚及中国人群的研究中,并未能得出PTPN22与RA有关的结论。此外,有研究显示,中国汉族人群该等位基因频率为0,进一步提示PTPN22 C1858T多态性与汉族人群RA发病无关[20-21]。
2.5 AITD AITD包括Graves病(GD)、慢性淋巴性甲状腺炎和特发性甲状腺功能减退等疾病。AITD通常在如劳累、感染、精神创伤、应激或摄碘增多等环境因素作用下发生,其免疫学特征表现为甲状腺有淋巴细胞浸润,以及血清TSH受体抗体(TRAb)、甲状腺过氧化物酶抗体(TPOAb)和甲状腺球蛋白抗体(TGAb)异常增高。AITD的发生是遗传因素和环境因素共同作用的结果。在青年GD患者中,遗传因素扮演了比环境因素更为重要的角色[22-23]。有研究显示,PTPN22与欧洲人群AITD相关,但T等位基因在欧洲人群的分布则显示为由欧洲北部向南部递减,从芬兰人口的15.6%左右至西班牙和意大利人口的6%左右[24-26]。在亚洲人群及非裔美籍人群中则仅有极少数个体存在T等位基因。与Alkhateeb[27]的研究结果显示T等位基因频率在突尼斯AITD人群中为均为1.2%,这一结果与Ban等[28]针对亚洲人群的研究及Xue[29]等在针对中国人群的研究中的结论相似。Ban[28]等利用PTPN22 T1858位点在亚洲人群中低频率这一特点,探索PTPN22其他突变位点与AITD的相关性,虽然得到阴性结果,但这对PTPN22 C1858T进一步研究提供新的思路。
2.6 脱髓鞘疾病 MS是免疫介导的中枢神经系统慢性炎性脱髓鞘疾病。Begovich等[14]选取家系患病者血样为实验样本,探索PTPN22 C1858T与MS的相关性,结果显示,二者间并无相关性,且这一结果由全基因组关联分析组织即GWAS所证实。Bettencourt等[30]在一项有关葡萄牙人群的研究中发现,该人群中PTPN22 C1858T与MS相关性不大,但合并PTPN22 C1858T突变的MS患者可能预后更好。 Asgari等[31]在高加索人群的相关研究中发现,PTPN22 C1858T突变与另一中枢神经系统炎性脱髓鞘疾病即视神经脊髓炎(NMO)具有相关性。目前有关PTPN22 C1858T与NMO之间关系的研究较少,且各种族间差异较大,仍需进一步研究证实。
除上述疾病外,PTPN22 C1858T还与阿狄森病(Addison disease)、ANCA相关性血管炎、免疫性血小板减少症、合并其他免疫疾病的白癜风、特发性肌炎等自身免疫疾病相关,而系统性硬化(systemic sclerosis)、银屑病(psoriasis)、炎性肠病(inflammatory bowel disease,IBD)、寻常型天疱疮(PV)、原发性硬化性胆管炎、原发性胆汁性肝硬化、强直性脊柱炎等多种自身免疫疾病则可能与PTPN22无关[2]。
3 PTPN22 C1858T与自身免疫疾病发病机制的关系
3.1PTPN22 C1858T与部分自身抗体活化有关 前述PTPN22 C1858T与RF及anti-CCP阳性RA相关,而与RF及anti-CCP阴性的RA无明确联系。由T细胞介导的自身免疫疾病〔如CD(克罗恩病)、UC、MS等〕与PTPN22 C1858T无关[15,18]。由此可以推测,PTPN22可能通过影响自身抗体的产生从而导致自身免疫疾病。但是,在SSc中并未发现PTPN22与ATA或ACA自身抗体产生的相关性。在T1D患者中,PTPN22 C1858T对自身抗体的水平亦无影响。PV是一种由自身抗体介导的自身免疫疾病,但其与PTPN22无关,这可能也是反驳PTPN22通过影响自身抗体产生从而导致疾病发生这一观点的有力证据。据此推测,PTPN22 C1858T可能与部分而不是全部的自身抗体活化有关,而且自身反应抗体的活化也不是这一基因突变导致的直接结果。
3.2PTPN22 C1858T影响自身免疫细胞的产生及活化PTPN22 C1858T导致脱离胸腺选择的T细胞增多,从而导致自身免疫疾病的发生。T等位基因的错义突变减弱了T细胞受体信号,从而导致自身免疫T细胞从胸腺选择中逃离,并被释放至外周免疫系统。而且,PTPN22 C1858T错义突变同样减弱B细胞受体信号,导致B细胞增多。因此,自身反应性T、B细胞的增多导致机体罹患自身免疫疾病风险增加。Menard等[32]的研究中发现,R620W错义突变后,改变了B细胞中枢免疫耐受过程中B细胞受体(BCR)信号转导,从而降低了B细胞在中枢及外周免疫系统检查站的移除效率,这一研究表明了R620W错义突变可能增加了自身免疫B细胞的产生。Zhang等[1]在针对基因敲除小鼠的研究中发现,在表达Pep619W(相当于人类Lyp620W)的小鼠中,胸腺及脾脏均有不同程度的肿大,并伴随有T细胞增殖、活化、数目增加以及树突细胞、B细胞的活化。该实验中发现,虽然Pep(相当于人类PTPN22)转录水平在突变前后并未有很大差异,但Pep蛋白表达水平明显降低。这可能是PTPN22 C1858T通过影响自身免疫细胞的产生及活化从而逐级促进自身免疫系统应答的有力证据。
此外,越来越多研究表明PTPN22 C1858T与自身免疫疾病关系密切,而多种疾病均有特定的靶组织,如白癜风累及皮肤,免疫性血小板减少症影响血液,T1D影响胰腺,SLE累及肾脏,RA累及结缔组织,自身免疫性甲状腺疾病累及甲状腺,RA、SLE累及关节,MG累及肌肉,Addison病累及肾上腺等,PTPN22C1858T与自身免疫疾病靶组织的关系尚未明了,是否也参与了上述疾病的发病机制尚待研究。
综上所述,PTPN22是表达在多种免疫细胞上的信号受体,它抑制免疫细胞的产生、活化及T细胞受体的表达,一旦其基因发生突变,将会导致自身免疫系统平衡被破坏。而当环境因素影响组织微环境或免疫赦免扰乱时,免疫细胞侵及靶组织,从而导致自身免疫疾病产生。然而,PTPN22可影响多种免疫细胞,而非仅影响T、B细胞,因此PTPN22导致自身免疫疾病发病机制非常复杂,仍需进一步研究探索。可见,PTPN22 C1858T多态性作为影响PTPN22表达的重要因素,仍需进一步深入研究,以便为自身免疫疾病的预防及治疗开拓新的思路。
[1]Zhang J,Zahir N,Jiang Q,et al.The autoimmune disease associated PTPN22 variant promotes calpain-ediated Lyp/Pep deradation associated with lymphocyte and dendritic cell hyper-responsiveness[J].Nat Genet, 2011, 43(9): 902-907.
[2]Zheng J, Ibrahim S, Petersen F, et al.Meta-analysis reveals anassociation ofPTPN22C1858T with autoimmune disease,which depends on the localization of the affected tissue[J].Genes Immun, 2012, 13(8): 641-52.
[3]Gregersen PK, Kosoy R, Lee AT, et al. Risk for myasthenia gravis maps to a (151) Pro-.Ala change in TNIP1 and to human leukocyte antigen-B*08[J]. Ann Neurol, 2012,72(6): 927-935.
[4]Kaya GA,CoskunAN,Yilmaz V,et al.The association ofPTPN22 R620W polymorphism is stronger with late-onset AChR-myasthenia gravis in Turkey[J].PLoS One, 2014, 9(8): e104760.
[5]Orozco G, Torres B, Ortegocenteno N, et al. Association of a functional single-nucleptide polimorphism ofPTPN22,encoding lymphoid protein phosphatase,with rheumatoid arthritis systemic lupus erythematosus[J].Arthritis Rheum, 2005, 52(1): 219-224.
[6]Kyogoku C, Langefeld CD,Ortmann WA, et al.Genetic association of the R620W polymorphism of protein tyrosine phosphatase PTPN22 with human SLE[J].AMJ hum Genet, 2004, 5(3): 504-507.
[7]Reddy MV, Johansson M, Sturfelt G, et al.The R620WC/T polymorphism of the genePTPN22 is associated with SLE independently of the association of PDCD1[J].Genes Immun, 2005, 6: 658-662.
[8]WU H, CantorRM, Graham DS,et al. Association analysis of the R620W polymorphism of protein tyrosine phosphatase PTPN22 in systemic lupus erythematosus families: increased T allele frequency in systemic lupus erythematosus patients with autoimmune thyroid disease[J]. Arthritis Rheum,2005,5: 2396-2402.
[9]Hamza RT, Awwad KS, Temsah KA,et al. Temsah and Amira I. Hamed et al.:R620W polymorphism of protein tyrosine phosphatase PTPN22 in Egyptian children and adolescents with systemic lupus eryth-ematosus:relation to thyroid autoimmunity[J].Int J Adolesc Med Health, 2013,25(2):143-149.
[10]Piotrowski P, Lianeri M, Wudarski M,et al.Contribution of the R620W polymorphism of protein tyrosine phosphatase non-receptor 22 to systemic lupus erythematosus in Poland[J].Clin Exp Rheumatol, 2008, 26(6): 1099-1102.
[11]Lee YH, Bae SC, Song GG.The association betweenthe functionalPTPN221858C/T and MIF-173C/G polymorphisms and juvenileidiopathic arthritis:a meta-analysis[J].Inflamm Res, 2012, 61: 411-415.
[12]Wang XF, Chen ZX, Shao YC,et al.Population-based and Family-based studies on the protein tyrosine phosphatase non-receptor 22 gene polymorphism and type 1 diabetes: A meta-analysis[J].Gene, 2013, 517(2):191-196.
[13]Thompson WS, Pekalski M L, Simons HZ,et al.Multi-parametric flow cytometric and genetic investigation of theperipheral B cell compartment in human type 1 diabetes[J].Clin Exp Immunol, 2014, 177(3): 571-585.
[14]Begovich AB, Carlton VE, Honigberg LA,et al.A missense single-nucleotide polymorphism in a gene encoding a protein tyrosine phosphatase (PTPN22) is associated with rheumatoid arthritis[J].Am J Hum Genet, 2004,75(2):330-337.
[15]Salama A, Elshazli R, Elsaid A,et al.Protein tyrosine phosphatase non-receptor type 22 (PTPN22) +1858 C>T gene polymorphism in Egyptian cases with rheumatoid arthritis[J].Cell Immunol, 2014, 290(1):62-65.
[16]Baka Z, Buzas E, Nagy G. Rheumatoid arthritis and smoking:Putting the pieces together[J]. Arthritis Res Ther, 2009, 11(4):238.
[17]Lee DM, Phillips R, Hagan EM,et al. Quantifying anti-cyclic citrullinated peptide titres:clinical utility and association with tobacco exposure in patients with rheumatoid arthritis[J]. Ann Rheum Dis,2009,68:201-208.
[18]Pedersen M, Jacobsen S, Klarlund M,et al. Environmental risk factors differ between rheumatoid arthritis with and without auto-antibodies against cyclic citrullinated peptides[J]. Arthritis Res Ther, 2006,8(4):R133.
[19]Taylor LH, Twigg S, Worthington J, et al.Metaanalysis of the association of smoking andPTPN22 r620w genotypeon autoantibody status and radiological erosions in rheumatoid Arthritis[J].J Rheumatol, 2013, 40(7): 1048-1053.
[20]柏素云, 张立民, 王翠香, 等. PTPN22单核苷酸多态性与类风湿关节炎关系的研究[J]. 泰山医学院学报,2010, 1:100-102.
[21]张志红, 张学龙, 陈峰, 等.类风湿性关节炎相关基因PTPN22 C1858T在中国6个民族中的遗传多态性研究[J].国际遗传学杂志, 2007,30: 81-84.
[22]Tomer Y, Menconi F, Davies TF,et al.Dissecting genetic heterogeneity in autoimmune thyroid diseases by subset analysis[J].J Autoimmun, 2007,29(2-3):69-77.
[23]Hemminki K, Li X, Sundquist J, et al.The epidemiology of Graves’ disease: evidence of a genetic and an environmental contribution[J].J Autoimmun, 2010, 34(3): J307-313.
[24]Pertovaara M, Raitala A, Juonala M,et al.Autoimmunit and atherosclerosis: functional polymorphism ofPTPN22 is associated with phenotypes related to the risk of atherosclerosis.The cardiovascular risk in Young Finns study[J]. Clin Exp Immunol, 2007, 147(2): 265-269.
[25]Lopez-Escamez JA, Saenz-Lopez P, Acosta L, et al.Association of a functional polymorphism ofPTPN22 encoding a lymphoid protein phosphatase in bilateral Meniere’sdisease[J]. Laryngoscope, 2010, 120(1):103-107.
[26]Totaro MC, Tolusso B, Napolioni V, et al.PTPN22 1858C>T polymorphism distribution in Europe and association with rheumatoid arthritis: case-control study and meta-
analysis[J].PLoS One, 2011, 6(9):e24292.
[27]Alkhateeb A, MarzoukaNA,TashtoushR.Variants inPTPN22 and SMOC2 genes and the risk of thyroid disease in the Jordanian Arab population[J].Endocrine, 2013, 44(3): 702-709.
[28]Ban Y, Tozaki T, Taniyama M, et al.Association of the protein tyrosine phosphatase nonreceptor 22 haplotypes with autoimmune thyroid disease in the Japanese population[J]. Thyroid, 2010, 20(8):893-839.
[29]Xue L, Pan C, Gu Z,et al.Genetic heterogeneity of susceptibility gene in different ethnic populations: refining association study of PTPN22 for Graves' disease in a Chinese Han population[J].PLoS One, 2013, 8(12):e84514.
[30]Bettencourt A, Martins da Silva A, Pinho E Costa P,et al.Molecular genetic studies of multiple sclerosis in the portuguese population[J].Acta Med Port, 2012, 25(4):224-230.
[31]Asgari N, Nielsen C, Stenager E,et al. HLA, PTPN22 and PD-1 associations as markers of autoimmunity in neuro-myelitis optica[J].Mult Scler, 2012 ,18(1): 23-30.
[32]Menard L, Saadoun D, Isnardi I, et al. The PTPN22 allele encoding an R620W variant interferes with the removal of developing autoreactive B cells in humans[J]. J Clin Invest, 2011, 121: 3635-3644.
(本文编辑:邹晨双)
10.3969/j.issn.1006-2963.2016.06.013
哈尔滨医科大学第二附属医院神经内科
王丽华,Email:wanglh211@163.com
R392
A
1006-2963(2016)06-0442-06
2015-04-28)

