稳定过表达人野生型及致病突变A30P、A53Tα-突触核蛋白单克隆SH-SY5Y细胞株的建立
东惟玲 方琪 张秀艳 赵昀 单立冬 惠国桢
稳定过表达人野生型及致病突变A30P、A53Tα-突触核蛋白单克隆SH-SY5Y细胞株的建立
东惟玲 方琪 张秀艳 赵昀 单立冬 惠国桢
目的 利用分子克隆技术构建含人野生型(WT)及致病突变A30P(G88C)、A53T(G157A) α-突触核蛋白基因(α-synuclein gene,SNCA)的重组真核表达载体pLentiVENUS-YFP-SNCA,通过慢病毒转染的方法获得过表达人野生型及致病突变A30P、A53T α-synuclein单克隆SH-SY5Y细胞株。方法 提取红白血病细胞K562细胞总RNA,以RT-PCR法扩增SNCA,SNCA与克隆载体PMD-19T的体外连接(T-A克隆)后进行基因测序,将测序正确者以限制性内切酶酶切后与真核表达载体pLentiVENUS连接,建立野生型重组真核表达载体。取正常SNCA与克隆载体连接体,利用单核苷酸差异引物定点突变法构建SNCA的两个突变型A30P、A53T,经基因测序、酶切与真核表达载体pLentiVENUS连接,建立突变型的重组真核表达载体。以磷酸钙沉淀法转染293T细胞制备的慢病毒转染SH-SY5Y细胞,利用流式细胞仪BD AriaⅢ进行96孔板单细胞分选以获得稳定过表达人野生型及致病突变型A30P、A53T α-突触核蛋白的单克隆细胞株,并通过倒置荧光显微镜、蛋白免疫印迹、逆转录-聚合酶链反应(reverse transcriotion-polymerase chain reaction,Rt-PCR)、鉴定各单克隆SH-SY5Y细胞株是否过表达。结果 Rt-PCR及电泳结果显示所获得目的基因,基因测序结果正确;重组真核表达载体pLentiVENUS-SNCA经限制性内切酶酶切和基因测序证明构建成功。倒置荧光显微镜显示除对照组(未转染组)外,空载体转染组及载体与SNCA重组后转染组均有荧光蛋白表达;但蛋白免疫印迹结果显示载体与正常或突变的SNCA重组后转染组的蛋白含量高于空载体组。RT-PCR结果显示载体与正常或突变的SNCA重组后转染组的细胞RNA表达量高于空载体组。 结论 利用分子克隆技术和慢病毒转染技术成功建立过表达α-突触核蛋白的WT及A53T、A30P突变型SH-SY5Y单克隆细胞株。
α-突触核蛋白;真核表达载体pLentiVENUS-SNCA;单克隆SH-SY5Y细胞株
人α-突触核蛋白基因(α-synuclein gene,SNCA)定位于染色体4q21.3-q22,由6个外显子和若干个内含子组成,其翻译产物为α-突触核蛋白(α-synuclein),这种蛋白在哺乳动物脑中广泛表达,并在突触前富集[1]。SNCA基因的二次重复突变和三次重复突变与散发性和家族性帕金森病(Parkinson disease,PD)均有关系,并且该基因点突变类型A53T、A30P等会引起常染色体显性遗传形式的PD[2]。而且,病理情况下α-突触核蛋白会异常聚集,聚集的α-突触核蛋白是残存神经元内包含体——路易小体(Lewy bodies,LB)的主要成分[3],而LB是PD的主要的特征性病理改变。尽管α-突触核蛋白在PD患者和模型脑中广泛存在,但是对LB的形成导致多巴胺神经元以及其他类型神经元退变的病理生理机制目前还知之甚少。由于深入的有关SNCA突变的研究能更好的了解这种蛋白在病理生理过程中的作用,因此本文作者利用分子克隆技术构建含人野生型(WT)及致病突变型A30P、A53T的SNCA重组真核表达pLentiVENUS-YFP-SNCA,并通过慢病毒侵染的方法获得过表达人WT及致病突变型A30P、A53TSNCA单克隆人神经母细胞瘤细胞(SH-SY5Y)细胞珠,期望为进一步研究α-突触核蛋白功能及PD发病机制奠定实验基础。
1 材料和方法
1.1 材料 Trizol试剂(Ambion公司)、反转录试剂盒(Roche公司)、Taq酶(TaKaRa公司)、胶回收试剂盒(Tiangen)、质粒小提试剂盒(Biomiga公司)、质粒大提试剂盒(Invitrogen公司),胎牛血清、培养基DMEM(Hyclone公司),兔抗人α-突触核蛋白抗体(Sigma公司);人神经母细胞瘤细胞(SH-SY5Y)由苏州大学神经科学研究所惠赠,克隆载体和真核表达载体pLentiVENUS、人胚肾293细胞系(293T细胞系)、红白血病细胞(K562细胞)及Top+10菌株由苏州大学唐仲英血液病学研究室惠赠。
1.2 方法
1.2.1 SNCA的克隆及突变质粒的构建:K562细胞总RNA以Trizol法提取并逆转录为cDNA。取cDNA 2 μL,引物1 μL进行 PCR,反应设置为94 ℃ 5 min预变性,94 ℃ 30 s变性55 ℃ 30 s退火,72℃ 45 s进行产物延伸,后三步反应反复28个循环。PCR产物电泳后由离心柱式胶回收试剂盒提纯。取胶回收产物4.5 μL,加入克隆载体PMD-19T Vector 0.5 μL,Solution I 5 μL 混合为10 μL连接反应体系于16℃静置反应30 min~1 h。将上述连接液与40 μL感受态细菌TOP+10混匀,冰浴(反应管置于碎冰中,温度约为2~4℃)30 min后于42℃热激90 s,置冰浴(同上) 2 min转化感受态细菌。加入异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)7 μL、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl β-D-galactopyranosid,X-gal)10 μL混匀,将细菌涂布于含氨苄青霉素的平板上,于37 ℃倒置过夜即可观察到蓝白斑,即蓝白相间的菌落(其中白色菌落为含有外源插入片段的转化子,蓝色菌落是载体自连的转化子)。筛选出白色阳性菌抽提质粒,以限制性内切酶BglⅡ酶切后进行琼脂糖凝胶电泳鉴定目的基因是否插入质粒,阳性者可以看到大小约为480 bp的基因序列。取阳性者送苏州金唯智公司测序,测序结果利用NCBI软件与基因图谱进行比对,以配对率为100%认为所获基因序列测序正确。
取测序正确的目的基因与克隆载体连接体,利用单核苷酸差异引物定点突变法[4]构建突变质粒,反应体系为Nuclease-Free Water 35 μL,Reaction Buffer 5 μL,引物 2 μL,dNTP 4 μL,待突变质粒模板 3 μL,总体积为49 μL,适当混匀加入1 μL DNA Polymerase。PCR设置为99℃热盖,95℃ 1 min预变性,95℃ 40s变性,60℃ 1 min退火,68 ℃ 3.5 min延伸,72℃ 10 min延伸补全,以上6个步骤进行18个循环。反应完成后直接在PCR反应体系中加入1 μL Dpn I消化,混匀后于37 ℃孵育1 h。反应产物与40 μL感受态细菌混匀转化感受态细菌,将混合液涂布于含氨苄青霉素的平板上板,倒置过夜。挑取单菌落,提取质粒,送检行基因测序,若突变成功可以看到A30P的序列88位G碱基变为C碱基,A53T的序列157位G碱基突变为A碱基。构建突变质粒的引物由上海生工生物有限公司合成,SNCA PCR引物序列为:正向为GGAAGATCTGTGTGGTGTAAAGGAAT
TCATT,反向为GGAAGATCTAGAAACTGGGAGCAAAGATA;两端引入BglⅡ的酶切位点(AGATCT);单核苷酸差异引物定点突变引物序列:A30P引物序列为:正向为GCACCAGGAAAGACAAAAGAGGGTGTTCTC,反向 GG
TGCTTCTGCCACACCCTGTTTGGTTTTC;A53T引物序列为:正向为GTGACAACAGTGGCTGAGAAGACCAAAGAG,反向为TTGTCACACCATGCACCACTCCCTCCTTGGTT。
1.2.2 重组真核表达载体的构建:将测序正确的目的基因与克隆载体连接的重组体进行限制性内切酶酶切,反应体系为10×Buffer 2 μL,BglⅡ1 μL,质粒DNA17 μL,反应完成后进行琼脂糖凝胶电泳,割胶回收酶切片段,T4 DNA连接酶连接Venus后于16℃过夜,连接体系为线性化Venus 1 μL,T4 DNA连接酶1 μL,10×T4 Buffer 1 μL,酶切片段 7 μL。以同样方法将连接液转化感受态细菌涂板,挑单菌落,抽提质粒,经酶切鉴定连接顺序的正反向,正向连接者可以看到大小约为800 bp的条带出现,选取正向连接者送检行基因测序,测序正确者可以看到WT的基因序列与基因图谱配对率100%,A30P的序列88位G碱基变为C碱基,A53T的序列157位G碱基突变为A碱基,测序结果与未和真核表达载体连接前相同。
1.2.3 病毒包装及细胞转染:将野生型及两种突变型重组真核表达载体转化感受态细菌混合液涂布于LB平板上,挑取单菌落利用质粒大量抽提试剂盒大量抽提质粒。分别将对照空载体Venus和抽提的目的质粒(10 μg)和慢病毒包装必需的三种公共质粒ΔR(6.5 μg)、VSV-G(3.5 μg)和Rev(2.5 μg)混匀,加入Cacl250 μL,混匀后逐滴加入2×Hank’s 平衡盐溶液(HBS),待有乳白色沉淀时加入293 T细胞中混匀,将293T细胞放回培养箱继续培养(293T细胞会胞吞含有质粒的颗粒,在细胞内合成慢病毒,然后利用胞吐作用将慢病毒吐出到培养基中),48 h和72 h后收集含有慢病毒的培养液混合,过滤去掉细胞碎片等杂质后分装于-80 ℃保存。将所获得的病毒10 μL加入SH-SY5Y细胞培养基中侵染SH-SY5Y细胞,24 h后更换新的培养基洗脱病毒,以防止病毒对细胞的继续毒性作用,继续培养细胞48 h后,通过流式细胞仪分选表达荧光蛋白的阳性细胞 ,并将单个阳性细胞打入96孔板中,每孔加含双抗的培养基200 μL,1周后观察细胞生长状况,并移入24孔板扩大培养,待细胞长满整个孔的80%左右时于250倍倒置荧光显微镜下观察。如图1所示为真核表达载体pLentiVENUS的结构图,α-突触核蛋白与荧光蛋白由核糖体载入位点序列(internal ribosome entry site,IRES)相连,IRES可翻译一条mRNA上的两个开放读框,由其连接的两个基因的表达率相同,可以通过观察荧光蛋白的水平来判断α-突触核蛋白的表达水平。表达载体可发出黄色荧光,置于倒置荧光纤维镜的绿色滤光片下,可见绿色荧光出现,通过荧光蛋白的表达来观察α-突触核蛋白的表达。
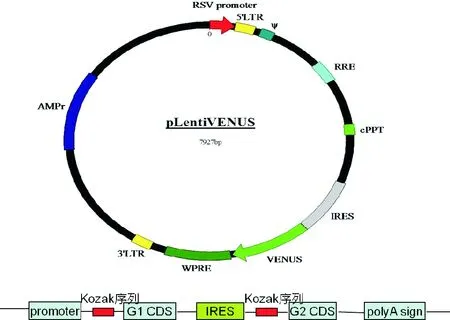
图1 pLentiVENUS的结构图
1.2.4 Western blot法检测α-突触核蛋白表达:将1.2.3中慢病毒转染后的细胞用胰酶消化,用磷酸盐缓冲液PBS洗两遍后加入细胞裂解液超声裂解,冰上放置1 h后于4℃ 12 000 g离心10 min,离心后的上清即为获得的细胞总蛋白,取适量用于蛋白浓度测定,其余蛋白-80℃保存。根据测定的蛋白浓度,用裂解液将蛋白均稀释至最小浓度 (一般为2.0μg/mL左右),加入上样缓冲液后置98℃ 5 min使蛋白变性,由于本实验中需要观察的蛋白α-突触核蛋白和内参蛋白β-actin的分子大小分别是43 000及19 000 ,选用中等浓度12%(最佳分离范围12 000~60 000)分离胶电泳,电泳完成后将胶上的蛋白转到NC膜上然后用5%脱脂奶粉或封闭液进行封闭2 h,封闭液浓度过高显示蛋白的特异性差,浓度过低又不容易显色,故选用5%的浓度,将稀释过的一抗(α-突触核蛋白 1︰1000,内参蛋白β-actin 1︰1000)加入玻璃皿中覆盖NC膜,4℃冰箱内于摇床上缓慢孵育过夜。次日洗膜后以HRP耦联的二抗孵育2 h,采用凝胶成像仪ECL显色,通过用Image Lab 3.0软件捕获不同曝光时长的图像并保存,观察空载体转染组及载体与SNCA(包括WT、A30P及A53T)重组后转染组蛋白条带的颜色深浅,如果有α-突触核蛋白过表达,可以看到分子量为19 000的蛋白条带颜色较深。
1.2.5 Rt-PCR法检测mRNA水平:Trizol法提取1.2.3步骤中慢病毒转染后获得的细胞总RNA,并逆转录为cDNA,以此为模板进行PCR,反应体系为25 μL,包括LA Taq酶0.25 μL、2×buffer 12.5 μL、cDNA 0.5 μL、dNTP 2 μL、primer 0.5 μL,以无菌水补足25 μL。反应设置为94℃ 5 min预变性,94℃ 30 s变性,55℃ 30 s退火,72℃ 45 s进行延伸,后三步反应反复28个循环。PCR反应完成后进行琼脂糖凝胶电泳,通过观察空载体转染组及载体与SNCA(包括WT、A30P及A53T)重组后转染组的条带的亮度来观察DNA水平进而观察逆转录前的mRNA水平,如果有α-突触核蛋白过表达,会看到480 bp处的条带较亮。
2 结果
2.1SNCAPCR获得目的片段、载体连接及酶切鉴定 提取细胞总RNA,逆转录为cDNA,加入SNCA引物进行PCR,产物进行琼脂糖凝胶电泳,电泳结果显示有分子大小约480 bp左右的条带出现(图2A),即SNCA。PCR产物与克隆载体连接后用限制性内切酶BglⅡ酶切再次鉴定,依然可以看到分子大小约480 bp左右的条带(图2B)。将剩余的与克隆载体连接后的质粒进行基因测序,测序正确的质粒用限制性内切酶BglⅡ酶切,再次电泳可见分子大小约480 bp左右的条带(图2C)。
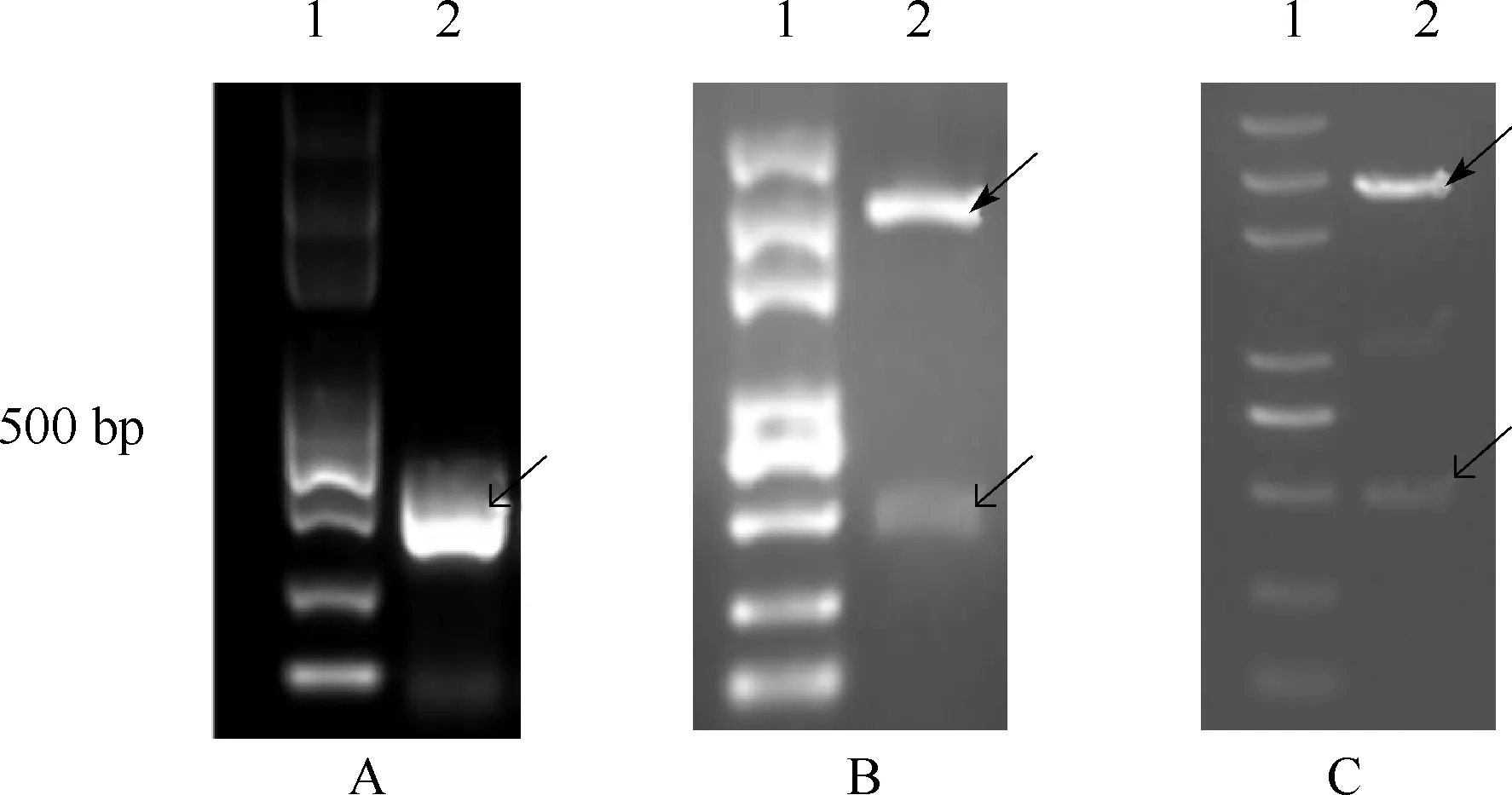
A:SNCA PCR产物;B:SNCA与克隆载体连接后利用限制性内切酶酶切;C:测序正确的质粒酶切后电泳图;1:Marker;2:PCR产物;载体:图中黑箭头所示;SNCA:图中燕尾箭头所示 图2 SNCA RT-PCR、载体连接及酶切鉴定
2.2SNCATA克隆及重组表达载体的测序SNCA与克隆载体连接后进行基因测序,利用NCBI软件将测得的序列与基因图谱进行比对正确率达100%(图3),即获得了正确序列的SNCA。利用单核苷差异引物定点突变法使SNCA发生突变,基因测序结果与正常基因进行比对,结果可见A30P突变型的序列(图4A)88位碱基由正常的G变为C,A53T突变型的序列(图4B)157位碱基由G变为A,获得了两种突变型的SNCA。
2.3SNCA与真核表达载体连接 目的基因与真核表达载体pLentiVENUS连接后转染感受态细菌,挑单菌落,抽提质粒,经酶切鉴定连接顺序的正反向,正向连接者可以看到分子量约为800 bp(见图5中样本6所示)。
2.4 各组α-突触核蛋白表达比较 倒置荧光显微镜下可见除未转染慢病毒的对照组细胞外,其余4种细胞,即空载体转染组及载体与SNCA重组后转染组均带有荧光(图6)。
Western blot结果显示,各组内参β-actin的表达相近,WT及两种突变型的SH-SY5Y细胞均有Mr约为19 000的蛋白条带出现,二转染空载体的细胞几乎看不到蛋白条带(图7)。

Query:T-A连接后的测得的序列;Sbjet:正常基因图谱;Identities:匹配率 图3 SNCA 与克隆载体连接后的测序结果与正常SNCA基因图谱比对结果

图4 突变型SNCA与正常基因序列比较:A30P突变型的序列88位碱基由正常的G变为C,A53T突变型的序列157位碱基由G变为A
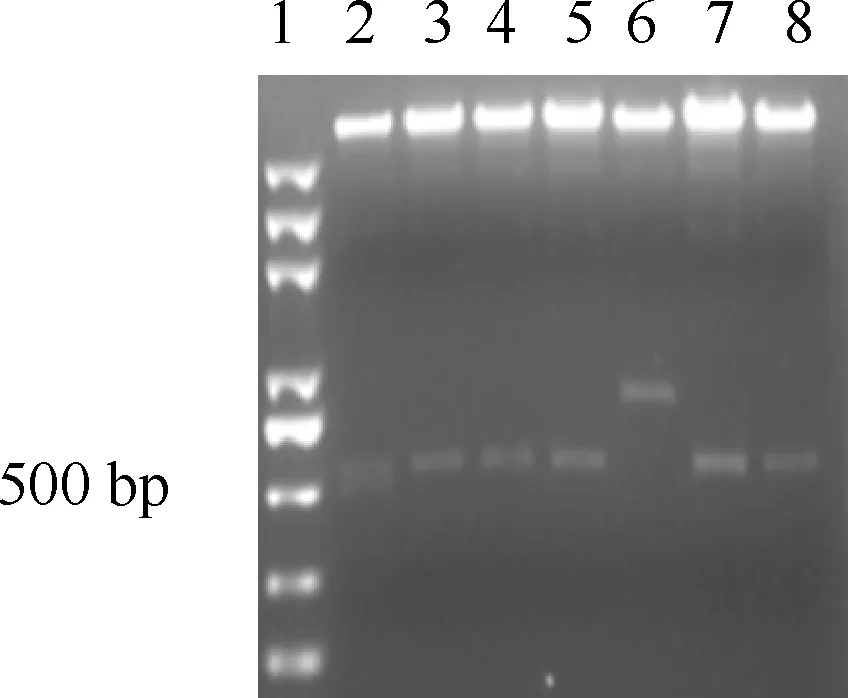
1:Marker;2-8表示不同的菌落样本 图5 SNCA与真核表达载体连接后酶切产物电泳图
Rt-PCR法检测SNCAmRNA水平,结果显示,四种细胞均可见大小100 bp左右、亮度相近的β-actin条带,WT及A30P、A53T突变型细胞扩增后均出现大小为480 bp左右的条带,空载体转染过的细胞也有相同大小条带出现,但亮度很低(图8)。
3 讨论
脂质体转染法和病毒介导的转染法是目前常用的细胞转染技术。现有众多的文献报道均认为,脂质体本身会参与细胞生理活动,引起基因表达的上调或下调,如参与蛋白激酶C(PKC)通路调节、抑制ATP酶的活性[14]等;自噬通路的抑制被认为是PD发病的主要因素,而脂质体转染过程中的血清剥夺会对自噬产生显著的影响,这些会对相关研究结果产生严重干扰,甚至影响研究结论。病毒载体转染因其转染效率高目前也应用较多,常用的病毒载体有腺病毒、γ-逆转录病毒和慢病毒,其中慢病毒应用最为广泛。慢病毒是一种复杂的逆转录病毒,病毒颗粒中含有线性的单链RNA基因组的同型二聚体,其与γ-逆转录病毒相似,可以将目的基因稳定插入宿主染色体中,使目的基因持续表达,与逆转录不同的是,慢病毒可以转染分裂期和非分裂期的细胞并可以保持目的基因长期表达;且载体转染后没有病毒蛋白的表达,不产生任何有效的细胞免疫应答,对宿主没有毒性,因此,慢病毒转染具有更为广阔的应用前景。因为SH-SY5Y能过表达标志性多巴胺β-羟化酶和酪氨酸羟化酶活性,具有许多神经元的生化和功能特征,常常被用来做PD细胞模型用来研究PD的发病机制,所以本文选择SH-SY5Y作为转染的对象。

A:对照组(未进行慢病毒转染的正常细胞);B:空载体转染组;C:WT转染组(载体与SNCA重组后转染组);D:A30P突变型转染组(载体与A30P突变型SNCA重组后转染组);E:A53T突变型转染组(载体与A53T突变型SNCA重组后转染组) 图6 各组细胞荧光蛋白表达比较(倒置荧光纤维镜×250)
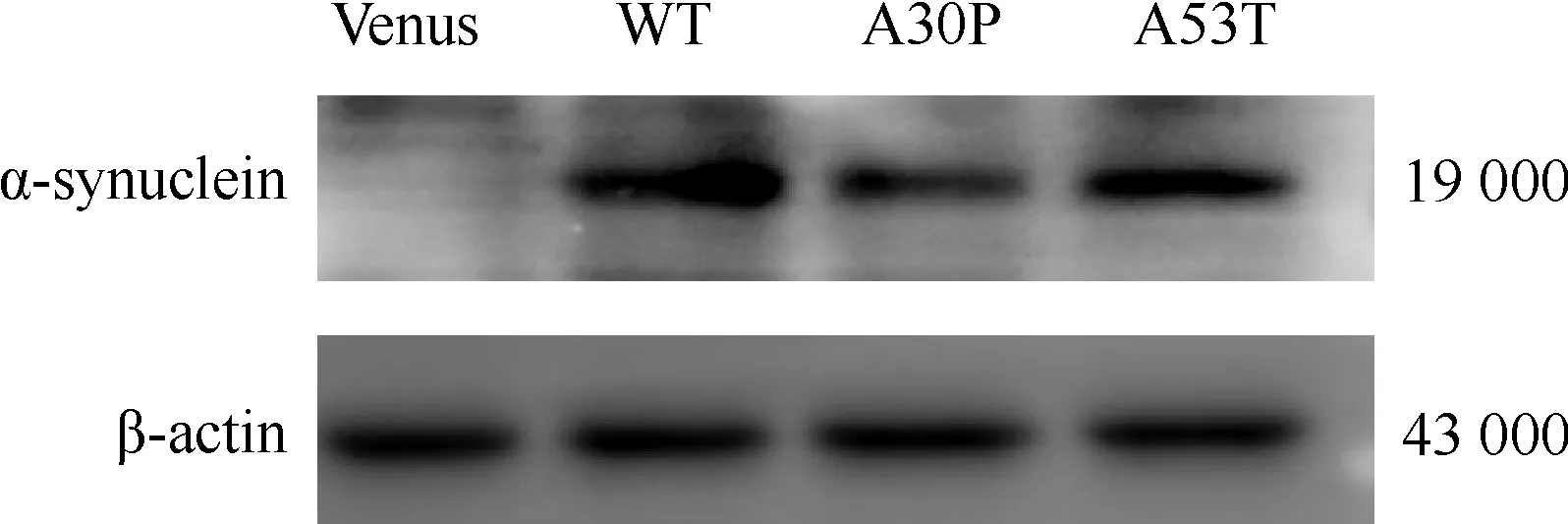
Venus:空载体转染组;WT:载体与A30P突变型SNCA重组后转染组;A30P:载体与A30P突变型SNCA重组后转染组;A53T:载体与A53T突变型SNCA重组后转染组;α-synuclein:α-突触核蛋白 图7 各组α-突触核蛋白表达比较(免疫印迹法)

Venus:空载体转染组;WT:载体与A30P突变型SNCA重组后转染组;A30P:载体与A30P突变型SNCA重组后转染组;A53T:载体与A53T突变型SNCA重重组后转染组;α-synuclein:α-突触核蛋白 图8 各组SNCA mRNA表达水平比较(Rt-PCR法)
本实验中使用的真核表达载体pLentiVENUS-YFP是一个大小为7927 bp的环形DNA分子,包含有一段核糖体IRES,它可翻译一条mRNA上的两个开放读框,由其连接的两个基因的表达率相同,前后的两个基因分别为荧光蛋白和SNCA所取代,因此可以通过测定荧光蛋白的表达来检测SNCA的表达。只要有表达载体转染就会有荧光蛋白的表达(图6)。但是在空载体与目的基因转染组都有荧光蛋白的表达,二者之间单纯通过荧光显微镜不能区分,还需进一步区分。因此,本研究利用PCR技术进行mRNA水平的检测,在内参表达量相同的情况下,空载体与目的基因转染组都能扩增出大小为480 bp左右的条带,但是与目的基因转染组相比,空载体转染组条带亮度很低,所以空载体转染组转录的mRNA水平较低(图8)。由于不能保证所有mRNA都会编码蛋白,故本实验中还利用蛋白免疫印迹方法在蛋白水平上进行检测,结果同样表明转染目的基因的细胞,不论是WT还是突变型α-突触核蛋白(A30P、A53T)水平都较空载体表达率高(图7)。可见,所以本实验获得的SH-SY5Y细胞株是过表达α-突触核蛋白的细胞株,从蛋白的转录与翻译水平均可表明,结果准确可靠。SNCA的突变是第一个被确认的引起PD的遗传因素,SNCA所编码的蛋白α-突触核蛋白是含140个氨基酸的蛋白质。这种蛋白在1988年首次被Maroteaux等[5]描述为分布在突触前神经末梢和核内的特异性神经元蛋白,并因此命名为突触核蛋白。α-突触核蛋白受到广泛关注始于1997年发现编码该蛋白的一个基因突变与家族早发性PD相关[2]。LB中检测到α-突触核蛋白也进一步支持这种蛋白在PD和路易体痴呆这些突触蛋白病的发病机制中发挥重要作用。尽管α-突触核蛋白与PD密切相关,但是α-突触核蛋白与黑质纹状体多巴胺能神经元的退变、LB的形成等病理生理机制还不是很清楚。许多证据表明,α-突触核蛋白在神经递质的释放方面有重要作用[6]。α-突触核蛋白的过表达对神经元有毒性作用,包括促进氧化应激[7-8]、蛋白聚集[9-10]和线粒体功能紊乱[11-12],不管是野生型还是突变型过表达的α-突触核蛋白都会引起神经元的功能缺失和退变[6,13]。过表达α-突触核蛋白的转基因果蝇和转基因小鼠都会出现PD症状,当SNCA敲除小鼠α-突触核蛋白缺乏时会出现线粒体毒素引起的细胞毒性抵抗[15-16]。以上研究的前提是有可靠的实验模型,所以本文通过分子克隆技术和慢病毒转染技术成功建立过表达α-突触核蛋白的WT及A53T、A30P突变型SH-SY5Y单克隆细胞株,可能为进一步研究α-突触核蛋白的作用提供可靠的细胞实验模型。
综上可见,本研究对SNCA重组真核表达载体的构建和过表达人野生型及致病突变A30P、A53Ta-synuclein单克隆SH-SY5Y细胞株的建立,为建立更加合理高效的PD细胞模型提供了实验方法,为今后探讨α-突触核蛋白在多巴胺能神经细胞变性坏死中的作用、PD的发病机制以及临床治疗的靶点奠定了一定实验基础。
[1]Chen X, de Silva HA, Pettenati MJ, et al. The human NACP/alpha-synuclein gene: chromosome assignment to 4q21.3-q22 and TaqI RFLP analysis[J]. Genomics,1995,26(2):425-427.
[2]Polymeropoulos MH, Lavedan C, Leroy E, et al. Mutation in the alpha-synuclein gene identified in families with Parkinson’s disease[J]. Science,1997,276(5321):2045-2047.
[3]Shults CW. Lewy bodies[J]. Proc Nael Acad of Sci U S A,2006,103(6):1661-1668.
[4]Choong CJ, Say YH. Neuroprotection of alpha-synuclein under acute and chronic rotenone and maneb treatment is abolished by its familial Parkinson’s disease mutations A30P, A53T and E46K[J]. Neurotoxicology,2011,32(6):857-863.
[5]Maroteaux L, Campanelli JT, Scheller RH. Synuclein: a neuron-specific protein localized to the nucleus and presynaptic nerve terminal[J]. J Neurosci,1988,8(8):2804-2815.
[6]Nemani VM, Lu W, Berge V, et al. Increased expression of alpha-synuclein reduces neurotransmitter release by inhibiting synaptic vesicle reclustering after endocytosis[J]. Neuron,2010,65(1):66-79.
[7]Chan T, Chow AM, Cheng XR, et al. Oxidative stress effect of dopamine on alpha-synuclein: electroanalysis of solvent interactions[J]. ACS Chem Neurosci,2012,3(7):569-574.
[8]Siddiqui A, Chinta SJ, Mallajosyula JK, et al. Selective binding of nuclear alpha-synuclein to the PGC1alpha promoter under conditions of oxidative stress may contribute to losses in mitochondrial function: implications for Parkinson’s disease[J]. Free Radic Biol Med,2012,53(4):993-1003.
[9]Lastres-Becker I, Ulusoy A, Innamorato NG, et al. alpha-Synuclein expression and Nrf2 deficiency cooperate to aggravate protein aggregation, neuronal death and inflammation in early-stage Parkinson’s disease[J]. Hum mol Genet,2012,21(14):3173-3192.
[10]Wu J, Lou H, Alerte TN, et al. Lewy-like aggregation of alpha-synuclein reduces protein phosphatase 2A activity in vitro and in vivo[J]. Neuroscience,2012,207:288-297.
[11]Devi L, Anandatheerthavarada HK. Mitochondrial trafficking of APP and alpha synuclein: Relevance to mitochondrial dysfunction in Alzheimer’s and Parkinson’s diseases[J]. Biochim Biophys Acta,2010,1802(1):11-19.
[12]Wu F, Poon WS, Lu G, et al. Alpha-synuclein knockdown attenuates MPP+induced mitochondrial dysfunction of SH-SY5Y cells[J]. Brain Res,2009,1292:173-179.
[13]Burre J, Sharma M, Tsetsenis T, et al. Alpha-synuclein promotes SNARE-complex assembly in vivo and in vitro[J]. Science,2010,329(5999):1663-1667.
[14]Chesselet MF. In vivo alpha-synuclein overexpression in rodents: a useful model of Parkinson’s disease?[J]. Exp Neurol,2008,209(1):22-27.
[15]Irvine GB, El-Agnaf OM, Shankar GM, et al. Protein aggregation in the brain: the molecular basis for Alzheimer’s and Parkinson’s diseases[J]. Mol Med,2008,14(7-8):451-464.
[16]Datiles MJ, Johnson EA, McCarty RE. Inhibition of the ATPase activity of the catalytic portion of ATP synthases by cationic amphiphiles[J]. Biochim Biophys Acta,2008,1777(4):362-368.
(本文编辑:邹晨双)
Establishment of monoclonal SH-SY5Y cell lines overexpressing WT,mutation A30P and A53T α-synuclein
*DONGWeiling,FANGQi*,ZHANGXiuyan,ZHAOYun,SHANLidong#,HUIGuozhen△.
#DepartmentofNeurology,TheFirstAffiliatedHospitalofSoochowUniversity,SuzhouJiangsu,215006,China;△NeurobiologyDepartmentofSoochowUniversity,Suzhou,Jiangsu, 215123,ChinaCyrusTangHematologyCenterofSoochowUniversity,SuzhouJiangsu,215123,China.
Corresponding author:SHAN Lidong,Email:danlidong@suda.edu.cn;HUI Guozhen,Email: guozhen-hui@163.com
*These authors contributed equally to the work.
Objective To establish recombinant eukaryotic expression vector pLentiVENUS-YFP-SNCAincluding Wild-type(WT) and A30P(G88C),A53T(G157A)α-synuclein gene(SNCA)and monoclonal SH-SY5Y cell lines overexpressing WT, mutation A30P and A53T α-synuclein by molecular cloning techniques and lentivirus infection method. Methods SH-SY5Y cells overexpressing WT α-synuclein was generated, RNA extracted from k562 cells was reversely transcribed with reverse transcriptase into cDNA, and PCR was used to amplify humanSNCA. The gene was sequenced after T-A clone(in vitro ligation of SNCA and cloning vector PMD-19T) and then the right one was digested by restriction endonuclease. The right sequence was ligated into the eukaryotic expression vector pLentiVENUS-YFP. WT recombinant eukaryotic expression vector was established. The familial PD-linked A53T and A30P mutation were generated by site-directed gene mutagenesis using primer difference in mononucleotide on the base of WTSNCA. We confirmed the orientation and sequence of each construction by restriction analysis and sequencing. We obtained the lentiviral vector containing the recombinant eukaryotic expression vector of pLentiVENUS-YFP-SNCAby calcium phosphate precipitate method in 293T cells. Then these lentiviral vectors infected SH-SY5Y cells, and then positive cells were sorted by BD AriaⅢ. Finally, the expression levels of α-synuclein were assessed by inverted fluorescence microscope, protein immunoblot,and RT-PCR. Results The results of PCR and gene sequence detection shown that we obtained objective gene. The recombinant eukaryotic expression vector pLentiVENUS-SNCAwere built, and checked by restriction enzyme digestion and sequencing. Inverted fluorescence microscope showed that cells expressed fluorescence protein except nontransfected cells, which indicated plasmids expressed. The result of protein immunoblot and RT-PCR proved that the protein content and RNA expression level were higher in the cells transfected with SNCA than the empty vector group. Conclusions We successfully establish the monoclonal SH-SY5Y cell lines overexpressing WT, mutation A30P and A53T α-synuclein by molecular cloning techniques and lentiviral vector infection.
α-synuclein; eukaryotic expression vector pLentiVENUS-SNCA; monoclonal SH-SY5Y cell lines
10.3969/j.issn.1006-2963.2016.06.006
苏州市科技计划项目基金(基金编号:SYS201103)
215006苏州大学附属第一医院神经内科(东惟玲、方琪*、惠国桢);215123苏州大学医学部神经生物学教研室(东惟玲、单立冬);215123唐仲英血液病学研究中心(张秀艳、赵昀)
单立冬,Email:danlidong@suda.edu.cn;惠国桢,Email:guozhen-hui@163.com
R742.5
A
1006-2963(2016)06-0408-07
2014-11-13)
*与第一作者工作同等重要

