MMP21 MMP28与胃癌进展及不良预后的相关性研究
颜文辉 马杰
MMP21 MMP28与胃癌进展及不良预后的相关性研究
颜文辉 马杰
目的观察人胃癌组织MMP21和MMP28的表达,探讨其与临床病理特征和预后的关系。方法应用免疫组化法检测436例胃癌组织和92例癌旁胃组织MMP21和MMP28的表达,分析其与胃癌进展及不良预后的相关性。结果在胃癌组织中,MMP21、MMP28的阳性检出率分别为31.9%(139/436)和34.4%(150/436);而92例癌旁胃组织中,MMP21、MMP28均为阴性。在胃癌组织中,MMP21和MMP28的阳性表达与肿瘤大小、浸润深度、血管侵袭、淋巴结、远处转移及TNM分期相关。总生存率在阳性患者比阴性患者低。Cox多因素分析表明在胃癌患者中MMP21、MMP28是生存的独立预测因素。结论MMP21、MMP28与胃癌的侵袭、转移和预后密切相关,其可能成为新的、独立的预后指标。
MMP21 MMP28 胃癌 TMA 肿瘤进展 预后
胃癌是全世界最常见肿瘤之一,在所有癌症病死率排名中位居第二,尤其在东亚和中国。因此,阐明胃癌病理机制并探寻有价值的预后指标和新的治疗策略意义重大。人基质金属蛋白酶(MMPs)包括胶原酶型(MMP-1,-8和-13),明胶酶型(MMP-2和-9),间质溶解素型(MMP-7和-26)和膜型基质金属蛋白酶型(MMP-14,-15,-16,-17,-24和-25)以及其他基质金属蛋白酶(MMP-19,-20,-21,-23和-28)。目前研究发现,在胃癌中,MMP-2,MMP-21,MMP-9,MMP-3,MMP-7和MMP-13的过表达与肿瘤侵袭性相关[1-3]。但MMP21和 MMP28在胃癌中表达情况和作用尚无详细报道。本实验研究胃癌中MMP21和MMP28的表达情况,并探讨其临床特征和胃癌总体生存率的相关性。
1 临床资料
1.1 一般资料 收集2003年1月至2008年1月浙江省人民医院胃癌组织标本436例及癌旁组织标本92例。男311,女125例;年龄17~91岁(平均年龄60岁),且术前未进行放化疗。所有原发肿瘤标本的组织形态学均经苏木精-伊红染色病理组织镜检证实。性别、年龄、分化程度、淋巴结转移和TNM分期临床参数收集后制成资料库(见表1)。从诊断到死亡或最后1次随访计算总生存期,通过电话访问和问卷调查的形式,每3个月更新1次随访信息,死亡患者由家属和备案材料证实,随访5年。本项目经浙江省人民医院伦理委员会批准。
1.2 方法 通过免疫组化对正常胃黏膜和胃癌中MMP21、MMP28的表达进行评估。组织切片(4μm)经过二甲苯脱蜡,梯度酒精脱水。切片浸入枸橼酸抗原修复缓冲液进行高压修复3min;每张切片加1滴3%H2O2,孵育15min,以阻断内源性过氧化物酶的活性;1%牛血清白蛋白孵育阻断非特异性结合。切片冲洗,用兔抗MMP21单抗(PBS稀释250倍;ab52817,Abcam,Cambridge,USA)和兔抗MMP28单抗(PBS稀释250倍;ab155507,Abcam,Cambridge,USA)染色,4℃过夜。正常山羊血清作为阴性对照组。滴加辣根过氧化物酶标记的二抗,室温下孵育20min。最后,DAB显色,切片用苏木精复染。每张切片由2名病理科医师分别计数,并进行免疫组化评估。通过观察在光学显微镜下的平均信号强度(0~3等级)和阳性细胞百分比(0:<5%;1:5%~25%;2:26%~50%;3:51%~75%;4:76%~100%)评估每张切片的免疫反应水平。积分为强度和阳性表达细胞数两项记分之和:0~3分为阴性,4~12分为阳性[4]。
1.3 统计学方法 采用SPSS 11.0统计软件。计数资料行χ2检验或Fisher检验。生存曲线用K-M法评估,并用log-rank检验计算曲线间的差异。使用Cox比例风险回归模型进行多因素分析。使用Pearson相关分析方法估计蛋白质表达和临床病理结果之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征 436例胃癌患者,并根据WHO胃癌组织分类标准进行分类,其中乳头状腺瘤16例、管状腺瘤326例、黏液腺瘤29例和印戒细胞癌65例。高分化13例、中分化128例、低分化293例、未分化2例。根据TNM分期标准、I期90例、II期104例、III期173例、IV期69例。血管侵犯253例、无血管侵犯183例。淋巴结转移270例、无淋巴结转移166例。远处转移61例、无远处转移375例。
2.2 MMP21、MMP28在胃癌中表达的临床病理学 通过观察436例患者标本中MMP21、MMP28阳性染色情况表明,黄棕色颗粒主要位于胃癌细胞胞浆,而在正常胃上皮细胞中染色阴性(见图1、2)。胃黏膜固有层细胞中检出的阳性染色为非特异性染色,不进行染色评估。在胃癌组织中,MMP21、MMP28的阳性检出率分别为31.9%(139/436)和34.4%(150/436),而正常胃组织样本中MMP21、MMP28染色均为阴性。Cox多因素分析表明在胃癌患者中TNM分期、Lauren分型及MMP21和MMP28表达为独立预后因子。因此,在胃癌患者中MMP21和MMP28是生存的独立预测因素。见表1、2。

表1 胃癌患者MMP21、MMP28表达阳性的相关因素[n(%)]
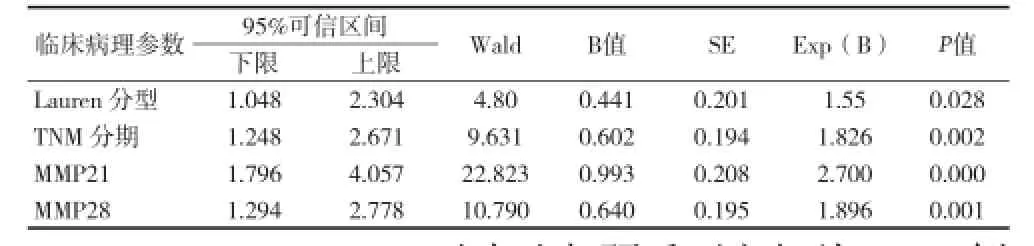
表2 Cox回归分析
2.3 MMP21、MMP28过表达与预后不良相关 260例胃癌患者MMP21、MMP28表达阴性;113例MMP21、MMP28表达均阴性。MMP21、MMP28之间有明显相关性(r=0.675,P<0.001)。在436例胃癌患者中,MMP21阳性患者的中位生存时间较MMP21阴性患者明显缩短[(27.95±1.19)个月:(50.42±0.86)个月,P<0.001];MMP21阳性患者5年生存率较MMP21阴性患者明显缩短(7.9%,11/139:56.2%,167/297,P<0.001)。同样,MMP28阳性患者的中位生存时间较MMP21阴性患者明显缩短[(29.06±1.27)个月:(50.73±0.85)个月,P<0.001];MMP28阳性患者5年生存率较MMP28阴性患者明显缩短(9.3%,14/150:57.3%,164/286,P<0.001)。在436例胃癌患者中,MMP21和MMP28均阳性患者的中位生存时间较阴性患者明显缩短[(27.65±1.31)个月:(52.87±0.77)个月,P<0.001]。

图1 MMP21在胃癌组织芯片中的免疫组化表达

图2 MMP21在胃癌组织芯片中的免疫组化表
3 讨论
手术切除是进展期及转移性胃癌最有效的治疗方法,但约40%的患者在根治性术后复发。因此,在胃癌治疗中,预测患者预后十分必要,故需找到一个更敏感的预后指标。
多种基质金属蛋白酶(MMPs)在炎症、黏膜创面愈合和肿瘤研究中有被报道。MMP28(上皮水解素)和MMP21是目前最新被克隆的人体基质金属蛋白酶,在肿瘤进展中发挥重要的作用。MMP21是一种分子量为57kD的具有蛋白转化酶活性的MMP。不同于其他包含10个外显子的MMP基因,MMP21基因只包含7个外显子。MMP21在人体多种恶性肿瘤如Merkel细胞癌、胰腺癌、结肠癌、乳腺癌、鳞状上皮细胞癌和肝癌细胞中广泛表达[5-10]。MMP28是一种分子量为59 kD的蛋白,包含一个信号肽序列、前肽区、锌离子结合催化活性区及C末端血红素结合蛋白样域。研究发现,在皮肤基底层、睾丸和肺中,MMP28 mRNA水平最高;在口腔鳞状细胞癌和食管癌细胞中,MMP28表达下调会导致锚着独立性生长能力下降[11]。也有证据表明,通过激活TGF-β可诱导肺癌上皮间质转化(EMT)[12]。
据报道,许多转录因子能与MMP21的启动子区序列结合,例如Sp-1、Tcf-4、Pax、Notch、维甲酸受体结合位点、Smad3及AP-1 recognition motifs[13]。启动子区包含一个保守GT盒,能与Sp1/Sp3蛋白(特异性蛋白1、3)结合,这在基因的基础表达中必不可少。这些转录因子和GT盒参与许多调控细胞的生长、周期及肿瘤进展的基因表达。与其他主要表达于基质细胞的基质金属蛋白酶不同,MMP21的表达主要局限于上皮细胞和肿瘤细胞,这表明,在癌症进展中,MMP21具有多种调节细胞的功能。因此,探讨MMP21在胃癌中的表达及预后价值是有意义的。
本资料中,MMP21和MMP28表达水平升高,其检出率分别为31.9%和34.4%。MMP21和MMP28的高表达与肿瘤浸润程度、淋巴结转移数、血管侵犯和远处转移有关,这表明MMP21和MMP28参与细胞外基质的分解,在胃癌侵袭和转移中扮演重要角色。从I期~IV期胃癌,MMP21和MMP28表达逐渐增高,这也表明MMP21和MMP28在胃癌进展中发挥重要作用。而两者与性别、年龄、lauren分型、组织类型、分化程度无关。更重要的是,K-M生存分析显示MMP21高表达的患者总生存期更低;MMP21和MMP28阳性患者比双阴性或单阴性患者的中位生存时间明显缩短。Cox回归分析表明,在436例胃癌患者中,Lauren分型、TNM分期及MMP21的表达为独立预后因素。其机制可能与细胞外基质的降解能力及转录因子调节MMP21和来诱导上皮间质转化(EMT)有关—降解IV、V、VII、IX和X型变性胶原或调节细胞生长、细胞周期、肿瘤进展。
这些数据表明,MMP21和MMP28的表达与不良预后有关,且为独立预后因素。其有望成为胃癌TNM分期系统外的另一个有用的预后指标,并可能通过此指标识别有可能复发和转移的患者,判断是否需要积极辅助化疗。
[1]Wu T, Li Y, Lu J, et al. Increased MMP-21 expression is associated with poor overall survival of patients with gastric cancer. Med Oncol, 2013, 30(1): 323.
[2]Chen J, Liu X, Jiao H, et al. Prognostic and clinical significance of STAT3 and MMP9 in patients with gastric cancer: a meta-analysis of a Chinese cohort. Int J Clin Exp Med, 2015, 8(1): 546-57.
[3]Ye Y, Zhou X, Li X, et al. Inhibition of epidermal growth factor receptor signaling prohibits metastasis of gastric cancer via downregulation of MMP7 and MMP13. Tumour Biol, 2014, 35(11): 10891-10896.
[4]Zhao Z S, Wang Y Y, Chu Y Q, et al. SPARC is associated with gastric cancer progression and poor survival of patients. Clin Cancer Res, 2010, 16(1): 260-268.
[5]Suomela S, Koljonen V, Skoog T, et al. Expression of MMP-10, MMP-21, MMP-26, and MMP-28 in Merkel cell carcinoma. Virchows Arch, 2009, 455(6): 495-503.
[6]Bister V, Skoog T, Virolainen S, et al. Increased expression of matrix met alloproteinases-21 and-26 and TIMP-4 in pancreatic adenocarcinoma. Mod Pathol, 2007, 20(11): 1128-1140.
[7]Huang Y, Li W, Chu D, et al. Overexpression of matrix met alloproteinase-21 is associated with poor overall survival of patients with colorectal cancer. J Gastrointest Surg, 2011, 15(7): 1188-1194.
[8]Shagisultanova E I, Novikova I A, Sidorenko Y S, et al. The matrix met alloproteinase-21 gene 572C/T polymorphism and the risk of breast cancer. Anticancer Res, 2004, 24(1): 199-201.
[9]Skoog T, Elomaa O, Pasonen-Seppanen S M, et al. Matrix met alloproteinase-21 expression is associated with keratinocyte differentiation and upregulated by retinoic acid in HaCaT cells. J Invest Dermatol, 2009, 129(1): 119-130.
[10]Boyd S, Virolainen S, Parssinen J, et al. MMP-10(Stromelysin-2) and MMP-21 in human and murine squamous cell cancer. Exp Dermatol, 2009, 18(12): 1044-1052.
[11]Marchenko G N and Strongin A Y. MMP-28, a new human matrix met alloproteinase with an unusual cysteine-switch sequence is widely expressed in tumors. Gene, 2001, 265(1-2): 87-93.
[12]Illman S A, Lehti K, Keski-Oja J, et al. Epilysin(MMP-28) induces TGF-beta mediated epithelial to mesenchymal transition in lung carcinoma cells. J Cell Sci, 2006, 119(Pt 18): 3856-3865.
[13]Marchenko GN, Marchenko ND and Strongin AY. The structure and regulation of the human and mouse matrix met alloproteinase-21 gene and protein. Biochem J, 2003, 372(Pt 2): 503-515.
ObjectiveTo observe the expression of MMP21 and MMP28 in gastric cancer tissues,and explore their relationship with clinical pathological feature and prognosis.MethodsThe expression was detected by immunohistochemical in 436 cases of gastric carcinoma and 92 cases of adjacent gastric tissue with MMP21 and MMP28,and we analyzed their correlation with the progression and poor prognosis of gastric cancer.ResultsThe positive rate of MMP21 and MMP28 in gastric cancer tissues was 31.9%(139/436)and 34.4%(150/436);but they were negative in 92 cases of adjacent normal gastric tissues. The positive expression of MMP21 and MMP28 related to tumor size,infi ltration depth,lymph vascular invasion,node metastasis and TNM staging. The total survival rate in positive patients lower than negative patients. Cox multivariate analysis showed that MMP21 and MMP2 were independent predictors of survival in patients with gastric cancer.ConclusionMMP21 and MMP28 closely contact with invasion,metastasis and prognosis,and they may become new and independent prognostic indicators in gastric cancer.
MMP21 MMP28 Gastric cancer TMA Tumour progression Prognosis
317500 浙江省温岭市中医院病理科(颜文辉)
310014 浙江省人民医院病理科(马杰)

