冬凌草甲素增强吉西他滨对胰腺癌Panc-1细胞裸鼠移植瘤的抑瘤作用
刘殿雷 卜贺启 赵金锋 黄海⋆
冬凌草甲素增强吉西他滨对胰腺癌Panc-1细胞裸鼠移植瘤的抑瘤作用
刘殿雷 卜贺启 赵金锋 黄海⋆
目的探讨冬凌草甲素在体内增强吉西他滨对胰腺癌Panc-1细胞裸鼠移植瘤的抑瘤作用及其可能的作用机制。方法 建立胰腺癌Panc-1细胞株的裸鼠皮下移植瘤模型,随机分为对照组(Control)、吉西他滨组(Gemcitabine)、冬凌草甲素组(Oridonin)以及冬凌草甲素联合吉西他滨组(Gem+Ori),每组各10只,各组均采用腹腔注射给药,1次/3d,共10次。实验过程中测量肿瘤体积并称量裸鼠体重。免疫组织化学染色法观察肿瘤组织中p38和p53表达的变化,Tunel法检测细胞凋亡。结果与其它各组比较,冬凌草甲素联合吉西他滨组对Panc-1细胞移植瘤的生长具有明显的抑制作用;末次用药1周后联合组肿瘤体积和质量明显小于其他各组(P<0.05);免疫组织化学染色结果显示冬凌草甲素联合吉西他滨组的p38和p53蛋白表达量显著增高(P<0.05);Tunel检测结果显示联合组凋亡细胞数明显增多。结论冬凌草甲素可协调增强吉西他滨对胰腺癌Panc-1细胞移植瘤的抑瘤作用,其机制可能是通过上调p38及其下游p53的表达而实现。
冬凌草甲素 胰腺癌 吉西他滨 p38 p53
冬凌草甲素是从唇形科Labtea香茶菜属Rabdosi提取的一种二萜类化合物,相关实验已报道它有各种药理学和生理学效应例如抗炎,抗菌,抗肿瘤作用[1]。关于其抗肿瘤活性,研究已经证实冬凌草甲素对一些肿瘤细胞能产生显著的抑制效应及细胞毒性作用[2-3]。近年来,较多实验研究表明化疗药物的联合比单个药物成分可更有效提高化疗效果,预防肿瘤的复发;其中,中药单体联合化疗药物治疗肿瘤也是目前研究的热点之一[4]。本实验在裸鼠移植瘤模型基础上研究冬凌草甲素协调增强胰腺癌吉西他滨化疗敏感性,并探讨其作用机制。
1 材料与方法
1.1 药品与试剂 冬凌草甲素(纯度>98%),购于北京环宇生物技术有限公司,用DMSO配制成10mmol/L(DMSO的终浓度<0.1%),-20℃冰箱保存;吉西他滨(法国礼来公司)用无菌生理盐水配成0.2 m mol/L;胎牛血清(四季青公司)、胰酶、RPMI-1640培养基(美国Gibco公司);兔抗人p38抗体和p53抗体(美国Epitomics公司)。
1.2 细胞培养 人胰腺癌细胞Panc-1(购于ATCC)培养于含10%胎牛血清、100U/ml青霉素和100μg/ml链霉素的RPMI1640培养液中,置于含5%CO2,37 ℃细胞培养箱中培养,每2~3d换液1次。细胞单层贴壁生长,至70%~80%融合时胰蛋白酶消化传代。
1.3 实验动物 4~6周龄健康雌性裸鼠购于中科院上海实验动物中心,体重20~22g,饲养于SPF屏障系统的洁净层流架内(无特定病原体级),室温控制在(25±1)℃,相对湿度40%~60%。
1.4 模型建立、分组及给药方法 将(5~10)×106个处于对数生长期的Panc-1细胞悬浮于0.2ml无血清RPMI-1640培养基中,注射到裸鼠背部靠近右侧后肢皮下,建立人胰腺癌裸鼠移植瘤模型。接种4周后,待移植瘤体积长至100~150mm3,将荷瘤裸鼠随机分为4组:对照组(N组,生理盐水)、吉西他滨组(G组,80mg/kg)、冬凌草甲素组(O组,40mg/kg)、联合组(G+O组,吉西他滨 80mg/kg;冬凌草甲素40mg/kg),每组各10只。分组当天开始腹腔注射给药,药物注射的最终体积为0.2ml/只,1次/3d,共9次。末次用药1周后处死裸鼠。分组当天即用游标卡尺监测肿瘤体积(V):V=π/6×a×b2,其中a、b分别为垂直方向的肿瘤最大和最小径线[5],以后每隔5d称量各组裸鼠体重并测量移植瘤长径和短径一次,处死裸鼠前称量裸鼠体重和肿瘤长短径,前后共测量7次裸鼠体重和瘤体大小。绘制各组荷瘤裸鼠的平均体重及移植瘤平均体积随用药时间点变化曲线。末次用药1周后用10%水合氯醛麻醉裸鼠,取肿瘤组织称量。取部分组织用4%多基甲醛固定,石蜡切片后做免疫组化染色。另一部分保存于液氮中备用。
1.5 Tunel法检测肿瘤细胞凋亡 取出制备好的石蜡切片。对各组标本的同一横截面进行连续切片,所得石蜡切片进行常规二甲苯脱蜡,梯度酒精水化,按照Tunel试剂盒所示的操作步骤进行操作;在高倍镜(OLYMPUS BX51,400×)随机选择10个视野,Image-pro plus 6(Ipp-6)软件分析平均光密度。
1.6 免疫组织化学法检测肿瘤组织中p38和p53表达 石蜡切片常规脱腊水化,0.3%H2O2封闭,微波抗原修复,滴加正常山羊血清封闭液,室温10min;兔抗人P38抗体(稀释度1∶300),P53 抗体(稀释度1∶500),4℃孵育过夜,PBS洗涤后滴加HRP标记的二抗37℃ 30min 时,DAB 显色3~5min,冲洗后苏木素复染,流水冲洗返蓝后脱水封。图片结果用Ipp-6图像处理软件进行分析平均光密度。
1.7 统计学方法 采用SPSS 17.0统计软件。计量资料以(x±s)的形式表示,进行方差分析,均数之间的多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 冬凌草甲素对荷瘤裸鼠体重的影响 各组荷瘤裸鼠在实验开始时体重(g)差异无统计学意义(P>0.05),分别为对照组(26.04±1.38)g、吉西他滨组(25.85±2.01)g,冬凌草甲素组(24.98±1.58)g和联合组(25.71±1.75)g。实验结束时各组荷瘤裸鼠体重:冬凌草甲素组(21.93±1.67)g、NS组(18.64±1.86)g、吉西他滨组(13.45±1.18)g、联合组(16.86±1.93)g。实验结果显示,冬凌草甲素组体重降低最少,其次为对照组,吉西他滨组体重降低最为明显。
2.2 各组肿瘤体积、质量变化 裸鼠随机分组当天各组的肿瘤平均体积为(132.14±12.62)mm3,差异均无统计学意义。末次用药后1周,瘤体平均体积对照组为(615.48±102.31)mm3,冬凌草甲素组为(362.34±36.47)mm3,吉西他滨组为(332.14±42.16)mm3,联合组为(217.68±37.24)mm3。与对照组比较,冬凌草甲素组与吉西他滨组的瘤体平均体积与质量均明显小于对照组(P<0.05),但联合组的变化更为明显,与其他各组相比,差异均有统计学意义(P<0.05)(见表1)。
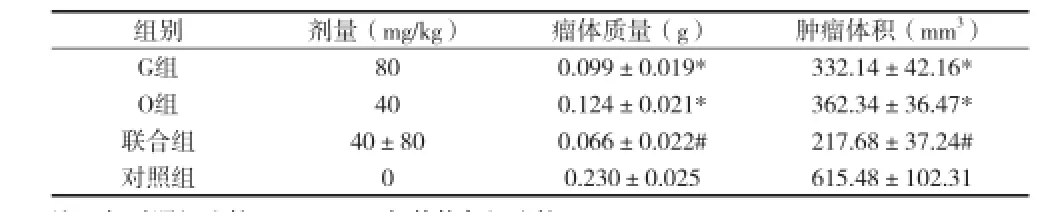
表1 冬凌草甲素增强吉西他滨的抑瘤作用
2.3 Tunel法检测各组瘤体细胞的凋亡情况 Tunel染色后阳性细胞的镜下表现为细胞核染成棕褐色,胞核固缩,染色质浓缩,而胞浆不着色;图片经Imagepro plus 6软件处理分析后,阳性细胞比例采用累积吸光值(IOD)表示,吸光值越大表明凋亡细胞数越多;实验结果显示(见图1):与对照组IOD值(32.7±2.76)相比较,冬凌草甲素组IOD值(82.1±6.46),吉西他滨组IOD值(97.4±7.62),联合组IOD值(216.3±12.27),均有明显增加,且均有统计学意义(P<0.05);尤以联合组增加更明显。
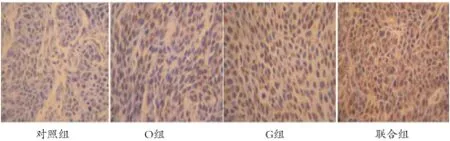
图1 各实验组药物处理后Tunel法检测瘤体细胞凋亡
2.4 免疫组织化学法检测肿瘤组织中p38和p53表达 Image-pro plus 6软件分析肿瘤组织中p38和p53的表达平均光密度,与对照组相比较,吉西他滨或冬凌草甲素单独可上调肿瘤组织中p38和p53的表达(P<0.05);而联合组能显著上调p38和p53在肿瘤组织中的表达,与其他各组相比较,差异均有统计学意义(P<0.05)(见图2)。
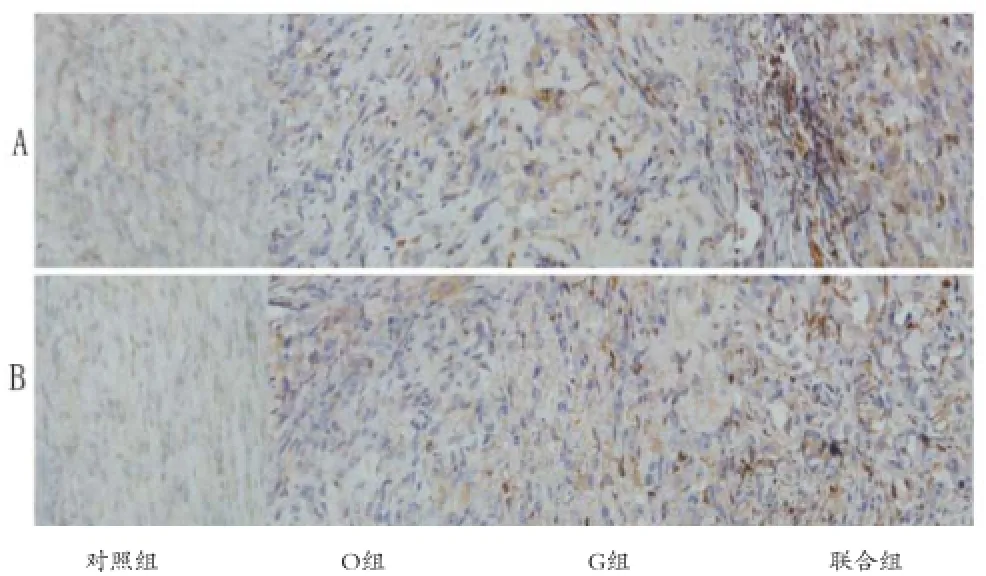
图2 各实验组药物处理后免疫组化法检测瘤体内p38和p53蛋白的变化
3 讨论
胰腺癌是一种临床表现隐匿、发展迅速、预后很差的消化系统恶性肿瘤,在美国,胰腺癌年死亡人数为39.590例,位居美国因恶性肿瘤病死率的第四位[6];2008年中国肿瘤登记地区的胰腺癌发病占全部癌症的2.86%,位居第7位,死亡占全部癌症4.09%,位居第6位[7];且病死率呈现逐年上升的趋势。吉西他滨是目前治疗进展期胰腺癌最好的一线化疗药物,但在长期的临床应用中发现,由于胰腺癌细胞获得性及内在的耐药性、早转移性等因素,吉西他滨治疗胰腺癌的效果并不理想,总有效率<20%[8]。因此,寻求一种安全有效的方法增强胰腺癌细胞对化疗药物的敏感性,增加吉西他滨的疗效显得尤为重要。
国内外研究已证实冬凌草甲素不仅在体内外对多种肿瘤细胞的增殖具有明显的抑制效应,而且发现联合使用时可以增强肿瘤细胞对其他抗肿瘤药物的敏感性。BU等对一项关于冬凌草甲素的体内外研究发现,其可以通过激活p38-MAPK信号通路上调p38及其下游的p53的表达来促进胰腺癌细胞的凋亡,并可通过阻止细胞周期的进展抑制其增殖的发生[9]。本资料结果显示,各组荷瘤裸鼠在实验开始时体重相比无明显差别,但实验结束时与对照组比较,冬凌草甲素组体重略微增加,联合组体重略微降低,吉西他滨组体重降低较为明显,且吉西他滨组荷瘤裸鼠体重与其他组相比有显著性差异,提示冬凌草甲素作为一种可能的胰腺癌抗肿瘤药物不仅能促进吉西他滨对胰腺癌Panc-1裸鼠移植瘤的凋亡,且提示在该治疗浓度范围内对裸鼠无明显的毒性作用。本资料干预结束后剥取各组动物的瘤块进行比较,单药组移植瘤体积与质量均明显小于对照组移植瘤体积,其中联合组移植瘤体积与质量较其他各组显著减少,且联合组抑瘤率较单药组较为明显。另外实验过程中发现联合组移植瘤体积呈逐渐缩小趋势。提示冬凌草甲素可增强吉西他滨对Panc-1细胞移植瘤的生长抑制作用。
丝裂原蛋白激酶是细胞内的一类丝氨酸/苏氨酸蛋白激酶,有研究证明,它是存在于大多数细胞内的一类重要的信号转导酶类,可将细胞外信号转导到细胞核内,影响基因的转录和调控。目前已确定出3条MAPK信号转导通路,而p38-MAPK则是介导细胞因子及应急刺激导致细胞凋亡、分化及炎症反应的重要细胞内信号转导途径[10]。已有研究证实p38MAPK信号通路参与胰腺癌细胞的凋亡过程[11-12]。p38-MAPK激活后可磷酸化多种转录因子,其中包括肿瘤抑制因子p53[13]。且有文献报道p38-MAPK通路的激活可导致p53诱导的凋亡[14]。p53是凋亡过程中一个重要调控因子,在维持细胞正常生长、抑制恶性增殖过程中起着重要作用。p53作为一个转录因子对DNA损伤做出反应,并诱导下游蛋白如p21、Mdm2和Bax的表达,这些下游蛋白可以调节细胞周期和凋亡[15]。本实验免疫组化结果显示,冬凌草甲素和吉西他滨单药组或联合组移植瘤组织中p38蛋白与p53蛋白均呈高表达,且联合组表达最为显著,提示p38-MAPK信号转导的激活促进其下游p53的表达,从而引起肿瘤细胞发生凋亡,抑制移植瘤的生长。
[1]Tan W, Lu J, Huang M, et al. Anti-cancer natural products isolated from Chinese medicinal herbs. Chin Med, 2011, 6(1): 27.
[2]Cheng Y, Qiu F, Ye YC, et al. Oridonin induces G2/M arrest and apoptosis via activating ERK-p53 apoptotic pathway and inhibiting PTK-RAS-RAFJNK survival pathway in murine fibrosarcoma L929 cells. Arch Biochem Biophys, 2009, 490(1): 70-75.
[3]Gao FH, Hu XH, Li W, et al. Oridonin induces apoptosis and senescence in colorectal cancer cells by increasing histone hyperacetylation and regulation of p16, p21, p27 and c-myc. BMC Cancer, 2010, 10: 610.
[4]Li-Weber M. Targeting apoptosis pathways in cancer by Chinese medicine. Cancer lett, 2013,332(2):304-312.
[5]R Kong, B Sun, H Jiang, et al. Downregulation of nuclear factorkappaB p65 subunit by small interfering RNA synergizes with gemcitabine to inhibit the growth of pancreatic cancer. Cancer lett, 2009, 291(1):90-98.
[6]Rebecca Siegel MPH, Jiemin Ma PhD, Zhaohui Zou MS, Ahmedin Jemal, DVM, PhD, cancer statistics 2014. CA: Cancer J Clin, 2014, 64(1):9-29.
[7]郑荣寿, 张思维, 吴良有,等. 中国肿瘤登记地区2008 年恶性肿瘤发病和死亡分析. 中国肿瘤,2012,21(1):1-12.
[8]Tada M, Arizumi T, Nakai Y, et al. Efficacy of gemcitabine for locally advanced pancreatic cancer: comparison with 5-fluorouracil-based chemoradiotherapy. Chemotherapy, 2008,54(4):302-308.
[9]Bu HQ, Liu DL, Wei WT, et al. Oridonin induces apoptosis in SW1990 pancreatic cancer cells via p53-and caspase-dependent induction of p38 MAPK. Oncology Reports,2014, 31(2):975-982.
[10]Rodríguez-Berriguete G, Fraile B, Martínez-Onsurbe P, et al. MAP kinases and prostate cancer. J Signal Transduct, 2012, 2012: 169170.
[11]Bu HQ, Liu DL, Wei WT, et al. Oridonin induces apoptosis in SW1990 pancreatic cancer cells via p53-and caspase-dependent induction of p38 MAPK. Oncol Rep, 2014, 31(2): 975-982.
[12]Bu HQ, Luo J, Chen H, et al. Oridonin enhances antitumor activity of gemcitabine in pancreatic cancer through MAPK-p38 signaling pathway. Int J Oncol, 2012, 41(3): 949-958.
[13]Harris SL, Levine AJ. The p53 pathway: positive and negative feedback loops. Oncogene, 2005, 24(17): 2899-2908.
[14]Bulavin DV, Fornace AJ Jr. p38 MAP kinase's emerging role as a tumor suppressor. Adv Cancer Res, 2004, 92: 95-118.
[15]Fuster JJ, Sanz-González SM, Moll UM, et al. Classic and novel roles of p53: prospects for anticancer therapy. Trends Mol Med, 2007, 13(5): 192-199.
ObjectiveThis study investigated oridonin enhanced the effects of gemcitabine against pancreatic cancer in nude-mouse transplanted tumor model as well as its mechanism of action.MethodsTo establish a pancreatic cancer nude-mouse transplanted tumor model;2. To set three groups which are control,gemicitabine,oridonim and Gem+Ori,respectively;3. To treat the mouse with intraperitoneal injection,once per 3 days,10 times totally;4. To weigh the tumor and the mouse;5. To compare the change of P38 and p53 using immunohistochemical analysis and TUNEL for cell apoptosis. Result We found that Oridonin can enhance the anti-tumor activity of Gemcitabine in pancreatic cancer nude-mouse transplanted tumor model. TheResultsindicated that:1. The volume and weight of the tumor was dramatic decreased after treatment of Oridonin;The expression of p38 and p53 were all increased(P<0.05);Apoptosis rate was higher in the group treated with both Gemcitabine and Oridonin than other groups.ConclusionOridonin could enhance the anti-tumor activity of Gemcitabine though up-regulate p38 and p53.
Oridonin Pancreatic cancer Gemcitabine P38 P53
浙江省中医药管理局优秀青年基金项目(2013ZQ026);杭州市科技发展计划项目(20140733Q34,20130633B19);浙江省医药卫生研究计划(2013KYA169);国家自然科学青年基金项目(81202821)
310007 杭州市中医院外一科(刘殿雷 赵金锋 黄海)310012 浙江省立同德医院肛肠科(卜贺启)*通信作者

